Электрохимический способ получения наноразмерных структур оксида титана (iv)
Иллюстрации
Показать всеИзобретение может быть использовано в производстве гетерогенных катализаторов, обладающих высокоразвитой поверхностью, и электродов в литий-ионных батареях. Электрохимический способ получения наноразмерных структур оксида титана (IV) включает анодное окисление титанового электрода в ионной жидкости с добавлением воды или пропиленгликоля в атмосфере воздуха. Ионная жидкость имеет общую формулу К+А-, где К+ - алкилимидазолий, А- - NTf2 -, или PF6 -, или Cl-. Анодное окисление проводят при температуре 20-25°C в течение 5-30 минут при постоянном токе 1-10 мА или при постоянном потенциале 1-10 B. Изобретение позволяет получать наночастицы оксида титана в виде наносфер, нановолокон или наностержней в зависимости от условий проведения синтеза. 8 ил., 7 пр.
Реферат
Предлагаемый способ относится к области электрохимического получения активных форм наночастиц оксидов металлов, конкретно оксида титана (IV), которые могут быть использованы в качестве гетерогенных катализаторов, обладающих высокоразвитой поверхностью, в качестве электродов в литий-ионных батареях.
Наночастицы определяют как твердые частицы с размером в диапазоне 10-1000 нм. Наночастицы привлекают к себе большое внимание в различных областях науки и нанотехнологий из-за их исключительных физико-химических свойств. В зависимости от применяемого метода синтеза могут быть получены наночастицы в виде наностержней, нанотрубок, нанокластеров, наносфер или нанофракталов.
Обычно для синтеза функциональных наноматериалов на основе оксидов металлов используют реакции, протекающие при высокой температуре, такие как лазерное облучение, ионная имплантация, химическое осаждение из вакуума, термическое разложение. Ионные жидкости (ИЖ), которые по определению являются солями, существующими в жидком виде, как правило ниже 100°C, могут быть использованы в качестве термически стабильных и нелетучих растворителей, которые могут быть полезны для сокращения выбросов растворителя по сравнению с обычными летучими органическими соединениями. Различные ионные жидкости на основе катиона имидазолия, в том числе [BMIM][Tf2N] и 1-бутил-3-метилимидазолий хлорид [BMIM]Cl, не только негорючи но и стабильны в широком диапазоне температур: от комнатной температуры до 400°C.
Наноструктуры оксида титана имеют разнообразные применения, например, в фотокатализе, преобразовании солнечной энергии, датчиках и для ВЧ керамики. Синтез оксидов титана различных размера и формы (сферические частицы, нанотрубки и наностержни) был описан в многочисленных исследованиях [Ding, К.L.; Miao, Ζ.J.; Liu, Ζ.M.; Zhang, Ζ.F.; Han, В.X.; An, G.M.; Miao, S. & Xie, Y. (2007). Facile synthesis of high quality TiO2 nanocrystals in ionic liquid via a microwave-assisted process. Journal of the American Chemical Society, Vol. 129, No. 20, (May 2007), pp. 6362-6363, ISSN 0002-7863; Choi, H.; Kim, Y.J.; Varma, R.S. & Dionysiou, D.D. (2006). Thermally stable nanocrystalline TiO2 photocatalysts synthesized via sol-gel methods modified with ionic liquid and surfactant molecules. Chemistry of Materials, Vol. 18, No. 22, (October 2006), pp. 5377-5384, ISSN 0897-4756; Zheng, W.; Liu, X.; Yan, Z. & Zhu, L. (2009). Ionic liquid-assisted synthesis of large-scale TiO2 nanoparticles with controllable phase by hydrolysis of TÍC14. ACS Nano, Vol.3, No. 1, (January 2009), pp. 115-122, ISSN 1936-0851]. Из трех основных полиморфых модификаций оксидов титана (анатаз, брукит, рутил), до настоящего времени исследования были сосредоточены на синтезе наночастиц анатаза. Однако рутил нанометровых размеров привлекает все больше внимания в силу его многообещающего потенциала как фотокатализатора и в качестве электродного материала.
Среди различных способов получения нанооксидов титана особое внимание привлекают синтезы в ионных жидкостях.
Известно, что анатаз с размером частиц 10-20 нм является термодинамически стабильной модификацией ТiО2. Синтез 2-3 нм размера нанокристаллов диоксида титана и их самосборка в мезопористые наносферы ТiО2 был проведен в ионной жидкости в мягких условиях. В результате полученные наноструктуры сочетают в себе преимущества более крупных сфер с высокой удельной поверхностью и узким распределением пор по размерам и, как ожидается, обладают огромным потенциалом в преобразовании солнечной энергии, катализе и оптико-электронных приборах. В типичном синтезе наночастиц TiO2, ионная жидкость 1-бутил-3-метилимидазолий тетрафторборат и ионная жидкость 1-бутил-3-метилимидазолий гексафторфосфат были использованы в качестве растворителя (Antonietti, M.; Kuang, D.В. Smarsly, В. & Yong, Ζ. Ionic liquids for the convenient synthesis of functional nanoparticles and other inorganic nanostructures. Angewandte Chemie, International Edition, (2004). Vol. 43, No. 38, pp. 4988-4992; Zhou, Y. & Antonietti, M. Synthesis of very small TiO2 nanocrystals in a roomtemperature ionic liquid and their self-assembly toward mesoporous spherical aggregates. Journal of the American Chemical Society, (2003). Vol. 125, No. 49, pp. 14960-14961).
Методика состоит в получении прекурсора титана, осаждении геля оксида титана с дальнейшим высушиванием оксида титана. Смешивают 1 мл тетрахлорида титана с ионной жидкостью [BMIM]+BF4-. После гомогенизации смеси к ней медленно добавляют при сильном перемешивании при комнатной температуре 2 мл дистиллированной воды. Гидролиз тетрахлорида титана происходит сразу, что видно по появлению взвеси. Взвесь перемешивают при 80°C в течение 12 часов. Для выделения продукта полученную эмульсию разбавляют водой до объема 20 мл с целью уменьшения вязкости ИЖ. Полученные наноструктуры осаждают центрифугированием. Остаточную ИЖ, содержащуюся в продукте, отмывают ацетонитрилом в закрытом сосуде при 50°C в течение 8 часов. Процесс экстракции ИЖ повторяют до полного ее удаления из осадка. Окончательный продукт сушат в вакууме при 40°C.
Недостатком предложенного способа является длительность процесса приготовления и техническая сложность процесса очистки получаемых наноструктур от ИЖ.
Предложен способ синтеза наноматериалов с заданными свойствами, включающий обработку реакционной смеси исходных жидкостного и твердотельного компонентов источником СВЧ-излучения в импульсном режиме генерации. В качестве жидкой фазы реакционной смеси применяют ионные жидкости состава К+А- с температурой плавления ниже 97,5°C и термической стабильностью выше 150°C. В качестве основного компонента твердой фазы используют микро-, моно- и поликристаллы эпитаксиальных подложек основной фазы формирующихся нанокристаллических матриц (патент РФ №2360314 C1, 28.03.2008). Получают наночастицы контролируемого размера в пределах 100-200 нм. Недостатком данного способа являются сложная многостадийная технология, высокое энергопотребление. Кроме того, в источнике не указаны возможные ионные жидкости.
Известен способ получения частиц физическим осаждением из паровой фазы в ионной жидкости. Изобретение относится к получению частиц, в частности наночастиц, в ионной жидкости. Устройство для реализации способа содержит камеру осаждения и сосуд для ионной жидкости. Способ получения наночастиц включает введение ионной жидкости состава К+А- в камеру осаждения; вакуумирование камеры осаждения для образования вакуума в интервале от 1 и 7 микронов Hg; и распыление одного или более катодов в камере осаждения для направления одного или более материалов по направлению к ионной жидкости для образования наночастиц в ионной жидкости. Катионы могут включать моно-, ди- и трехзамещенные имидазолии; замещенные пиридинии; замещенные пирролидинии; тетраалкилфосфониии; тетраалкиламмонии; гуанидинии; изоуронии и тиуронии. Анионы могут включать хлориды; бромиды; йодиды; тетрафторбораты; гексафторфосфаты; бис(трифторметилсульфонил)имиды; трис(пентафторэтил)трифторофосфаты (FAP); трифторметансульфонаты; трифторацетаты; метил сульфаты; октилсульфаты; роданиды; органобораты и пара- толуолсульфонаты. Конкретные неограниченные примеры: IL включают 1-бутил-3-метилимидазолия гексафторфосфат ([BMIM]PF6), 1-гексил-3-метилимидазолия тетрафторборат ([HMIM]bf4), 1-бутил-3-метилимидазолия тетрафторборат ([BMIM]BF4), 1-этил-3-метилимидазолия трифторметан сульфонамид ([EMIM](CF3SO2)2N). Технический результат - упрощение способа и повышение качества получаемых частиц (патент RU 2404024 С2, 17.01.2007). Недостатками этого способа являются жесткий контроль вязкости ионной жидкости и сложная многостадийная технология.
Анодные процессы представляют относительно недорогие методы получения высокоорганизованных оксидных материалов для различных применений.
Авторы (Langmuir 2009, 25, 509-514, Abu Ζ. Sadek, Haidong Zheng, Kay Latham, Wojtek Wlodarski, and Kourosh Kalantar-zadeh) получали пористый оксид титана в нейтральном электролите, содержащем фторид аммония (0.5%) и этиленгликоль (0.5%), в интервале потенциалов 3-20 В без перемешивания. В отсутствие фторид-ионов на поверхности титана образуется тонкий барьерный слой оксида, который препятствует росту оксидного слоя за счет падения напряжения, что приводит к снижению тока окисления. В присутствии фторид-ионов могут образовываться комплексные соединения титана (IV) состава [TiF6]2-, которые препятствуют осаждению ТiО2 (или гидратированного оксида состава Ti(OH)xOy). Это приводит к тому, что травление поверхности продолжается, что вызывает рост тока на начальной стадии. В дальнейшем скорость образования и растворения оксида титана становятся равны и толщина барьерного слоя стабилизируется. Влияние напряжения выражается в изменении диаметра пор. При напряжении 5 В диаметр составляет 10 нм, а для напряжения 10 В - 20 нм. Недостатком описанного способа является использование водных растворов, также не вполне определено, что такое нейтральный электролит.
Наиболее близким к предлагаемому способу по совокупности существенных признаков является способ получения нанотрубок оксида титана в ионных жидкостях (Jun Qu, Huimin Luo, and Sheng Dai. U.S. Patent 8,585,886, November 19, 2013). В патенте заявлено использование различных ИЖ общей формулы К++А-, где К+ выбирают из замещенных имидазолиев, пиридиния, четвертичного аммония со фторсодержащими анионами из B F 4 − , P F 6 − , N T f 2 − и др. Метод состоит в том, ионную жидкость 1-бутил-3-метилимидазолий тетрафторборат (BMIMBF4) смешивают с дистиллированной водой в весовом отношении 0.276:1 и полученный раствор используют в качестве электролита. Рабочим электродом служит титановая фольга толщиной 0.5 мм, поверхность которой предварительно тщательно очищают ацетоном и этанолом. Фольгу помещают в двухэлектродную ячейку. Вспомогательным электродом является платиновая пластина. Напряжение выбирают в ряду от 0 до 40 В. Синтез проводят при комнатной температуре (21°C). В течение электролиза поддерживают постоянное напряжение. Оптимизацию осуществляют подбором времени. Зависимость тока от времени фиксируют с помощью миллиамперметра. В начале синтеза ток составляет около 2 мА, постепенно падает за 80 минут до 0.5 мА, после чего резко возрастает до 20 мА, что служит сигналом окончания синтеза.
Недостатком этого способа является, что в качестве электролита используют смесь ионной жидкости с водой, хотя не все упомянутые в патенте ИЖ являются гидрофильными и способны смешиваться с водой в заявленных количествах, например ИЖ с анионом трифлатимида (NTf2).
Задачей предлагаемого способа является получение оксида титана (IV) на титановом аноде в нанодисперсном состоянии.
Поставленная задача решена данным изобретением.
Электрохимический способ получения наноразмерных частиц оксида титана (IV) включает анодное окисление титанового электрода в ионной жидкости общей формулы К+А- при температуре 20-25°C в течение 5-30 минут, при постоянном токе 1-10 мА или при постоянном потенциале 1-10 В и в атмосфере воздуха. К+ выбирают из алкилимидазолия, алкилпиридиния, алкилпиперидиния и др. А- выбирают из N T f 2 − , B F 4 − , P F 6 − , Cl- и др.
В предлагаемом способе в качестве растворителя выбрана ионная жидкость, поскольку она обладает достаточной электропроводностью, что в общем случае не требует введения постороннего фонового электролита. В то же время ионные жидкости характеризуются большими «окнами» электрохимической устойчивости (от -2 до +2 В относительно потенциала хлорсеребряного электрода) и одновременно выполняют роль среды, формирующей и стабилизирующей наночастицы оксидов металлов. Высокая вязкость ионной жидкости способствует тому, что в ее присутствии формирование наночастиц оксидов металлов происходит в виде отдельных зерен на поверхности электрода, а не в виде тонкого слоя из компактного оксида.
В предлагаемом способе к растворителю (ионной жидкости) добавляют воду или пропиленгликоль. Образующиеся при анодном растворении титана ионы Ti4+ в присутствии воды образуют аквакомплексы состава [Тi(Н2О)4]4+, которые при гидролизе образуют оксид титана. Гликоли и полиолы также имеют важное значение в синтезе хорошо охарактеризованных наноструктурных оксидных материалов, поскольку они являются хелатирующими лигандами иона металла, что позволяет контролировать скорость гидролиза алкоксидов переходных металлов (Chem. Soc. Rev., 2012, 41, 5313-5360, T. Fröschl, U. Hörmann, P. Kubiak, G. Kučerova′, M. Pfanzelt, C. K. Weiss, R. J. Behm, N. Hüsing, U. Kaiser, K. Landfesterd, M. Wohlfahrt-Mehrens). Гликоляты состава Ti(OC(CH3)H2CH2O)2+ в предлагаемом способе образуются in sity.
В качестве катода могут быть использованы электроды, например, из платины, графита, стеклоуглерода, меди, кобальта и других материалов, обладающих достаточной электропроводностью и не взаимодействующих с ионной жидкостью. Электродом сравнения является серебряная проволока
Электрохимическое анодирование титана проводят в атмосфере воздуха.
Перечень иллюстративных материалов.
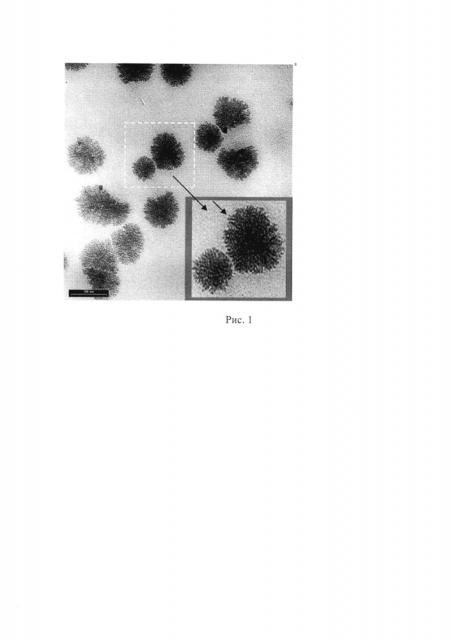
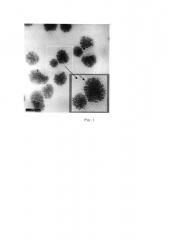
На рис. 1 представлены микрофотографии частиц оксида титана (по данным Journal of the American Chemical Society, (2003). Vol. 125, No. 49, pp. 14960-14961). На рис. 1 видны нанокристаллы оксида титана размером 2-3 нм, объединенные в сферы большего размера с высокоразвитой поверхностью. Полученные наночастицы имеют сферическую форму и достаточно узкое распределение частиц по размерам.
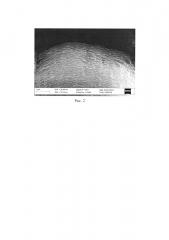
На рис. 2 представлена микрофотография фрагмента титанового анода, полученная через 5 мин воздействия анодным током плотностью 0.6 мА·см-2 в ионной жидкости BMIMCl в присутствии добавки воды (объемное отношение V(H2O):V(ИЖ)=0.1:1) в атмосфере воздуха при температуре 25°C. На рис. 2 четко видна волокнистая структура оксида титана. Длина волокон может составлять от 0.1 до нескольких микрон, толщина волокон соответствует приблизительно 100 нм.
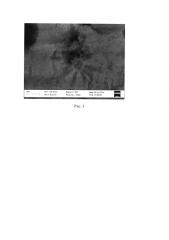
На рис. 3 представлена микрофотография фрагмента титанового анода, полученная через 5 мин воздействия анодным током плотностью 0.6 мА·см-2 в ионной жидкости BMIMNTf2 в присутствии добавки воды (объемное отношение V(H2O):V(ИЖ)=0.1:1) в атмосфере воздуха при температуре 25°C. На рис. 3 на поверхности титанового электрода видны неупорядоченно расположенные сферические образования оксида титана размером от 50 до 200 нм.
На рис. 4 представлена микрофотография фрагмента титанового анода, полученная через 7 мин воздействия анодным током плотностью 0.6 мА·см-2 в ионной жидкости BMIMCl в присутствии добавки пропиленгликоля (объемное отношение 1:1) в атмосфере воздуха при температуре 25°C. На рис. 4 на поверхности титанового электрода видны неупорядоченно расположенные сферические образования оксида титана размером от 50 до 200 нм.
На рис. 5 представлена микрофотография фрагмента титанового анода, полученная через 30 мин воздействия анодным током плотностью 6 мА·см-2 в ионной жидкости BMIMNTf2 в присутствии добавки пропиленгликоля (объемное отношение 1:1) в атмосфере воздуха при температуре 25°C. На рис. 5 на поверхности титанового электрода видны неупорядоченно расположенные наноразмерные образования оксида титана в виде стержней размером от 50 до 200 нм, диаметром 50-100 нм.
На рис. 6 представлена микрофотография фрагмента титанового анода, полученная через 15 мин воздействия анодным током плотностью 2.5 мА·см-2 в ионной жидкости BMIMCl в присутствии добавки воды (объемное отношение V(Н2О):V(ИЖ)=0.1:1) в атмосфере воздуха при температуре 25°C. На рис. 6 четко видна волокнистая структура оксида титана. Длина волокон может составлять от 0.1 до нескольких микрон, толщина волокон соответствует приблизительно 50-100 нм.
На рис. 7 представлена микрофотография фрагмента титанового анода, полученная через 15 мин воздействия анодным током плотностью 9 мА·см-2 в ионной жидкости BMIMCl в присутствии добавки воды (объемное отношение V(H2O):V(ИЖ)=0.1:1) в атмосфере воздуха при температуре 25°C. На рис. 7 четко видна волокнистая структура оксида титана. Длина волокон может составлять от 0.1 до нескольких микрон, толщина волокон соответствует приблизительно 100 нм.
На рис. 8 представлена микрофотография фрагмента титанового анода, полученная через 30 мин анодного воздействия при Е=5B в ионной жидкости BMIMPF6 в присутствии добавки воды (объемное отношение V(Н2О):V(ИЖ)=0.1:1) в атмосфере воздуха при температуре 25°C. На рис. 8 четко видны наночастицы двух видов: сферические с плотной адгезией с подложкой и стержни толщиной около 50 нм и длиной около 200 нм.
Данные, полученные при анодном электрохимическом воздействии на титановый анод в среде ионной жидкости, свидетельствуют о том, что в результате этого процесса на поверхности титана образуются наночастицы оксида титана в виде наносфер, нановолокон или наностержней в зависимости от условий проведения синтеза.
Предложенный способ иллюстрируется следующими примерами.
Пример 1
Электрохимическое получение оксида титана проводили из раствора ионной жидкости 1-бутил-3-метил имидазолий хлорида BMIMCl, содержащего дистиллированную воду в объемном отношении (V(H2O):V(BMIMCl)=0.1:1). Процесс проводили при температуре 25°C в течение 5 мин при плотности тока 6 мА·см-2. В качестве анода использовали титановую фольгу (S=0.4 см2) и в качестве катода никель. Электрод сравнения - серебряная проволока.
Данные электронной микроскопии титанового анода (рис. 2) получены через 5 мин анодного воздействия. На рис. 2 видны продукты полного окисления титана с высокоразвитой поверхностью на электроде из титана. На рис. 2 видна волокнистая структура оксида титана. Длина волокон может составлять от 0.1 до нескольких микрон, толщина волокон соответствует приблизительно 100 нм. Согласно данным элементного анализа содержание кислорода (61-63% атомных), титана (24-27% атомных) и оставшееся - адсорбированный хлорид-ион.
Пример 2
В условиях эксперимента, аналогичных примеру 1, синтез наноразмерных частиц оксида титана проводили из раствора ионной жидкости 1-бутил -3-метил имидазолий трифлатимида BMIMNTf2, содержащего дистиллированную воду в объемном отношении (V(H2O):V(BMIMNTf2)=0.1:1) с использованием никелевого катода и анода из титановой фольги (S=0.4 см2) в течение 5 мин при плотности тока 6 мАсм-2 при температуре 25°C.
Обнаружено покрытие поверхности анода неупорядоченно расположенными сферическими образованиями оксида титана размером от 50 до 200 нм (рис. 3).
Пример 3
В условиях эксперимента, аналогичных примеру 1, синтез наноразмерных частиц оксида титана проводили из раствора ионной жидкости 1-бутил-3-метил имидазолий хлорида BMIMCl, содержащего пропиленгликоль в объемном отношении (V(пропиленгликоль):V(BMIMCl)=1:1). Процесс проводили при температуре 25°C в течение 7 мин при плотности тока 6 мА·см-2. В качестве анода использовали титановую фольгу и в качестве катода - никель. Электрод сравнения - серебряная проволока.
Обнаружено покрытие поверхности титанового анода неупорядоченно расположенными сферическими образованиями оксида титана размером от 50 до 200 нм (рис. 4).
Пример 4
В условиях эксперимента, аналогичных примеру 1, синтез наноразмерных частиц оксида титана проводили из раствора ионной жидкости 1-бутил-3-метил имидазолий трифлатимида BMIMNTf2 содержащего пропиленгликоль в объемном отношении (V(пропиленгликоль):V(BMIMNTf2)=1:1). Процесс проводили при температуре 25°C в течение 30 мин при плотности тока 6 мА·см-2. В качестве анода использовали титановую фольгу и в качестве катода никель. Электрод сравнения - серебряная проволока.
Обнаружено покрытие поверхности титанового электрода неупорядоченно расположенными наноразмерными образованиями оксида титана в виде стержней размером от 50 до 200 нм (рис. 5).
Пример 5
Электрохимическое получение оксида титана проводили из раствора ионной жидкости 1-бутил-3-метил имидазолий хлорида BMIMCl, содержащего дистиллированную воду в объемном отношении (V(H2O):V(BMIMCl)=0.1:1). Процесс проводили при температуре 25°C в течение 15 мин при плотности тока 2.5 мА·см-2. В качестве анода использовали титановую фольгу (S=0.4 см2) и в качестве катода никель. Электрод сравнения - серебряная проволока.
Данные электронной микроскопии титанового анода (рис. 6) получены через 5 мин анодного воздействия. На рис. 6 видны продукты полного окисления титана с высокоразвитой поверхностью на электроде из титана. На рис. 6 видна волокнистая структура оксида титана. Длина волокон может составлять от 0.1 до нескольких микрон, толщина волокон соответствует приблизительно 100 нм. Согласно данным элементного анализа содержание кислорода (61-63% атомных), титана (24-27% атомных) и оставшееся - адсорбированный хлорид-ион.
Пример 6
Электрохимическое получение оксида титана проводили из раствора ионной жидкости 1-бутил-3-метил имидазолий хлорида BMIMCl, содержащего дистиллированную воду в объемном отношении (V(H2O):V(BMIMCl)=0.1:1). Процесс проводили при температуре 25°C в течение 15 мин при плотности тока 9 мА·см-2. В качестве анода использовали титановую фольгу (S=0.4 см2) и в качестве катода никель. Электрод сравнения - серебряная проволока.
Данные электронной микроскопии титанового анода (рис. 7) получены через 5 мин анодного воздействия. На рис. 7 видны продукты полного окисления титана с высокоразвитой поверхностью на электроде из титана. На рис. 7 видна волокнистая структура оксида титана. Длина волокон может составлять от 0.1 до нескольких микрон, толщина волокон соответствует приблизительно 50 нм.
Пример 7
Электрохимическое получение оксида титана проводили из раствора ионной жидкости 1-бутил-3-метил имидазолий гексафторфорфата BMIMPF6, содержащего дистиллированную воду в объемном отношении (V(H2O):V(BMIMPF6)=0.1:1). Процесс проводили при температуре 25°C в течение 30 мин при потенциале Е=5B. В качестве анода использовали титановую фольгу (S=0.4 см2) и в качестве катода никель. Электрод сравнения - серебряная проволока.
Данные электронной микроскопии титанового анода (рис. 8) получены через 30 мин анодного воздействия. На рис. 8 видны продукты полного окисления титана с высокоразвитой поверхностью на электроде из титана. На рис. 8 четко видны наночастицы двух видов: сферические с плотной адгезией с подложкой и стержни, толщиной около 50 нм и длиной около 200 нм.
Электрохимический способ получения наноразмерных структур оксида титана (IV) в виде наносфер, нановолокон или наностержней, включающий анодное окисление титанового электрода в ионной жидкости общей формулы К+А-, где К+ - алкилимидазолий, А- - NTf2 -, или PF6 -, или Cl-, с добавлением воды или пропиленгликоля в атмосфере воздуха, отличающийся тем, что анодное окисление проводят при температуре 20-25°C в течение 5-30 минут при постоянном токе 1-10 мА или при постоянном потенциале 1-10 B.