Способ проведения теста на растворение твердых композиций, содержащих пищеварительные ферменты
Иллюстрации
Показать всеИзобретение относится к способу измерения количества пищеварительных ферментов, высвобождаемых из твердой композиции в среде растворения, посредством флуоресцентной спектроскопии. Сущность способа заключается в том, что твердую композицию панкрелипазы добавляют в первую среду растворения, обладающую рН от примерно 1 до примерно 4,5, затем переносят суспензии во вторую среду растворения, обладающую рН от примерно 5 до примерно 6,8. Далее обеспечивают высвобождение пищеварительных ферментов, производят отбор аликвот среды растворения и снятие показания флуоресценции, рассчитывают количество высвобожденных пищеварительных ферментов. 18 з.п. ф-лы, 5 ил., 6 табл., 12 пр.
Реферат
Область изобретения
[001] Настоящее изобретение относится к способу измерения количества пищеварительных ферментов, которые высвобождаются из твердой композиции в среде растворения, с помощью флуоресцентной спектроскопии. Настоящее изобретение также относится к комбинированному способу измерения как растворения, так и резистентности к действию желудочного сока твердой композиции, содержащей панкрелипазу.
Предпосылки изобретения
[002] Твердая фармацевтическая композиция или лекарственная форма, такая как таблетка или капсула, обычно состоит из смеси активного ингредиента(ов) и наполнителя(ей). Воспроизводимость адсорбции активного ингредиента (лекарственного средства) из формы твердой композиции после перорального введения зависит от нескольких факторов, таких как высвобождение лекарственного средства из композиции и растворение или солюбилизация лекарственного средства в физиологических условиях. Ввиду критического характера высвобождения лекарственного средства из композиции и растворения или солюбилизации лекарственного средства, тест на растворение является весьма значимым для прогнозирования in-vivo эффективности лекарственного средства. Органы, утверждающие лекарственные средства, такие как FDA и ЕМА, часто требуют от фармацевтических компаний определения характеристик высвобождения лекарственного средства для любой новой фармацевтической композиции в целях получения утверждения. Данные тесты также могут являться необходимыми в качестве параметра качества USP для оценки качества фармацевтической композиции от партии к партии, для одобрения препаратов, отмены требований биоэквивалентности или подтверждения запросов в отношении отличных от рекомендуемых требований биоэквивалентности.
[003] Разработаны различные протоколы для проведения in-vitro тестов на растворение, и они регулярно применяются как для разработки препарата, так и для контроля качества. Тест на растворение лекарственного средства в основном проводят с использованием способов и устройств рекомендуемых справочников, таких как фармакопея США и Европейская фармакопея, например, USP 34 <711> и EP 7.2, 2.9.3. Обычно применяемыми в таких тестах средами растворения являются, например, вода и буферы, такие как фосфатные буферы или цитратные буферы. Различные типы приборов для растворения, основанные на разных способах перемешивания, доступны коммерчески и признаны в способах справочников. Данные приборы включают в себя: лопастную мешалку, корзинку, проточную ячейку и поршневой цилиндр. В то время как точные процедуры (протоколы) и приборы различаются, все способы теста на растворение лекарственного средства включают помещение фармацевтической композиции или лекарственной формы в среду растворения и применение определенного перемешивания среды растворения, чтобы активизировать распад и растворение испытываемого лекарственного средства.
[004] Среда растворения и способ обнаружения для определения количества высвобожденного лекарственного средства в среде растворения зависит от (выбирается в зависимости от) химической природы лекарственного средства, при этом физические факторы и факторы стабильности также имеют большое значение в принятии соответствующих вариантов выбора.
[005] Тест капсулы с отсроченным высвобождением панкрелипазы, включенный в монографию USP по определению высвобождения пищеварительных ферментов из фармацевтических лекарственных форм для перорального применения, таких как капсулы с отсроченным высвобождением панкрелипазы, основан на специфическом измерении активности липазы. Такой способ требует длительного времени анализа и характеризуется несколькими недостатками. Основным недостатком является нестабильность маркера-липазы в среде растворения, а точнее в буферной (pH 6,0) среде растворения энтеросолюбильного этапа; необходимо установить степень разрушения липазы, а затем в расчет растворения ввести поправочный коэффициент для учета потери липазной активности во время теста. Кроме того, сложность способа (как в подготовке реагентов/субстратов, так и определении аналитическим путем) значительно увеличивает изменчивость результатов и ухудшает воспроизводимость внутрилабораторных/межлабораторных результатов. Кроме того, анализ липазы обладает узким диапазоном линейности (8-16 единиц USP/мл): это представляет собой существенное ограничение, так как анализ охватывает только концентрацию в капсуле в диапазоне от 6400 до 12800 USP UI/капсула, и, следовательно, осуществить подход тестирования отдельной единицы не является возможным. Длительное время анализа в данном способе ограничивает возможность его применения для определения многоточечного профиля растворения.
[006] Не существует способа/процедуры, описывающих, как преодолеть данные недостатки для определения высвобождения пищеварительных ферментов из твердой композиции.
[007] Пищеварительные ферменты, такие как панкрелипаза и другие продуты панкреатических ферментов (PEP), можно вводить пациентам, страдающим от экзокринной недостаточности поджелудочной железы (EPI); при этом введение добавок из пищеварительных ферментов позволяет пациентам более эффективно переваривать пищу.
[008] Экзокринная недостаточность поджелудочной железы (EPI), от которой по оценкам FDA страдают более 200000 американцев, включает физиологическое расстройство, при котором индивиды не способны должным образом переваривать пищу в связи с недостатком пищеварительных ферментов, производимых их поджелудочной железой. Такая потеря пищеварительных ферментов приводит к таким расстройствам, как нарушенное пищеварение и нарушение всасывания питательных веществ, что приводят к недостаточности питания и другим вытекающим нежелательным физиологическим состояниям, связанным с этим. Данные расстройства являются общими для людей, страдающих от муковисцидоза (CF) и других состояний, нарушающих экзокринную функцию поджелудочной железы, таких как рак поджелудочной железы, панкреатэктомия и панкреатит. Недостаточность питания может представлять опасность для жизни при отсутствии лечения, особенно в случае младенцев и пациентов с CF, и данное расстройство может приводить к нарушению роста, ослаблению иммунного ответа и сокращению продолжительности жизни.
[009] Пищеварительные ферменты, такие как панкрелипаза и другие препараты ферментов поджелудочной железы (PEP), можно вводить для по меньшей мере частичного излечения EPI. Вводимые пищеварительные ферменты обеспечивают пациентов возможностью более эффективного переваривания пищи.
[0010] Ферменты поджелудочной железы, которые применялись при лечении EPI для восполнения утраченной пищеварительной функции, находятся в применении уже более 60 лет. Их использование до недавнего времени не подчинялось современным нормативным рекомендациям, регулирующим утверждение лекарственных средств, основанное на безопасности, эффективности и управлении производством. В последнее время заместительные терапии препаратами ферментов поджелудочной железы стали предметом инициатив регулирующих органов США и Европейских регулирующих органов, которые требуют, чтобы продаваемые препараты ферментов поджелудочной железы, дабы оставаться в торговом обороте, подвергались действующему процессу утверждения лекарственных средств. Zenpep®, Creon® и Pancreaze® являются тремя препаратами, которые успешно прошли процесс, установленный FDA, и одобрены для продажи в Соединенных Штатах. На других территориях/странах, где подобные инициативы продвигаются до сих пор или еще не реализованы, остается доступным разнообразие препаратов ферментов поджелудочной железы.
[0011] Для перорального введения были разработаны капсулы, содержащие пищеварительные ферменты, такие как панкрелипаза. Однако если пациент не может глотать капсулы, каждую капсулу можно открыть и нанести содержимое на небольшое количество пищи, как правило, мягкой, кислой пищи (такой как имеющееся в продаже яблочное пюре), и ввести перорально пациенту с помощью ложки. Альтернативно, такие лекарственные препараты можно вводить перорально младенцам и детям, применяя шприцевое устройство, содержащее содержимое, суспендированное в среде, поддающейся введению таким образом.
[0012] Препараты панкрелипазы обычно обозначены как содержащие три класса ферментов, липазу, амилазу и протеазу, уровни или активность которых перечислены. Данные ферменты катализируют гидролиз жиров до глицерина и жирных кислот, крахмала до декстрина и сахаров, а белков до аминокислот и производных веществ. Пищеварение, однако, является сложным процессом, включающим многие другие ферменты и субстраты, которые способствуют правильному функционированию пищеварения и получению полного набора продуктов переваривания. Другие ферменты, содержащиеся в панкрелипазе, включают среди прочего трипсин, карбоксипептидазы, эластазы, фосфолипазы и холестеразы, а также различные кофакторы и коферменты. Данные вещества естественным путем вырабатываются в поджелудочной железе и также способствуют правильному функционированию пищеварения.
[0013] Панкрелипазу обычно получают из поджелудочных желез свиней, хотя также могут использоваться другие источники, например, описанные в патентных документах США 6051220, 2004/0057944, 2001/0046493 и WO 2006044529, каждый из которых включен в данный документ посредством ссылки во всей своей полноте во всех отношениях.
[0014] Ферменты поджелудочной железы демонстрируют оптимальную активность в близких к нейтральным и слегка щелочным условиях. В условиях желудка ферменты поджелудочной железы могут инактивироваться с потерей в результате биологической активности. Следовательно, экзогенно вводимые ферменты, как правило, защищены от инактивации в желудке и остаются неизмененными во время их прохождения через желудок и в двенадцатиперстную кишку. Поэтому, желательно покрывать ферменты поджелудочной железы оболочкой. Панкреатические липазы наиболее чувствительны к инактивации в желудке и являются ключевыми ферментами в лечении нарушения всасывания. Липазная активность обычно контролируется для определения стабильности ферментной композиции, содержащей липазу. Полное содержание патентного документа США 7658918, выданного Ortenzi и соавт., явным образом включено в данный документ посредством ссылки во всей своей полноте во всех отношениях и описывает стабильные композиции пищеварительных ферментов, а также объясняет, что определенные лекарственные препараты в виде частиц, вводимые перорально, предназначены для прохождения через желудок пациента и последующего высвобождения в кишечнике. Введение надлежащей дозы таких лекарственных препаратов в виде частиц пациентам, особенно младенцам и детям, должно осуществляться максимально точно.
[0015] К сожалению, не описан ни один способ измерения количества пищеварительных ферментов, высвобождаемых из твердой фармацевтической композиции или лекарственной формы, обладающий хорошей точностью и хорошей чувствительностью, и который готов к внедрению в разных лабораториях.
Краткое описание
[0016] Настоящее изобретение относится к способу измерения количества пищеварительных ферментов, высвобождаемых из твердой композиции в среде растворения, с помощью флуоресцентной спектроскопии. Настоящее изобретение также относится к комбинированному способу измерения как растворения, так и резистентности к действию желудочного сока твердых композиций, содержащих панкрелипазу.
Краткое описание фигур
[0017] Фигура 1. Профиль растворения гранул панкрелипазы (минитаблетки Zenpep®) - анализ протеаз (кривая, проведенная через точки средних значений).
[0018] Фигура 2. Профиль растворения гранул панкрелипазы (минитаблетки Zenpep®) - анализ липаз (кривая, проведенная через точки средних значений).
[0019] Фигура 3. Профиль растворения гранул панкрелипазы (минитаблетки Zenpep®) - анализ общего белка с помощью флуоресцентной спектроскопии (кривая, проведенная через точки средних значений).
[0020] Фигура 4a. Профили растворения гранул панкрелипазы (минитаблетки Zenpep®): фермент-специфичные измерения по сравнению с флуорометрическим определением содержания общего белка.
[0021] Фигура 4b. Профили растворения гранул панкрелипазы (минитаблетки Zenpep): анализ липаз по сравнению с флуорометрическим определением содержания общего белка.
[0022] Фигура 4c. Профили растворения гранул панкрелипазы (минитаблетки Zenpep®): анализ протеаз по сравнению с флуорометрическим определением содержания общего белка.
[0023] Фигура 5. Профиль растворения композиций панкрелипазы (Zenpep® и Creon®).
Подробное описание
[0024] Настоящее изобретение относится к способу измерения количества пищеварительных ферментов, высвобождаемых из твердой композиции в среде растворения, с помощью флуоресцентной спектроскопии. Количество измеряется как % пищеварительных ферментов, высвобождаемых из твердой композиции, или лекарственной формы, или единичной лекарственной формы.
[0025] В другом варианте осуществления способа по настоящему изобретению твердая композиция является составом, содержащим панкрелипазу, более конкретно она является композицией панкрелипазы с энтеросолюбильным покрытием, включающей фармацевтически неактивные наполнители.
[0026] В другом варианте осуществления способ включает этапы: (a) обеспечения высвобождения пищеварительных ферментов из твердой композиции панкрелипазы в среде растворения, (b) снятия показания флюоресценции для измерения в среде количества пищеварительных ферментов.
[0027] В другом варианте осуществления настоящего изобретения средой растворения является вода, раствор HCl, воспроизводимый желудочный сок, буферный раствор, воспроизводимый кишечный сок или водный или буферный раствор, содержащий по меньшей мере одно поверхностно-активное вещество.
[0028] В другом варианте осуществления среда растворения состоит по меньшей мере из двух сред, которые применяются последовательно. С помощью настоящего способа также можно осуществлять двухэтапный тест на растворение. Первый этап является кислотным этапом, и среда растворения представляет собой водную среду, обладающую кислым pH, таким как pH в диапазоне от примерно 1 до примерно 4,5, или от примерно 1 до примерно 2, или примерно 1,2. Второй этап осуществляют во второй среде растворения, которая представляет собой водный буферный раствор, обладающий pH выше 5, или от примерно 5,5 до примерно 6,8, или примерно 6.
[0029] В способе согласно настоящему изобретению методика, применяемая для обнаружения пищеварительных ферментов, высвобождаемых из композиции в среде растворения, является флуоресцентной спектроскопией.
[0030] Молекулы обладают различными состояниями, называемыми энергетическими уровнями. Флуоресцентная спектроскопия в первую очередь связана с электронным и колебательным состояниями. Как правило, рассматриваемые образцы обладают основным электронным состоянием и возбужденным электронным состоянием более высокой энергии. В пределах каждого из данных электронных состояний существуют различные колебательные состояния. При флуоресцентной спектроскопии образец сначала возбуждается, поглощая фотон, от его основного электронного состояния до одного из различных колебательных состояний в возбужденном электронном состоянии. Затем молекула снова опускается до одного из различных колебательных уровней основного электронного состояния, испуская в данном процессе фотон. Так как молекулы могут опускаться на любой из нескольких колебательных уровней в основном состоянии, испускаемые фотоны будут обладать различными энергиями и, соответственно, частотами. Флуоресцентный ответ белка обусловлен присутствием аминокислот, содержащих ароматический фрагмент (триптофан, тирозин или фенилаланин). Флуоресцентный ответ белка обычно получают с помощью длины волны возбуждения 280 нм. Большинство испусканий флуоресценции в белках обусловлены возбуждением остатков триптофана, с небольшим участием тирозина и фенилаланина.
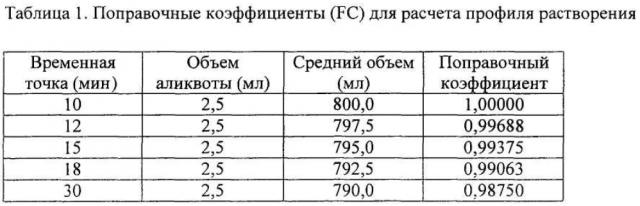
[0031] Флуорометрический способ, раскрытый в данном документе, основан на измерении содержания общего белка пищеварительных ферментов (панкрелипаза, API), высвобождаемых в среде растворения из композиции или лекарственной формы, содержащей указанные ферменты. Фраза "общий белок", применяемая в данном документе, указывает на все белки, которые высвобождаются готовой лекарственной формой, то есть все белки, присутствующие в исходной твердой композиции, такие как липазы, протеазы и амилазы. Для получения точного значения высвобожденного API, стандарт, предпочтительно применяемый в данном способе, получают с помощью той же партии тестируемой готовой лекарственной формы, но измельчая и высыпая ее в ту же среду растворения с получением 100% растворенного API. Растворение тестируемой навески измеряется как процент фракции по отношению к стандартному препарату.
[0032] Способ по настоящему изобретению можно применять к твердым композициям панкрелипазы, которые могут содержать фармацевтически неактивные наполнители, таким как любая подходящая лекарственная форма для перорального применения, которая содержит пищеварительные ферменты. Неограничивающие примеры подходящих лекарственных форм включают таблетки, капсулы, саше или единичные лекарственные формы. В конкретном варианте осуществления лекарственная форма является капсулой. Каждая лекарственная форма содержит гранулы пищеварительных ферментов (также называемые единицами) из API (лекарственное средство). В отношении настоящего изобретения гранулы пищеварительных ферментов являются частицами любого вида. Термин "гранула" включает гранулу, частицу, таблетку, сферу, минитаблетку, микротаблетку, микрочастицу, микросферу, минимикросферу, микрокапсулу и микропеллету. Гранула может иметь любой подходящий размер частицы или форму; в частности, обладать размером в диапазоне от примерно 50 до примерно 5000 мкм, более конкретно, она может обладать номинальным (например, средним) диаметром частиц в диапазоне от примерно 2 до примерно 5 мм, или менее примерно 2 мм, например, примерно 1-2 мм. "Минимикросферы", обладающие наименьшим медианным размером в 1,15 мм, или "микротаблетки", обладающие наибольшим медианным размером в 2,63 мм, также пригодны для настоящего способа. Гранулы могут обладать средним размером меньше 800 мкм, предпочтительно меньше 500 мкм, предпочтительно от примерно 400 мкм до примерно 600 мкм или от примерно 250 мкм до примерно 500 мкм. Данные гранулы могут обладать объемным диаметром (d(v,0,1) (определяется как диаметр, где 10% объемного распределения находится ниже данного значения, а 90% находится выше данного значения) не меньше 400 мкм и объемным диаметром d(v,0,9) (определяется как диаметр, где 90% объемного распределения находится ниже данного значения, а 10% находится выше данного значения) не больше 900 мкм.
[0033] Все гранулы пищеварительных ферментов, более конкретно, гранулы ферментов панкрелипазы, пригодные для получения фармацевтических препаратов, могут быть покрыты энтеросолюбильным слоем. В вариантах осуществления, где панкрелипазные сердцевины окружены энтеросолюбильным покрытием, покрытие действует в качестве барьера, защищая лекарственное средство от кислой среды желудка, и в значительной степени препятствует высвобождению лекарственного препарата до достижения им тонкой кишки. Подходящие комбинации композиций энтеросолюбильных покрытий с другими композициями покрытий могут применяться для получения требуемого типа контроля над высвобождением лекарственного средства или терапевтическими эффектами. Энтеросолюбильное покрытие включает по меньшей мере один энтеросолюбильный полимер и дополнительные наполнители. Фраза "энтеросолюбильный полимер" означает полимер, который защищает пищеварительные ферменты от желудочного содержимого, например полимер, который является стабильным при кислом pH, но может быстро распадаться при более высоком pH, или полимер, скорость гидратации или эрозии которого достаточно медленная, чтобы гарантировать, что контакт желудочного содержимого с пищеварительными ферментами является относительно небольшим, пока он находится в желудке, в отличие от остальной части желудочно-кишечного тракта. Неограничивающими примерами полимеров, резистентных к действию желудочного сока, являются целлюлозы ацетатфталат, гидроксипропилметилцеллюлозы фталат, гидроксипропилметилцеллюлозы ацетата сукцинат, поливинилацетата фталат, сополимеры метакриловой кислоты, сложные эфиры метилметакрилата и шеллак. Данные полимеры имеются в продаже под различными торговыми названиями, например, Cellacefate® (целлюлозы ацетатфталат), Eudragit® L100, S100, L30D, FS30D, L100-55 (сополимеры метакриловой кислоты), Aquateric® (целлюлозы ацетатфталат), Aqoat® (гидроксипропилметилцеллюлозы ацетата сукцинат), НР55® (гидроксипропилметилцеллюлозы фталат). Предпочтительно энтеросолюбильное покрытие включает: 10-20 вес.% по меньшей мере одного энтеросолюбильного полимера; где каждый упомянутый вес.% основан на общем весе частиц с покрытием. Покрытие может дополнительно включать липофильное средство, такое как С6-С30 липофильные молекулы с низким молекулярным весом, которые выбирают из алифатических карбоновых кислот и спиртов, предпочтительно С14-С18 карбоновых кислот или спиртов, таких как стеариновая кислота, миристиновая кислота, миристиновый спирт или стеариловый спирт.Другими необязательными ингредиентами покрытия являются пластификаторы, антиадгезионные средства (такие как тальк, стеарат магния, коллоидный диоксид кремния и их комбинации; дополнительно, необязательно этилцеллюлоза с низкой вязкостью). Неограничивающие примеры подходящих пластификаторов включают триацетин, трибутилцитрат, триэтилцитрат, ацетилтри-н-бутилцитрат, диэтилфталат, дибутилсебацинат, полиэтиленгликоль, полипропиленгликоль, касторовое масло, ацетилированные моно- и диглицериды, цетиловый спирт, миристиловый спирт и их смеси. Предпочтительным пластификатором является нефталатный пластификатор или его смеси.
[0034] Покрытые стабилизированные частицы пищеварительных ферментов затем можно составлять в капсулы. Особой лекарственной формой стабилизированных частиц пищеварительных ферментов является капсула, заполненная гранулами панкрелипазных ферментов с энтеросолюбильным покрытием. Капсулы, содержащие панкрелипазные ферменты с энтеросолюбильным покрытием, включающим гидроксипропилметилцеллюлозу с содержанием воды примерно 6 вес.% или меньше, являются конкретным вариантом осуществления лекарственной формы; более конкретно, с содержанием воды примерно 4 вес.% или меньше; еще более конкретно с содержанием воды примерно 2 вес.% или меньше.
[0035] Термин "пищеварительный фермент", применяемый в данном документе, обозначает фермент в пищеварительном тракте, который расщепляет компоненты пищи так, что они могут потребляться или поглощаться организмом. Неограничивающие примеры пищеварительных ферментов включают панкрелипазу (также упоминаемую как панкреатин), липазу, колипазу, трипсин, химотрипсин, химотрипсин В, панкреатопептидазу, карбоксипептидазу А, карбоксипептидазу В, гидролазу сложных эфиров глицерина, фосфолипазу, гидролазу сложных эфиров стерина, эластазу, кининогеназу, рибонуклеазу, дезоксирибонуклеазу, α-амилазу, папаин, химопапаин, глютеназу, бромелаин, фицин, β-амилазу, целлюлазу, β-галактозидазу, изомальтазу и их смеси. Их получают путем экстракции из поджелудочной железы или сока поджелудочной железы, или производят искусственно, или получают из источников помимо поджелудочной железы, таких как микроорганизмы, бактерии, плесени, грибы, растения или ткани других животных, генетически модифицированные микроорганизмы, грибы или растения.
[0036] Термины "панкрелипаза", или "панкрелипазные ферменты", или "панкреатин" означают смесь нескольких типов ферментов, включая амилазные, липазные и протеазные ферменты, или их смесь панкреатического происхождения. В продаже имеется панкрелипаза, например, от Nordmark Arzneimittel GmbH, Scientific Protein Laboratories LLC или Sigma Aldrich; а также могут применяться подобные экстракты, источниками которых являются свиньи, крупный рогатый скот или другие млекопитающие. Примеры коммерческих составов панкрелипазы включают Zenpep, Viokace, Ultrase, Creon, Pancreaze и Panzytrat; более конкретно, капсула Zenpep для перорального введения содержит гранулы с энтеросолюбильным покрытием (1,8-1,9 мм для 750, 3000, 5000 липазных единиц USP, 2,2-2,5 мм для 10000, 15000, 20000, 25000 и 40000 липазных единиц USP).
[0037] Термин "липаза" означает фермент, который катализирует гидролиз липидов до глицерина и простых жирных кислот.Примеры липаз, подходящих для настоящего изобретения, включают без ограничений липазу животных (например, липазу свиней), липазу бактерий (например, липазу из Pseudomonas и/или липазу из Burkholderia), липазу грибов, липазу растений, рекомбинантную липазу (например, полученную путем технологии рекомбинантной ДНК с помощью подходящей культивируемой клетки-хозяина, которую выбирают из любых клеток-хозяев из микроорганизмов, бактерий, дрожжей, грибов, растений, насекомых или млекопитающих, или рекомбинантные липазы, что включают аминокислотную последовательность, которая является гомологичной или практически идентичной встречающейся в природе последовательности, липазы, кодируемые нуклеиновой кислотой, которая является гомологичной или практически идентичной встречающейся в природе кодирующей липазу нуклеиновой кислоте, и т.д.), синтетическую липазу, химически модифицированную липазу и их смеси. Термин "липиды" в широком смысле включает встречающиеся в природе молекулы, в том числе жиры, воски, стерины, жирорастворимые витамины (такие как витамины A, D, Е и K), моноглицериды, диглицериды, триглицериды, фосфолипиды и т.д.
[0038] Термин "амилаза" относится к ферментам гликозидгидролазам, которые расщепляют крахмал, например, α-амилазы, β-амилазы, γ-амилазы, кислые α-глюкозидазы, амилазы слюны, такие как птиалин, и т.д. Амилазы, подходящие для применения в настоящем изобретении, включают без ограничений амилазы животных, амилазы бактерий, амилазы грибов (к примеру амилазу из Aspergillus, например амилазу из Aspergillus oryzae), амилазы растений, рекомбинантные амилазы (например, получаемые путем технологии рекомбинантной ДНК с помощью подходящей культивируемой клетки-хозяина, которую выбирают из любых клеток-хозяев из микроорганизмов, бактерий, дрожжей, грибов, растений, насекомых или млекопитающих, или рекомбинантные амилазы, что включают аминокислотную последовательность, которая является гомологичной или практически идентичной встречающейся в природе последовательности, амилазы, кодируемые нуклеиновой кислотой, которая является гомологичной или практически идентичной встречающейся в природе кодирующей амилазу нуклеиновой кислоте, и т.д.), химически модифицированные амилазы и их смеси.
[0039] Термин "протеаза" относится, как правило, к ферментам (например, протеиназам, пептидазам или протеолитическим ферментам), которые разрушают пептидные связи между аминокислотами белков. Протеазы, как правило, идентифицируют по их каталитическому типу, например, пептидазы аспарагиновой кислоты, цистеиновые (тиол) пептидазы, металлопептидазы, сериновые пептидазы, треониновые пептидазы, щелочные или полущелочные протеазы, нейтральные пептидазы и пептидазы неизвестного каталитического механизма. Неограничивающие примеры протеаз, подходящих для применения в настоящем изобретении, включают сериновые протеазы, треониновые протеазы, цистеиновые протеазы, протеазы аспарагиновой кислоты (например, плазмепсин), металлопротеазы и протеазы глутаминовой кислоты. В дополнение, протеазы, подходящие для применения в настоящем изобретении, включают без ограничения протеазы животных, протеазы бактерий, протеазы грибов (например, протеаза из Aspergillus melleus), протеазы растений, рекомбинантные протеазы (например, получаемые путем технологии рекомбинантной ДНК с помощью подходящей культивируемой клетки-хозяина, которую выбирают из любых клеток-хозяев из бактерий, дрожжей, грибов, растений, насекомых или млекопитающих, или рекомбинантные протеазы, что включают аминокислотную последовательность, которая является гомологичной или практически идентичной встречающейся в природе последовательности, протеазы, кодируемые нуклеиновой кислотой, которая является гомологичной или практически идентичной встречающейся в природе кодирующей протеазу нуклеиновой кислоте, и т.д.), химически модифицированные протеазы и их смеси.
[0040] Панкрелипазные ферменты композиций или пероральных лекарственных форм, анализируемых в настоящем изобретении, могут включать одну или несколько липаз (т.е. одну липазу, или две, или больше липаз), или одну или несколько амилаз (т.е. одну амилазу, или две, или больше амилаз), или одну или несколько протеаз (т.е. одну протеазу, или две, или больше протеаз), а также смеси данных ферментов в различных комбинациях и соотношениях.
[0041] Активность липазы в композициях или лекарственных формах, подлежащих анализу с помощью способа по настоящему изобретению, может составлять от примерно 650 до примерно 45000 ME (способ USP), от примерно 675 до примерно 825 ME, от примерно 2700 до примерно 3300 ME, от примерно 4500 до примерно 5500 ME, от примерно 9000 до примерно 11000 ME, от примерно 13500 до примерно 16500 ME, от примерно 18000 до примерно 22000 ME, от примерно 22500 до примерно 27500 ME, от примерно 36000 до примерно 44000 ME, включая все диапазоны и поддиапазоны между ними. Активность липазы может составлять примерно 750, примерно 3000, примерно 4200, примерно 5000, примерно 6000, примерно 10000, примерно 10500, примерно 15000, примерно 16800, примерно 20000, примерно 21000, примерно 24000, или примерно 25000, или примерно 40000 ME (способ USP), или кратную им величину. Активность амилазы в композициях или лекарственных формах может составлять от примерно 1600 до примерно 6575 ME (способ USP), от примерно 6000 до примерно 225000 ME, например, от примерно 6400 до примерно 26300 ME, от примерно 10700 до примерно 43800 ME, от примерно 21500 до примерно 87500 ME, от примерно 32100 до примерно 131300 ME, от примерно 42900 до примерно 175000 ME, от примерно 53600 до примерно 218700 ME, включая все диапазоны и поддиапазоны между ними. Активность протеаз в композициях или лекарственных формах может составлять от примерно 1250 до примерно 3850 ME (способ USP), от примерно 5000 до примерно 130000 ME, например, от примерно 5000 до примерно 15400 ME, от примерно 8400 до примерно 25700 ME, от примерно 16800 до примерно 51300 ME, от примерно 25000 до примерно 77000 ME, от примерно 33500 до примерно 102600 ME, от примерно 41800 ME до примерно 128300 ME, включая все диапазоны и поддиапазоны между ними. Комбинированные ферментные композиции включают следующее: (А) активность липазы может находиться в диапазоне от примерно 675 до примерно 825 ME, активность амилазы от примерно 1600 до примерно 6575 ME, и активность протеазы от примерно 1250 до примерно 3850 ME (способ USP); (В) активность липазы может находиться в диапазоне от примерно 2700 до примерно 3300 ME, активность амилазы от примерно 6400 до примерно 26300 ME, и активность протеазы от примерно 5000 до примерно 15400 ME (способ USP); (С) активность липазы может находиться в диапазоне от примерно 4500 до примерно 5500 ME, активность амилазы от примерно 10700 до примерно 43800 ME, и активность протеазы от примерно 8400 до примерно 25700 ME (способ USP); (D) активность липазы может находиться в диапазоне от примерно 9000 до примерно 11000 ME, активность амилазы от примерно 21500 до примерно 87500 ME, и активность протеазы от примерно 16800 до примерно 51300 ME (способ USP); (Е) активность липазы от примерно 13500 до примерно 16500 ME, активность амилазы от примерно 32100 до примерно 131300 ME, и активность протеазы от примерно 25000 до примерно 77000 ME (USP); (F) активность липазы может находиться в диапазоне от примерно 18000 до примерно 22000 ME, активность амилазы от примерно 42900 до примерно 175000 ME, и активность протеазы от примерно 33500 до примерно 102600 ME (USP); и (G) активность липазы может находиться в диапазоне от примерно 22500 до примерно 27500 ME, активность амилазы от примерно 53600 до примерно 218700 ME, и активность протеазы от примерно 41800 ME до примерно 128300 ME (USP). Также активность липазы в композициях или лекарственных формах, подлежащих анализу с помощью способа по настоящему изобретению, может находиться в диапазоне от примерно 5000 липазных единиц PriEur до примерно 40000 липазных единиц PhEur, она может составлять примерно 5000, или примерно 10000, или примерно 15000, или примерно 20000, или примерно 30000, или примерно 40000 липазных единиц PhEur.
[0042] В другом варианте осуществления настоящего изобретения также отдельные единицы, содержащие фракцию с перечисленными выше значениями активности амилазы, также можно анализировать с помощью настоящей методики.
[0043] В другом варианте осуществления настоящего изобретения также отдельные единицы, содержащие фракцию с перечисленными выше значениями активности амилазы, также можно анализировать с помощью настоящего способа.
[0044] Отношение активностей амилазы/липазы в композициях или лекарственных формах может находиться в диапазоне от примерно 1 до примерно 10, например, от примерно 2,38 до примерно 8,75 (ферментативный анализ выполняется в соответствии с USP). Данное отношение может находиться в диапазоне от примерно 1 до примерно 8, например, от примерно 1,86 до примерно 5,13 (ферментативный анализ выполняется в соответствии с USP), или отношение может составлять примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9 или примерно 10.
[0045] Неактивные ингредиенты препарата включают кроскармеллозу натрия, гидрогенизированное касторовое масло, коллоидный диоксид кремния, микрокристаллическую целлюлозу, стеарат магния, гипромеллозы фталат, тальк и триэтилцитрат. Каждая доза препаратов Aptalis Pharma предоставляет пациентам и врачам постоянное количество основных панкреатических ферментов, липазы, протеазы и амилазы, благодаря их высокоустойчивому составу. Можно открывать капсулы и разделять содержимое для индивидуальной корректировки дозы.
[0046] Согласно другому варианту осуществления настоящего изобретения способ включает этапы: (а) обеспечения высвобождения пищеварительных ферментов из твердой композиции панкрелипазы в среде растворения, (b) снятия показания флюоресценции для обнаружения ферментов и измерения количества пищеварительных ферментов в среде. Тест на растворение проводят с использованием оборудования для растворения, описанного в справочниках способов USP или EMA, или с использованием всего такого оборудования и протоколов, которые известны и применяются специалистами данной области. Среду растворения выбирают из различных растворов, подходящих для тестирования растворения общего белка, таких как вода, растворы HCl, воспроизводимый желудочный сок, буферные растворы, воспроизводимый кишечный сок, водные или буферные растворы, содержащие поверхностно-активные вещества. Буферные растворы могут являться, например, фосфатными буферами или цитратными буферами.
[0047] В конкретном варианте осуществления среда растворения состоит по меньшей мере из двух сред растворения, которые применяются последовательно (два этапа). Первая среда растворения является водной средой с кислым pH от примерно 1 до 4,5, в частности, от примерно 1 до примерно 2, более конкретно с pH примерно 1,2 (кислотный этап), а вторая среда растворения является водным раствором с pH выше примерно 5,0, в частности, от примерно 5,5 до примерно 6,8, более конкретно с pH примерно 6 (буферный энтеросолюбильный этап).
[0048] В другом варианте осуществления настоящего изобретения первая среда растворения является водной средой с pH от примерно 1 до примерно 4,5, а вторая среда растворения является водным буферным раствором с pH выше примерно 5.
[0049] В другом варианте осуществления первая среда растворения является водной средой с pH от примерно 1 до примерно 4,5, а вторая среда растворения является водным буферным раствором с pH от примерно 5,5 до примерно 6,8.
[0050] В другом варианте осуществления настоящего изобретения первая среда растворения является водной средой с pH от примерно 1 до примерно 2, а вторая среда растворения является водным буферным раствором с pH выше примерно 5.
[0051] В другом варианте осуществления настоящего изобретения первая среда растворения является водной средой с pH от примерно 1 до примерно 2, а вторая среда растворения является водным буферным раствором с pH от примерно 5,5 до прим