Средство адресной доставки лекарств в клетки и способ его применения
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к средству адресной доставки лекарств в клетки. Средство для адресной доставки лекарственного средства в клетки содержит природного происхождения нанотрубки галлуазита, которые отмывают в этаноле и воде, помещают в емкость с жидким лекарственным средством, вносят в вакуумный десикатор, где полости нанотрубок заполняются лекарством. Заполненные лекарством нанотрубки извлекают из десикатора и повторно отмывают в воде, высушивают, перемалывают, вносят в раствор ферментно-деградируемого вещества - декстрина. Емкость с раствором ферментно-деградируемого вещества - декстрина и загруженными лекарством нанотрубками повторно помещают в вакуумный десикатор и выдерживают, затем извлекают из десикатора и отмывают от излишков декстрина. Осуществление изобретения позволяет создать биосовместимое наноразмерное средство адресной доставки лекарственных препаратов, обеспечивающих активацию препарата только при попадании в клетку и избирательное его накопление внутри клеток. 1 з.п. ф-лы, 2 ил.
Реферат
Изобретение относится к области технологических процессов. Может быть использовано в химии, биологии, медицине и ветеринарии.
Одной из основных проблем лечения заболеваний, например - онкологических, путем химиотерапии является потребность повышения избирательности действия лекарственного препарата в очаге болезни без повреждения окружающих здоровых клеток организма. Этим объясняется большой интерес к развитию систем адресной доставки лекарств и таргетной терапии в последние десятилетия [1].
Известен способ, когда в качестве носителя лекарственного препарата используют микрочастицы из клеточной мембраны, а в качестве химиотерапевтического препарата - доксорубицин [2].
Недостатком [2] является то, что система доставки лекарств имеет одинаковую (высокую) степень сродства и действует одинаково как на раковые, так и на обычные клетки. Доксорубицин проявляет большую специфичность к опухолевым клеткам, но при этом токсичен и для здоровых клеток. У используемого по способу в качестве носителя препарата микрочастиц отсутствует способность адресной доставки своего груза. Поэтому не обеспечивается целенаправленная доставка доксорубицина только к раковым клеткам. То есть, одинаковым оказывается количество цитотоксичного лекарственного препарата, доставленного как к клеткам-мишеням, так и здоровым клеткам в организме. В итоге отсутствие направленности при доставке снижает эффективность действия препарата и вызывает повреждение здоровых клеток. Недостаток существенно ограничивает результативность лечебного процесса с использованием способа [2].
Известен способ [3] цитотоксического действия на опухолевые клетки при помощи совместного воздействия коллоидного раствора наночастиц серебра в концентрации 34 мкг/мл и СВЧ-облучения частотой 915 МГц. Воздействие осуществляют в течение 30 мин. Способ обеспечивает существенное увеличение цитотоксического эффекта, при этом процент погибших клеток К562 достигает 95%, а клеток плоскоклеточного рака полости рта - 100%. Наночастицы серебра оказывают лечебный эффект, действуя в совокупности с СВЧ-излучением. Результат воздействия по способу на здоровые ткани из описания патента не определяется. При этом общеизвестно воздействие серебра на любые живые организмы, в том числе - и токсическое.
Недостатком способа [3] является отсутствие избирательности при адресной доставке наночастиц серебра к пораженным клеткам и гарантии безопасности здоровых клеток, окружающих пораженные, нуждающиеся в лечении ткани. Применение [3] чревато опасностью для здоровья пациента, ибо неосуществим контроль за локализацией наночастиц в теле больного. А это означает, что они (наночастицы) бесконтрольно разносятся по всему организму и оказывают цитотоксичное влияние на здоровые клетки под воздействием СВЧ-облучения. Недостаток существенно снижает лечебный эффект и ограничивает область применения способа [3].
Наиболее близким по существу заявляемого изобретения, прототипом, является способ получения наноразмерного средства доставки лекарств на основе мезопористых наночастиц кремния с ферментно-активируемым покрытием [4]. Способ основан на первоначальной обработке олигосахаридов 3-аминопропилтриэтоксисиланом, получении и закреплении алкоксиланов на поверхности мезопористых наночастиц кремния, используемых в качестве средства адресной доставки. Недостатком является то, что прототип [4] основан на использовании пористых наночастиц кремния, для которых характерен весьма малый размер пор - от 3 до 7 нм, что делает невозможным загрузку и адресную доставку лекарственных средств с большой молекулярной массой (и размерами), например - белков. Другим недостатком [4] является одинаковость механизма поглощения носителей - пористых наночастиц кремния - как опухолевыми, так и здоровыми клетками. Это делает невозможным осуществление избирательного, адресного действия доставляемого препарата только на раковые клетки. При использовании пористых наночастиц кремния выявлено наличие существенных морфологических изменений в селезенке и печени, нарушений работы иммунной системы животных [5]. Кроме того, способ получения этого наноразмерного средства доставки весьма сложный и трудоемкий. Недостатки прототипа [4] существенно ограничивают область его применения.
Целью предлагаемого изобретения является создание биосовместимого наноразмерного средства адресной доставки лекарственных препаратов, обеспечивающего активацию препарата только при попадании в клетку и избирательное его (препарата) накопление внутри клеток.
Цели достигают тем, что природного происхождения нанотрубки галлуазита отмывают в этаноле и воде, помещают в емкость с жидким лекарственным средством, вносят в вакуумный десикатор, где полости нанотрубок заполняются лекарством. Заполненные лекарством нанотрубки извлекают из десикатора. Эти нанотрубки повторно отмывают в воде, высушивают, перемалывают, вносят в раствор ферментно-деградируемого вещества - декстрина, емкость с раствором ферментно-деградируемого вещества - декстрина и загруженными лекарством нанотрубками повторно помещают в вакуумный десикатор и выдерживают. Затем загруженные лекарством и упакованные декстрином нанотрубки галлуазита извлекают из десикатора, отмывают от излишков ферментно-деградируемого вещества - декстрина и используют по назначению. Средство используют для адресной доставки препаратов цитотоксического действия в опухолевые клетки организма.
Заявляемое изобретение осуществляют, например, следующим путем для адресной доставки лекарственного средства. В примере в качестве лекарственного средства используют, например, синтетический анилиновый краситель трифенилметанового ряда - тетраэтил-4,4-диаминотрифенилметана оксалат (далее по тексту - бриллиантовый зеленый), проявляющий выраженный противоопухолевый эффект [6]. Бриллиантовый зеленый является и весьма удобной моделью для наблюдений при отработке методики применения. Пример с использованием в качестве адресно-доставляемого лекарственного средства бриллиантового зеленого не ограничивает применимость заявляемого способа для адресной доставки широкого перечня иных лекарственных средств цитотоксического действия.
Берут известные природного происхождения алюмосиликатные нанотрубки галлуазита, например - фирмы Applied Minerals Inc. (КНР) и готовят их для использования в качестве средства адресной доставки вещества, например - бриллиантового зеленого. Нанотрубки отмывают, например - при комнатной температуре, двукратно - этанолом, затем - стерильной водой, после чего диспергируют в ультразвуковой бане [7], завершают подготовку нанотрубок для загрузки их адресно доставляемым веществом.
В качестве доставляемого вещества используют бриллиантовый зеленый. Изготавливают спиртовый раствор: 1%-й раствор бриллиантового зеленого в 60%-ном этаноле. К 100 мг отмытых нанотрубок галлуазита в пробирке добавляют 1 мл 1%-ного раствора бриллиантового зеленого в 60%-ном этаноле и пробирку вносят в ультразвуковое поле, например - интенсивностью 21 W/м2, на 30 сек. Пробирку с нанотрубками галлуазита в растворе бриллиантового зеленого помещают в вакуумный десикатор, например на 0,5 час, и загружают бриллиантовый зеленый в полость нанотрубок галлуазита. Завершив загрузку (бриллиантового зеленого), нанотрубки отмывают от оставшегося незагруженного бриллиантового зеленого, например - путем промывания, например - двукратного, суспензии стерильной водой, с последующим центрифугированием, например - в течение 5 мин при 6 тыс. оборотах в минуту. Загруженные бриллиантовым зеленым нанотрубки галлуазита высушивают, например - при плюс 45°C и перемалывают до состояния пудры. Составляющие пудру, загруженные цитотоксическим лекарственным препаратом, например - бриллиантовым зеленым, нанотрубки упаковывают, например - путем обработки веществом, деградирующим (разрушающимся) при воздействии внутриклеточных ферментов (далее по тексту - ферментно-деградируемым веществом), например - декстрином. Упаковку загруженных нанотрубок выполняют, например, следующим путем.
В пробирку берут 10 мг загруженных нанотрубок, смешивают с 1 мл водного раствора декстрина (10 мг/мл) и вносят в поле ультразвука, например - интенсивностью 7 W/м2, на время не более 10 секунд. Затем пробирку с нанотрубками галлуазита и ферментно-деградируемым веществом - декстрином помещают в вакуумный десикатор на 1 час, где декстрин обволакивает нанотрубки и закупоривает открытые концы нанотрубок. После пребывания в вакуумном десикаторе дважды производят отмывку загруженных бриллиантовым зеленым и закупоренных декстрином нанотрубок стерильной водой от не связавшегося декстрина, например - путем центрифугирования в течение 5 мин при 6 тыс.оборотах в минуту.
В итоге получают загруженные лекарством нанотрубки галлуазита в декстрине - средство для адресной доставки лекарства (бриллиантового зеленого) в клетки организма, например - человека. Внутри организма средство доставки с лекарственным препаратом распространяется в ходе естественных процессов жизнедеятельности (организма). При этом декстриновое покрытие обеспечивает целенаправленный адресный выход вещества - только внутри клетки. Адресный выход доставленного вещества обеспечивается за счет деградации (разрушения) декстриновой упаковки под действием только внутриклеточных ферментов, а именно - гликозид-гидролаз (отсутствующих вне клетки). После разрушения декстриновой пробки доставленное лекарственное средство постепенно вытекает из средства доставки (нанотрубки) и оказывает пролонгированное действие внутри клетки. Так достигают цели изобретения.
Полученное средство доставки (вещества) одновременно решает ряд проблем в терапии, а именно: повышает точность доставки по адресу (внутрь клеток) лекарственного вещества, обеспечивает повышенную эффективность его (лекарства) действия, например - при онкологических заболеваниях - за счет преимущественного накопления цитотоксичного препарата внутри опухолевых клеток и пролонгированного выхода его (препарата) из носителя.
Существенным преимуществом заявляемого изобретения являются большие, по сравнению с прототипом (размер пор - от 3 до 7 нм), размеры полости (диаметр 15 нм, длина до 800 нм) средства доставки, используемого для загрузки цитотоксичного препарата. Это позволяет осуществлять адресную доставку подавляющего большинства лекарственных препаратов, в том числе - состоящих из макромолекул, например -полипептидов.
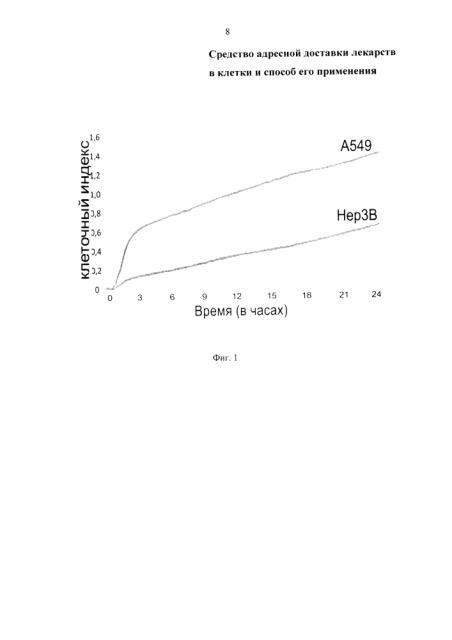
Преимущественное накопление нанотрубок внутри опухолевых, например -раковых, клеток обусловлено установленным заявителем фактом: чем выше скорость метаболизма и пролиферации клеток - тем больше степень поглощения ею (клеткой) нанотрубок. На Фиг. 1 показаны результаты измерения клеточного индекса двух раковых клеточных линий человека А549 и Hep3b. Эти значения коррелируют со скоростью деления клеток - клетки А549 делятся примерно в два раза быстрее, чем Hep3b. На Фиг. 2 приведены фотографии просвечивающей электронной микроскопии клеток А549 (2.1) и Hep3b (2.2), которые росли в течение 24 часов вместе с нанотрубками галлуазита. Результаты (Фиг. 2) показывают, что вдвое быстрее делящиеся клетки А549 (по Фиг. 1) поглощают нанотрубки галлуазита (черные области) в значительно большем количестве, чем Hep3b. А высокая степень пролиферации (деления) является характерной чертой опухолевых клеток. Следствием высокой степени пролиферации является преимущественное, по сравнению со здоровыми клетками, адресное накопление заряженных лекарственным препаратом нанотрубок в опухолевых клетках. Это обстоятельство обеспечивает избирательное действие химиопрепарата, доставленного преимущественно (в большем количестве) в опухолевые клетки. Здоровые клетки имеют низкую, по сравнению с опухолевыми, скорость деления, поэтому они поглощают нанотрубки с цитотоксином в существенно меньшей степени (до 2,5 раз), в здоровые клетки поступает меньшее количество цитотоксина. Это обеспечивает минимизацию их (здоровых клеток) повреждения. Необходимую для достижения лечебного эффекта с максимальным воздействием на опухолевые клетки при минимальном вредном воздействии на здоровые клетки концентрацию лечебного препарата регулируют изменением дозировки вводимого в организм препарата. Дозировку определяют опытным путем, индивидуально для подвергаемого лечению субъекта, например - путем использования выделенных из организма здоровых и опухолевых клеток. Возможную эффективность действия адресно-доставляемого лекарства определяют до назначения химиотерапевтических препаратов с органоспецифической токсичностью (например, эхокардиографией до назначения доксорубицина). Модификация доз препаратов или исключения отдельных из них может быть необходима у больных с хроническими заболеваниями легких (блеомицин), почечной недостаточностью (метотрексат), дисфункцией печени (таксаны).
Закрытость просвета нанотрубок ферментно-деградируемым веществом - декстрином препятствует преждевременному выходу токсического препарата в межклеточную жидкость. Это делает заявляемое средство в процессе доставки (по пути движения и вокруг очага) безопасным для окружающих клеток и обеспечивает максимальную эффективность действия на раковые клетки за счет целенаправленного и преимущественного его (средства доставки цитотоксина) накопления внутри опухолевых клеток. Загруженные цитотоксином, например - бриллиантовым зеленым, и проникшие внутрь опухолевых клеток носители подвергаются действию внутриклеточных ферментов (гликозид-гидролаз), которые (ферменты) расщепляют, разрушают декстриновое покрытие носителя (нанотрубок), ранее препятствовавшее выходу лекарственного препарата. После разрушения внутриклеточными ферментами (гликозид-гидролазами) декстринового покрытия препарат (цитотоксин) выходит из носителя и начинает действовать, причем преимущественно - внутри пораженных болезнью клеток, интенсивно поглотивших носители вследствие присущей им высокой степени пролиферации (деления) - в отличие от здоровых клеток с существенно меньшей (в десятки раз) степенью пролиферации. Благодаря меньшей степени пролиферации здоровых клеток количество доставленного и выделяющегося в здоровых клетках цитотоксина, например - бриллиантового зеленого, регулируемо поддерживают ниже порогового значения, проявляющего цитотоксическое действие, например - изменением дозировки вводимого цитотоксина.
Описываемые результаты показывают и подтверждают достижение цели заявляемого изобретения.
Приведенные примеры применения предполагаемого изобретения показывают его полезность для лечения различных патологий людей, в том числе и онкологических. Изобретение так же применимо в ветеринарной практике. Заявляемое изобретение позволяет минимизировать повреждения здоровых клеток организма, оказывая избирательное воздействие на опухолевые клетки. Это существенно повышает лечебный эффект использования лекарственных препаратов с наименьшим ущербом для здоровья пациентов.
Предлагаемое изобретение удовлетворяет критериям новизны, так как при определении уровня техники не обнаружено средство, которому присущи признаки, идентичные всем признакам, перечисленным в формуле изобретения.
Способ адресной доставки лекарств имеет изобретательский уровень, поскольку решение не очевидное, не выявлены технические решения, имеющие признаки, совпадающие с отличительными признаками данного изобретения.
Заявляемое средство адресной доставки лекарственных средств осуществимо в промышленных масштабах с использованием природных материалов, стандартного оборудования и технических средств. Это соответствует критерию «промышленная применимость», предъявляемому к изобретениям.
ИСПОЛЬЗОВАННЫЕ ИСТОЧНИКИ
1. Vergaro, V., Abdullayev, Е., Lvov, Y.М., Zeitoun, A., Cingolani, R., Rinaldi, R., Leporatti, S. (2010). Cytocompatibility and uptake of halloysite clay nanotubes. Biomacromolecules, 11(3), 820-6.
2. Tang, K., Zhang Y., Zhang H. Xu P., Liu J., Ma J., Lv M., Li D., Katirai F., Shen G-X., Zhang G., Feng Z-H., Ye D., Huang В., (2012) Delivery of chemotherapeutic drugs in tumour cell-derived microparticles. Nature communications, 3, 1282.
3. Патент RU №2468447, МПК G09B 23/28 (2006.01), A61N 5/02 (2006.01), A61K 33/38 (2006.01), A61P 35/00 (2006.01), B82Y 5/00. Приоритет от.27.06.2011 Опубликован 27.11.2012. Описание патента.
4. Bernardos, A., Mondragon, L., Aznar, E., Marcos, M.D., Martinez-Manez, R., Sancenon, F., Amoros, P. (2010). Enzyme-responsive intracellular controlled release using nanometric silica mesoporous supports capped with "saccharides". ACS Nano, 4(11), 6353-68.
5. Soyoung Lee, Mi-Sun Kim, Dakeun Lee, Taeg Kyu Kwon, Dongwoo Khang., Hui-Suk Yun. (2013) The comparative immunotoxicity of mesoporous silica nanoparticles and colloidal silica nanoparticles in mice. International Journal of Nanomedicine, 8, 147-58
6. Xu Zhang, Yujuan Zheng, Levi E. Fried, Yatao Du, Sergio J. Montano, Allie Sohn, Benjamin Lefkove, Lars Holmgren, Jack L. Arbiser, Arne Holmgren, Jun Lu (2011) Disruption of the mitochondrial thioredoxin system as a cell death mechanism ofcationic triphenylmethanes. Free Radical Biology & Medicine. 50, 811-20.
7. Wei, W., Minullina, R., Abdullayev, E., Fakhrullin, R., Mills, D., & Lvov, Y. (2014). Enhanced efficiency of antiseptics with sustained release from clay nanotubes. RSC Advances, 4(1), 488-94.
1. Средство адресной доставки лекарств в клетки, заключающееся в том, что природного происхождения нанотрубки галлуазита отмывают в этаноле и воде, помещают в емкость с жидким лекарственным средством, вносят в вакуумный десикатор, где полости нанотрубок заполняются лекарством, заполненные лекарством нанотрубки извлекают из десикатора, нанотрубки повторно отмывают в воде, высушивают, перемалывают, вносят в раствор ферментно-деградируемого вещества - декстрина, емкость с раствором ферментно-деградируемого вещества - декстрина и загруженными лекарством нанотрубками повторно помещают в вакуумный десикатор и выдерживают, извлекают из десикатора, отмывают от излишков ферментно-деградируемого вещества и используют по назначению.
2. Средство по п. 1 используют для адресной доставки препаратов цитотоксического действия в опухолевые клетки организма.