Способ повышения клинико-иммунологической эффективности терапии генитального герпеса с использованием внутрисосудистого лазерного облучения крови
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к иммунологии, и может быть использовано для лечения генитального герпеса. Для этого проводят внутрисосудистую лазеротерапию на фоне противовирусной терапии при длине волны 365 нм, мощности излучения на конце световода 1 мВт, экспозиции 8 минут, курс 6 сеансов. Использование данного способа позволяет добиться нормализации клинической картины, исчезновения клинических проявлений в сроки наблюдения до года, восстановления факторов антимикробной защиты, регистрируемых в результатах клинико-лабораторных исследований. 2 табл.
Реферат
Изобретение относится к медицине, дерматовенерологии, иммунологии, в частности к оценке иммунопатогенетических особенностей генитального герпеса и методам его терапии, включающим анализ клинико-инструментальных, лабораторных данных, состояния факторов врожденного и адаптивного иммунитета с целью повышения клинико-иммунологической эффективности терапии генитального герпеса с использованием внутрисосудистого лазерного облучения крови, позволяющего ускорить нормализацию клинической картины и корректировать дисфункции факторов антимикробной защиты организма.
Генитальный герпес и методы его лечения - важнейшая проблема современного здравоохранения, поскольку, согласно статистическим данным ВОЗ и CDC, вирусом ВПГ-2 инфицированы около 400 миллионов человек во всем мире [Руководство CDC по лечению инфекций, передающихся половым путем. - Москва, 2007. - 40 с.]. В Российской Федерации показатель заболеваемости генитальным герпесом в 2014 году составил 18,9 случаев на 100000 населения [Перламутров Ю.И., Рахматулина М.Р., 2013], продолжая повсеместно увеличиваться на 4% ежеквартально [Sanchez-Aleman М.А., Conde-Glez C.J. et al. Sexual behavior and Herpes simplex virus 2 infection in college students. Arch. Med. Res; 2012]. Растущая частота данной патологии создает серьезную проблему для репродуктивного здоровья населения, поскольку может служить фактором риска по перинатальной патологии, провоцировать невынашивание беременности и рождение детей с низкой и экстремально низкой массой тела, повышению смертности новорожденных. Кроме того, генитальный герпес - инфекционно-воспалительное полиэтиологическое заболевание, при котором регистрируются дисфункции факторов врожденного и адаптивного иммунитета, ослабление антигенспецифического иммунного ответа, что проявляется частыми рецидивами и длительным течением [Саразитдинова В.Ф. Наиболее распространенные вирусные инфекции, передаваемые половым путем (герпетическая, папилломавирусная, цитомегаловирусная) / В.Ф. Сиразетдинова // Клин. дерматол. и венерол. 2011. №3. С. 82-87]. Особое место в иммунопатогенезе данного заболевания отводится нарушениям функционирования иммунокомпетентных клеток и нарушениям взаимосвязанности протекания иммунных реакции, дисфункциям в системе нейро-иммунно-эндокринной регуляции, вследствие чего генитальный герпес является серьезной угрозой репродуктивному потенциалу и здоровью нации в целом. Ранее проведенные исследования иммуногенеза генитального герпеса, показало, что данный инфекционный процесс, как правило, сопровождается отчетливыми изменениями субпопуляционного состава лимфоцитов и нарушением эффекторных функций фагоцитов периферической крови, как следствием, снижением их функциональной активности, влекущий угнетение выработки биологически активных мессенжеров иммунной системы, в том числе интерферонов [Плехова Н.Г. Бактерицидная активность фагоцитов / Н.Г. Плехова // Журн. микробиологии, эпидемиологии и иммунобиологии. - 2006. - №6. - С. 89-96]. Метаанализ патогенеза генитального герпеса уточнил наличие дисфункций факторов антиинфекционной защиты, рассматриваемых в качестве возможных причин прогрессирования и хронизации генитального герпеса с формированием стойкого воспалительного симптомокомплекса, приводящего к депрессии адаптивного иммунитета, повышению риска возникновения и неблагоприятных последствий сопутствующей инфекционной и вирусной патологии [Chida Y., Мао X. Does psychosocial stress predict symptomatic herpes simplex virus recurrence? A metaanalytic investigation on prospective studies. Brain Behav Immun 2009; 23: 7: 917-925].
Несмотря на совершенствование технологий лечения и внедрение в дерматовенерологию ациклических нуклеозидов - препаратов избирательного фосфорилирования в инфицированных ВПГ клетках и конкурентного субстратного ингибирования полимеразы дезоксирибонуклеиновой кислоты (ДНК), ведущей к окончанию считывания цепи ДНК вируса с высокой биодоступностью, большинство исследователей отмечают возрастание удельного веса длительно текущих, рецидивирующих форм генитального герпеса [Страчунский Л.С. Практическое руководство по антиинфекционной химиотерапии / Л.С. Страчунский, Ю.Б. Белоусов, С.Н. Козлов. - Москва, 2002. - 350 с.].
Таким образом, изучение механизмов иммунопатогенеза генитального герпеса, методов его лечения, клинических нарушений и дисфункций факторов колонизационной резистентности при данной патологии является актуальной проблемой современной фундаментальной медицинской науки и предпосылкой для поиска способов и средств патогенетической терапии, способствующих повышению эффективности терапии данного заболевания [Летяева О.И. Генитальный герпес: долгосрочные подходы к терапии" пожизненной инфекции" / О.И. Летяева, О.А. Гизингер, О.Р. Зиганшин // Клиническая дерматология и венерология. - 2013. - №6. - С. 61-66].
Неудовлетворенность эффективностью стандартных схем лечения генитального герпеса, связанных, возможно, с резистентностью к ациклическим нуклеозидам, традиционно используемых в качестве средства этиотропной терапии данного заболевания побуждает к поиску адъювантных патогенетических подходов [Бабюк И.А. Базовое лечение генитальной герпесвирусной инфекции / И.А. Бабюк, П.Д. Цветкова, И.Б. Рымарь, Л.А. Борлова // Украïнський журнал дерматологiï, венерологiï, косметологiï. - 2013. - №3. - С. 130-136. - Режим доступа: http://nbuv.gov.ua/j-pdf/Ujdvc2013_3_22.pdf]. На сегодняшний день в дерматовенерологической практике наряду с этиотропными методами широко используются физиотерапевтические воздействия, в частности низкоинтенсивная лазеротерапия (НИЛИ). Положительный опыт использования НИЛИ в терапии воспалительных заболеваний урогенитального тракта, позволил внедрить в клиническую практику целый ряд новых лечебных подходов, а именно локальной и системной, внутрисосудистой (ВЛОК), лазеротерапии [Гизингер, О.А. Роль физиотерапевтических факторов в коррекции дисфункций факторов противонфекционной защиты организма / О.А. Гизингер, О.И. Летяева, Т.А. Зиганшин [и др.] // Вестн. новых мед. технологий. - 2011. - Т. 18, №4. - С. 8-12].
Рассматривая возможность использования каждого нового метода терапевтических воздействий необходимо с особой тщательностью подходить к оценке ответных гомеостатических реакций, происходящих с участием клеток-эффекторов иммунных реакций [Дифференцированная иммунокоррекция с использованием препаратов циклоферона в терапии больных дерматозами и инфекциями, передающимися половым путем: метод, рекомендации / Под ред. В.П. Федотова. - Днепропетровск, 2001. - 48 с.].
Теоретически идеальным вариантом химиотерапии был и остается механизм прямой инактивации вирусной ДНК, но из-за неизбежного общего токсического, цитопатического и канцерогенного эффекта этот способ для клинического использования оказался неприемлемым и не используется в практической медицине Позднее был разработан способ инактивации вирусной ДНК, состоящий в подавлении активности вирусных ферментов, обеспечивающих жизнедеятельность ДНК и созданы препараты видарабин, цитарабин, рибавирин, фоскарнет и другие противовирусные цитостатики [Хахалин Л.Н. Этиопатогенетическое обоснование современной терапии генитального герпеса / Л.Н. Хахалин // Информационно-аналитический бюллетень. Заболевания, передаваемые половым путем. 1995, №3, с. 18-22]. Однако эти препараты обладали выраженной токсичностью и вызывали мутации человеческой ДНК. Наиболее безопасным вариантом оказалось создание синтетических аналогов нуклеозидов герпес-вирусной ДНК, которые избирательно фосфорилируются не клеткой, а вирусспецифическим ферментом - тимидинкиназой. В процессе копирования вирусной ДНК эти псевдонуклеазиды встраиваются в дочерние вирусные ДНК, что приводит к генетическому дефекту или нежизнеспособности вирусной ДНК. На сегодняшний день для клинической практики предложены два новых ациклических нуклеазида - валацикловир и фамцикловир, в которых преодолен основной недостаток ацикловира - низкая биодоступность при пероральном применении [Кузьмин А. Н. Современный взгляд на клиническое течение, диагностику и терапию генитального герпеса у женщин // Consilium medicum. - 2015. - Т. 16. - №. 6. - С. 55-60].
На сегодняшний день существуют ряд способов терапии генитального герпеса, изложенных в методических рекомендациях и технологиях по лечению данного заболевания [Акушерство и гинекология: клинич. рекомендации / Под ред. Г.М. Савельева [и др]. - 3-е изд., испр. и доп. - Москва, 2009. - 868 с.; 40. Европейские стандарты диагностики и лечения заболеваний, передающихся половым путем. - Москва: Мед. лит., 2004. - 272 с.; 50. Клинические рекомендации. Ведение больных инфекциями передаваемыми половым путем и урогенитальными инфекциями / Под ред. А.А. Кубановой. - Москва: Деловой экспресс, 2013. - 114 с.]. Рекомендованные методы терапии предусматривают применение валацикловира по 500 мг один раз в день на протяжении 6 мес, ацикловира по 400 мг 2 раза в сутки также в течение 6 мес. Недостатком терапии ациклическими нуклеозидами является то, что в ряде случаев на фоне длительной превентивной терапии могут возникать обострения и эпизоды бессимптомного вирусовыделения, при которых не исключена возможность неумышленного инфицирования половых партнеров. Это объясняется прежде всего развитием устойчивости вируса герпеса к ацикловиру. За последние 10 лет увеличилось число исследований, в которых показано, что изоляты вируса простого герпеса (ВПГ)-2, полученные от пациенток с продолжающимися рецидивами генитального герпеса на фоне длительной супрессивной терапии (более 4 мес), обладают резистентностью по отношению к ацикловиру [Сидорова И.С. Современные способы лечения инфекции нижнего отдела половых путей у женщин / И.С. Сидорова, Х.А. Белопольская // Вестник Российской академии медицинских наук. - 2012. - №. 4. С. 34-36]. Большинство исследователей сходится во мнении, что ни ацикловир, ни другие противовирусные агенты - фамцикловир, валацикловир - не предотвращают перехода вируса в латентное состояние, ни возникновения рецидивов после их отмены, ни передачи инфекции, не влияют на естественное течение этой инфекции в плане полного излечения. Поэтому важен поиск методов, влияющих на иммунную систему больных генитальным герпесом с целью стимуляции ее специфических и неспецифических факторов, способствуя блокаде репродукции вируса. Однако большинство зарубежных специалистов отдают предпочтение противовирусной химиотерапии, поскольку применение иммуномодулирующих препаратов, по их мнению, нецелесообразно в связи с несформированной окончательно концепцией иммунодефицита, возникающего при генитальном герпесе [Руководство CDC по лечению инфекций, передающихся половым путем. - Москва, 2007. - 40 с.]. Отечественные специалисты [Клинические рекомендации Российского общества дерматовенерологов и косметологов (2013) по ведению больных инфекциями, передаваемыми половым путем, и урогенитальными инфекциями» под ред. А.А. Кубановой. - М. - 2013. - 45 с.] считают правомочным применение иммуномодулирующих средств с целью блокады персистенции вируса, но иммуномодуляторы, по их мнению, должны применяться только после предварительного изучения количества и функционального резерва клеток-мишеней иммунной системы, так как ограничение иммунного ответа, вызванное специфическим иммунодефицитом, вызванным вирусной агрессией, не может быть преодолено слабым неспецифическим стимулом. ВЛОК, успешно сочетая противовоспалительные, анальгезирующие, иммуномодулирующие эффекты [Москвин С.В. Эффективность лазерной терапии / С.В. Москвин // М., 2014. - 896 с.], может быть с успехом применен в терапии генитального герпеса, причем основополагающими должны стать результаты исследований, подтверждающие высокую эффективность данного метода терапии. Ранее, исследованиями О. А. Гизингер с соавторами была показана иммуномодулирущая роль физиотерапевтических факторов в комплексной терапии инфекционно воспалительных заболеваний слизистых [Гизингер О.А. Влияние низкоинтенсивного лазерного излучения на нейтрофилы и факторы мукозального иммунитета. Дис. … д-ра биол. наук. Челябинск, 2010; Гизингер О.А. Роль физиотерапевтических воздействий в коррекции дисфункций факторов противоинфекционной защиты организма (Обзор литературы) / О.А. Гизингер, Т.А. Зиганшина, И.В. Семенова // Вестник новых медицинских технологий, 2011, Т. 18, №4, С. 9-13], что также может служить основанием для применения лазеротерапии при лечении генитального герпеса.
На сегодняшний момент для повышения эффективности терапии генитального герпеса предложен рад способов, в частности предложен способ лечения генитального герпеса «Способ лечения рецидивирующего генитального герпеса у женщин» [патент RU 2179849, МПК A61K 31/19, A61K 35/74, Способ лечения рецидивирующего генитального герпеса у женщин. Рос. Федерация. - Заявл. 99116293/14, 27.07.1999; опубликован: 27.02.2002. Т.В. Кузовкова (RU), Н.В. Щербакова (RU), Л.И. Юровских (RU), Н.П. Евстигнеева (RU). Патентообладатель: Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии], включающий комплексное применение противовирусного препарата Валтрекс, иммуномодулирующего препарата Неовир и препарата, воздействующий на микрофлору мочеполового тракта - ацилакт. Больным назначали валтрекс по 0,5 г 2 раза в день, курс 5 дней, одновременно назначали неовир по 250 мг внутримышечно, 10 инъекций в два этапа, первые шесть инъекций с интервалом 48 часов, последние четыре инъекции с интервалом 7 дней, после окончания приема валтрекса назначали ацилакт в виде влагалищных свечей по 5 доз ежедневно, на ночь, в течение 10 дней. До и после назначения терапии у пациенток для оценки биоценоза полового тракта определяют лизоцимную активность влагалища, рН влагалища, флору с подсчетом общего микробного числа (методом посева на кровяной агар). Безусловным достоинством метода является то, что способ позволяет увеличить сроки ремиссии в 4-5 раза у 75,9% пациентов. Недостатками метода является низкий коплаенс пациентов к проводимой терапии, связанный с необходимостью применения нескольких видов препаратов. Другим недостатком можно считать экономическую составляющую, связанную с ценами на фармацевтические препараты, используемые в процессе лечения генитального герпеса и длительность их применения. Следующим недостатком можно считать применение иммуномодулирующего препарата имеющего ограничения по применению у определенных групп пациентов.
Одним из способов лечения генитального герпеса является способ использования лекарственной формы под названием «Лечебно-профилактический гигиенический противогерпетический крем» [патент RU №2097016 (13) С1, МПК A61K 7/00, A61K 7/48. Лечебно-профилактический гигиенический противогерпетический крем. Рос. Федерация. - Заявл. 95118080/14, 02.11.1995; опубл. 27.11.1997. Баринский И.Ф. (RU), Бондаренко H.A. (RU), Львов Н.Д. (RU), Рудомино М.В. (RU), Самгин M.A. (RU), Чудинов A.B. (RU), Чернышев Е.А. (RU), Щербинин B.B. (RU), Павлов К.В. (RU), Шведов И.П. (RU), Мартынов A.И. (RU), Артемова Т.А. (RU), Лебедева Л.К. (RU), Болдырева Д.А. (RU), Татарникова Н.П. (RU), Патентообладатель: Товарищество с ограниченной ответственностью "Снежный Барс"], заключающийся в создании крема, обладающего противовирусными противогерпетическими свойствами, содержащего воска эмульсионные, моноглицериды дистиллированные, воск пчелиный, ланолин безводный, метиловый и пропиловый эфиры параоксибензойной кислоты, твин-80 или натрийлаурилсульфат, спирты синтетические С6-С0 биологически-активную добавку, включающую фоскарнет натрия и масляный экстракт календулы или чистотела, а также отдушку и воду и субстанцию герматранол. Крем обладает высокой противовирусной активностью, не оказывает раздражающего действия и особенно актуален при генитальном герпесе. Недостатками метода можно считать отсутствие противорецидивного эффекта крема, отсутствие системных и иммуномодулирующих эффектов при эпизодах генитального герпеса. Кроме того, авторами, с позиции доказательной медицины, не рассматривается влияние крема на ускорение сроков эпителизации слизистых и не рассматриваются конкретные эффекторы для активации иммунного ответа, всегда отмечаемого при рецидивах генитального герпеса. Можно предположить, что крем позволяет повысить эффективность только местной терапии генитального герпеса, проявляя при этом исключительно топические эффекты.
Близким техническим решением, взятым нами за прототип, является «Способ лечения реактивированной формы цитомегаловирусной инфекции урогенитального тракта у женщин репродуктивного возраста» [патент RU №2513474 С1, МПК A61N 5/067. Способ лечения реактивированной формы цитомегаловирусной инфекции урогенитального тракта у женщин репродуктивного возраста. Рос. Федерация. - Аявл. 2013115641/14, 08.04.2013; опубл. 20.04.2014. С.В. Москвин (RU), Ю.Н. Перламутров (RU), Н.И. Чернова (RU), К.Б. Ольховская, Патентообладатели: Перламутров Юрий Николаевич (RU), Чернова Надежда Ивановна (RU), Ольховская Кира Брониславовна (RU), Москвин Сергей Владимирович (RU)], который может быть использован при лечении цитомегаловирусной инфекции урогенитального тракта при ее реактивированном течении. Способ состоит в том, что на фоне противовирусной терапии осуществляют внутривенное лазерное облучение крови сначала с длиной волны 365 нм, мощностью излучения 2 мВт, экспозицией 2 минуты. На следующий день - с длиной волны 530 нм, мощностью 2 мВт, экспозицией 8 минут. Проводят 15 сеансов ВЛОК. Способ обеспечивает прекращение реактивации цитомегаловирусной инфекции урогенитального тракта, уменьшение продолжительности последующих рецидивов, увеличивает межрецидивный период и способствует переходу течения вирусного инфекционного процесса в персистенцию за счет стимуляции недостаточного иммунного ответа, нормализации интерферонового статуса и супрессии гиперактивных процессов. Недостатками метода являются сложность проведения методики, а именно ее многоэтапность, причем авторами не предоставлены объяснения по клинико-иммунологической эффективности применения предложенного этапного алгоритма, в том числе и на модели in vitro и его отличия, например, от одноэтапного метода терапии с использованием НИЛИ. С другой стороны, недостатком метода стал узкий спектр возбудителей из обширного семейства герпесвирусов, при которых данный метод мог бы быть эффективным, что делает необходимым проведение дополнительного поиска методов терапии генитального герпеса и других герпесвирусных ассоциированных заболеваний, которые, так же как и цитомегаловирус, являются представителями семейства герпесвирусов.
Необходимо отметить, что внутрисосудистое лазерное облучение крови широко применяется для нормализации функциональной активности клеточных элементов крови, что подтверждено патентом «Способ коррекции иммуногемостатических изменений при лечении глазных болезней» [патент RU №96104663 А, МПК A61F 9/00. Способ коррекции иммуногемостатических изменений при лечении глазных болезней. Рос. Федерация. - Заявл. 96104663/14, 11.03.1996 опубл. 10.06.1998. Л.М. Балашова Л.М., Н.А. Листопадова Н.А., Н.С. Зайцева, В.Л. Гришин, Л.Е. Теплинская, B.C. Ефимов, Е.П. Кантаржи, Московский научно-исследовательский институт глазных болезней им. Гельмгольца], который включает внутрисосудистое низкоинтенсивное лазерное облучение крови в течение 20-25 мин с мощностью на выходе 15 мВт, отличающийся тем, что непосредственно перед облучением проводят ингаляции гепарина в терапевтической дозировке при общем курсе 10 дней, что приводит к нормализации иммуногемостатических изменений в терапии офтальмологической патологии.
С другой стороны внутрисосудистое лазерное облучение крови не менее широко применяется для терапии патологии клеточных структур, о чем свидетельствует патент «Способ лечения генитального эндометриоза» [патент RU №2188681 С1, МПК A61N 5/067, А61Л 33/00, А61Л 33/14. Способ коррекции иммуногемостатических изменений при лечении глазных болезней. Рос. Федерация. - Заявл. 2001110287/14, 16.04.2001; опубл. 10.09.2002. И.Н. Коротких, Э.В. Ходасевич. Воронежская государственная медицинская академия им. Н.Н. Бурденко], который включает внутрисосудистое облучение крови гелий-неоновым лазером в течение 20-30 мин при мощности лазерного излучения 1 мВт, длине волны 0,63 мкм. За 60 мин до лазерного воздействия внутривенно авторы патента вводят озонированный физиологический раствор с концентрацией озона 1-2 мг/л. Терапию проводят ежедневно один раз в день, в одно и то же время. Курс лечения 7-10 сеансов. Способ позволяет усилить и удлинить лечебный эффект от воздействия обоих физических факторов, что повышает эффективность консервативной терапии у женщин детородного возраста. Недостатками метода является высокая частота травмирования вены (инвазивная процедура проводится дважды; для проведения лазеротерапии и озонотерапии), длительность процедуры: 90 минут и необходимость ее проведения в одно и тоже время, что не всегда удобно в условиях амбулаторного лечения пациентки.
В основу нашего изобретения положена задача, заключающаяся создании способа повышения клинико-иммунологической эффективности терапии генитального герпеса с использованием метода внутрисосудистого лазерного облучения крови, проявляющим ранозаживляющие, противомикробные, и иммуномодулирующие эффекты. Задачей предлагаемого изобретения является устранение недостатков ранее предложенных способов патогенетической терапии, повышение эффективности лечения генитального герпеса и его переносимости, уменьшение количества требуемых лекарственных препаратов, увеличение периода между рецидивами за счет более эффективной санации и активизации факторов антимикробной защиты организма.
Указанная техническая задача решается за счет внедрения в практику результатов исследования, проведенного в 2014-2015 гг. на базе медицинского центра «Ситимед» (г. Челябинск, Россия) и кафедры дерматовенерологии ГБОУ ВПО Южно-Уральский государственный университет (г. Челябинск, Россия), Областного кожно-венерологического диспансера (г. Челябинск, Россия), включающего обследование и лечение 78 женщин с рецидивирующим генитальным герпесом, репродуктивного возраста, средний возраст 28,9±0,4 года. До начала исследования от участников исследования было получено письменное информированное согласие на участие в исследовании в соответствии с основами законодательства РФ «Об охране здоровья граждан, правил проведения клинической практики в РФ», (приказ МЗ РФ №266 от 19.07.03 г.; приказ Росздравнадзора №2325-Пр/06 от 17.10.06 г.). План исследования соответствовал положениям Хельсинской декларации Всемирной медицинской ассоциации (ВМА) последнего пересмотра (г. Эдинбург, Шотландия, 2000 г.), с учетом разъясняющего примечания п. 29, одобренного Генеральной ассамблеей ВМА (Сеул, 2008). Критериями включения в дальнейшее исследование были: наличие клинических проявлений герпетической инфекции, частота рецидивов от 4 до 6 в год, выявление ДНК герпеса, репродуктивный возраст, согласие пациенток на участие в исследовании. Критериями исключения являлось: наличие тяжелой соматической патологии, гормональные нарушения, беременность, лактация, наличие других заболеваний, передающихся половым путем, ВИЧ, несогласие пациенток на участие в исследовании. В соответствии с МКБ-Х и «Клиническими рекомендациями Российского общества дерматовенерологов и косметологов (2013) по ведению больных инфекциями, передаваемыми половым путем, и урогенитальными инфекциями». Под ред. А.А. Кубановой, был выставлен диагноз А.60.0 Герпетическая инфекция половых органов и мочеполового тракта, рецидивирующее течение, средняя степень тяжести. Частота рецидивов составляла 4-6 раз в год, межрецидивный период не менее 2-3 месяцев. Для проведения исследования были сформированы следующие группы: №1 здоровые n=40, состояла из женщин, не имеющих клинических проявлений герпетической инфекции, группа №2 (n=38), получали терапию Валацикловиром по 500 мг один раз в день на протяжении 6 месяцев в соответствии с «Клиническими рекомендациями Российского общества дерматовенерологов и косметологов (2013) по ведению больных инфекциями, передаваемыми половым путем, и урогенитальными инфекциями», группа №3 (n=40) получали терапию валацикловиром по 500 мг один раз в день на протяжении 6 месяцев и на фоне противовирусной терапии получали внутрисосудистое лазерное облучение крови при длине волны 365 нм, мощности излучения на конце световода 1 мВт, экспозицией 8 минут, курс составил 6 сеансов. Группы были стратифицированы между собой на начальном этапе (до назначения лечения) по признакам, характеризующим заболевание: жалобы, клинические проявления, лабораторные показатели. Результаты лечения оценивали по изменению длительности и тяжести рецидива генитального герпеса, показателей иммунного статуса. Материалом для выделения и последующей амплификации ДНК ВПГ послужили соскобы эпителия цервикального канала, взятые одноразовыми цитощетками. Всем пациенткам было проведено комплексное исследование включавшее: осмотр врача, микроскопическое исследование отделяемого цервикального канала, цитологическое исследование мазков отпечатков, исследование показателей местного иммунитета. Всем женщинам проводилось микробиологическое исследование на наличие гонореи и трихомонад, согласно методическим рекомендациям МЗ РФ «Стандартизация медицинской помощи больным гонококковой инфекцией» (Приказ №176 от 28.02.05 г.) и Положения МЗ РФ «О мерах по предупреждению распространения заболеваний, передающихся половым путем» (Приказ №291 от 30.07.01 г.). Микроскопии подвергались нативные, а также окрашенные по Грамму и метиленовым синим мазки соскобов влагалища и цервикального канала. Материалом для исследования иммунного статуса служила перифериченская кровь. Всем женщинам проводили иммунологическое исследование с иммунофенотипированием (лаборатория «Прогрессивные медицинские технологии», г. Челябинск) Методом проточной цитофлюориметрии исследовали субпопуляционный состав лимфоцитов периферической крови на проточном цитофлуориметре «Cytomics FC500» с помощью набора моноклональных антител (МАТ) («BeckmanCoulter», США). В процессе исследования было определено абсолютное и относительное содержание CD3+-, CD4+-, CD8+- CD16+-CD19+- HLA-DR+-клеток. Для определения CD4+CD45RO+-, CD8+CD45+RO+-, CD3-HLA-DR+-, CD3+HLA-DR+-, CD3-CD16+-CD3+CD16+-клеток методом прямой иммунофлюоресценции использовали МАТ с двойной меткой.
Способность нейтрофилов к фагоцитозу проводили на модели поглощения частиц латекса. Для этого 0,2 мл суспензии этих клеток смешивали с 0,02 мл взвеси латекса диаметром 1,7 мкм (10 частиц/мл), полученного из ВНИИСК (С.-Петербург). Исследование внутриклеточного кислородзависимого метаболизма проводили, используя НСТ-тест. Параллельно определяли способность нейтрофилов отвечать повышением метаболической активности на стимуляцию частицами латекса. Также рассчитывали функциональный резерв нейтрофилов (ФРН), который представляет собой соотношение между коэффициентами интенсивности реакции НСТ-индуцированного и НСТ-спонтанного тестов. Число лизосом в цитоплазме фагоцитов исследовали прижизненным окрашиванием акридиновым оранжевым, которое проводили в суспензии нейтрофилов. С этой целью 0,2 мл взвеси нейтрофилов в физиологическом растворе смешивали с 0,02 мл раствора акридинового оранжевого в концентрации 2 мкг/мл. После 30-минутной инкубации при температуре 37°С каплю взвеси помещали на предметное стекло, накрывали покровным стеклом и под иммерсией исследовали в потоке сине-фиолетового света люминесцентного микроскопа. Результаты выражали в процентах нейтрофилов, содержащих лизосомы. Определение концентрации иммуноглобулинов и цитокинов в периферической крови проводилось с использованием соответствующих тест-систем для иммуноферментного анализа (ООО «Вектор-Бест», г. Новосибирск). Статистический анализ данных проводился при помощи пакета статистических программ STATISTICA 12.5 (StatSoft, 2014), статистически достоверными считались значения р<0,05.
До начала лечения пациенток с герпетической инфекцией урогенитального тракта беспокоили зуд, жжение в области гениталий различной интенсивности, у 54,1% женщин отмечалась болезненность при мочеиспускании. 16,6% женщин с генитальным герпесом жаловались на слизистые выделения и дискомфорт в области наружных половых органов. В 100% случаев пациентки были тревожны, отмечали снижение качества жизни из-за страха возникновения рецидива, боязни инфицировать полового партнера, 16,4% отметили, что во время рецидива избегают даже дополнительных бытовых контактов с близкими. Все пациентки обратились за медицинской помощью во время очередного рецидива, из анамнеза удалось установить, что средняя продолжительность болезни составляла 4,1±0,6 г. Клинически у 100% женщин, страдающих генитальной герпетической инфекцией, на момент осмотра выявлены эрозивные поражения гениталий. У 39,9% эрозии имелись в области малых половых губ, у 40,1% - на задней спайке, у 30,3% отмечалось поражение шейки матки. В 8,9% поражение выявлено на задней спайке и шейке матки. Эрозии на наружных половых органах, как правило, имели фестончатые края, размером от 0,35 до 1,3 см, умеренно болезненны, кожа гиперемирована, отечна. Поражение шейки матки сопровождалось помимо эрозивных элементов еще и значительным количеством слизистых выделений. Вовлечение в патологический процесс уретры проявлялось значительной болезненностью, отечностью и гиперемией губок уретры. Важным индикатором воспалительного процесса, происходящего на слизистых оболочках, является содержание нейтрофилов. У здоровых оно невелико и сопоставимо с содержанием в периферической крови здоровых людей, но с появлением хронического воспалительного процесса увеличивается. Лабораторное исследование выявило повышение числа лейкоцитов в цервикальном канале до 47,6±2,9 в поле зрения, пласты эпителиальных клеток, количество лейкоцитов в уретре составляло 18,3±1,2. Оценка локального иммунологического статуса показала достоверное увеличение общего числа лейкоцитов, жизнеспособных клеток, снижение спонтанного и индуцированного НСТ-теста, функционального резерва нейтрофилов. Контрольные исследования были проведены по истечении 6 и 12 месяцев от начала лечения. В течение 6 месяцев приема препаратов в группе пациенток, получавших валацикловир, рецидив герпетической инфекции отмечен у 8,09% пациенток, при этом интенсивность клинических проявлений была менее выраженной, чем до лечения. В группе пациенток, получавших комплексную терапию с применением ВЛОК, рецидивов отмечено не было. За период с 7 по 12 месяц наблюдения частота рецидивов у 23,4% пациенток из группы, получавших валацикловир составила в среднем 2,0±1,4 года. В группе получавших комплексную терапию с применением ВЛОК за этот же период наблюдения один эпизод рецидива генитального герпеса отмечен у 7,69% женщин. Длительность рецидива составила 3,3±1,2 дня. Оценивая приверженность пациенток к проводимой терапии (комплаенс), было установлено, что в группе Валацикловир 32,8% женщин нарушали предписанный режим приема препарата, объясняя причины такого поведения (периодической самостоятельной отмены препарата) появлением тяжести в правом подреберье, дисфагией, диспепсией. Оценка этиологической эффективности проведенной терапии показала отсутствие ДНК ВПГ через 6 месяцев в группе Валацикловир у 9,09% и в группе получавших комплексную терапию с применением ВЛОК у 7,69%. Частота выявления ВПГ через год составила 13,6% и 7,69% соответственно. Полученные данные были достоверны (р<0,05).
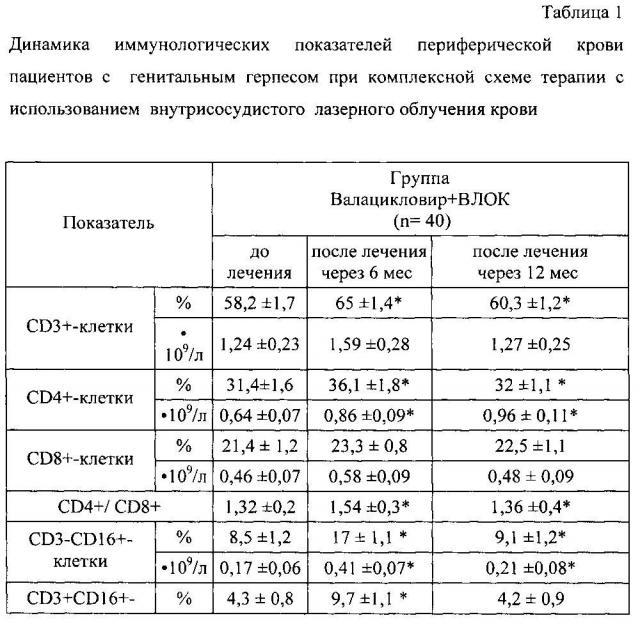
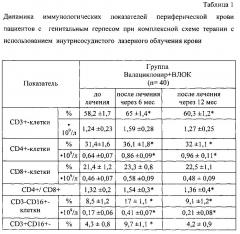
Сравнительный анализ динамики иммунологических показателей после проведенной комплексной терапии с применением ВЛОК через 6 и 12 месяцев после проведенной терапии выявил достоверные положительные изменения иммунологических показателей периферической крови: восстановление количественного и субпопуляционного состава лейкоцитов, нормализации межклеточных взаимоотношений субпопуляций Т-лимфоцитов, а именно повышение относительного количества CD3+-клеток, иммунорегуляторного индекса, относительного и абсолютного количества CD4+-, CD3-CD16+-, CD3-CD16+-CD3+HLA-DR+-клеток, что приводило к увеличению количества иммунокомпетентных клеток в крови, нормализации роста поглотительной способности нейтрофилов по тесту с латексом, восстановление биоцидной функции этих клеток по НСТ-тесту, функционального резерва, содержания в сыворотке крови IgA, IgM, уровня ИФН-гамма в крови. При изучении фагоцитарной активности и активности нейтрофилов в НСТ-тесте по их способности поглощать микросферы латекса и восстанавливать нитросиний тетразолий, было установлено снижение изучаемых показателей до лечения и восстановление после проведенной комплексной терапии (табл. 1).
Таким образом, применение внутрисосудистого лазерного облучения крови в терапии генитального герпеса приводит к полному или частичному восстановлению количественного и качественного состава нейтрофилов периферической крови, их поглотительной способности и кислород-зависимого метаболизма выраженная в повышении активности фагоцитов периферической крови по их способности захватывать частицы латекса и генерации активных форм кислорода, выраженной в повышении активности фагоцитоза нейтрофилов на 16%, интенсивности фагоцитоза нейтрофилов на 38%, усилении активности спонтанного НСТ-теста на 34%, усилении интенсивности спонтанного НСТ-теста на 19%, увеличению функционального резерва нейтрофилов периферической крови на 26%, увеличению содержания интерферона гамма на 87%, увеличению содержания иммуноглобулина А на 29%. Выявленная положительная динамика иммунологических показателей свидетельствует о восстановлении потенциала факторов врожденного и адаптивного иммунитета у женщин, получавших комплексную терапию с использованием внутрисосудистого лазерного облучения крови.
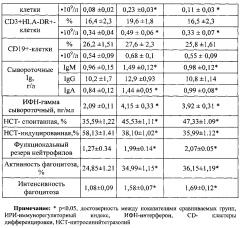
Сравнительный анализ динамики иммунологических показателей периферической крови женщин, пролеченных без использования внутрисосудистой лазеротерапии через 6 и 12 месяцев, показал однонаправленный характер изменений в сторону восстановления иммунологических показателей периферической крови, однако стоит заметить, что степень нормализации данных факторов была значительно менее выраженным и по ряду показателей можно говорить лишь о тенденции к их восстановлению. Таким образом, сравнительный анализ динамики иммунологических показателей после проведенной комплексной терапии без использования ВЛОК не выявил достоверных изменений иммунологических показателей периферической крови по восстановлению количественного и субпопуляционного состава лейкоцитов, нормализации субпопуляций Т-лимфоцитов, иммунорегуляторного индекса, относительного и абсолютного количества CD4+-, CD3-CD16+-, CD3-CD16+-CD3+HLA-DR+-клеток, восстановлению поглотительной способности нейтрофилов по тесту с латексом, восстановлению биоцидной по НСТ-тесту, функционального резерва, содержания в сыворотке крови IgA, IgM, уровня ИФН-гамма в крови (табл. 2).
Применение способа повышения клинико-иммунологической эффективности терапии генитального герпеса с использованием внутрисосудистого лазерного облучения крови позволяет расширить знания о иммунопатогенезе данного заболевания и предложить способ терапии и коррекции дисфункций факторов врожденного и адаптивного иммунитета, регистрируемого при данном заболевании.
Предлагаемый способ отличается от существующих тем, что, используя метод комплексной терапии, а затем клинико-иммунологическую оценку действия внутрисосудистого лазерного облучения крови, приобретается возможность более качественно, с использованием отечественных методик лазеротерапии, не имеющих зарегистрированных побочных эффектов, кроме индивидуальной непереносимости процедуры, проводить лечение и дать оценку его эффективности, чтобы, в конечном итоге, предложить метод терапии, показавший высокую клинико-иммунологическую эффективность. Ввиду корректности метода, простоты выполнения манипуляций и дешевизны проведения процедуры лазеротерапии, лабораторных иммунологических методов исследования указанный способ терапии доступен в практике врача дерматовенеролога в амбулаторных, стационарных, санаторно-курортных учреждениях здравоохранения, занимающихся изучением и решением соответствующей пробле