Гемостатическое средство
Иллюстрации
Показать всеИзобретение относится к медицине и заключается в гемостатическом средстве, которое представляет собой полииммонийметандиамина хлорид. Технический результат заключается в эффективном кровоостанавливающем действии с обеспечением выраженного обезболивания. 21 з.п. ф-лы, 2 пр., 30 табл.
Реферат
Изобретение относится к медицине, а именно к средствам, используемым для остановки кровотечений.
Известно жидкое пенящееся гемостатическое средство, содержащее белок в качестве пенящегося компонента, фибриноген в качестве активного вещества; препарат также может включать агент, ускоряющий коагуляцию, US 2014161738 (A1), опубл. 12.06.2014.
Недостатком данного средства является невысокая эффективность остановки кровотечений, а также отсутствие обезболивающего эффекта.
Известна гемостатическая композиция в виде порошка, содержащая коллаген в форме волокон и, по меньшей мере, один моносахарид; композиция также может содержать смесь коагуляционных веществ и глюкозаминоглюканов, US 2014023714 (A1), опубл. 23.01.2014.
Данное средство не производит обезболивающего эффекта, а в ряде случаев может усилить болевые ощущения при его наложении на рану.
Известно гемостатическое средство, предназначенное, преимущественно, для использования в стоматологии. Композиция представляет собой гидрофильную пасту, содержащую, масс. %: хлорид алюминия 5-15, каолин 2-15, структурирующее вещество 10-20, вода 50-70, увлажняющее вещество 0-20; общее количество воды и увлажняющего вещества составляет 55-75% от общей массы композиции, US 2014348921 (A1), опубл. 27.11.2014.
Данная композиция обладает удовлетворительным кровоостанавливающим действием, однако ее применение ограничивается, главным образом, стоматологией; обезболивающим действием данная композиция не обладает.
Известно кровоостанавливающее средство Ferric Subsulfate (торговое наименование AstrinGyn), представляющее собой раствор солей железа 259 mg/g, http://www.drugs.com/ppa/ferric-subsulfate.html, 08.12.2014.
Данный препарат, принятый в качестве прототипа настоящего изобретения, обладает выраженными гемостатическими свойствами при небольших размерах раневой поверхности, однако местное обезболивающее действие отсутствует.
Задачей настоящего изобретения является создание эффективного кровоостанавливающего препарата с обеспечением выраженного обезболивающего действия.
Поскольку в практической медицине кровотечения в большинстве случаев сопровождаются болевыми ощущениями, задача создания эффективных кровоостанавливающих препаратов, обладающих одновременно обезболивающим эффектом, важна и актуальна.
Согласно изобретению гемостатическое средство представляет собой полииммонийметандиамина хлорид общей формулы:
где: n=1-20, m=1-10, при этом n×m≥8.
Гемостатическое средство может применяться в виде 0,01-10% водного раствора. Водный раствор препарата может применяться для импрегнации материалов, используемых для остановки кровотечений, шовного материала, перевязочного материала. Гемостатическое средство может применяться в составе ретракционной нити, адгезивных паст, вагинальных и ректальных свечей, крема, геля, а также с использованием чипов, обеспечивающих медленное высвобождение препарата. Препарат может также применяться в составе глазных капель, глазной мази, смазки, наносимой на поверхность катетера. Препарат может применяться при эндодонтическом лечении, может вводиться в полимерный силер для обтурации зубных каналов, а также местно при помощи электрофореза. Гемостатическое средство может использоваться совместно с гелем на основе сульфата алюминия или раствором серебра, а также с полисахаридной гемостатической системой.
Заявленное средство получали следующим образом.
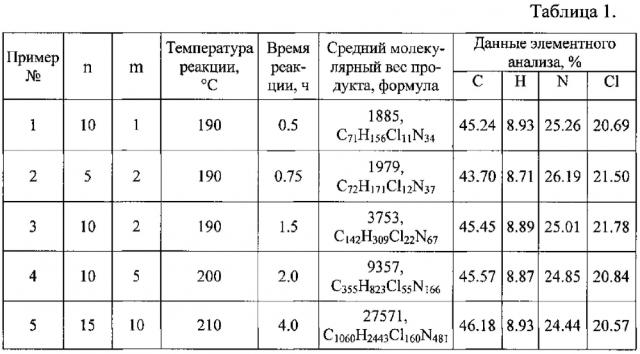
Пример 1: n=10, m=1.
В трехгорлую колбу вместимостью 1 л, снабженную трубкой для подачи инертного газа, термометром и газоотводной трубкой, загружали 95,5 г (1 моль) иминометандиамина гидрохлорида (46,7 масс. %), 104,4 г (0.90 моль) 1,6-диаминогексана (ДГ) (51.1 масс. %), после чего колбу продували азотом. Содержимое колбы нагревали до 100°C и перемешивали до полного растворения. Затем добавляли 4.5 г (0.09 моль) гидразингидрата (ГГ) (2,2 масс. %), перемешивали и помещали в воздушный термостат, а газоотводную трубку подсоединяли к приемнику для улавливания аммиака. Затем при продувании азотом со скоростью 30-40 мл/мин нагревали реакционную смесь с постепенной отгонкой воды и аммиака, в течение 1 ч доводя температуру массы до постоянной температуры реакции 190°C. Выдерживали при температуре реакции 30 мин, продувая систему азотом. После этого охлаждали систему до 160°C и горячую сиропообразную массу выливали на металлический противень, охлаждали и получили 169,9 продукта в виде твердого, практически, бесцветного прозрачного вещества.
Пример 2. Гемостатическое средство получали аналогично примеру 1, при этом n=5, m=2, ДГ=0.85 моль, ГГ=0.17 моль.
Пример 3. Гемостатическое средство получали аналогично примеру 1, при этом n=10, m=2, ДГ=0.9 моль, ГГ=0.09 моль.
Пример 4. Гемостатическое средство получали аналогично примеру 1, при этом n=10, m=5, ДГ=0.9 моль, ГГ=0.09 моль.
Пример 5. Гемостатическое средство получали аналогично примеру 1, при этом n=15, m=10, ДГ=0.93 моль, ГГ=0.063 моль. Температура реакции и время выдержки согласно примерам 1-5 приведены в таблице 1.
Образующийся полимер является нестереорегулярным, то есть взаимное расположение чередующихся звеньев гидразина и 1,6 диаминогексана в полимерной цепочке может быть любым. Но усредненное количественное соотношение этих звеньев, задаваемое пропорцией исходных реагентов, в каждом примере имеет постоянное значение. Полученное вещество имеет наноструктуру.
Наноструктура определена методами динамического рассеяния света с использованием анализатора размера частиц Malvern Instruments Nanosizer Nano-ZS и с использованием просвечивающего электронного микроскопа FEI Tecnai G212Cryo12 с возможностью охлаждения образцов по температуре кипения жидкого азота.
Методом динамического рассеяния света установлено, что при концентрации препарата 0,05 мг/мл в растворе содержатся глобулы размером 10-15 нм. При электронно-микроскопическом исследовании также были выявлены глобулы 10-15 нм.
Заявителю не известны какие-либо источники информации, в которых бы содержались сведения об идентичных технических решениях, что позволяет сделать вывод о соответствии заявленного изобретения условию патентоспособности «Новизна».
Заявителем не обнаружены какие-либо источники информации, содержащие сведения о достигаемом изобретением техническом результате - обеспечении одновременно как эффективного кровоостанавливающего, так и выраженного обезболивающего действия. Это, по мнению заявителя, свидетельствует о соответствии изобретения условию патентоспособности «Изобретательский уровень».
Эффективность заявленного гемостатического средства с обезболивающим действием поясняется примерами.
I. Исследование гемостатической активности препарата.
Пример 1.1. Изучение влияния заявляемого вещества на функцию гемостаза проводили на кроликах обоего пола массой 2000-4000 г. Эксперименты выполняли под общим наркозом. Животным делали лапаратомию, используя разрез по белой линии живота. В рану выводили кишечник, ограничивая его салфетками, смоченными 0,9% раствором хлорида натрия (температура 370°C), и переднюю поверхность печени. При помощи бритвы наносили поверхностную рану печени площадью 1,5 см2 и глубиной 0,1 см.
Остановку капиллярно-паренхиматозного кровотечения выполняли путем равномерного нанесения 1% раствора или спрея заявляемого вещества на всю площадь раневой поверхности. При этом для сравнения времени остановки кровотечения использовали субсульфат железа. Гемостатическую активность оценивали по изменению интенсивности кровотечения. Результаты представлены в таблице 2.
Данные таблицы 2 свидетельствуют о более высокой гемостатической активности заявляемого вещества в сравнении с прототипом.
Пример 1.2. Для оценки эффективности заявляемого вещества при импрегнации перевязочных материалов, используемых для остановки кровотечений, стерильный тампон пропитывали раствором заявляемого вещества в концентрации от 0,01% до 10% и высушивали. Для сравнения времени остановки кровотечения в качестве контроля использовали обычный марлевый тампон. В эксперименте использовали животную модель, как описано в примере №4. Гемостатическую активность оценивали по изменению интенсивности кровотечения. Результаты представлены в таблице 3.
Данные таблицы 3 свидетельствуют о высокой гемостатической активности заявляемого вещества при использовании его для импрегнации материалов, используемых для остановки кровотечений. Данная активность у заявленного вещества выше в сравнении с прототипом.
Пример 1.3. Для оценки эффективности заявляемого вещества при импрегнации шовных материалов, используемых в хирургии, рассасывающийся шовный материал (кетгут) и не рассасывающийся шовный материал (нейлон) пропитывали 5% раствором заявляемого вещества. Для сравнения времени остановки кровотечения в качестве контроля использовали тот же шовный материал, не прописанный заявляемым веществом. В эксперименте использовали животную модель (кролика), в ходе которого наркотизированным животным выполняли разрез на лапе кролика длиной 2 см и глубиной 0,5 см. Гемостатическую активность оценивали по изменению интенсивности кровотечения. Результаты представлены в таблице 4.
Данные таблицы 4 свидетельствуют о высокой гемостатической активности заявляемого вещества при использовании его для импрегнации шовных материалов.
Пример 1.4. Оценку эффективности заявляемого вещества изучали при его добавлении к различным абсорбирующим гемостатическим средствам для местного применения в виде раствора в концентрации от 0,01% до 10%. Для сравнения времени остановки кровотечения в качестве контроля использовали гемостатические средства для местного применения, не пропитанные заявляемым веществом: коллагеновая гемостатическая губка, фибринная пленка, комбинированная губка, содержащая фибриноген и тромбин. В эксперименте использовали животную модель, как описано в примере 4.
Гемостатическую активность оценивали по изменению интенсивности кровотечения. Результаты представлены в таблицах 5-7.
Данные таблицы 5 свидетельствуют о высокой гемостатической активности заявляемого вещества при использовании его совместно с коллагеновой гемостатической губкой. Данная активность у заявленного вещества выше в сравнении с прототипом.
Данные таблицы 6 свидетельствуют о высокой гемостатической активности заявляемого вещества при использовании его совместно с фибринной пленкой.
Данные таблицы 7 свидетельствуют о высокой гемостатической активности заявляемого вещества при использовании его совместно с комбинированной губкой, содержащей фибриноген и тромбин.
Пример 1.5. Гемостатическую активность заявляемого вещества изучали при его добавлении к гемостатическим полимерам, в концентрации от 0,01% до 10%. Для сравнения времени остановки кровотечения в качестве контроля использовали полисахаридную гемостатическую систему и гемостатический материал на основе целлюлозы. В эксперименте использовали животную модель, как описано в примере 4. Гемостатическую активность оценивали по изменению интенсивности кровотечения. Результаты представлены в таблицах 8 и 9.
Данные таблицы 8 свидетельствуют о высокой гемостатической активности заявляемого вещества при использовании его совместно с полисахаридной гемостатической системой.
Данные таблицы 9 свидетельствуют о высокой гемостатической активности заявляемого вещества при использовании его совместно с гемостатическим материалом на основе целлюлозы.
Пример 1.6. Оценку эффективности заявляемого вещества изучали при его совместном использовании с гелем на основе сульфата алюминия, а также раствором нитрата серебра (1:200). Для сравнения времени остановки кровотечения в качестве эталона (контроля) использовали гель на основе сульфата алюминия или раствора нитрата серебра (1:200) без добавления заявляемого вещества. В эксперименте использовали животную модель, как описано в примере 4. Гемостатическую активность оценивали по изменению интенсивности кровотечения. Результаты представлены в таблице 10.
Данные таблицы 10 свидетельствуют о высокой гемостатической активности заявляемого вещества при использовании его совместно с гелем на основе сульфата алюминия или раствором нитрата серебра.
Пример 1.7. Оценку эффективности заявляемого вещества изучали при пропитывании им ретракционной нити, в концентрации раствора от 0,01% до 10%. Для сравнения времени остановки кровотечения в качестве контроля использовали ретракционную нить без добавления заявляемого вещества. Эксперименты проводились на людях из числа добровольцев, которым требовалась остановка кровотечения из зубодесневого кармана, возникшего в результате стоматологического лечения. Гемостатическую активность оценивали по изменению интенсивности кровотечения. Результаты представлены в таблице 11.
Данные таблицы 11 свидетельствуют о высокой гемостатической активности заявляемого вещества для остановки кровотечения с использованием ретракционной нити. Данная активность у заявляемого вещества выше в сравнении с прототипом.
Пример 1.8. Оценку эффективности заявляемого вещества изучали при его нанесении в концентрации от 0,01% до 10% на перевязочный материал или пластырь для нанесения на раневую поверхность. Для сравнения времени остановки кровотечения в качестве контроля использовали перевязочный материал или пластырь без добавления заявляемого вещества. Эксперименты проводились на кроликах. Животным под местной анестезией на лапах скарификатором наносили надрез длиной 2 см и глубиной 0,5 см. Гемостатическую активность оценивали по изменению времени окончательной остановки кровотечения. Результаты представлены в таблице 12.
Данные таблицы 12 свидетельствуют о высокой гемостатической активности заявляемого вещества.
II. Определение анестезирующей активности.
Пример 2.1. Исследование анестезирующей активности проводили на ненаркотизированных кроликах, которых помещали в специальный ящик с отверстием, фиксирующим голову. Определяли порог чувствительности роговицы глаза кролика к тактильному воздействию. С этой целью применяли тонкую металлическую проволоку, не травмирующую роговицу. Исследуемое соединение и препарат сравнения оксибупрокаин вводили в конъюнктивальный мешок глаза кролика в виде 0,5% водных растворов, общим объемом до 0,4 мл. Определение поверхностной анестезии проводили начиная с 1-й минуты исследования. Отсутствие мигательного рефлекса в течение 1 мин (100 прикосновений) учитывали, как показатель полной анестезии. Исходя из полученных данных, отражающих изменения чувствительности роговицы под воздействием препаратов, определяли начало, длительность полной (100%) анестезии и общую длительность анестезии.
Относительную активность исследуемых соединений высчитывали по уравнению Валетта. Индекс Ренье для заявленного препарата составляет 852,4, для препарата сравнения - 63,5. Продолжительность анестезии заявленного препарата составила 234 мин, оксибупрокаина - 24 мин.
Пример 2.2. Оценку анестезирующей активности препарата изучали при распылении спрея, содержащего 0,01-10% препарата или при его нанесении в концентрации от 0,01% до 10% на перевязочный материал или пластырь для наложения на мягкую мозоль. В качестве контроля использовали раствор субсульфата железа. Для оценки эффективности использовали изменение интенсивности болевых ощущений по визуально-аналоговой шкале (ВАШ) от 0 до 10 баллов через 1 минуту после нанесения препарата и через 2 дня при каждодневном применении. Результаты представлены в таблице 13.
Данные таблицы 13 свидетельствуют о высокой активности заявляемого вещества для элиминации болевых ощущений при мягких мозолях и отсутствии противоболевого эффекта у прототипа.
Пример 2.3. Оценку анестезирующей активности препарата для снижения зуда при генитальном кандидозе изучали при его нанесении на слизистые в виде раствора в концентрации от 0,01% до 10% или введением вагинальных суппозиториев, содержащих заявляемое вещество. Для оценки эффективности использовали изменение интенсивности зуда по шкале Itch Severity Score (ISS) через 1 минуту после нанесения/введения препарата и через 5 дней при каждодневном введении. Результаты представлены в таблице 14.
Данные таблицы 14 свидетельствуют о высокой активности заявляемого вещества для элиминации зуда слизистых оболочек и отсутствии подобного эффекта у прототипа.
Пример 2.4. Оценка эффективности заявляемого вещества для снижения болевых ощущений при поражении слизистых оболочек на примере афтозного стоматита. Пациенты с выраженным болевым синдромом при афтозном стоматите в группе контроля получали адгезивную пасту солкосерила, в другой группе - пасту, содержащую препарат от 0,01% до 10%. Для оценки эффективности использовали изменение интенсивности болевых ощущений по визуально-аналоговой шкале через 1 минуту после нанесения препарата и через 2 дня при каждодневном применении. Результаты представлены в таблице 15.
Данные таблицы 15 свидетельствуют о высокой активности заявляемого вещества для элиминации болевых ощущений при поражениях слизистой оболочки.
Пример 2.5. Оценку эффективности заявляемого вещества для снижения болевых ощущений и кровотечения при геморрое изучали введением ректальных суппозиториев, содержащих заявляемое вещество. Изучена эффективность свечей у больных хроническим геморроем, а так же у больных хроническим геморроем II и III стадии с ярко выраженным болевым синдромом. Конечный результат проводимого лечения оценивали при осмотре пациента через 3 и 7 дней от начала лечения по трем признакам по 3-бальной шкале каждый признак. В качестве контроля использованы свечи с субсульфатом железа.
Данные таблицы 16 свидетельствуют о высокой активности заявляемого вещества в терапии геморроя и отсутствии терапевтического эффекта у прототипа по показателям «болевые ощущения», «анальный зуд» и более низкой эффективности по показателю «геморрагия».
Пример 2.6. Оценку эффективности заявляемого вещества для снижения зуда у пациентов с атопическим дерматитом, экземой, нейродермитом или псориазом изучали при его нанесении на пораженные участки в виде раствора в концентрации от 0,01% до 10%, в виде крема, содержащего от 0,01% до 5% препарата, в виде 0,01%-5% геля, в виде 0,01%-5% мази, в виде аппликационных полосок с нанесенным на них 0,01%-10% раствором препарата. Для оценки эффективности использовали изменение интенсивности зуда по шкале Itch Severity Score (ISS) через 1 минуту после нанесения/введения препарата и через 5 дней при каждодневном применении. Результаты представлены в таблице 17.
Данные таблицы 17 свидетельствуют о высокой активности заявляемого вещества для элиминации зуда при кожных заболеваний.
Пример 2.7. Оценку эффективности заявляемого вещества для снижения болевых ощущений у пациентов с ожогами изучали при его нанесении в виде раствора/спрея на пораженные участки в концентрации от 0,01% до 10%. Для оценки эффективности использовали изменение интенсивности болевых ощущений по визуально-аналоговой шкале (ВАШ) от 0 до 10 баллов через 1 минуту после нанесения/введения препарата и через 5 дней при каждодневном применении. Результаты представлены в таблице 18.
Данные таблицы 18 свидетельствуют о высокой активности заявляемого вещества для элиминации болевых ощущений при ожогах.
Пример 2.8. Оценку эффективности заявляемого вещества для снижения болевых ощущений проводили у пациентов с послеоперационным болевым синдром. Пациентам после лапароскопической холецистектомии заявляемое вещество наносили в виде раствора/спрея на пораженные участки в концентрации от 0,01% до 10%. В качестве препарата сравнения для поверхностной анестезии использовали оксибупрокаин. Для оценки эффективности использовали изменение интенсивности болевых ощущений по визуально-аналоговой шкале, через 1 минуту после нанесения/введения препарата и через 2 дня при каждодневном применении. Результаты представлены в таблице 19.
Данные таблицы 19 свидетельствуют о высокой активности заявляемого вещества для элиминации болевых ощущений при поражениях кожи.
Пример 2.9. Оценку эффективности заявляемого вещества для снижения болевых ощущений при ангине проводили у пациентов с ангиной. Пациенты с выраженным болевым синдромом при глотании получали для полоскания горла раствор (или наносили спрей) на миндалины в концентрации от 0,01% до 10%. В качестве контроля использовали 0,9% раствор хлорида натрия. Для оценки эффективности использовали изменение интенсивности болевых ощущений по визуально-аналоговой шкале, через 1 минуту после нанесения/введения препарата и через 2 дня при каждодневном применении. Результаты представлены в таблице 20.
Данные таблицы 20 свидетельствуют о высокой активности заявляемого вещества для элиминации болевых ощущений при ангине.
Пример 2.10. Оценку эффективности заявляемого вещества для уменьшения кровотечения при эндодонтическом лечении проводили на животных. Для этого собакам под местной анестезией вскрывали полость зуба и обнажали поверхность пульпы. При удалении пульпы возникало кровотечение, которое останавливали с использованием раствора заявляемого вещества в концентрации от 0,01% до 10% или с использованием бумажных штифтов, пропитанных заявляемым веществом, или тупферов, пропитанных заявляемым веществом. Животные в группах контроля получали или 0,9% раствор хлорида натрия или бумажные штифты или тупферы без пропитки. Для оценки эффективности использовали изменение времени окончательной остановки кровотечения. Результаты представлены в таблице 21.
Данные таблицы 21 свидетельствуют о высокой активности заявляемого вещества для использования в эндодонтической практике.
Пример 2.11. Оценка эффективности заявляемого вещества для снижения болевых ощущений у пациентов с эндодонтическим лечением. С этой целью в полимерный силер для обтурации зубных каналов вводили заявляемое веществ до его конечной концентрации от 0,01% до 2%. Пациенты группы контроля получали полимерный силер для обтурации каналов. В исследовании участвовали пациенты с проведенным эндодонтическим лечением по поводу обострения хронического пульпита моляров. Для оценки эффективности использовали изменение интенсивности болевых ощущений (по визуально-аналоговой шкале, через 24 и 36 часов после проведенного лечения и введения препарата). Результаты представлены в таблице 22.
Данные таблицы 22 свидетельствуют о высокой активности заявляемого вещества для элиминации болевых ощущений при эндодонтическом лечении.
Пример 2.12. Оценку эффективности заявляемого вещества для снижения болевых ощущений при воспалительных заболеваниях пародонта и десен у пациентов с соответствующим болевым синдромом. Пациенты полоскали ротовую полость 0,01%-10% раствором препарата или получали 0,01%-10% гель, который вводили в пародонтальный карман, или получали «чипы» с медленным высвобождением активного вещества, содержащегося в концентрации от 0,01% до 10%. Препараты группы контроля получали 0,9% раствор хлорида натрия. Для оценки эффективности использовали изменение интенсивности болевых ощущений по визуально-аналоговой шкале, через 1 минуту после нанесения/введения препарата и через 2 дня при каждодневном применении. Результаты представлены в таблице 23.
Данные таблицы 23 свидетельствуют о высокой активности заявляемого вещества для элиминации болевых ощущений при воспалительных заболеваниях пародонта и десен.
Пример 2.13. Оценка эффективности заявляемого вещества для снижения болевых ощущений и кровотечения у пациентов с заболеваниями дыхательной системы (хроническая обструктивная болезнь легких, пневмония, муковисцидоз, туберкулез и др.) и после диагностических процедур (бронхоскопия, промывание бронхов и др.). Пациенты получали раствор заявляемого вещества в концентрации от 0,01% до 1% ингаляционно с использованием небулайзера. Пациенты группы контроля получали раствор субсульфата железа. В исследовании участвовали пациенты с хронической обструктивной болезнью легких, отмечающие усиление болевых ощущений в грудной клетке и появление кашля с кровянистой мокротой в течение последних трех дней. Для оценки эффективности учитывали изменение интенсивности болевых ощущений по визуально-аналоговой шкале через 1 минуту после введения препарата и через 5 дней при каждодневном однократном применении и исчезновение следов крови в мокроте.
Наличие крови в мокроте оценивали визуально:
«+++» - значительное количество,
«++» - умеренное количество,
«+» - малое количество,
«-» - отсутствие.
Результаты представлены в таблицах 24 и 25.
Данные таблицы 24 свидетельствуют о высокой анестезирующей активности заявляемого вещества для элиминации болевых ощущений при различных заболеваниях дыхательной системы и отсутствию таковой активности у прототипа (субсульфат железа).
Данные таблицы 25 свидетельствуют о высокой активности заявляемого вещества для снижения выраженности легочных кровотечений.
Пример 2.14. Оценка эффективности заявляемого вещества для снижения болевых ощущений у пациентов с заболеваниями опорно-двигательного аппарата. Пациентам с артритами, ревматизмом, остеохондрозом позвоночника вводили раствор заявляемого вещества местно при помощи электрофореза.
Пациенты группы контроля получали 0,9% раствор хлорида натрия с таким же способом введения. Для оценки эффективности использовали изменение интенсивности болевых ощущений по визуально-аналоговой шкале (ВАШ) от 0 до 10 баллов.
Результаты представлены в таблице 26.
Пример 2.15. Оценка эффективности заявляемого вещества для снижения болевых ощущений у пациентов с поражением суставов при подагре. Пациентам вводили раствор заявляемого вещества местно при помощи электрофореза. Критериями включения пациентов в исследование были следующие: диагноз подагры в соответствии с критериями ACR (4), возраст старше 18 лет, острый подагрический артрит, длительность которого не превышала 3-х недель, поражение не более 4-х суставов и подписанное больными информированное согласие. В дальнейшем в течение 7 дней производилась оценка выраженности болевого синдрома по ВАШ. Компьютерная обработка результатов осуществлялась при помощи пакета статистических программ Statistica, version 6. Пациенты группы контроля получали 0,9% раствор хлорида натрия с таким же способом введения.
Результаты представлены в таблице 27.
Пример 2.16. Оценка эффективности заявляемого вещества для снижения болевых ощущений в области глазного яблока при посттравматических процессах. Пациентам с различными поражениями глазного яблока, в том числе после хирургических вмешательств, в конъюнктивальный мешок закапывали раствор заявляемого вещества. В качестве контроля использовали глазные капли Диклофенак. Для оценки эффективности использовали изменение интенсивности болевых ощущений по ВАШ от 0 до 10 баллов.
Результаты представлены в таблице 28.
Пример 2.17. Оценка эффективности заявляемого вещества для снижения кровотечения и болевых ощущений при патологии ЛОР органов, верхних отделов дыхательной, а также пищеварительной системы, при инструментальных исследованиях данных систем. Пациентам с различными медицинскими вмешательствами после процедуры с гемостатической целью и снижения болевых ощущений применяли заявленный препарат. В качестве контроля использовали раствор субсульфата железа. Для оценки противоболевого эффекта использовали изменение интенсивности болевых ощущений по ВАШ от 0 до 10 баллов. Результаты приведены в таблицах 29 и 30.
Данные таблиц 29-30 свидетельствуют о высокой активности заявляемого вещества для остановки кровотечений, вместе с тем заявляемое вещество в отличие от прототипа существенно снижает болевые ощущения.
1. Гемостатическое средство, представляющее собой полииммонийметандиамина хлорид общей формулы где: n=1-20, m=1-10, при этом n×m≥8.
2. Гемостатическое средство по п. 1, отличающееся тем, что применяется в виде 0,01-10% водного раствора.
3. Гемостатическое средство по п. 2, отличающееся тем, что применяется для импрегнации материалов, используемых для остановки кровотечений.
4. Гемостатическое средство по п. 3, отличающееся тем, что применяется для импрегнации шовного материала.
5. Гемостатическое средство по п. 3, отличающееся тем, что используется для импрегнации перевязочного материала.
6. Гемостатическое средство по п. 1, отличающееся тем, что применяется в составе ретракционной нити.
7. Гемостатическое средство по п. 1, отличающееся тем, что применяется в составе адгезивных паст.
8. Гемостатическое средство по п. 2, отличающееся тем, что применяется в виде спрея.
9. Гемостатическое средство по п. 2, отличающееся тем, что применяется для ингаляционного введения.
10. Гемостатическое средство по п. 1, отличающееся тем, что применяется в составе вагинальных свечей.
11. Гемостатическое средство по п. 1, отличающееся тем, что применяется в составе ректальных свечей.
12. Гемостатическое средство по п. 1, отличающееся тем, что применяется в составе крема.
13. Гемостатическое средство по п. 1, отличающееся тем, что применяется в составе геля.
14. Гемостатическое средство по п. 1, отличающееся тем, что применяется с использованием чипов, обеспечивающих медленное высвобождение препарата.
15. Гемостатическое средство по п. 1, отличающееся тем, что применяется в составе глазных капель.
16. Гемостатическое средство по п. 1, отличающееся тем, что применяется в составе глазной мази.
17. Гемостатическое средство по п. 1, отличающееся тем, что применяется в составе смазки, наносимой на поверхность катетера.
18. Гемостатическое средство по п. 1, отличающееся тем, что применяется при эндодонтическом лечении.
19. Гемостатическое средство по п. 1, отличающееся тем, что вводится в полимерный силер для обтурации зубных каналов.
20. Гемостатическое средство по п. 1, отличающееся тем, что вводится местно при помощи электрофореза.
21. Гемостатическое средство по п. 1, отличающееся тем, что используется совместно с гелем на основе сульфата алюминия или раствором нитрата серебра.
22. Гемостатическое средство по п. 1, отличающееся тем, что используется совместно с полисахаридной гемостатической системой.