Способ получения днк-праймеров и зондов для малоинвазивной пренатальной пцр-диагностики трисомии 21-й хромосомы у плода по крови беременной женщины и диагностический набор для ее осуществления
Иллюстрации
Показать всеПредложенная группа изобретений относится к области медицины. Предложен способ получения ДНК-праймеров и зондов для малоинвазивной пренатальной ПЦР-диагностики трисомии 21-й хромосомы у плода по крови беременной женщины, характеризующийся тем, что выбирают сайт дифференциального метилирования фетальной ДНК 21-й хромосомы и ДНК 21-й хромосомы взрослого человека, чувствительный к эндонуклеазам, синтезируют прямой и обратный праймер, соответствующие ампликону длиной от 60 до 300 п.н., а также зонд, соответствующий этому ампликону, проводят ПЦР в реальном времени смеси образцов после их обработки эндонуклеазой рестрикции, отбирают пары праймеров и зонды, обеспечивающие эффективность реакции ПЦР в реальном времени выше 90% и линейность при изменении относительной концентрации образцов выше 90%. Предложены также набор и малоинвазивный способ пренатальной ПЦР-диагностики в реальном времени трисомии 21-й хромосомы у плода по крови беременной женщины. Предложенная группа изобретений обеспечивает эффективные средства и методы определения трисомии хромосомы 21 плода по крови беременной женщины. 3 н. и 13 з.п. ф-лы, 15 ил., 3 табл., 1 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к медицине, в особенности к молекулярно-биологическим исследованиям в области определения анеуплодий, и может быть использовано для определения трисомий 21-й хромосомы плода по крови беременной женщины.
УРОВЕНЬ ТЕХНИКИ
Хромосомная патология является причиной многих врожденных заболеваний, среди которых самым распространенным является синдром Дауна, вызванный полной или частичной трисомией по хромосоме 21. Тяжесть заболевания и риск конкретных клинических проявлений зависит от многих невыясненных факторов, но даже в легких формах синдром Дауна вызывает инвалидность с самого раннего возраста ребенка.
Применение инвазивных методов дородовой диагностики (трансабдоминальной хорионбиопсии или плацентобиопсии, трансцервикальной хорионбиопсии или плацентобиопсии, амниоцентеза или кордоцентеза) оказывается наиболее эффективным, так как их результаты позволяют с высокой точностью судить о наличии у плода наследственной патологии. Однако, несмотря на очевидные преимущества ранней пренатальной диагностики, существуют и значительные недостатки, связанные, преждевсего, с возникновением угрозы выкидыша. Показано, что у 10÷12% женщин отмечаются маточные кровотечения, у 3% повышается тонус матки, а в 1,5÷2% случаев происходит самопроизвольное прерывание беременности. Во многих случаях, при нарушении технологии забора плодного материала возможно инфицирование организма плода и матери.
В последние годы интенсивно разрабатываются неинвазивные негенетические методы дородовой диагностики различной наследственной патологии. Риск осложнений при их проведении существенно ниже, чем при использовании инвазивных методов. Наиболее часто неинвазивные методы, не требующие забора плодного материала, применяют для диагностики у плода врожденных пороков развития и хромосомных синдромов. Точность этих методов, при разных их сочетаниях и в разные сроки беременности, составляет 80÷90%, при этом 10% результатов являются ложноположительными.
Предложен ряд подходов для детекции трисомий, основанных на технологии полногеномного секвенирования, но они характеризуются высокой трудоемкостью и стоимостью исследования.
Таким образом, в настоящее время все еще сохраняется потребность в создании способа диагностики хромосомных синдромов, которые были бы свободны от вышеупомянутых недостатков инвазивных способов и в то же время превосходили бы существующие неинвазивные и малоинвазивные способы в плане надежности результатов диагностики.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В настоящем тексте использованы следующие сокращения:
БСА - бычий сывороточный альбумин.
ДНК - дезоксирибонуклеиновая кислота.
ПЦР - полимеразная цепная реакция.
FAM/BHQ-1 - один из распространенных пар флуоресцентных красителей/гасителей флуоесценции. В настоящем изобретении могут быть использованы и другие пары флуоресцентных красителей/гасителей флуоресценции, например, FAM/Dabcyl, HEX/BHQ1, HEX/BHQ2, R6G/BHQ2, ROX/BHQ2, Cy5/BHQ2, Cy5/BHQ3, Cy5.5/BHQ3, FAM/(BHQ2-dT)внутр., R6G/(BHQ2-dT)внутр.
ЭДТА - этелендиаминтетраацетат натрия.
Задачей настоящего изобретения состоит в создании способа определения наличия трисомии хромосомы 21, позволяющего выявлять ДНК в плазме человека в минимальных концентрациях, и диагностического набора для его осуществления, позволяющего определять трисомию хромосомы 21 плода по крови беременной женщины.
Совместное присутствие ДНК будущей матери и плода в материнской плазме предполагает развитие ДНК-диагностики, основанной, в значительной степени, на использовании генетических маркеров, которые позволили бы различать ДНК плода и матери.
Большинство методов обнаружения анеуплоидии, основанных на исследовании клеток, не могут быть применены, так как нуклеиновые кислоты циркулируют в материнской плазме во внеклеточной форме, поэтому в настоящем изобретении предлагается использовать различия в метилировании разных регионов 21-й хромосомы, что позволяет дифференцировать плодную ДНК и ДНК матери и провести прямое измерение количества копий хромосомы 21 у плода.
Техническим результатом является создание способа определения наличия трисомии хромосомы 21, позволяющего выявлять ДНК в плазме человека в минимальных концентрациях, и диагностического набора для его осуществления, позволяющего определять трисомию хромосомы 21 плода по крови беременной женщины.
Вышеуказанный результат достигнут благодаря тому, что предложен способ получения ДНК-праймеров и зондов для малоинвазивной пренатальной ПЦР-диагностики трисомии 21-й хромосомы у плода по крови беременной женщины используют:
(а) сайт-специфичную(-ые) эндонуклеазу(-ы) рестрикции, чувствительную(-ые) к метилированию,
(б) образец гиперметилированной или фетальной ДНК человека,
(в) образец гипометилированной ДНК или ДНК взрослого человека, характеризующийся тем, что он предусматривает следующие стадии:
(1) выбирают сайт дифференциального метилирования фетальной ДНК 21-й хромосомы и ДНК 21-й хромосомы взрослого человека, чувствительный к упомянутой эндонуклеазе(-ам),
(2) синтезируют прямой и обратный праймер, соответствующие ампликону длиной от 60 до 300 пар нуклеотидов, содержащему сайт(ы) дифференциального метилирования 21-й хромосомы, а также зонд, соответствующий этому ампликону,
(3) проводят полимеразную цепную реакцию смеси образцов (б) и (в) после их обработки эндонуклеазой рестрикции (а), по меньшей мере, при трех различных соотношениях концентрации этих образцов,
(4) отбирают пары праймеров и зонды, обеспечивающие эффективность реакции ПЦР выше 90% и линейность при изменении относительной концентрации образцов (б) и (в) выше 90%.
Также, в еще одном аспекте, настоящее изобретение относится к набору для малоинвазивной пренатальной ПЦР-диагностики трисомии 21-й хромосомы у плода по крови беременной женщин, содержащий, по меньшей мере, одну пару, состоящую изпрямого и обратного праймеров, полученных в соответствии с вышеописанным способом, и, по меньшей мере, один соответствующий им зонд.
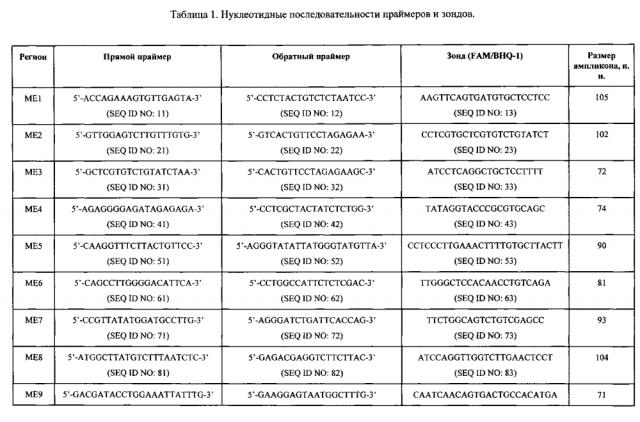
При разработке методик детекции количества копий ДНК с помощью разрушаемых олигонуклеотидных зондов основной проблемой является неспецифичный отжиг зондов, что может приводить к значительным систематическим ошибкам измерения. Для устранения этого явления необходимо выбирать наиболее специфичные комбинации праймеров и зондов и тщательно оптимизировать концентрацию олигонуклеотидов в смеси. Также следует принимать во внимание известные из литературных данных ограничения на длину ампликонов для фетальной ДНК, так как длина ее фрагментов в кровотоке матери не превышает 300 п.н. С учетом этого для выбранных регионов был проведен дизайн праймеров и зондов, позволивший увеличить специфичность in silico и получить максимально короткие ампликоны.
Таким образом, предпочтительно, когда набор включает праймеры, размер ампликона у котороых составляет целое число в диапазоне от 60 до 300 пар нуклеотидов, предпочттельно, целое число в диапазоне от 71 до 105 пар нуклеотидов.
Наиболее предпочтительными для включения в состав набора являются следующие пары праймеров:
SEQ ID NO: 41 и SEQ ID NO: 42, и/или гомологичные им, по меньшей мере, на 95% пары праймеров, и/или
SEQ ID NO: 71 и SEQ ID NO: 72, и/или гомологичные им, по меньшей мере, на 95% пары праймеров, и/или
SEQ ID NO: 101 и SEQ ID NO: 102, и/или гомологичные им, по меньшей мере, на 95% пары праймеров.
В одном из наиболее предпочтительных форм выполнения, вышеописанный набор дополнительно включает в себя ДНК индивидуума с трисомией 21-й хромосомы для положительного контроля. Положительный(-ые) контроль(-и), позволяет(-ют) проконтролировать качество выделения ДНК и снизить вероятность ложноотрицательных результатов.
В еще одной из форм выполнения, вышеописанный набор дополнительно включает в себя термостабильную ДНК-полимеразу 10 единиц/мкл.
В другой предпочтительной форме выполения, вышеописанный набор дополнительно включает в себя водный раствор, содержащий:
приблизительно 67 мМ трис-HCl, pH 8,8 при 25°C,
приблизительно 16,6 мМ (NH4)2S04,
приблизительно 6,7 мМ MgCl2,
приблизительно 6,7 мкм ЭДТА,
приблизительно 170 мкг БСА, и
смесь четырех основных dNTP в концентрации приблизительно 0,2 мМ каждого.
В еще одной предпочтительной форме выполнения вышеописанный набор дополнительно включает в себя воду ампулированную.
В еще одном своем аспекте, настоящее изобретение относится к малоинвазивному способу пренатальной ПЦР-диагностики трисомии 21-й хромосомы у плода по крови беременной женщины, в котором используют:
(а) образец крови беременной женщины;
(б) вышеописанные праймеры и зонды;
(в) сайт-специфичную(-ые) эндонуклеазу(-ы) рестрикции, чувствительную(-ые) к метилированию, предусматривающий следующие стадии:
(1) выделяют ДНК из образца (а);
(2) обрабатывают ДНК, выделенную на стадии (1) эндонуклеазами (в);
(3) проводят количественную полимеразную цепную реакцию продуктов реакции, полученных на стадии (2) состоящую из начального плавления и ряда циклов из плавления, отжига и синтеза;
(4) определяют количество продуктов ПЦР посредством флуоресцентной спектрометрии в присутствии зондов (б).
В одной из предпочтительных форм осуществления вышеописанного способа диагностики, в нем дополнительно используют:
(г) пару праймеров и зонд к гиперметилированному фрагменту референсной хромосомы, которые получены в соответствии с вышеописанным способом, при этом
(4) в качестве диагностического показателя используют соотношение сигналов от зондов (б) и (г).
Предпочтительно, когда в качестве референсной хромосомы используют 13-ю хромосому.
Особенно предпочтительно, когда в качестве пары праймеров и зонда (г) используют пару праймеров и зонд, имеющие последовательности SEQ ID NO: 131, SEQ ID NO: 132 и SEQ ID NO: 133, и/или гомологичную им, по меньшей мере, на 95% последовательность.
В одной из предпочтительных форм осуществления способа сайт-специфичная эндонуклеаза рестрикции, чувствительная к метилированию, представляет собой HpaII и/или BstFNI.
В еще одной из предпочтительных форм осуществления способа, при проведении стадии ПЦР
проводят начальное плавление в течение 2 мин при температуре 95°C,
50÷60 раз проводят цикл, включающий плавление при 94÷96°C в течение от 10÷30 с, отжиг и синтез при температуре 62÷66°C в течение 30÷60 мин,
детекцию продуктов ПЦР проводят во время стадии отжига.
В другой предпочтительной форме осуществления способа, расщепление проводят 100 единицами эндонуклеазы в течении 16 часов.
В особенно предпочтительной форме осуществления способа, концентрация праймеров в реакционной смеси составляет 500 нМ, зондов - 250 нМ, а температура отжига - 60°C.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1. Результаты экспериментальной проверки различных концентрации набора праймеров и зондов для региона МЕ1, по осям X и Y - значения концентрации праймеров, по оси Ζ - значения эффективности ПЦР, в данном примере используемая концентрация зонда - 200 нМ.
Фиг. 2. График накопления флуоресценции для региона МЕ1. ДНК контролей в реакционной смеси с количеством копий: 105, 104, 103, 102, 101.
Фиг. 3. Пример эффективности (Е=74%) амплификации для региона МЕ1 с помощью ПЦР в реальном времени. ДНК контролей в реакционной смеси с количеством копий: 105, 104, 103, 102, 101.
На Фиг. 4-15 представлены результаты экспериментальной проверки соотношения метилирования для региона МЕ1- ME12, соответственно.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Для оценки характеристик способа флуоресцентной детекции концентрацию праймеров и зондов варьируют в диапазоне 100-4000 нМ с шагом 100 нМ для праймеров и 50÷500 нМ с шагом 50 нМ для зондов.
Оценку эффективности амплификации различных комбинаций концентраций праймеров и зондов проводят с разведениями ДНК контролей в реакционной смеси с количеством копий: 105, 104, 103, 102, 101.
Используют образцы геномной ДНК клеточных линий Jurkat, неметилированную и метилированную по всем CpG-островкам (производитель «Thermo Scientific)), США).
Концентрацию ДНК измеряют на спектрофотометре Nano Vue («HealthCare BioSciences АВ», Швеция).
Эндонуклеазное расщепление материнской ДНК проводят эндонуклеазами рестрикции HpaII и BstFNI (ООО «СибЭнзим», 100 единиц эндонуклеазы в течении 16 часов в буфере, рекомендованном производителем).
Амплификацию проводят на термоциклере ABI StepOnePlus («Applied Biosystems») в 20 мкл реакционной смеси следующего состава:
70 мМ Трис-HCl, pH 8,8,
16,6 мМ сульфат аммония,
0,01%-ный Твин-20,
2,0 мМ хлорид магния,
200 нМ каждого dNTP, 100÷1000 нМ праймеров, 50÷500 нМ зондов,
1,0 единиц Taq-ДНК-полимеразы.
Условия амплификации фрагмента ДНК: 95°C/2 мин - первый цикл; 94°C/10 с, 60°C/90 с - 40 циклов.
Регистрируемое накопление сигнала флуоресценции свидетельствовало о том, что в образце есть ДНК, содержащая гиперметилированный регион.
На Фиг. 1 показаны результаты экспериментальной проверки различных концентрации набора пар праймеровов и зондов для региона МЕ1, по осям X и Y - значения концентрации пар праймеровов, по оси Ζ - значения эффективности ПЦР, в данном примере используемая концентрация зонда - 200 нМ.
Пример результатов экспериментальной проверки характеристик различных наборов праймеров и зондов приведены в таблице 2 и на Фиг. 1, графики накопления флуоресценции и вычисления эффективности ПЦР для региона МЕ1 представлены на фигурах 2, 3, 4 и 5.
Аналогичные эксперименты проводят для всех регионов и всех вариантов концентраций праймеров и зондов.
Экспериментальным путем для всех вариантов концентраций праймеров и зондов для всех наборов установили, что оптимальной концентрацией праймеров в реакционной смеси является концентрация 500 нМ, зондов - 250 нМ, а температура отжига - 60°C.
На основе полученных значений параметров ПЦР можно сделать вывод о том, что все наборы праймеров и зондов подходят для проведения анализа и демонстрируют высокие значения эффективности и близкие к единице значения линейности R2, что позволяет использовать данные наборы олигонуклеотидов для измерения количества копий хромосомы 21 (см. таблицу 3).
Эффективность и линейность - представляют собой параметры ПЦР, получаемые из серии разведений концентраций в 10 раз. Эти параметры определяют следующим образом. Строят график зависимости (например, как показано на Фиг. 3) порогового цикла от логарифма концентрации; проводят апроксимирующую прямую (полученную, например, методом наименьших квадратов); из уравнения прямой y=ax+b вычисляют эффективность, равную Е=10(-1/а), при этом R2 - коэффициент корреляции, показывающий, насколько точно экспериментальные точки приближаются к аппроксимирующей прямой, величина достоверности апроксимации (например, средний квадрат отклонения).
Для оценки характеристик выбранных дифференциальнометилируемых регионов мы используют критерий Вилкоксона-Манна-Уитни, расчет базировался на параметре степени метилирования, рассчитываемом по следующей формуле:
СМ=(Среднее нормированное Ct дублей образцов) / (Среднее нормированное Ct нормальных контролей)
Значение СМ≤1 рассматривалось как отсутствие трисомии.
Значение СМ>1 рассматривалось как наличие трисомии.
Среднее нормированное Ct вычисляется как среднее дублей постановок одного образца или контроля:
нормCtобразец=ЕвхСt-мCt,
где:
BxCt - пороговый цикл образца до обработки эндонуклеазами рестрикции;
mCt - пороговый цикл образца после обработки эндонуклеазами рестрикции;
Ε - эффективность реакции ПЦР для данной пары праймеров.
На фигурах 4-15 представлены значения СМ для пар норма-трисомия (10 пар) с минимальными и максимальными значениями, верхних и нижним квартилями и средним.
На основе полученных значений можно сделать вывод о том, что в состав тест-системы оптимально включить следующие дифференциальнометилируемые регионы: МЕ4, МЕ7, МЕ10.
С помощью дискриминантного анализа и на основе значений статистики лямбда Уилкса были подобраны коэффициенты уравнения для дискриминации:
D=-3,461+0,842 ХМЕ4+0,428 ХМЕ7+0,845 ΧΜΕ10,
где D - коэффициент дискриминации,
при D>0 случай рассматривается как трисомия,
при D≤0 случай рассматривается как норма;
Χ - относительное содержание в образце региона хромосомы 21, нормированное на гиперметилированный регион сравнения хромосомы 13 по методу «дельта-дельта Ct», например:
ХMЕ4=ЕMЕ4 -(ME4Ctобразца-ME4Ctконтроля)/EHP1 -(НР1Ctобразца-HP1Ctконтроля))
1. Способ получения ДНК-праймеров и зондов для малоинвазивной пренаталыюй ПЦР-диагностики трисомии 21-й хромосомы у плода по крови беременной женщины, в котором используют:(а) сайт-специфичную(-ые) эндонуклеазу(-ы) рестрикции, чувствительную(-ые) к метилированию,(б) образец гиперметилированной или фетальной ДНК человека,(в) образец гипометилированной ДНК или ДНК взрослого человека, характеризующийся тем, что он предусматривает следующие стадии:(1) выбирают сайт дифференциального метилирования фетальной ДНК 21-й хромосомы и ДНК 21-й хромосомы взрослого человека, чувствительный к упомянутой эндонуклеазе(-ам),(2) синтезируют прямой и обратный праймер, соответствующие ампликону длиной от 60 до 300 пар нуклеотидов, содержащему сайт(ы) дифференциального метилирования 21-й хромосомы, а также зонд, соответствующий этому ампликону,(3) проводят полимеразную цепную реакцию в реальном времени смеси образцов (б) и (в) после их обработки эндонуклеазой рестрикции (а) по меньшей мере при трех различных соотношениях концентрации этих образцов,(4) отбирают пары праймеров и зонды, обеспечивающие эффективность реакции ПЦР в реальном времени выше 90% и линейность при изменении относительной концентрации образцов (б) и (в) выше 90%.
2. Набор для малоинвазивной пренатальной ПЦР-диагностики в реальном времени трисомии 21-й хромосомы у плода по крови беременной женщин, содержащий по меньшей мере одну пару, состоящую из прямого и обратного праймеров, полученных в соответствии со способом по п. 1, и по меньшей мере один соответствующий им зонд.
3. Набор по п. 2, характеризующийся тем, что размер ампликона составляет целое число в диапазоне от 60 до 300 пар нуклеотидов, предпочттельно, целое число в диапазоне от 71 до 105 пар нуклеотидов.
4. Набор по п. 2, характеризующийся тем, что он включает в себяпару праймеров SEQ ID NO: 41 и SEQ ID NO: 42, и/или гомологичную им по меньшей мере на 95% пару праймеров, и/илипару праймеров SEQ ID NO: 71 и SEQ ID NO: 72, и/или гомологичную им по меньшей мере на 95% пару праймеров, и/илипару праймеров SEQ ID NO: 101 и SEQ ID NO: 102, и/или гомологичную им по меньшей мере на 95% пару праймеров.
5. Набор по п. 2, характеризующийся тем, что он дополнительно включает в себя ДНК индивидуума с трисомией 21-й хромосомы для положительного контроля.
6. Набор по п. 2, характеризующийся тем, что он дополнительно включает в себя термостабильную ДНК-полимеразу 10 единиц/мкл.
7. Набор по п. 2, характеризующийся тем, что он дополнительно включает в себя водный раствор, содержащий:приблизительно 67 мМ трис-HCl, рН 8,8 при 25° С,приблизительно 16,6 мМ (NH4)2SO4 приблизительно 6,7 мМ MgCl2,приблизительно 6,7 мкм ЭДТА,приблизительно 170 мкг БСА, исмесь четырех основных dNTP в концентрации приблизительно 0,2 мМ каждого.
8. Набор по п. 2, характеризующийся тем, что он дополнительно включает в себя воду ампулированную.
9. Малоинвазивный способ пренатальной ПЦР-диагностики в реальном времени трисомии 21-й хромосомы у плода по крови беременной женщины, в котором используют:(а) образец крови беременной женщины;(б) праймеры и зонды по любому из пп. 1 или 4;(в) сайт-специфичную(-ые) эндонуклеазу(-ы) рестрикции, чувствительную(-ые) к метилированию,характеризующийся тем, что он предусматривает следующие стадии:(1) выделяют ДНК из образца (а);(2) обрабатывают ДНК, выделенную на стадии (1) эндонуклеазами (в);(3) проводят количественную полимеразную цепную реакцию в реальном времени продуктов реакции, полученных на стадии (2) состоящую из начального плавления и ряда циклов из плавления, отжига и синтеза;(4) определяют количество продуктов ПЦР посредством флуоресцентной спектрометрии в присутствии зондов (б).
10. Способ по п. 9, характеризующийся тем, что в нем дополнительно используют:(г) пару праймеров и зонд к гиперметилированному фрагменту референсной хромосомы, полученных аналогично способу по п. 1, при этом(4) в качестве диагностического показателя используют соотношение сигналов от зондов (б) и (г).
11. Способ по п. 10, характеризующийся тем, что референсная хромосома представляет собой 13-ю хромосому.
12. Способ по п. 11, характеризующийся тем, что пара праймеров и зонд (г) имеют последовательности SEQ ID NO: 131, SEQ ID NO: 132 и SEQ ID NO: 133, и/или гомологичную им по меньшей мере на 95% последовательность.
13. Способ по п. 9, характеризующийся тем, что сайт-специфичная эндонуклеаза рестрикции, чувствительная к метилированию, представляет собой HpaII и/или BstFNI.
14. Способ по п. 9, характеризующийся тем, что при проведении стадии ПЦР проводят начальное плавление в течение 2 мин при температуре 95°С,50-60 раз проводят цикл, включающий плавление при 94-96°С в течение от 10-30 с, отжиг и синтез при температуре 62-66° С в течение 30-60 мин,детекцию продуктов ПЦР проводят во время стадии отжига.
15. Способ по п. 9, характеризующийся тем, что в нем, расщепление проводят 100 единицами эндонуклеазы в течение 16 часов.
16. Способ по п. 9, характеризующийся тем, что в нем концентрация праймеров в реакционной смеси составляет 500 нМ, зондов - 250 нМ, а температура отжига 60°С.