Способ выявления веществ и их композиций с противоопухолевой активностью
Иллюстрации
Показать всеИзобретение относится к области разработки лекарственных препаратов для лечения онкологических заболеваний. Предложен способ выявления веществ и их композиций с противоопухолевой активностью, основанный на увеличении продукции репортерного белка, кодируемого рекомбинантным репликативно-дефектным аденовирусом, в ответ на воздействие веществ или их композиций на молекулярные мишени из числа протеинкиназы mTOR, топоизомераз I и II, гистон деацетилаз и неизвестных мишеней, ингибируемых соединениями LY294002 и LY303511. Изобретение обеспечивает эффективное выявление веществ, обладающих противоопухолевой активностью, и их композиций. 9 з.п. ф-лы, 4 ил., 4 пр.
Реферат
Область техники, к которому относится настоящее изобретение
Настоящее изобретение относится к области разработки лекарственных препаратов для лечения онкологических заболеваний, в частности к первичной идентификации перспективных веществ и их композиций, обладающих противоопухолевой активностью.
Предшествующий уровень техники настоящего изобретения
Онкологические заболевания продолжают оставаться одной из основный причин смертности, несмотря на существенный прогресс в разработке новых стратегий их лечения. Одно из основных мест в лечении онкологических заболеваний занимают лекарственные препараты, представляющие собой малые молекулы. Основным требованием для таких малых молекул является их селективное токсическое воздействие на опухолевые клетки в сочетании с отсутствием токсического действия на нормальные клетки организма. Исторически мишенью первых препаратов с противоопухолевой активностью являлся процесс клеточного деления, одна из основных характеристик опухолевых клеток. В этом случае селективность воздействия на опухолевые клетки достигалась за счет дифференциации по принципу присутствия процесса клеточного деления. В настоящее время процесс клеточного деления продолжает оставаться одной из мишеней при разработке противоопухолевых препаратов с различными механизмами действия. Однако современная тенденция в области разработки новых противоопухолевых препаратов состоит в специфическом воздействии на молекулярные мишени, существенные - и, желательно, уникальные - для опухолевых клеток. Такой рационально обоснованный подход основан на выявлении таких мишеней с последующим поиском малых молекул, специфически воздействующих на эту мишень. Одним из примеров такой комбинации опухоль-специфической молекулярной мишени и воздействующей на нее малой молекулы является мутированный протоонкоген B-Raf (V600E) и препарат вемурафениб (Zelboraf®). Разработка подобных таргетных препаратов позволяет повысить эффективность и специфичность воздействия на опухолевые клетки. Поиск новых малых молекул с анти-неопластичными свойствами продолжает оставаться актуальной областью исследования, являясь предтечей разработки на их основе противоопухолевых лекарственных препаратов.
В настоящее время выявлено большое число молекулярных мишеней для воздействия с целью лечения онкологических заболеваний, многие из которых являются пригодными для воздействия на них с помощью малых молекул. Дальнейшая концепция развития этого направления состоит в выявлении малых молекул, воздействующих на эти мишени, с последующими исследованиями, призванными выявить действительную эффективность полученных молекул в экспериментах in vivo, в доклинических моделях и клинических исследованиях, с параллельной оптимизацией структуры молекулы для увеличения ее специфической активности и получения приемлемых фармакологических показателей. Для поиска таких молекул с целью последующей их оптимизации в части специфической активности и фармакологических характеристик применяют два основных подхода: поиск молекул, обладающих заданной специфической активностью, из набора (коллекции) широкого спектра химических веществ (библиотеки веществ), и выбор молекул(ы)-кандидата(ов) in silico на основании компьютерного моделирования с использованием 3D-структуры мишени (Liu R, Hsieh CY, Lam KS. New approaches in identifying drugs to inactivate oncogene products. Semin Cancer Biol. 2004; 14(1):13-21; Shoemaker RH, Scudiero DA, Melillo G, Currens MJ, Monks AP, Rabow AA, Covell DG, Sausville EA. Application of high-throughput, molecular-targeted screening to anticancer drug discovery. Curr Top Med Chem. 2002; 2(3):229-46). Также возможна и комбинация этих подходов, когда на первом этапе проводится скрининг небольшой библиотеки структурно различных веществ для первоначального выявления структур, принципиально позволяющих реализовать заданную активность, с последующей оптимизации структуры отобранных кандидатов на основании определенных 3D-структур комплекса молекул вещества и мишени.
Технически отбор молекул-кандидатов по признаку присутствия заданной активности или анализ ее присутствия у предсказанных молекул может проводиться двумя способами: в системе in vitro, когда активность молекулы (например, способность ингибировать активность определенного фермента) анализируется непосредственно в ходе химической реакции, или в системах in vivo, основанных на анализе воздействия молекулы на клетки, которые, как правило, модифицированы надлежащим образом, что позволяет судить о воздействии исследуемой молекулы на заданную мишень по изменению регистрируемых параметров системы (например, пролиферативная активность, активность репортерного гена и т.п.). С очевидностью, в первом случае диапазон поиска строго ограничен единственной молекулой мишенью, анализ изменения активности которой в присутствии исследуемых малых молекул проводится in vitro. Во втором случае появляется возможность отбора молекул, которые воздействуют не только на непосредственную мишень, но и на ее регуляторы, эндогенно присутствующие в клетках, если такие существуют. Тем не менее, в обоих вариантах реализации поиска молекул с противоопухолевой активностью диапазон поиска по спектру мишеней ограничен или строго одной мишенью, или одной мишенью с регуляторами ее активности, то есть одним процессом (например, сигнальным каскадом) в клетке. При необходимости поиска молекул, воздействующих на иную мишень, возникает необходимость разработки новой системы скрининга. Очевидно, что при использовании систем скрининга, основанных на культурах клеток, потенциальная продуктивность системы скрининга в части выявления молекул, воздействующих на различные мишени (как заданную, так и ее регуляторов, которые часто также являются валидированными мишенями), существенно шире по сравнению с системами скрининга in vitro, что является несомненным преимуществом, позволяя мультиплицировать анализ, особенно в случае скринига в системах на основе эукариотических клеток (предпочтительно, клеток млекопитающих) в силу присутствия внутриклеточных систем регуляции мишени, принципиально сходных с таковыми в опухолевых клетках человека.
При разработке клеточных систем скрининга, как правило, регистрируется косвенный результат воздействия на мишень, например, по активации определенного сигнального пути или изменении транскрипции репортерного гена. В каждом случае дизайн системы скрининга является уникальной задачей и должен принимать во внимание все известные молекулярные механизмы действия мишени. В ряде случаев мишень для воздействия является «суррогатной», то есть предоставляя возможность регистрации ее активности и являясь по своей сути сенсором, позволяет выявить молекулы, которые влияют не непосредственно на нее, а на ее регуляторы, тем самым достигая желаемого биологического противоопухолевого эффекта. Примером такого подхода является скрининг веществ по их способности индуцировать экспрессию белка p21(Waf), позволивший идентифицировать новый продукт природного происхождения псаммаплин А, действие которого основано на ингибировании активности гистон-деацетилаз, и на его основе создать молекулу с приемлемым фармакологическим профилем (NVP-LAQ824, dacinostat) (Remiszewski SW. The discovery of NVP-LAQ824: from concept to clinic. Curr Med Chem. 2003; 10(22):2393-402). Таким образом, проведение поиска малых молекул с противоопухолевой активностью на основании анализа суррогатного параметра, коррелирующего со свойствами опухолевых клеток и активностью существенных молекулярных мишеней, является жизнеспособным и экспериментально валидированным подходом при поиске новых молекул с противоопухолевой активностью. Очевидно, что использование суррогатного параметра, способного изменять свои характеристики в ответ на воздействие на множественные и не связанные между собой, но существенные для опухолевой клетки мишени, является актуальной задачей. Ее решение позволит вместо проведения процедур скрининга для каждой мишени в отдельности выявлять кандидатные вещества или их композиции, воздействующие на различные молекулярные мишени, в рамках одного первичного скрининга. При этом, с очевидностью, для возможности анализа активности большого числа веществ и их композиций система скрининга, удовлетворяющая таким требованиям, должна быть реализована в высокопроизводительном и, предпочтительно, в гомогенном формате, что исключает дополнительные манипуляции при проведении анализа активности исследуемых веществ и делает процедуру скрининга более простой, быстрой и менее затратной.
Ранее нами было установлено, что обработка клеток, зараженных рекомбинантным репликативно-дефектным аденовирусом, кодирующим зеленый флуоресцентный белок (EGFP) или иной белок, ингибиторами киназ LY294002 или LY303511, приводит к усилению экспрессии трансгена с увеличением продукции кодирующего его белка (Shepelev MV, Korobko EV, Vinogradova TV, Kopantsev EP, Korobko IV. LY294002 enhances expression of proteins encoded by recombinant replication-defective adenoviruses via mTOR- and non-mTOR-dependent mechanisms. Mol Pharm. 2013;10(3):931-9).
Соединение LY294002 (2-(4-морфолинил)-8-фенил-4Н-1-бензопиран-4-он) обладает способностью ингибировать фосфоинозитид-3-киназы (PI3K), протеинкиназы mTOR и казеинкиназу II. Указанное соединение само по себе не является фармакологически применимым ингибитором в силу его нерастворимости в воде и быстрого распада после введения. Однако его растворимое в воде производное (конъюгат с пептидом RGDS), SF1126 (Semaphore Pharmaceuticals Inc) является перспективным лекарственным средством и проходит в настоящее время клинические испытания как ингибитор РБК. В публикации Garlich et al. (Garlich JR, De P, Dey N, Su JD, Peng X, Miller A, Murali R, Lu Y, Mills GB, Kundra V, Shu HK, Peng Q, Durden DL. A vascular targeted pan phosphoinositide 3-kinase inhibitor prodrug, SF1126, with antitumor and antiangiogenic activity. Cancer Res. 2008; 68(1):206-15) приведены подробные сведения по эффективному действию SF1126 как противоопухолевого препарата на модели опухолей на мышах. К настоящему времени результаты клинических испытаний SF1126 (I фаза) свидетельствуют о хорошей толерантности к SF1126 у пациентов и его клинической активности у пациентов с солидными опухолями, выраженную в стабилизации болезни (Chiorean et al., ASCO 2009, J Clin Oncol).
Близкий структурный аналог LY294002 - соединение LY303511 (2-(4-пиперазинил)-8-фенил-4Н-1-бензопиран-4-он) - не способен ингибировать PI3K, но сохраняет способность ингибировать активность mTOR и казеинкиназы И. Будучи ингибиторами mTOR-сигнального пути, LY303511 и его производные рассматриваются как перспективные средства для ингибирования нежелательной пролиферации клеток, в том числе опухолевых (заявка на выдачу патента США №20070173514). Соединение LY303511 сенсибилизирует клетки к апоптозу, индуцированному химиотерапевтическими средствами (например, винкристином) (Poh TW, Pervaiz S. LY294002 and LY303511 sensitize tumor cells to drug-induced apoptosis via intracellular hydrogen peroxide production independent of the phosphoinositide 3-kinase-Akt pathway. Cancer Res. 2005; 65(14): 6264-74) и ингибирует пролиферацию клеток в культуре, а также рост опухоли у мышей в модельной системе (Kristof AS, Pacheco-Rodriguez G, Schremmer В, Moss J. LY303511 (2-piperazinyl-8-phenyl-4H-1-benzopyran-4-one) acts via phosphatidylinositol 3-kinase-independent pathways to inhibit cell proliferation via mammalian target of rapamycin (mTOR)-and non-mTOR-dependent mechanisms. J Pharmacol Exp Ther. 2005; 314(3):1134-43), что делает его перспективным как противоопухолевое средство.
Таким образом, LY294002, LY303511 и их производные являются основой для разработки перспективных препаратов, одной из ниш применения которых является лечение онкологических заболеваний.
Ранее нами было показано, что при обработке клеток, зараженных рекомбинантным репликативно-дефектным аденовирусом, кодирующим белок EGFP, ингибитором LY294002 усиление продукции белка EGFP частично обусловлено способностью LY294002 ингибировать активность протеинкиназы mTOR (Shepelev MV, Korobko EV, Vinogradova TV, Kopantsev EP, Korobko IV. LY294002 enhances expression of proteins encoded by recombinant replication-defective adenoviruses via mTOR- and non-mTOR-dependent mechanisms. Mol Pharm. 2013; 10(3):931-9). Внутриклеточный сигнальный каскад, включающий в себя Р13-киназы, протеинкиназы Akt и mTOR, часто аномально активирован в опухолевых клетках. Компоненты этого сигнального каскада, в частности протеинкиназа mTOR, являются привлекательными мишенями для терапии опухолей путем ингибирования их активности (LoPiccolo J, Blumenthal GM, Bernstein WB, Dennis PA. Targeting the PI3K/Akt/mTOR pathway: effective combinations and clinical considerations. Drug Resist Updat. 2008; 11(1-2):32-50; Engelman JA. Targeting PI3K signalling in cancer: opportunities, challenges and limitations. Nat Rev Cancer. 2009; 9(8):550-62). В частности, производное ингибитора mTOR рапамицина, темсиролимус, в настоящее время одобрен для лечения некоторых типов опухолей. Однако опухолевые клетки часто приобретают резистентность к рапамицину, что делает необходимым поиск иных ингибиторов mTOR-сигнального пути. Результаты, полученные нами ранее, демонстрируют, что вещества-ингибиторы каталитической активности mTOR, в частности ингибитор Ku-63794, также способны приводить к увеличению продукции белка EGFP в клетках, зараженных рекомбинантным репликативно-дефектным аденовирусом, кодирующим EGFP. Таким образом, ингибирование активности протеинкиназы mTOR, молекулярной мишени для разработки противоопухолевых препаратов, может быть зарегистрировано по увеличению продукции белка EGFP в клетках, зараженных рекомбинантным репликативно-дефектным аденовирусом, кодирующим EGFP.
Как отмечалось выше, эффект ингибитора LY294002 на усиление продукции белка при обработке клеток, зараженных рекомбинантным репликативно-дефектным аденовирусом, лишь частично обусловлено способностью LY294002 ингибировать активность протеинкиназы mTOR. В то же время, этот эффект также дополнительно обусловлен воздействием LY294002 на другие мишени, однако не из числа известных мишеней LY294002, к которым относятся PI3-киназы, казеин киназа II, протеинкиназа Pim-1 и ДНК-зависимая протеинкиназа (Shepelev MV, Korobko EV, Vinogradova TV, Kopantsev EP, Korobko IV. LY294002 enhances expression of proteins encoded by recombinant replication-defective adenoviruses via mTOR- and non-mTOR-dependent mechanisms. Mol Pharm. 2013; 10(3):931-9). Воздействие на эти неизвестные мишени также обуславливает активность ингибитора LY303511 в части увеличения продукции трансгена, кодируемого рекомбинантным аденовирусом (Shepelev MV, Korobko EV, Vinogradova TV, Kopantsev EP, Korobko IV. LY294002 enhances expression of proteins encoded by recombinant replication-defective adenoviruses via mTOR- and non-mTOR-dependent mechanisms. Mol Pharm. 2013; 10(3):931-9). Учитывая, что LY303511 обладает противоопухолевой активностью, это означает, что увеличение продукции трансгена, кодируемого рекомбинантным аденовирусом, является результатом воздействия на неидентифицированные мишени, существенные для опухолевых клеток.
Таким образом, на основании вышеизложенного можно сделать вывод, что увеличение продукции трансгена, кодируемого рекомбинантным аденовирусом, в частности белка EGFP, происходит в ответ на воздействие на молекулярные мишени для создания противоопухолевых препаратов, в число которых входит протеинкиназа mTOR, а также неизвестные молекулярные мишени, ингибируемые соединениями LY294002 и LY303511.
Анализ опубликованных ранее результатов исследований показал, что способностью увеличивать продукцию трансгена, кодируемого рекомбинантным аденовирусом, обладает и ряд других веществ с противоопухолевой активностью. К их числу относятся ингибиторы топоизомеразы I (этопозид) и топоизомеразы II (топотекан) (Shieh GS, Shiau AL, Yo YT, Lin PR, Chang CC, Tzai TS, Wu CL. Low-dose etoposide enhances telomerase-dependent adenovirus-mediated cytosine deaminase gene therapy through augmentation of adenoviral infection and transgene expression in a syngeneic bladder tumor model. Cancer Res. 2006; 66(20):9957-66; Zamir G, Zeira E, Gelman AE, Shaked A, Olthoff KM, Eid A, Galun E. Replication-deficient adenovirus induces host topoisomerase I activity: implications for adenovirus-mediated gene expression. Mol Ther. 2007; 15(4):772-81), а также вещества из класса ингибиоторов гистон деацетилаз, которые также рассматриваются как перспективная основа для разработки противоопухолевых препаратов (Nguyen TL, Wilson MG, Hiscott J. Oncolytic viruses and histone deacetylase inhibitors - a multi-pronged strategy to target tumor cells. Cytokine Growth Factor Rev. 2010;21(2-3): 153-9). Таким образом, увеличение продукции трансгена, кодируемого рекомбинантным аденовирусом, в частности белка EGFP, также будет происходить в ответ на воздействие на молекулярные мишени для создания противоопухолевых препаратов, в число которых, помимо вышеупомянутых, входят топоизомеразы I и II и гистон деацетилазы.
Раскрытие настоящего изобретения
Настоящее изобретение стало возможным на основании того факта, что ряд химических соединений с описанной противоопухолевой активностью обладает способностью при их воздействии на клетки, зараженные рекомбинантным репликативно-дефектным аденовирусом, усиливать продукцию белка, кодируемого трансгеном, содержащимся в рекомбинантном аденовирусе.
Настоящее изобретение относится к новому способу выявления веществ и их композиций с противоопухолевой активностью, который основан на увеличении продукции белка (далее - репортерный белок), кодируемого трансгеном (далее - репортерный ген) в составе репликативно-дефектного рекомбинантного аденовируса в ответ на воздействие веществ или их композиций на одну или несколько молекулярных мишеней в опухолевых клетках из числа протеинкиназы mTOR, топоизомераз I и II, гистон деацетилаз и неизвестных мишеней, ингибируемых соединениями LY294002 и LY303511.
Конкретно настоящее изобретение относится к способу идентификации веществ и их композиций с противоопухолевой активностью, предусматривающего следующие стадии:
а) рассев клеток;
б) заражение клеток рекомбинантным репликативно-дефектным аденовирусом, кодирующим репортерный белок;
в) инкубацию зараженных клеток для наработки начального уровня репортерного
белка;
г) добавление к клеткам испытуемого вещества или их композицией (опыт) или растворителя испытуемого вещества или их композиции (контроль);
д) инкубацию опытных и контрольных клеток;
е) измерение количества репортерного белка в опытных и контрольных клетках;
ж) определение количества опытных и контрольных клеток;
з) нормирование уровней репортерного белка в опыте и контроле на соответствующее количество клеток;
и) сравнение уровней репортерного белка в опыте и контроле, причем увеличение уровня репортерного белка в опыте по сравнению с контролем означает, что испытуемое вещество или их композиция обладает потенциальной противоопухолевой активностью.
Как следует из формулировки способа, идентификация веществ и их композиций проводится с использованием культивируемых in vitro клеток. Такими клетками могут являться опухолевые клетки различного происхождения. Специалисту в данной области будет очевидно, что из-за гетерогенности молекулярных изменений в различных опухолевых клетках чувствительность к воздействию на конкретную молекулярную мишень может варьировать в клетках различных линий. Поэтому изобретение предусматривает проведение анализа испытуемых веществ на опухолевых клетках различных линий и различного происхождения для исключения возможности получения ложно негативного результата при воздействии испытуемого вещества или их композиции на клетки с низкой чувствительностью к воздействию на такую мишень.
В соответствии с одним из вариантов осуществления настоящего изобретения на стадии а) рассев клеток для испытания веществ или их композиций может осуществляться в лунки многолуночного планшета, что позволяет единовременно проводить испытания многочисленных веществ и их композиций.
В соответствии с одним из вариантов осуществления настоящего изобретения на стадии а) рассева клеток в многолуночный планшет рассев клеток для испытания веществ или их композиций может осуществляться в лунки 96-луночного планшета, обеспечивая высокопроизводительность проводимого анализа.
В соответствии с одним из вариантов осуществления настоящего изобретения на стадии б) клетки заражаются рекомбинантным репликативно-дефектным аденовирусом, кодирующим зеленый флуоресцентный белок EGFP, который выступает в качестве репортерного белка, что позволяет измерять уровень его продукции с помощью флуориметрии.
Из существующего уровня техники известно, что увеличение продукции белка, кодируемого трансгеном, содержащимся в рекомбинантном аденовирусе, в результате воздействия ряда химических соединений с описанной противоопухолевой активностью не является уникальным свойством, присущим EGFP при его использовании в качестве такого белка (Shepelev MV, Korobko EV, Vinogradova TV, Kopantsev EP, Korobko IV. LY294002 enhances expression of proteins encoded by recombinant replication-defective adenoviruses via mTOR- and non-mTOR-dependent mechanisms. Mol Pharm. 2013;10(3):931-9), и при включении в состав рекомбинантного аденовируса кДНК другого белка его продукция также будет увеличиваться в ответ на воздействие ряда химических соединений с описанной противоопухолевой активностью. Этот факт обосновывает возможность использования иных, чем EGFP, белки в качестве репортерных белков при осуществлении настоящего изобретения, проводя мониторинг изменения их количества в результате воздействия веществ на зараженные рекомбинантным аденовирусом клетки. В частности, учитывая существование известных из уровня техники методов определения количества некоторых белков, предпочтительным является использование в качестве репортерных белков, кодируемых применяемыми в молекулярно-биологических исследованиях репортерными генами, включая, но не ограничиваясь, иными флуоресцентными белками, люциферазами, щелочной фосфатазой, Р-галактозидазой.
В соответствии с одним из вариантов осуществления настоящего изобретения на стадии б) клетки заражаются рекомбинантным репликативно-дефектным аденовирусом, в котором уровень экспрессии репортерного гена может контролироваться внешними воздействиями, обеспечивающими изменение активности промотора, под контролем которого находится репортерный ген. В этом варианте возможно подобрать силу воздействия для обеспечения оптимального динамического диапазона уровня продукции репортерного белка, который будет достаточен для уверенной его детекции используемыми инструментальными средствами, и не быть максимально возможным или близким к максимально возможному, обеспечиваемому данными клетками, тем самым делая возможным существенное увеличение его уровня при воздействии испытуемых веществ на одну или несколько молекулярных мишеней.
В соответствии с одним из вариантов осуществления настоящего изобретения на стадии б) клетки заражаются рекомбинантным репликативно-дефектным аденовирусом, в котором уровень экспрессии репортерного гена контролируется отвечающим на терациклин промотором, а сам аденовирус также кодирует зависимый от тетрациклина транскрипционный фактор. В этом варианте базовый уровень продукции репортерного белка в клетках, зараженных рекомбинантным аденовирусом, может контролироваться путем варьирования концентрации добавленного в культуральную среду тетрациклина или доксициклина, стимулирующих активность промотора, под контролем которого находится репортерный ген.
В соответствии с одним из вариантов осуществления настоящего изобретения на стадии е) в качестве репортерного гена используется ген EGFP. В этом варианте измерение количества репортерного белка производится с помощью флуориметрии по количеству испускаемой флуоресценции на длине волны, близкой или совпадающей с 509 нм при облучении клеток светом с длиной волны, близкой или совпадающей с 488 нм. В этом случае измеренный сигнал флуоресценции клеток будет пропорционален количеству белка EGFP в них.
Специалисту в данной области будет понятно, что при использовании иных репортерных белков должен быть применен тот или иной конкретный способ, обеспечивающий измерение его количества.
Стадия ж) подразумевает измерение количества клеток. Специалисту в данной области известно, что существует большое количество способов измерения количества клеток. Количество клеток может быть определено их прямым подсчетом с использованием гемоцитометра или иных специальных приборов-счетчиков клеток, однако данный способ не обеспечивает высокопроизводительности анализа. Количество клеток также может быть определено методами на основании определения содержания в них метаболитов или ферментов, которые совместимы с высокопроизводительным форматом. Однако, как известно, некоторые вещества могут вызывать изменения этих параметров, что будет приводить к неверному определению количества клеток. В то же время количество геномной ДНК остается постоянным в клетке вне зависимости от способа воздействия на нее.
Поэтому в соответствии с одним из вариантов осуществления настоящего изобретения на стадии ж) измерение количества клеток проводится путем измерения количества ДНК.
В соответствии с одним из вариантов осуществления настоящего изобретения на стадии ж) количество ДНК определяется по флуоресценции красителя Hoechst33342, связавшегося с ДНК в клетках, после их инкубации с красителем и удаления его несвязавшегося избытка. Поскольку спектры испускания и возбуждения для Hoechst33342 и EGFP существенно отличаются друг от друга (максимумы возбуждения/испускания 361 нм/486 нм и 488 нм/509 нм, соответственно), это позволяет измерять их флуоресценцию независимо друг от друга в одном образце с использованием соответствующих наборов оптических фильтров для возбуждения и испускания.
Специалисту в данной области будет понятно, что могут быть использованы и иные специальные красители для определения количества ДНК.
В соответствии с одним из вариантов осуществления настоящего изобретения на стадии е) и ж) могут быть объединены при использовании метода проточной цитофлуориметрии, который при использовании в качестве репортерного белка одного из флуоресцентных белков позволяет определять на основании интенсивности сигнала флуоресценции количество репортерного белка в каждой клетке, что исключает необходимость нормирования на количество клеток.
Таким образом, настоящее изобретение позволяет расширить набор способов поиска веществ и их композиций с противоопухолевой активностью, позволяя единовременно проводить анализ по признаку влияния на единственную или несколько молекулярных мишеней, и обеспечивая проведение анализа в гомогенном и высокопроизводительном формате.
Краткое описание фигур
Далее изобретение будет более подробно раскрыто со ссылкой на отдельные иллюстративные фигуры.
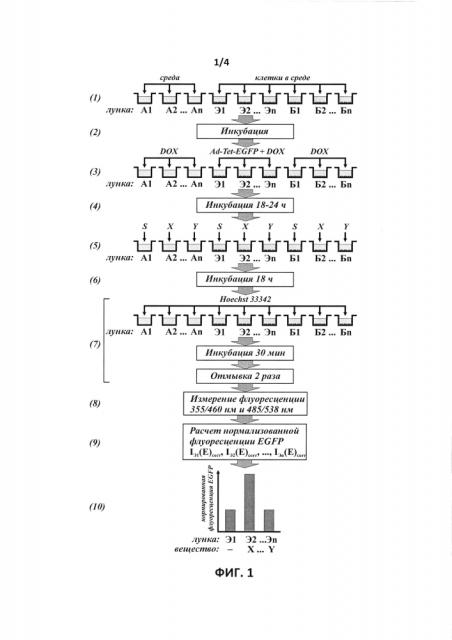
На фиг. 1 показана общая схема скрининга веществ на присутствие противоопухолевой активности.
На фиг. 2 показана зависимость результатов измерения флуоресценции клеток линии NCI-H1299, выращенных в 96-луночном планшете и окрашенных красителем Hoechst33342, от количества зассеянных в лунку клеток. Данные представлены в относительных единицах флуоресценции Hoechst33342 как среднее значение измерений в трех лунках ± стандартное отклонение после коррекции на уровень сигнала от клеток, не окрашенных красителем.
На фиг. 3 показаны результаты определения интенсивности флуоресценции EGFP в клетках линии NCI-H1299, зараженных рекомбинантным аденовирусом Ad-Tet-EGFP, через 20, 40 и 65 часов инкубации в присутствии доксициклина в указанных концентрациях. Данные представлены в относительных единицах флуоресценции EGFP после коррекции на уровень сигнала от клеток, незараженных аденовирусом.
На фиг. 4 показаны результаты определения интенсивности флуоресценции EGFP в клетках линии NCI-H1299, зараженных рекомбинантным аденовирусом Ad-Tet-EGFP, через 18 часов после инкубации в присутствии доксициклина в концентрации 10 нг/мл в присутствии ингибитора LY294002 в концентрации 25 мкМ (LY2), ингибитора протеинкиназы mTOR Compound 401 в концентрации 50 мкМ (401), ингибиторов LY294002 или Compound 401 в тех же концентрациях в сочетании с ингибитором топоизомеразы II этопозидом в концентрации 10 мкМ (LY2+Eto и 401+Eto, соответственно), или растворителя ингибиторов диметилсульфоксида (DMSO). Данные представлены в относительных единицах флуоресценции EGFP как среднее значение измерений в трех лунках±стандартное отклонение после коррекции сигнала EGFP на уровень сигнала от клеток, незараженных аденовирусом, и нормировки на интенсивность флуоресценции клеток после окраски красителем Hoechst33342 с предварительной коррекцией на сигнал флуоресценции в лунках при отсутствии клеток.
Описание конкретных примеров осуществления изобретения
Пример 1. Общее описание проведения процедуры выявления веществ и их композиций с противоопухолевой активностью с использованием рекомбинантного репликативно-дефектного аденовируса для экспрессии EGFP под контролем тетрациклин-индуцируемого промотора
Схема проведения идентификации веществ и их композиций с противоопухолевой активностью с использованием рекомбинантного репликативно-дефектного аденовируса для экспрессии EGFP под контролем тетрациклин-индуцируемого промотора (далее - Ad-Tet-EGFP) представлена на фиг. 1.
При скрининге веществ на противоопухолевую активность, выявляемую по увеличению продукции белка EGFP в клетках, зараженных аденовирусом Ad-Tet-EGFP, дизайн эксперимента предусматривает следующие экспериментальные точки, позволяющие провести корректную нормировку сигнала и сравнить его с базовым уровнем продукции EGFP в отсутствии воздействия веществ:
- лунка А1 - лунка со средой с растворителем испытуемого вещества без клеток. Измеряются фоновые интенсивности флуоресценции в диапазонах флуоресценции красителя Hoechst33342 IA1(H) и EGFP IA1(H). В случае, если испытуемые вещества растворены в различных растворителях, для каждого растворителя предусматривается отдельная лунка, аналогичная А1;
- лунка Б1 - лунка с клетками без заражения аденовирусом, которые инкубировались с растворителем испытуемого вещества. Измеряется интенсивность IБ1(E) для определения фонового значения флуоресценции лунки с клетками в диапазоне флуоресценции EGFP, а также измеряется интенсивность флуоресценции красителя Hoechst33342 IБ1(H) для нормирования интенсивности сигнала в диапазоне флуоресценции EGFP на количество клеток в лунке. В случае, если испытуемые вещества растворены в различных растворителях, для каждого растворителя предусматривается отдельная лунка, аналогичная Б1;
- лунка Э1 - лунка с клетками, зараженными аденовирусом, которые инкубировались с растворителем испытуемого вещества. Измеряется интенсивность IЭ1(E) для определения базового значения флуоресценции EGFP, а также измеряется интенсивность флуоресценции красителя Hoechst33342 IЭ1(H) для нормирования интенсивности сигнала EGFP на количество клеток в лунке. В случае, если испытуемые вещества растворены в различных растворителях, для каждого растворителя предусматривается отдельная лунка, аналогичная Э1;
- лунка An (n>1) - лунки со средой с испытуемыми веществами без клеток. Измеряются фоновые интенсивности флуоресценции в диапазонах флуоресценции красителя Hoechst33342 IAn(H) и EGFP IAn(Н);
- лунки Бn (n>1) - лунки с клетками без заражения аденовирусом, которые инкубировались с испытуемыми веществами. Измеряются интенсивности IБn(Е) для определения фонового значения флуоресценции лунки с клетками в присутствии испытуемого вещества в диапазоне флуоресценции EGFP, а также измеряются интенсивности флуоресценции красителя Hoechst33342 IБn(Н) для нормирования интенсивности сигнала EGFP на количество клеток в лунке;
- лунки Эn (n>1) - лунки с клетками, зараженными аденовирусом, которые инкубировались с испытуемыми веществами. Измеряются интенсивности IЭn(E) для определения значения флуоресценции EGFP при воздействии испытуемого вещества для сравнения с базовым значением флуоресценции EGFP, определенного в лунке Э1, а также измеряются интенсивности флуоресценции красителя Hoechst33342 IЭn(H) для нормирования интенсивности сигнала EGFP на количество клеток в лунке.
На первом этапе ((1) на фиг. 1) проводится рассев клеток в лунки 96-луночного культурального планшета, пригодного для последующего проведения измерения флуоресцентного сигнала (с белыми непрозрачными стенками лунок, например Costar #3610, США) в лунки Б1, Б2, …, Бn и Э1, Э2, …, Эn. Плотность рассева клеток подбирается таким образом, чтобы к моменту измерения флуоресцентных сигналов клетки находились в субконфлюентном состоянии. В лунки A1, А2, …, An добавляется среда без высева клеток для последующего использования для коррекции на фоновую флуоресценцию лунок в диапазонах флуоресценции красителя Hoechst33342 и белка EGFP.
После этого клетки инкубируются несколько часов для их прикрепления к поверхности лунок ((2) на фиг. 1) и затем в лунки Э1, Э2, …, Эn путем замены среды добавляется рекомбинантный репликативно-дефектный аденовирус для экспрессии EGFP под контролем тетрациклин-индуцируемого промотора (Ad-Tet-EGFP) с необходимой множественностью заражения, и индуктор экспрессии трансгена доксициклин (DOX) в подобранной концентрации. В лунки A1, А2, …, An и Б1, Б2 … Бn добавляется среда без аденовируса ((5) на фиг. 1).
Клетки инкубируются в течение 18-24 часов для наработки базального уровня репортерного белка EGFP ((4) на фиг. 1), после чего с заменой среды в лунки добавляется растворитель испытуемых веществ S (лунки А1, Б1 и Э1) и испытуемые вещества (X, Y, …) (соответственно в лунки А2, Б2, Э2; …; An, Бn, Эn) ((5) на фиг. 1).
После инкубации в течение 18 часов ((6) на фиг. 1) культуральная среда удаляется из всех лунок и добавляется фосфатно-солевой буфер, содержащий 10 мкг/мл красителя Hoechst33342. После инкубации в течение 30 мин при 37°С лунки дважды промываются фосфатно-солевым буфером для удаления несвязавшегося с клеточной ДНК красителя ((7) на фиг. 1). После этого измеряется флуоресценция лунок с параметрами длин волн возбуждения/испускания 485 нм / 538 нм для измерения интенсивности сигнала EGFP и 355 нм / 460 нм для измерения интенсивности сигнала красителя Hoechst33342 с использованием планшетного флуориметра (например, Fluoroskan Ascent FL, Thermo Electron Copr., США)) ((5) на фиг. 1).
Расчет интенсивностей нормализованных сигналов флуоресценции EGFP в клетках, зараженных аденовирусом Ad-Tet-EGFP, после инкубации с испытуемыми веществами или их композициями для выявления факта увеличения продукции рекомбинантного белка в результате действия испытуемого вещества или их композиции, проводится следующим образом ((9) на фиг. 1).
Полученные значения интенсивностей флуоресценции красителя Hoechst33342 и EGFP в лунках Б1, …, Бn и Э1, …, Эn корректируются на фоновое значение флуоресценций лунок А1, … An, соответственно
Затем рассчитывается нормированная на количество клеток флуоресценция EGFP в лунках Б1, …, Бn и Э1, …, Эn
После этого для получения истинного значения флуоресценции EGFP в экспериментальных лунках Э1, …, Эn проводится корректировка на фоновое значение флуоресценций лунок с клетками, незараженными аденовирусом:
Истинные значения флуоресценции в опытных лунках Эп IЭn(Е)corr сравниваются со значением флуоресценции в контрольной лунке Э1 IЭ1(Е)corr в отсутствии воздействия испытуемых веществ и в присутствии их растворителя ((10) на фиг. 1). Вещества, вызывающие увеличение нормированного сигнала EGFP по сравнению с сигналом лунки Э1, отбираются как потенциально обладающие противоопухолевой активностью (вещество X на фиг. 1) благодаря воздействию на протеинкиназу mTOR, топоизомеразы I или II, гистон деацетилазы, неизвестные мишени, в частности, ингибируемые соединениями LY294002 и LY303511, или их комбинации, для последующего детального изучения и характеризации.
Пример 2. Валидация метода определения количества клеток по окраске красителем Hoechst33342
Клетки линии NCI-H1299 (немелкоклеточный рак легкого человека) рассевали в лунки 96-луночного плоскодонного планшета с белыми стенками (Costar #3610, США) в количестве 2, 5 и 10 тыс. на лунку в модифицированной среде Дульбекко: среде F12 (1:1) (среда DMEM/F12), содержащей 10% фетальной бычьей сыворотки, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина и инкубировались в ростовой среде. После этого культуральную среду удаляли из лунок и добавляли в каждую лунку по 100 мкл фосфатно-солевого буфера, содержащего 10 мкг/мл красителя Hoechst33342. После 30-минутной инкубации лунки промывали 2 раза 100 мкл фосфатно-солевого буфера, и затем измеряли значение флуоресценции (длины волн возбуждения/испускания 355 нм/460 нм) в лунках с последующей коррекцией на значение флуоресценции в лунке без клеток (измерения выполнялись на планшетном флуориметре Fluoroskan Ascent FL, Thermo Electron Copr., США). Для каждого высеваемого числа клеток эксперимент проводился в 3-кратном повторе. На фиг. 2 представлены результаты измерений. Видно, что присутствует линейная зависимость интенсивности сигнала флуоресценции Hoechst33342 от количества клеток.
Пример 3. Подбор оптимального уровня продукции репортерного белка EGFP
Клетки л