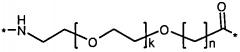Дважды ацилированные производные glp-1
Иллюстрации
Показать всеИзобретение относится к производному аналога GLP-1, где аналог содержит первый остаток К в позиции, соответствующей позиции 27 в GLP-1 (7-37) (SEQ ID №1); второй остаток К в позиции, соответствующей позиции 36 в GLP-1 (7-37), и максимум десять аминокислотных замен по сравнению с GLP-1 (7-37); где первый остаток К обозначается как К27, а второй остаток К обозначается как K36; где производное содержит две альбуминсвязывающие группировки, прикрепленные к К27 и K36, соответственно, через линкер, и альбуминсвязывающая группировка содержит пролонгирующую группировку, выбранную среди НООС-(СН2)x-СО- и НООС-С6Н4-O-(СН2)y-СО-; где x представляет собой целое число в диапазоне 6-16, а y представляет собой целое число в диапазоне 3-17; где линкер содержит элемент формулы -NH-(CH2)2-(O-(CH2)2)k-O-(CH2)n-CO-, где k представляет собой целое число в диапазоне 1-5 и n представляет собой целое число в диапазоне 1-5; или к его фармацевтически приемлемой соли, амиду или сложному эфиру. Производное аналога GLP-1 предназначено для лечения и/или профилактики сахарного диабета и связанных с ним заболеваний. Данные производные подходят для перорального введения. 3 н. и 10 з.п. ф-лы, 4 табл., 40 пр.
Реферат
Ссылка на родственные заявки
Данная заявка заявляет преимущество предварительной патентной заявки США с серийным номером 61/474913, поданной 13 апреля 2011 года под 37 CFR § 1,53 (с), которая включена в данное описание посредством ссылки во всей ее полноте.
Область изобретения
Изобретение относится к производным аналогов глюкагон-подобного пептида 1 (GLP-1), более конкретно к дважды ацилированным производным GLP-1, ацилированным на К27 и на другом остатке К пептида, и к их фармацевтическому применению.
Включение списка последовательностей посредством ссылки
Список последовательностей, озаглавленный как «Список последовательностей», является 568-байтовым, создан 11 апреля 2012 года и включен в данное описание посредством ссылки.
Уровень техники
Journal of Medicinal Chemistry (2000), vol.43, no.9, p.1664-1669, описывает производные GLP-1 (7-37), в том числе дважды ацилированные.
WO 98/08871 А1 описывает ряд производных GLP-1, включая дважды ацилированные. Лираглутид, моноацилированное производное GLP-1 для введения один раз в сутки, который доступен на рынке с 2009 от Novo Nordisk A/S, также описан в WO 98/08871 А1 (пример 37).
WO 99/43706 А1 описывает ряд моно- и дважды ацилированных производных GLP-1, включая некоторые K27,26 и K27,34-производные.
WO 06/097537 А2 описывает ряд производных GLP-1, включая семаглутид (пример 4), моноацилированное производное GLP-1 для введения один раз в неделю, которое находится у Novo Nordisk A/S в стадии разработки.
Angewandte Chemie International Edition 2008, vol.47, p.3196-3201, сообщает об открытии и описывает класс производных 4-(п-иодфенил)бутановой кислоты, которые предположительно демонстрируют стабильное нековалентное связывание и с мышиным сывороточным альбумином (mouse serum albumin, MSA), и с человеческим сывороточным альбумином (human serum albumin, HSA).
Сущность изобретения
Изобретение относится к производным пептидов GLP-1.
Производные подвергают ацилированию на лизине, заменяя нативную глутаминовую кислоту в позиции 27, а также на другом лизиновом остатке. Боковые цепи являются группировками, связывающими альбумин. Они включают пролонгирующую группировку, предпочтительно выбранную среди жирных двухосновных кислот, и жирные кислоты с дистальной феноксигруппой, все возможно замещенные. Карбоксильная группа жирной кислоты или жирной двухосновной кислоты ацилирована, возможно через линкер, на лизиновом остатке в пептида GLP-1, предпочтительно на эпсилон-аминогруппе.
Пептид GLP-1 может быть аналогом GLP-1 (7-37) (SEQ ID №1), имеющим в общей сложности до десяти аминокислотных различий с GLP-1 (7-37), например одно или более чем одно добавление, одну или более чем одну делецию и/или одно или более чем одно замещение.
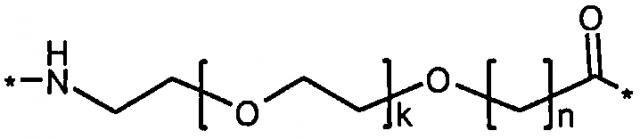
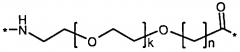
Более конкретно, данное изобретение относится к производному аналога GLP-1, где аналог содержит первый остаток К в позиции, соответствующей позиции 27 в GLP-1 (7-37) (SEQ ID №1), второй остаток К в позиции, соответствующей позиции Т в GLP-1 (7-37), где Т представляет собой целое число в диапазоне 7-37 за исключением 18 и 27; а также до десяти аминокислотных замен в сравнении с GLP-1 (7-37); где первый остаток К обозначается как К27, а второй остаток К обозначается как KT; при этом указанное производное содержит две альбуминсвязывающие группировки, прикрепленные к К27 и KT, соответственно, посредством линкера, причем каждая альбуминсвязывающая группировка содержит пролонгирующую группировку, выбранную среди НООС-(СН2)x-СО-* и НООС-С6Н4-O-(СН2)y-СО-*, где x представляет собой целое число в диапазоне 6-16, а y обозначает целое число в диапазоне 3-17 и где линкер содержит линкерный элемент с формулой Соед. 5:
,
где k представляет собой целое число в диапазоне 1-5 и n представляет собой целое число в диапазоне 1-5; или к его фармацевтически приемлемой соли, амиду или сложному эфиру.
Изобретение также относится к таким производным для применения в качестве лекарственного средства, в частности для применения в лечении и/или профилактике всех форм сахарного диабета и связанных с ним заболеваний, таких как пищевые расстройства, сердечно-сосудистые заболевания, желудочно-кишечные заболевания, осложнения диабета, критические заболевания и/или синдром поликистоза яичников, и/или для улучшения липидных параметров, улучшения функции β-клеток, и/или для отсрочки или предотвращения прогрессирования диабетического заболевания.
Кроме того, изобретение относится к промежуточным продуктам в форме новых аналогов GLP-1, которые подходят для изготовления некоторых производных в соответствии с изобретением.
Производные данного изобретения являются биологически активными. Кроме того, или альтернативно, они имеют пролонгированный фармакокинетический профиль. Кроме того, или альтернативно, они устойчивы к разрушению желудочно-кишечными ферментами. Кроме того, или альтернативно, они имеют высокую биодоступность. Эти свойства имеют большое значение в разработке следующего поколения соединений GLP-1 для подкожного, внутривенного и/или, в частности, перорального введения.
Подробное описание
Далее греческие буквы могут быть представлены их символами или соответствующими письменными названиями, например: α = альфа; β = бета; ε = эпсилон; γ = гамма; ω = омега и т.д. Кроме того, греческая буква µ может быть представлена как «u», например µl=ul, или µМ=uM
Звездочка (*) в химической формуле обозначает i) точку присоединения, ii) радикал и/или iii) неподеленный электрон.
В первом аспекте данное изобретение относится к производным аналога GLP-1, где аналог содержит первый остаток К в позиции, соответствующей позиции 27 в GLP-1 (7-37) (SEQ ID №1); второй остаток К в позиции, соответствующей позиции Т в GLP-1 (7-37), где Т представляет собой целое число в диапазоне 7-37, за исключением 18 и 27; а также до десяти аминокислотных замен по сравнению с GLP-1 (7-37), где первый остаток К обозначается как К27, а второй остаток К обозначается как KT; где производное содержит две альбуминсвязывающие группировки, прикрепленные к К27 и KT, соответственно, через линкер, при этом альбуминсвязывающие группировки содержат пролонгирующие группировки, выбранные среди Соед. 1 и Соед. 2:
Соед. 1: НООС-(СН2)x-СО-*
Соед. 2: НООС-С6Н4-О-(СН2)y-СО-*
где x представляет собой целое число в диапазоне 6-16, y обозначает целое число в диапазоне 3-17, а линкер содержит Соед. 5:
Соед. 5:
где k обозначает целое число в диапазоне 1-5, а n представляет собой целое число в диапазоне 1-5; или к их фармацевтически приемлемой соли, амиду или сложному эфиру.
Аналоги GLP-1
Термин «GLP-1-аналог» или «аналог GLP-1», используемый в данном документе, относится к пептиду, или соединению, представляющему собой вариант человеческого глюкагон-подобного пептида-1 (GLP-1 (7-37)), последовательность которого включена в список последовательностей как SEQ ID №1. Пептид с последовательностью SEQ ID №1 также может быть обозначен как «нативный GLP-1».
В списке последовательностей первому аминокислотному остатку SEQ ID №1 (гистидину) присваивается №1. Тем не менее, в дальнейшем - в соответствии с установившейся практикой в данной области - это остаток гистидина называют №7, и последующие аминокислотные остатки пронумерованы соответственно, заканчивая глицином №37. Поэтому, как правило, в данном документе любая ссылка на номер аминокислотного остатка или номер позиции в последовательности GLP-1 (7-37) является ссылкой на последовательность, начинающуюся с His в позиции 7 и заканчивающуюся Gly в позиции 37.
GLP-1-аналоги производных изобретения могут быть описаны посредством ссылки на i) номер аминокислотного остатка в нативном GLP-1 (7-37), который соответствует аминокислотному остатку, который был заменен (например, соответствующей позиции в нативном GLP-1), и на ii) фактическую замену. Ниже приведены неограничивающие примеры подходящей номенклатуры аналогов.
Неограничивающий пример GLP-1-аналога производного изобретения является аналогом, который изменен таким образом, что содержит первый остаток лизина в позиции, соответствующей позиции 27 GLP-1 (7-37), и второй остаток лизина в позиции 12. Аминокислотная последовательность этого аналога в остальном идентична нативному GLP-1, и этот аналог может быть обозначен как K12,K27-GLP-1 (7-37). Это обозначение представляет аминокислотную последовательность нативного GLP-1, где фенилаланин в позиции 12 был заменен на лизин, и глутамин в позиции 27 был заменен на лизин.
GLP-1-аналог, образующий часть производного в соответствии с изобретением, содержит до десяти аминокислотных замен по сравнению с нативным GLP-1 (7-37) (SEQ ID №1). Другими словами, это пептид GLP-1 (7-37), в котором ряд аминокислотных остатков был изменен по сравнению с нативным GLP-1 (7-37) (SEQ ID №1). Эти изменения могут представлять собой, независимо друг от друга, одно или более чем одно аминокислотное замещение, добавление и/или делецию.
Далее следуют неограничивающие примеры номенклатуры соответствующих аналогов.
Например, аналог [Aib8,Lys22,Val25,Arg26,Lys27,His31,Arg34]-GLP-1-(7-37) обозначает пептид GLP-1 (7-37), который по сравнению с нативным GLP-1 имеет следующие замены: замена аланина в позиции 8 на Aib (α-аминоизомасляную кислоту), глицина в позиции 22 на лизин, аланин в позиции 25 на валин, лизина в позиции 26 на аргинин, глутаминовой кислоты в позиции 27 на лизин, триптофана в позиции 31 на гистидин и лизина в позиции 34 на аргинин. Этот аналог может быть кратко обозначен как (8Aib, 22K, 25V, 26R, 27К, 31Н, 34R).
В качестве другого примера, аналог [Aib8,Lys20,Glu22,Arg26,Lys27,Glu30,Gly34]-GLP-1-(7-34) обозначается как пептид GLP-1 (7-37), который в сравнении с нативным GLP-1 изменена путем замены аланина в позиции 8 на Aib, замены лейцина в позиции 20 на лизин, замены глицина в позиции 22 на глутаминовую кислоту, замены лизина в позиции 26 на аргинин, замены глутаминовой кислоты в позиции 27 на лизин, замены аланина в позиции 30 на глутаминовую кислоту, замены лизина в позиции 34 на глицин, и путем делеции С-конца глицин-аргинин-глицина в позиции 35-36-37. Этот аналог может быть кратко обозначен как (8Aib, 20К, 22Е, 26R, 27К, 30Е, 34G, des35-37), где предполагается ссылка на GLP-1 (7-37), a «des» обозначает делецию.
В качестве еще одного примера, аналог, содержащий Glu38 и Gly39, относится к пептиду GLP-1 (7-37), который при сравнении с нативным GLP-1 содержит добавление дипептида (глутаминовая кислота-глицин) на С-конце GLP-1 (7-37). Можно также кратко сказать, что этот аналог содержит (38Е, 39G), где подразумевается ссылка на GLP-1 (7-37).
Аналоги, «содержащие» определенные указанные изменения, могут содержать дополнительные изменения по сравнению с SEQ ID №1. Одним из неограничивающих примеров аналога, содержащего (38Е, 39G), является пептидная часть Соед. 51.
Как видно из приведенных выше примеров, аминокислотные остатки могут быть идентифицированы по их полному имени, их однобуквенному коду и/или их трехбуквенному коду. Эти три способа полностью эквивалентны.
Выражения «позиция, эквивалентная чему-либо» или «соответствующая позиция» могут быть использованы для описания места введения замены в последовательность вариантного GLP-1 (7-37) со ссылкой на нативный GLP-1 (7-37) (SEQ ID №1). Эквивалентные или соответствующие позиции, а также ряд замен можно легко вывести, например, путем простой рукописной записи и визуального контроля; и/или можно использовать стандартную программу для выравнивания белков или пептидов, такую как «align», которая является выравниванием по Нидлману-Вуншу. Алгоритм описан в Needleman, S.B. and Wunsch, C.D., (1970), Journal of Molecular Biology, 48: 443-453, и программа для выравнивания описана в Myers and W. Miller "Optimal Alignments in Linear Space" CABIOS (computer applications in the biosciences) (1988) 4: 11-17. Для выравнивания могут быть использованы по умолчанию матрица весов выравнивания BLOSUM50 и матрица идентичности, и штраф на первый остаток в делеции может быть установлен на -12, или предпочтительно на -10, а штраф на дополнительные остатки в делеции на -2, или предпочтительно на -0,5.
Пример такого выравнивания приведен ниже, где последовательность №1 (SEQ_ID_NO_1) представляет собой SEQ ID №1, а последовательность №2 (АНАЛОГ) представляет собой ее аналог (22К, 26R, 27К, 30Е, 34G, des35-37).
# Выровненные последовательности: 2
# 1: SEQ_ID_NO_1
# 2: АНАЛОГ
# Матрица: EBLOSUM62
# Штраф на введение делеции: 10,0
# Штраф на удлинение делеции: 0,5
# Длина: 31
# Идентичность: 23/31 (74,2%)
# Сходство: 25/31 (80,6%)
# Делеции: 3/31 (9,7%)
# Оценка: 117,0
В случае неприродных аминокислот, таких как Aib, включенных в последовательность, они с целью выравнивания могут быть заменены на X. При необходимости Х в дальнейшем может быть исправлен вручную.
Термин «пептид», например, используемый в контексте GLP-1-аналогов производных изобретения, относится к соединению, которое содержит ряд аминокислот, связанных с помощью амидных (или пептидных) связей.
Пептиды изобретения содержат по меньшей мере пять конститутивных аминокислот, соединенных пептидными связями. В конкретных воплощениях пептид включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, более предпочтительно по меньшей мере 25, или наиболее предпочтительно по меньшей мере 28 аминокислот.
В конкретном воплощении пептид состоит по меньшей мере из пяти конститутивных аминокислот, предпочтительно состоит по меньшей мере из 10, по меньшей мере из 15, по меньшей мере из 20, по меньшей мере 25, или наиболее предпочтительно состоит по меньшей мере из 28 аминокислот.
В дополнительном конкретном воплощении пептид а) состоит из или б) содержит i) 28, ii) 29, iii) 30, iv) 31, v) 32 или vi) 33 аминокислоты.
В еще одном конкретном воплощении пептид состоит из аминокислот, соединенных пептидными связями.
Аминокислоты представляют собой молекулы, содержащие аминогруппу и карбоксильную группу и, возможно, одну или более чем одну дополнительную группу, которые часто называют боковыми цепями.
Термин «аминокислота» включает протеогенные аминокислоты (кодируемые генетическим кодом, в том числе природные аминокислоты и стандартные аминокислоты), а также непротеогенные (не найденные в белках и/или не закодированные стандартным генетическим кодом) и синтетические аминокислоты. Таким образом, аминокислоты могут быть выбраны из группы протеиногенных аминокислот, непротеиногенных аминокислот и/или синтетических аминокислот.
Неограничивающими примерами аминокислот, которые не кодируются генетическим кодом, являются гамма-карбоксиглутаминовая кислота, орнитин и фосфосерин. Неограничивающими примерами синтетических аминокислот являются D-изомеры аминокислот, такие как D-аланин и D-лейцин, Aib (α-аминоизомасляная кислота), β-аланин и дезаминогистидин (desH, альтернативное название имидазолпропионовой кислоты, сокращенно Imp).
В дальнейшем все аминокислоты, для которых не указан оптический изомер, будут пониматься как L-изомеры (если не указано иное).
GLP-1-производные и аналоги изобретения обладают GLP-1-активностью. Этот термин относится к способности связываться с GLP-1-рецептором и инициировать путь передачи сигнала, приводящий к инсулинотропному действию или другим физиологическим эффектам, известным в данной области. Например, аналоги и производные изобретения могут быть проверены на GLP-1-активность путем анализа, описанного в примере 33 данного документа. Анализ рецепторного связывания GLP-1, описанный в примере 34, также может быть использован для определения активности GLP-1 (эксперимент с низким HSA).
GLP-1-производные
Термин «производное», используемый в данном документе в связи с GLP-1-пептидом или аналогом, означает химически модифицированный GLP-1-пептид или аналог, в котором один или более чем один заместитель был ковалентно присоединен к пептиду. Заместители могут быть отнесены к боковой цепи.
В конкретном воплощении боковая цепь способна образовывать нековалентные агрегаты с альбумином, что способствует циркуляции производных с током крови, а также обеспечивает эффект увеличения времени действия производного в связи с тем фактом, что агрегат GLP-1-производного и альбумина медленно распадается, высвобождая активный фармацевтический ингредиент. Таким образом, заместитель, или боковая цепь, в целом предпочтительно относится к альбуминсвязывающей группировке.
В другом конкретном воплощении альбуминсвязывающая группировка содержит часть, которая особенно подходит для связывания альбумина и, следовательно, для пролонгирования, и может быть названа пролонгирующей группировкой. Пролонгирующая группировка может находиться на противоположном конце альбуминсвязывающей группировки по отношению к точке его прикрепления к пептиду или вблизи этого конца.
В еще одном конкретном воплощении альбуминсвязывающая группировка включает часть между пролонгирующей группировкой и точкой прикрепления к пептиду, которая может быть названа линкером, линкерной группировкой, спейсером и т.д. Линкер может быть необязательным, и, следовательно, в этом случае альбуминсвязывающая группировка может быть идентична пролонгирующей группировке.
В конкретных воплощениях альбуминсвязывающая группировка и/или пролонгирующая группировка является липофильной и/или отрицательно заряженной при физиологическом значении рН (7,4).
Альбуминсвязывающая группировка, пролонгирующая группировка или линкер могут быть ковалентно присоединены к остатку лизина пептида GLP-1 путем ацилирования.
В предпочтительном воплощении активный эфир альбуминсвязывающей группировки, предпочтительно включающий пролонгирующую группировку и линкер, ковалентно связан с аминогруппой остатка лизина, предпочтительно с его эпсилон-аминогруппой, с образованием амидной связи (это процесс называется ацилированием).
Если не указано иное, то когда дается ссылка на ацилирование остатка лизина, следует понимать, что оно происходит на эпсилон-аминогруппе.
Производное, содержащее две пролонгирующие группировки, присоединенные к первому и второму остаткам К (т.е. к К27 и KT) через линкер, может быть названо производным, ацилированным дважды, дважды ацилированным или производным с двойным ацилированием на эпсилон-аминогруппах первого и второго остатков лизина, например в позициях, соответствующих позициям 27 и Т, соответственно, пептида GLP-1.
Для данных целей термины «альбуминсвязывающая группировка», «пролонгирующая группировка» и «линкер» могут включать непрореагировавшие, а также прореагировавшие формы этих молекул. Либо имеется в виду ни одна из этих форм или другая форма, что становится ясно из контекста, в котором этот термин используется.
В одном аспекте каждая пролонгирующая группировка включает или состоит из пролонгирующей группировки, независимо выбранной среди Соед. 1 и Соед. 2:
Соед. 1: НООС-(СН2)x-СО-*
Соед. 2: НООС-С6Н4-O-(СН2)y-СО-*
где x является целым числом в диапазоне 6-16, а y является целым числом в диапазоне 3-17.
В одном воплощении *-(СН2)x-* относится к прямому или разветвленному, предпочтительно прямому, алкилену, где x является целым числом в диапазоне 6-16.
В другом воплощении *-(CH2)y-* относится к прямому или разветвленному, предпочтительно прямому, алкилену, где y является целым числом в диапазоне 3-17.
Термин «жирная кислота» относится к алифатическим одноосновным кислотам, имеющим от 4 до 28 атомов углерода, предпочтительно неразветвленным, и/или имеющим четное число атомов, которые могут быть насыщенными или ненасыщенными.
Термин «двухосновная жирная кислота» относится к жирным кислотам, описанным выше, но с дополнительной карбоксильной группой в позиции омега. Таким образом, двухосновные жирные кислоты являются дикарбоновыми кислотами.
Номенклатура является такой, которая обычно используется в данной области, например, в приведенных выше формулах *-СООН, а также НООС-* относится карбокси; *-С6Н4-* к фенилену; *-СО-*, а также *-ОС-* к карбонилу (O=С<**); С6Н5-O-* к фенокси. В конкретных воплощениях ароматические структуры, такие как фенокси- и фенилен-радикалы, могут находиться, независимо друг от друга, в орто-, мета- или пара-положении.
Как указывалось выше, GLP-1-производные данного изобретения являются дважды ацилированными, т.е. две альбуминсвязывающие группировки ковалентно прикреплены к GLP-1-пептиду.
В конкретном воплощении две альбуминсвязывающие группировки (т.е. целые боковые цепи) являются подобными, предпочтительно в значительной степени идентичными или, наиболее предпочтительно, идентичными.
В другом конкретном воплощении две пролонгирующие группировки являются подобными, предпочтительно в значительной степени идентичными или, наиболее предпочтительно, идентичными.
В еще одном конкретном воплощении два линкера являются подобными, предпочтительно в значительной степени идентичными или, наиболее предпочтительно, идентичными.
Термин «в значительной степени идентичны» включает отличия в идентичности, которые связаны с формированием одной или более чем одной соли, сложного эфира и/или амида; предпочтительно с формированием одной или более чем одной соли, метилового эфира и простого амида; более предпочтительно с формированием не более двух солей, метиловых эфиров и/или простых амидов; еще более предпочтительно с формированием не более одной соли, метилового эфира и/или простого амида; или наиболее предпочтительно с формированием не более чем одной соли.
В контексте химических соединений, таких как альбуминсвязывающие группировки, пролонгирующие группировки и линкеры, сходство и/или идентичность можно определить с помощью любой подходящей компьютерной программы и/или алгоритма, известного в данной области.
Например, сходство двух пролонгирующих группировок, двух линкеров и/или двух целых боковых цепей может соответственно быть определено с помощью методики «молекулярных отпечатков пальцев». Методика молекулярных отпечатков представляет собой математический способ представления химической структуры (см., например Cheminformatics: A textbook, Johann Gasteiger and Thomas Engel (Eds), Wiley-VCH Verlag, 2003).
Примеры подходящих отпечатков включают, но не ограничиваясь ими, отпечатки UNITY, отпечатки MDL и/или отпечатки ECFP, такие как отпечатки ECFP_6 (ECFP означает методику отпечатков с расширенной способностью к взаимодействию).
В конкретном воплощении две пролонгирующие группировки, два линкера и/или две целые боковые цепи представлены в виде а) отпечатков ECFP_6, b) отпечатков UNITY; и/или с) отпечатков MDL.
Для вычисления сходства двух отпечатков, будь то а), b) или с), предпочтительно используют коэффициент Танимото.
В конкретном воплощении, используется ли а), b) или с), две пролонгирующие группировки, два линкера и/или две целые боковые цепи, соответственно, имеют сходство по меньшей мере 0,5 (50%); предпочтительно по меньшей мере 0,6 (60%); более предпочтительно по меньшей мере 0,7 (70%) или по меньшей мере 0,8 (80%); еще более предпочтительно по меньшей мере 0,9 (90%); или наиболее предпочтительно по меньшей мере 0,99 (99%), например, сходство 1,0 (100%).
Отпечатки UNITY могут быть рассчитаны с помощью программы SYBYL (доступна от Tripos, 1699 South Hanley Road, St. Louis, МО 63144-2319 USA). Отпечатки ECFP_6 и MDL могут быть рассчитаны с использованием программы Pipeline Pilot (доступной от Accelrys Inc., 10188 Telesis Court, Suite 100, San Diego, CA 92121, USA).
Для получения дополнительной информации, см., например, J. Chem. Inf. Model. 2008, 48, 542-549; J. Chem. Inf. Comput. Sci. 2004, 44, 170-178; J. Med. Chem. 2004, 47, 2743-2749; J. Chem. Inf. Model. 2010, 50, 742-754, а также SciTegic Pipeline Pilot Chemistry Collection: Basic Chemistry User Guide, March 2008, SciTegic Pipeline Pilot Data Modeling Collection, 2008 - оба от Accelrys Software Inc., San Diego, US, и руководства http://www.tripos.com/tripos_resources/fileroot/pdfs/Unity_111408.pdf и http://www.tripos.com/data/SYBYL/SYBYL_072505.pdf.
Пример подсчета сходства приведен ниже, где целая боковая цепь Соед. 66 была сравнена с ее метиловым эфиром, а именно монометилэфиром глутаминовой линкерной группировки (Соед. 66а):
Соед. 66а:
С использованием а) отпечатков ECFP_6 сходство составляло 0,798, с использованием б) отпечатков UNITY сходство составляло 0,957, и с использованием отпечатков MDL сходство составляло 0,905.
В случае двух одинаковых боковых цепей (альбуминсвязывающих группировок) производные могут быть обозначены симметрично.
В конкретных воплощениях коэффициент сходства составлял по меньшей мере 0,80, предпочтительно по меньшей мере 0,85, более предпочтительно по меньшей мере 0,90, более предпочтительно по меньшей мере 0,95 или, наиболее предпочтительно, по меньшей мере 0,99.
Каждый из двух линкеров производного изобретения может включать следующий первый линкерный элемент:
Соед. 5:
где k является целым числом в диапазоне 1-5 и n является целым числом в диапазоне 1-5.
В конкретном воплощении, когда k=1 и n=1, этот линкерный элемент может быть обозначен как OEG, или двойной радикал 8-амино-3,6-диоксаоктановой кислоты, и/или он может быть представлен следующей формулой:
Соед. 5а:
*-NH-(СН2)2-O-(СН2)2-O-СН2-СО-*.
В другом конкретном воплощении каждый линкер производного изобретения может независимо включать второй линкерный элемент, предпочтительно двойной радикал Glu, такой как Соед. 6 и/или Соед. 7:
Соед. 6:
Соед. 7:
,
где двойной радикал Glu может быть включен p раз, где p является целым числом в диапазоне 1-2.
Соед. 6 может также относиться к гамма-Glu, или, сокращенно, gGlu, в связи с тем, что это гамма-карбоксильная группа аминокислоты глутаминовой кислоты, которая может использоваться здесь для соединения с другим линкерным элементом, или может относиться к эпсилон-аминогруппе лизина. Как объяснялось выше, другой линкерный элемент может, например, быть другим остатком Glu, или OEG-молекулой. Аминогруппа Glu, в свою очередь, может формировать амидную связь с карбоксильной группой пролонгирующей группировки, или с карбоксильной группой, например, OEG-молекулы, если она присутствует, или с гамма-карбоксильной группой, например, другого Glu, если он присутствует.
Соед. 7 может также относиться к альфа-Glu, или, сокращенно, aGlu, или просто Glu, в связи с тем, что это альфа-карбоксильная группа аминокислоты глутаминовой кислоты, которая может использоваться здесь для связывания с другим линкерным элементом или эпсилон-аминогруппой лизина.
Приведенные выше структуры Соед. 6 и Соед. 7 покрывают L-форму, а также D-форму Glu.
Производные изобретения могут существовать в различных стереоизомерных формах с одной и той же молекулярной формулой и последовательностью связанных атомов, но отличающихся только в трехмерной ориентации их атомов в пространстве. Стереоизомерия типичных производных изобретения указана в экспериментальной части, в названиях, а также в структурах с помощью стандартной номенклатуры. Если не указано иное, изобретение относится ко всем стереоизомерным формам заявленного производного.
Концентрация в плазме производных GLP-1 изобретения может быть установлена с помощью любого подходящего способа. Например, может быть использована LC-MS (жидкостная хроматография/масс-спектрометрия) или иммунологические анализы, такие как RIA (радиоиммуноанализ), ELISA (иммуноферментный сорбционный анализ) и LOCI (иммунологический анализ люминесценции кислородных каналов). Общие протоколы подходящих анализов RIA и ELISA можно найти, например, в WO 09/030738 на стр.116-118. Предпочтительным анализом является анализ LOCI, описанный в примерах 35, 39 и 40 данного документа.
Фармацевтически приемлемая соль, амид или эфир
Производные и промежуточные продукты изобретения могут находиться в форме фармацевтически приемлемой соли, амида или эфира.
Соли, например, образуются в результате химической реакции между основанием и кислотой, например: 2NH3+H2SO4→(NH4)2SO4.
Соль может быть основной солью, кислой солью, либо она может быть ни той, ни другой (т.е. нейтральной солью). Основные соли дают гидроксид-ионы в воде, а кислые соли дают ионы гидроксония.
Соли производных изобретения могут быть образованы с добавленными катионами или анионами, которые реагируют с анионными или катионными группами, соответственно. Эти группы могут быть расположены в пептидной группировке и/или в боковой цепи производных изобретения.
Неограничивающие примеры анионных групп производных изобретения включают свободные карбоксильные группы в боковой цепи, если таковые имеются, а также в пептидной группировке. Пептидная группировка часто включает свободную карбоксильную группу на С-конце, и также она может включать свободные карбоксильные группы на внутренних аминокислотных остатках, таких как Asp и Glu.
Неограничивающие примеры катионных групп в пептидной группировке включают свободную аминогруппу на N-конце, если она присутствует, а также любую свободную аминогруппу внутренних основных аминокислотных остатков, таких как His, Arg и Lys.
Эфир производных изобретения может быть сформирован, например, в результате реакции свободной карбоксильной группы со спиртом или фенолом, что приводит к замене по меньшей мере одной гидроксильной группы на алкокси- или арилокси-группу.
В образование эфира может быть вовлечена свободная карбоксильная группа на С-конце пептида и/или любая свободная карбоксильная группа в боковой цепи.
Амид производных изобретения может быть сформирован, например, в результате реакции свободной карбоксильной группы с амином или замещенным амином, или в результате реакции свободной или замещенной аминогруппы с карбоновой кислотой.
В образование амида может быть вовлечена свободная карбоксильная группа на С-конце пептида и/или любая свободная карбоксильная группа в боковой цепи, свободная аминогруппа на N-конце пептида и/или свободная или замещенная аминогруппа пептида в пептиде и/или боковой цепи.
В конкретном воплощении пептид или производное находится в форме фармацевтически приемлемой соли. В другом конкретном воплощении производное находится в форме фармацевтически приемлемого амида, предпочтительно с амидной группой на С-конце пептида. В еще одном конкретном воплощении пептид или производное находится в форме фармацевтически приемлемого эфира.
Промежуточные продукты
Во втором аспекте изобретение относится к промежуточным продуктам.
Один тип промежуточного продукта изобретения имеет форму GLP-1-аналога, который включает следующие модификации по сравнению с GLP-1 (7-37) (SEQ ID №1): (i) 38Q; и/или (ii) 39G; или его фармацевтически приемлемой соли, амида или сложного эфира.
Другой промежуточный продукт изобретения в форме аналога GLP-1 представляет собой аналог, включающий, предпочтительно имеющий, следующие аминокислотные замены по сравнению с GLP-1 (7-37) (SEQ ID №1): (i) 22E, 26R, 27К, 34R, 37К; (ii) 22E, 26R, 27K, 30Е, 34R, 36K, 38E, 39G; (iii) 22E, 26R, 27K, 34R, 36K, des37; (iv) 22E, 25V, 26R, 27K, 34R, 37К; (v) 8Aib, 20K, 22E, 26R, 27K, 30Е, 34G, des35-37; (vi) 26R, 27K, 30Е, 34R, 36K, 38E; (vii) 8Aib, 22K, 25V, 26R, 27K, 31H, 34R; (iix) 8Aib, 22K, 25V, 26R, 27K, 34R, des35-37; (ix) 8Aib, 22K, 25V, 26R, 27K, 34R, des36-37; (x) 26H, 27K, 30Е, 34R, 36K, 38E; (xi) 22K, 25V, 26R, 27K, 30Е, 34Q; (xii) 25V, 26R, 27K, 30Е, 34R, 36K, 38Q; (xiii) 25V, 26R, 27K, 30Е, 34Q, 36K, 38E; (xiv) 22K, 26R, 27K, 31H, 34G, des35-37; (xv) 8Aib, 25V, 26R, 27K, 31H, 34Q, 37К; (xvi) 25V, 26R, 27К, 31H, 34Q, 37К; (xvii) 22E, 23E, 25V, 26R, 27K, 31H, 34Q, 37К; (iixx) 8Aib, 12K, 22E, 26R, 27K, 31H, 34Q; (ixx) 8Aib, 22K, 26R, 27K, 31H, 34G, des35-37; (xx) 22E, 26H, 27K, 30Е, 34R, 36K, 38E; (xxi) 22E, 24K, 26R, 27K, 31H, 34G, des35-37; (xxii) 25V, 26R, 27K, 34Q, 36K; (xxiii) 22E, 24K, 25V, 26R, 27K, 31H, 34R; (xxiv) 22E, 24K, 25V, 26R, 27K, 34G, des35-37; (xxv) 22E, 24K, 25V, 26R, 27K, 34R; (xxvi) 8Aib, 22E, 24K, 25V, 26R, 27K, 31H, 34Q; или (xxvii) 8Aib, 22E, 26R, 27K, 30Е, 34R, 36K, 38E, 39G; или его фармацевтически приемлемую соль, амид или сложный эфир.
Функциональные свойства
В первом функциональном аспекте производные изобретения обладают высокой активностью. Кроме того, или альтернативно, во втором функциональном аспекте они обладают длительным фармакокинетическим профилем. Кроме того, или альтернативно, в третьем функциональном аспекте они обладают высокой пероральной биодоступностью. Кроме того, или альтернативно, в четвертом функциональном аспекте их биофизические свойства улучшены.
Биологическая активность (сила)
В соответствии с первым функциональным аспектом производные изобретения, а также конститутивные GLP-1-пептиды как таковые, обладают биологической активностью, или силой.
В конкретном воплощении сила и/или активность относится к активности in vitro, т.е. к производительности в функциональном GLP-1-рецепторном анализе, более конкретно к возможности стимулировать образование цАМФ в клеточной линии, экспрессирующей клонированный человеческий GLP-1-рецептор.
Стимуляция образования цАМФ в среде, содержащей человеческий GLP-1-рецептор, предпочтительно может быть определена с помощью стабильно трансфицированной клеточной линии, такой как ВНК467-12А (tk-ts13), и/или путем определения цАМФ в функциональном рецепторном анализе, например, на основании конкуренции между эндогенно образованным цАМФ и экзогенно добавленным биотин-меченым цАМФ, где цАМФ более предпочтительно захватывают с помощью специфического антитела, и/или где еще более предпочтительным является анализ AlphaScreen cAMP Assay, наиболее предпочтительно описанный в Примере 33.
Термин «половина максимальной эффективной концентрации» (EC50) обычно относится к концентрации, которая вызывает реакцию, находящуюся посередине между базальной и максимальной, со ссылкой на кривую «доза-реакция». ЕС50 используется как мера активности соединения и представляет собой концентрацию, при которой наблюдается 50% максимального эффекта.
Можно установить, как описано выше, активность производных изобретения in vitro, и определить ЕС50 рассматриваемого производного. Чем ниже ЕС50, тем выше активность.
Подходящая среда имеет следующий состав (концентрации при окончательном анализе): 50 мМ Трис-HCl, 5 мМ HEPES, 10 мМ MgCl2, 6H2O; 150 мМ NaCl, 0,01% Tween; 0,1% BSA, 0,5 мМ IBMX, 1 мМ АТР, 1 мкМ GTP, рН 7,4.
ЕС50 производных изобретения находится на уровне 3500 пМ или ниже, предпочтительно ниже 3200 пМ. ЕС50 может быть ниже 1200 пМ, предпочтительно ниже 1000 пМ, еще более предпочтительно ниже 500 пМ или, наиболее предпочтительно, ниже 200 пМ
В другом конкретном воплощении первого функционального аспекта сила и/или активность относится к способности связываться с рецептором GLP-1 в присутствии низкой концентрации альбумина. Связывание с рецептором GLP-1 в присутствии низкой концентрации альбумина должно быть настолько высоким, насколько это возможно, соответствуя низкому значению IC50. Оно может быть определено, как описано в примере 35. IC50 (при низком альбумине) производных изобретения составляет 500 нМ или ниже, у многих ниже 100 нМ или даже 10 нМ.
В другом конкретном воплощении производные изобретения являются активными in vivo, что можно определить, как известно в данной области, на любой подходящей животной модели, а также в клинических испытаниях.
Диабетическая db/db-мышь является одним из примеров подходящей животной модели, и на таких мышах можно определить in vivo также эффект снижения уровня глюкозы в крови, например, как описано в примере 36, или как описано в примере 43 WO 09/030738.
Кроме того, или альтернативно, влияние на потребление пищи in vivo можно определить в фармакодинамических исследованиях на свиньях, например, как описано в примере 38.
Пролонгирование - рецепторное связывание/низкий и высокий альбумин
В соответствии со вторым функциональным аспектом производные изобретения являются пролонгированными.
GLP-1-рецепторное связывание
В одном конкретном воплощении пролонгирование относится к способности производных изобретения связываться с GLP-1-рецептором при низкой и высокой концентрации альбумина, соответственно, которая может быть определена, как описано в примере 34.
Как правило, связывание с GLP-1-рецептором при низкой концентрации альбумина должно быть настолько высоким, насколько это возможно, соответствуя низким значениям IC50. В одном воплощении низкий уровень альбумина относится к 0,005% HSA. В другом воплощении низкий уровень альбумина относится к 0,001% HSA.
Значение IC50 при высокой концентрации альбумина является мерой влияния альбумина на связывание производного с GLP-1-рецептором. Как известно, производные GLP-1 также связываются с альбумином. Это, как правило, желательный эффект, который увеличивает их время жизни в плазме крови. Таким образом, значение IC50 при высоком альбумине, как правило, будет выше, чем значение IC50 при низком альбумине, соответствуя сниженному связыванию с GLP-1-рецептором, вызва