Нанонити альфа-формы фталоцианина цинка, обладающие повышенными растворимостью в воде и диспергируемостью в воде, композит альфа-формы нанонитей фталоцианина цинка/фенотиазина и способ их получения
Иллюстрации
Показать всеНастоящее изобретение относится к нанонитям альфа-формы фталоцианина цинка (ZnPc HH), обладающим повышенными растворимостью в воде и диспергируемостью в воде, к композиту нанонити альфа-формы фталоцианина цинка/фенотиазина, к способу их получения и к содержащему их фотосенсибилизатору или к содержащей их фармацевтической композиции для предупреждения или лечения раковых заболеваний. Полученные предложенным способом нанонити альфа-формы фталоцианина цинка обладают растворимостью в воде и диспергируемостью в воде от 100 до 140 мг/л при комнатной температуре. Предложенные нанонити или композит, проявляющие фототермические и фотодинамические свойства в одной молекуле, весьма полезны для развития многофункциональной молекулярной системы, а также могут быть успешно применены в фототерапии раковых заболеваний благодаря их благоприятным фототерапевтическим эффектам. Кроме того, композит нанонити альфа-формы фталоцианина цинка/фенотиазина может обладать флуоресценцией, что способствует введению в систему визуализации изображения, в результате чего диагностика и лечение могут быть проведены одновременно с помощью одного вещества. 6 н. и 5 з.п. ф-лы, 6 пр., 33 ил.
Реферат
Область техники
Настоящее изобретение относится к нанонитям альфα-формы фталоцианина цинка (ZnPc-HH), обладающим повышенными растворимостью в воде и диспергируемостью в воде, композиту нанонити альфα-формы фталоцианина цинка/фенотиазина, способу их получения, фотосенсибилизатору, их содержащему, или фармацевтической композиции, их содержащей, для предупреждения или лечения рака.
Уровень техники
Фотодинамическая терапия (ФДТ) является современным методом лечения злокачественных опухолей, поскольку ее широко используют для клинического лечения рака. При фотодинамической терапии происходит избирательное уничтожение опухолевых поражений с помощью цитотоксических активных форм кислорода (АФК), генерируемых за счет активации фотосенсибилизатора светом. Одними из важнейших факторов, определяющих эффективность фотодинамической терапии, являются фотохимические и фотофизические свойства фотосенсибилизатора.
Фотосенсибилизаторы подразделяют на следующие четыре основных класса: производные порфирина, хлора, порфиценов и фталоцианинов (Рс). Среди указанных соединений значительный интерес привлек металлофталоцианин (МРс), обладающий фотодинамическим (ФД) свойством, которое можно легко изменять за счет природы центрального иона металла и функциональных групп, введенных в качестве заместителя во фталоцианиновое (Рс) кольцо. Фталоцианин цинка (ZnPc), как известно, обладает высоким фотодинамическим эффектом, так как он содержит диамагнитный центральный ион металла Zn (II), d-оболочка которого полностью занята, в результате чего выход триплетного возбужденного состояния с длительным периодом жизни, необходимым для генерации АФК, становится высоким. Кроме того, фталоцианин цинка имеет большое сечение поглощения света в спектральном диапазоне проникающего в ткань излучения от 650 до 900 нм.
Основная проблема при применении большинства фотосенсибилизаторов, в том числе ZnPc, для фотодинамической терапии, заключается в низком уровне физиологического принятия из-за их высоких гидрофобных характеристик, ответственных за плохую растворимость в биологической жидкости. Чтобы преодолеть эту проблему, для увеличения растворимости в воде были разработаны производные ZnPc, такие как тетрасульфонированный ZnPc (ZnPcS4), [1,2,3,4-тетракис (α/β-D-галактопираноз-6-ил)-фталоцианинато] цинк, тетра- и окта-триэтиленоксисульфонил замещенный ZnPc. Кроме того, также были разработаны различные средства доставки, включая липосому, эмульсию и наночастицы, для транспортировки не растворимых в воде фотосенсибилизаторов к мишеням.
Однако эти подходы требуют многочисленных и сложных стадий химической функционализации, во время которых может наблюдаться уменьшение фотоактивности из-за разрушения исходной электронной системы сопряжения фотосенсибилизатора. Другая трудность состоит в реализации фотосенсибилизатора, который одновременно обладает фотодинамическим и фототермическим эффектами, что позволяет проводить двойную синергичную фототерапию, и что редко наблюдается для отдельного фотосенсибилизатора.
Кроме того, в фотодинамической терапии для точного определения местоположения фотосенсибилизатора в организме и концентрации фотосенсибилизатора, накопленного в клетках-мишенях используют систему флуоресцентной визуализации изображения, и таким образом обеспечивается возможность проведения прицельного лечения в отношении раковых клеток в локальной области. Среди различных фотосенсибилизаторов нанонити фталоцианина цинка могут поглощать свет при больших длинах волн и генерировать гораздо более активные формы кислорода за счет присутствия атомов цинка, но их введение в систему флуоресцентной визуализации изображения затруднено из-за отсутствия флуоресценции.
Таким образом, существует необходимость в разработке композита, в который вводят материал, способный флуоресцировать, чтобы преодолеть эти недостатки.
Описание изобретения
Техническая задача
Соответственно, авторами настоящего изобретения было обнаружено, что когда из порошка ZnPc выращивают одномерные нанонити (НН), растворимость в воде и диспергируемость в воде значительно возрастают даже без введения каких-либо специальных функциональных групп; также, было обнаружено, что при облучении лазером в ближней инфракрасной области (λ=808 нм) нанонити α-формы ZnPc проявляют как фотодинамический, так и фототермический эффекты, которые, как известно, не наблюдаются для порошка ZnPc, а также было обнаружено, что при получении композита путем введения в эти нанонити α-формы ZnPc молекул фенотиазина, которые способны флуоресцировать, сам композит способен флуоресцировать, и, таким образом, может быть легко введен в систему визуализации изображения, что, тем самым, завершает настоящее изобретение.
Соответственно, задача настоящего изобретения заключается в обеспечении нанонитей α-формы фталоцианина цинка (ZnPc-HH), обладающих повышенными растворимостью в воде и диспергируемостью в воде, композиту нанонити α-формы фталоцианина цинка/фенотиазина и способа их получения.
Кроме того, задача настоящего изобретения заключается в обеспечении фотосенсибилизатора, содержащего нанонити α-формы фталоцианина цинка (ZnPc-HH), или композит нанонити α-формы фталоцианина цинка/фенотиазина.
Кроме того, задача настоящего изобретения заключается в обеспечении фармацевтической композиции для предупреждения или лечения раковых заболеваний, содержащей нанонити α-формы фталоцианина цинка (ZnPc-HH), или композит нанонити α-формы фталоцианина цинка/фенотиазина в качестве активного ингредиента.
Техническое решение
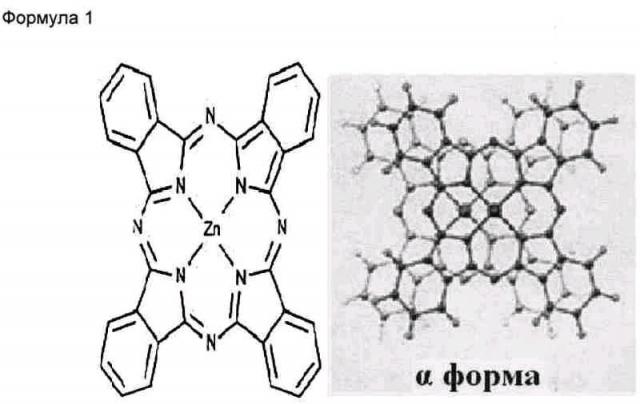
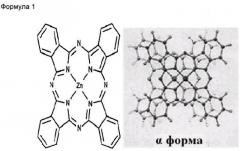
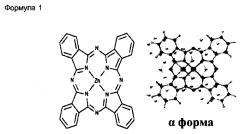
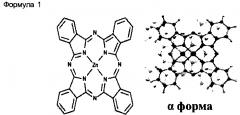
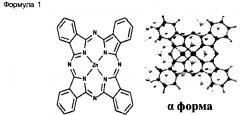
Настоящее изобретение относится к нанонитям α-формы фталоцианина цинка, обладающим повышенными растворимостью в воде и диспергируемостью в воде, представленным следующей Формулой 1:
Нанонити α-формы фталоцианина цинка в соответствии с настоящим изобретением получают путем испарения-конденсации-перекристаллизации (ИКП). В частности, нанонити α-формы фталоцианина цинка могут быть получены в результате конденсации и перекристаллизации паров, испаренных путем нагревания сырого фталоцианина цинка (например, в виде порошка) при 500°С или выше, предпочтительно при 550°С или выше, например, при 500°С-1000°С, предпочтительно при 550°С-800°С, более предпочтительно при 550°С-650°С, на подложке, находящейся при более низкой температуре, чем температура нагрева, например, при 300°С или ниже, предпочтительно при 200°С или ниже, более предпочтительно при 180°С или ниже, например, при температуре от комнатной до 300°С, от комнатной до 200°С, или от комнатной до 180°С, в результате чего фталоцианин цинка выращивают в форме нанонитей на указанной подложке. Полученные таким образом нанонити α-формы фталоцианина цинка могут иметь диаметр приблизительно от 50 до 100 нм и длину приблизительно от 1 до 10 мкм.
Кроме того, в отличие от существующего порошка фталоцианина цинка нанонити α-формы фталоцианина цинка имеют превосходную растворимость и диспергируемость в воде и, следовательно, обладают значительно большей стабильностью в водном растворе (т.е. стабильность сохраняется в водном растворе в течение более 3 месяцев). Растворимость нанонитей α-формы фталоцианина цинка в воде может быть дополнительно улучшена путем перемешивания, такого как обработка ультразвуком. Соответственно, растворимость и диспергируемость в воде полученных таким образом нанонитей α-формы фталоцианина цинка может составлять до 140 мг/л при комнатной температуре.
Кроме того, настоящее изобретение относится к композиту нанонити α-формы фталоцианина цинка, представленной вышеприведенной Формулой 1, и фенотиазина.
Композит нанонити α-формы фталоцианина цинка/фенотиазина, в который вводят способные флуоресцировать молекулы фенотиазина, способен флуоресцировать, что облегчает введение его в систему визуализации изображения, в результате чего возможно проведение диагностики и лечения одновременно с помощью одного вещества.
Кроме того, настоящее изобретение относится к способу получения нанонитей α-формы фталоцианина цинка, включающему стадии:
(а) образования пара фталоцианина цинка (ZnPc) путем испарения фталоцианина цинка в результате нагревания при температуре от 500 до 1000°С в атмосфере инертного газа; и
(b) получения нанонитей α-формы фталоцианина цинка, представленных вышеприведенной Формулой 1, путем конденсации и перекристаллизации пара фталоцианина цинка, полученного на стадии (а), при температуре от комнатной до 300°С в атмосфере инертного газа.
Кроме того, настоящее изобретение относится к способу получения композита нанонити α-формы фталоцианина цинка/фенотиазина, включающему стадии:
(а′) образования паров фталоцианина цинка (ZnPc) и фенотиазина путем испарения фталоцианина цинка и фенотиазина в результате нагревания при температуре от 500 до 1000°С в атмосфере инертного газа; и
(b′) получения композита из нанонити α-формы фталоцианина цинка, представленной вышеприведенной Формулой 1, и фенотиазина путем конденсации и перекристаллизации паров фталоцианина цинка и фенотиазина, полученных на стадии (а′), при температуре от комнатной до 300°С в атмосфере инертного газа.
Далее, способ получения по настоящему изобретению будет описан подробно, шаг за шагом.
На стадиях (а) и (а′) получают пар ZnPc и/или пар фенотиазина путем испарения фталоцианина цинка и/или фенотиазина в виде порошка в результате нагревания при температуре 500°С или выше, предпочтительно при температуре 550°С или выше, например, при температуре от 500 до 1000°С, предпочтительно при температуре от 550 до 800°С, более предпочтительно при температуре от 550 до 650°С в атмосфере инертного газа.
На стадиях (b) и (b′) конденсируют и проводят перекристаллизацию пара ZnPc и/или пара фенотиазина в атмосфере инертного газа на подложке. В это время температура находится в диапазоне температур, при которых могут быть собраны, сконденсированы и перекристаллизованы пар ZnPc и/или пар фенотиазина, образованные на стадиях (а) и/или (а′), и такая температура ниже температуры нагрева и может составлять 300°С или менее, предпочтительно 200°С или менее, более предпочтительно 180°С или менее, например, от комнатной температуры до 300°С, от комнатной температуры до 200°С, или от комнатной температуры до 180°С.
Инертный газ, используемый на стадиях (а), (а′), (b) и (b′), может представлять собой азот, аргон или гелий, но не ограничивается ими, и в настоящем изобретении предпочтительно используют аргон.
Подложка на стадиях (b) и (b′) может быть любого типа, который находится в контакте с паром фталоцианина цинка и позволяет нанонитям расти, и может включать, например, кремний, кварц и т.д., но не ограничивается ими.
Кроме того, настоящее изобретение относится к фотосенсибилизатору, содержащему нанонити α-формы фталоцианина цинка (ZnPc-HH), или композит нанонити α-формы фталоцианина цинка, представленной вышеприведенной Формулой 1, и фенотиазина.
Фотосенсибилизатор, содержащий нанонити α-формы фталоцианина цинка (ZnPc-HH), или композит нанонити α-формы фталоцианина цинка/фенотиазина, поглощает свет в ближнем инфракрасном диапазоне от 650 до 900 нм с образованием активных форм кислорода и тепла.
Фототерапия является одним из широко используемых клинических способов лечения раковых заболеваний из-за ее меньшего числа побочных эффектов, неинвазивности и высокой селективности к свету определенной длины волны.
При проведении фототерапии, как фотодинамической терапии (ФДТ), так и фототермической терапии (ФТТ), необходимо применение света и фотосенсибилизатора для образования активных форм кислорода и тепловой энергии, соответственно, что приводит к индуцированию апоптоза.
В целом, фталоцианин цинка (ZnPc) является одним из перспективных фотосенсибилизаторов, так как он имеет сильное сечение поглощения в спектральном диапазоне от 650 до 900 нм, который обеспечивает максимальное проникновение излучения в ткань. Одной из важнейших проблем при использовании молекулы фталоцианина (Рс), в том числе ZnPc, является плохая растворимость ZnPc в воде. Поэтому для увеличения растворимости ZnPc в воде были проведены различные химические модификации с целью повышения гидрофильности путем введения различных функциональных групп в основную цепь ZnPc.
Авторами настоящего изобретения было обнаружено, что нанонити (НН) α-формы ZnPc, непосредственно выращенные из порошка ZnPc путем испарения-конденсации-перекристаллизации, характеризуются повышенной растворимостью в воде и диспергируемостью в воде без проведения функционализации. Водный раствор нанонити α-формы ZnPc стабилен в течение более трех месяцев без какой-либо агрегации.
Кроме того, было обнаружено, что водный раствор нанонити α-формы ZnPc обладает высокоэффективным двойным эффектом - одновременно фотодинамическим и фототермическим эффектами - при облучении лазером в ближней инфракрасной области (λ=808 нм). Было доказано, что такой двойной фототерапевтический эффект нанонитей α-формы ZnPc обеспечивает усиление цитотоксичности против раковых КВ-клеток в экспериментах in vitro и in vivo.
Металлофталоцианин (МРс) образует либо активные формы кислорода, либо тепловую энергию после облучения светом в ближней инфракрасной области в зависимости от электронной конфигурации центрального металла. Когда центральный металл имеет электронную конфигурацию d0 или d10 (заполненная оболочка, как у Zn (II)), триплетное возбужденное состояние имеет долгое время жизни, достаточное для образования АФК (фотодинамический (ФД) эффект). С другой стороны, МРс, содержащий центральные атомы металлов, у которых d-орбитали заняты неполностью (незаполненная оболочка, как у Ni (II), Со (II) и др.) характеризуется низким ФД эффектом, но в значительной степени характеризуется быстрым преобразованием энергии электронного возбужденного состояния в колебательную энергию, в результате чего обеспечивается фототермический (ФТ) эффект.
Поскольку необходимые условия электронных энергетических состояний фотосенсибилизаторов для ФД и ФТ эффектов противоречат друг другу (то есть триплетное возбужденное состояние фотосенсибилизатора с долгим временем жизни выгодно для ФД эффекта, но неблагоприятно для ФТ эффекта), реализация фотосенсибилизаторов, которые обладают одновременно двумя фотоэффектами, является трудной задачей.
Нанонити α-формы ZnPc или композит нанонити α-формы фталоцианина цинка/фенотиазина в соответствии с настоящим изобретением обладают одновременно ФД и ФТ эффектами после облучения светом в ближней инфракрасной области. ФД активность нанонитей α-формы ZnPc была доказана путем обнаружения активных форм кислорода, образующихся после облучения нанонитей α-формы ZnPc лазером в ближней инфракрасной области (А=808 нм).
Соответственно, нанонити α-формы ZnPc или композит нанонити α-формы ZnPc/фенотиазина в соответствии с настоящим изобретением могут быть эффективно использованы в качестве фотосенсибилизатора.
Кроме того, настоящее изобретение относится к фармацевтической композиции для предупреждения или лечения рака, содержащей нанонити α-формы фталоцианина цинка (ZnPc НН), или композит нанонити α-формы фталоцианина цинка/фенотиазина, представленной вышеприведенной Формулой 1, в качестве активного ингредиента.
Что касается активных форм кислорода и тепла, которые образуются при облучении инфракрасным светом (в частности, светом в ближней инфракрасной области) нанонитей α-формы фталоцианина цинка или композита нанонити α-формы фталоцианина цинка/фенотиазина, когда нанонити α-формы фталоцианина цинка вводят в область опухоли и облучают инфракрасным светом (в частности, светом в ближней инфракрасной области), образуются активные формы кислорода и тепло, которые уничтожают (ликвидируют) раковые клетки или ткань, и, таким образом, нанонити α-формы фталоцианина цинка или композит нанонити α-формы фталоцианина цинка/фенотиазина в соответствии с настоящим изобретением могут.быть эффективно использованы для предупреждения или лечения рака.
Нанонити α-формы фталоцианина цинка или композит нанонити α-формы фталоцианина цинка/фенотиазина, используемые в качестве активного ингредиента в фотосенсибилизаторе или фармацевтической композиции для предупреждения или лечения раковых заболеваний, могут находиться в виде водного раствора, т.е. растворены в воде. С точки зрения образования активных форм кислорода и тепла желательно, чтобы концентрация нанонитей α-формы фталоцианина цинка в растворе нанонити или композита нанонити α-формы фталоцианина цинка/фенотиазина в растворе композита была высокой, и концентрация может составлять 60 мг/л или выше, предпочтительно 80 мг/л или выше, более предпочтительно 100 мг/л или выше, например, может составлять от 60 до 140 мг/л, от 80 до 140 мг/л, от 100 до 140 мг/л или от 100 до 130 мг/л.
Примеры раковых заболеваний, которые можно лечить с помощью нанонитей α-формы фталоцианина цинка или композита нанонити α-формы фталоцианина цинка/фенотиазина в соответствии с настоящим изобретением, могут включать все виды солидных раковых заболеваний, в частности, эпителиальный рак, вызванный злокачественной трансформацией эпителиальных тканей, таких как кожа, мембраны и т.д., и может представлять собой по меньшей мере одно, выбранное из группы, состоящей из плоскоклеточной карциномы полости рта, рака кожи, рака молочной железы, рака желудка, рака яичников, рака шейки матки, рака печени, рака легких, рака простаты, рака почек и рака щитовидной железы.
Фармацевтическая композиция согласно настоящему изобретению может содержать по меньшей мере один известный активный ингредиент, имеющий противоопухолевый эффект, в комбинации с нанонитями α-формы фталоцианина цинка или композитом нанонити α-формы фталоцианина цинка/фенотиазина.
Для введения фармацевтическая композиция согласно настоящему изобретению может дополнительно содержать по меньшей мере один фармацевтически приемлемый носитель в дополнение к указанным выше активным ингредиентам. Примеры фармацевтически приемлемого носителя включают физиологический раствор, стерильную воду, раствор Рингера, буферный солевой раствор, раствор декстрозы, раствор мальтодекстрина, глицерин, этанол и их комбинации. Если необходимо, к композиции могут быть добавлены другие обычные добавки, такие как антиоксидант, буферный раствор, антибактериальный агент и т.д. Кроме того, фармацевтическая композиция согласно настоящему изобретению может быть приготовлена в виде инъекций, таких как водный раствор, суспензия, эмульсия и т.д., таблеток, капсул, гранулы или пилюль, путем добавления разбавителя, поверхностно-активного вещества, связующего вещества и смазывающего вещества. Кроме того, фармацевтическая композиция согласно настоящему изобретению может быть приготовлена с помощью соответствующих способов в данной области техники или способов, описанных в Remington′s Pharmaceutical Science (последнее издание), Mack Publishing Company, Easton PA, в зависимости от заболевания и/или ингредиентов.
Фармацевтическая композиция согласно настоящему изобретению может быть введена перорально или парентерально (например, внутрь опухоли, интраваскулярно, внутривенно, подкожно, внутрибрюшинно или местно) в дозе, зависящей от различных факторов, включая вес, возраст, пол, состояние здоровья пациента, рацион, время введения, путь введения, скорость экскреции, тяжесть заболевания и т.д. Суточная доза нанонитей α-формы фталоцианина цинка может составлять от 0,00001 до 1 мг/мм3 (объем опухоли), предпочтительно от 0,0001 до 0,1 мг/мм3 (объем опухоли), но не ограничивается этими числами.
Для предупреждения или лечения рака фармацевтическая композиция согласно настоящему изобретению может быть использована индивидуально или в сочетании с другими видами терапии, включая хирургическую терапию, гормональную терапию, лекарственную терапию и терапию с использованием модификаторов биологического ответа.
Полезные эффекты
Нанонити α-формы фталоцианина цинка или композит нанонити α-формы фталоцианина цинка/фенотиазина в соответствии с настоящим изобретением могут проявлять одновременно фототермический и фотодинамический эффекты от одной молекуле, что имеет значительные преимущества для развития многофункциональных молекулярных систем и имеют превосходные фототерапевтические эффекты и, таким образом, могут быть эффективно использованы в фототерапии рака. Кроме того, композит нанонити α-формы фталоцианина цинка/фенотиазина обладает способностью флуоресцировать, что облегчает введение в систему визуализации изображения, и, соответственно, диагностика и лечение могут быть проведены одновременно с помощью одного вещества.
Описание чертежей
На ФИГ.1А схематически показан ИКП процесс выращивания нанонитей α-формы ZnPc согласно настоящему изобретению.
На ФИГ.1 В показано СЭМ-изображение (сканирующая электронная микроскопия) нанонитей α-формы ZnPc, полученных способом ИКП.
На ФИГ.1C и 1D показаны дифрактограммы нанонитей ZnPc (а-форма) и порошка ZnPc (β-форма), собранных с Si (100) подложки, соответственно.
На ФИГ.2 показаны ИК-Фурье-спектры нанонитей α-формы ZnPc (красная линия) и порошка β-формы ZnPc (черная линия).
На ФИГ.3 показаны результаты термогравиметрического анализа (ТГА) нанонитей α-формы ZnPc.
На ФИГ.4, часть А, показано ПЭМ-изображение (просвечивающая электронная микроскопия) высокого разрешения выделенной отдельной нанонити α-формы ZnPc, выращенной вдоль направления [010] (вставка показывает ЭДОУ-картину (электронная дифракция на отдельных участках) нанонити ZnPc, выращенной вдоль направления [100], на ФИГ.4, часть В, показан увеличенный вид части А на желтом поле (изображение межплоскостного расстояния решетки: 1,14 нм), на ФИГ.4, часть С, схематически показана кристаллическая структура нанонити α-формы ZnPc в проекции вдоль оси а, где плоскости цинка выделены красным цветом, что соответствует множеству ионов Zn (II) в нанонити α-формы слева, а молекулярная структура ZnPc показана справа).
На ФИГ.5 показаны рентгенограммы нанонитей α-формы ZnPc, выращенных на Si (100)подложке.
На ФИГ.6 показаны масс-спектры нанонитей α-формы ZnPc (часть А) и порошка ZnPc (часть В).
На ФИГ.7 показаны спектры 1H ЯМР нанонитей α-формы ZnPc (часть А) и порошка ZnPc (часть 7 В).
На ФИГ.8 показаны растворимость в воде нанонитей α-формы ZnPc и влияние ультразвука, где в верхней строке показаны изображения водных растворов нанонити α-формы ZnPc, в средней строке показаны ПЭМ-изображения нанонитей α-формы ZnPc, а в нижней строке схематически показано возрастание взаимодействия между водой и единицой ZnPc при более длительном времени обработки ультразвуком, где синие пунктирные линии показывают водородные связи между атомами водорода воды и атомами азота ZnPc.
На ФИГ.9 показана стабильность в воде порошка ZnPc и нанонитей α-формы ZnPc.
На ФИГ.10 показаны ИК-Фурье-спектры нанонитей α-формы ZnPc (красная линия) и порошка (3-формы ZnPc (черная линия), где в полосе нанонити α-формы ZnPc имеются валентные колебания -ОН в молекуле воды от 3600 до 3300 см-1.
На ФИГ.11 показаны обзорные РФС-спектры (рентгеновская фотоэлектронная спектрометрия) нанонитей α-формы ZnPc, выдержанных на воздухе (слева), и нанонитей α-формы ZnPc, отожженных в вакууме (справа), где пик O1s наблюдается при 533 эВ из-за адсорбированной H2O.
На ФИГ.12 показаны спектры поглощения в видимой и ультрафиолетовой областях нанонитей α-формы ZnPc, растворенных в смешанном растворителе, содержащем ДМФА и воду в различных соотношениях, где с увеличением содержания воды цвет раствора меняется на синий от 343 нм до 330 нм, и на вставке показан раствор нанонитей α-формы ZnPc в зависимости от соотношения ДМФА/вода.
На ФИГ.13 показаны полиморфные структуры α-формы и β-формы молекул ZnPc.
На Фиг.14А показаны ИК-Фурье-спектры нанонитей Рс (красная линия) и порошка Рс (черная линия), на которых полосы валентного колебания -ОН при 3600 до 3300 см-1 наблюдаются для нанонитей Рс, но не наблюдаются для порошка Рс, что свидетельствует, что поведение нанонитей α-формы ZnPc и порошка ZnPc является сходным.
На ФИГ.14В показан спектр раствора нанонитей Рс в видимой и ультрафиолетовой областях, на котором видны хорошо разрешенные полосы Соре и Q-полосы, аналогичные таковым для водного раствора нанонитей α-формы ZnPc, где на вставке изображен водный раствор нанонитей Рс.
На ФИГ.15 показаны полученные с помощью флуоресцентной микроскопии фотографии плоскоклеточного рака полости рта (КВ-клетки), где виден окислительный стресс, обнаруженный с помощью комплекта Image-iT™ LIVE Активные Формы Кислорода (АФК), и где в верхнем левом углу показаны необработанные КВ-клетки, в правом верхнем углу показаны КВ-клетки, облученные светом в ближней ИК-области (808 нм, 3 Вт/см2), внизу слева показаны KB клетки, обработанные раствором нанонитей α-формы ZnPc (120 мг/л), в правом нижнем углу показаны КВ-клетки, обработанные раствором нанонитей ZnPc в α-форме (120 мг/л) с последующим облучением светом в ближней ИК-области (808 нм, 3 Вт/см2), а клетки с зеленой флуоресценцией представляют собой клетки, подвергнувшиеся действию окислительного стресса, пораженные АФК.
На ФИГ.16 показана относительная интенсивность флуоресценции каждой группы, где данные представлены как среднее значение ± стандартное отклонение (n=3, три повторности).
На ФИГ.17 показаны спектры в видимой и ультрафиолетовой областях нанонити ZnPc в α-форме (красная линия) и раствора ZnPcS4 (синяя линия), где видно сильное поглощение раствора нанонити ZnPc в α-форме (при 600, 800 нм) и раствора ZnPcS4 (при 630 нм) в ближней ИК-области, и на вставке показано изображение раствора нанонити ZnPc в α-форме (синий, слева) и раствора ZnPcS4 (цвет морской волны, справа).
На ФИГ.18 и 19 показаны изменения температуры водного раствора нанонити ZnPc в α-форме и водного раствора ZnPcS4 при различных концентрациях, соответственно, после облучения светом в ближней ИК-области (660 нм, 3 Вт/см2) в течение 3 минут.
На ФИГ.20 показаны изменения температуры чистой воды после облучения светом в ближней ИК-области (660 нм и 808 нм, 3 Вт/см2) в течение 3 минут.
На ФИГ.21 и 22 показаны изменения температуры водного раствора нанонити ZnPc и водного раствора ZnPcS4 при различных концентрациях, соответственно, после облучения светом в ближней ИК-области (808 нм, 3 Вт/см2) в течение 3 минут, где данные представлены как среднее значение±стандартное отклонение {п=3, три повторности).
На ФИГ.23 показаны спектры комбинационного рассеяния нанонитей ZnPc в α-форме, выращенных на кремниевой подложке (черная линия), и водного раствора нанонити ZnPc (красная линия).
На ФИГ.24 показаны спектры комбинационного рассеяния, полученные для исходных КВ-клеток (черная линия) и КВ-клеток, обработанных растворм нанонити ZnPc (красная линия), где характеристичные пики комбинационного рассеяния, соответствующие валентным колебаниям пирролла в ZnPc, наблюдаются при 1336 см-1 и 1506 см-1 и обозначены (а) и (b), а на вставке показано полученное с помощью оптического микроскопа изображение стеклянной пластины, на которую помещены КВ-клетки, обработанные раствором нанонити ZnPc в α-форме (масштаб линейки: 4 мкм).
На ФИГ.25 показаны конфокальные спектральные изображения, отображенные с интенсивностями пиков (а) и (b), показанных на ФИГ.24, где вертикальный шаг сканирования (глубина) составляет 2 мкм, а яркость цвета зависит от интенсивности пика (масштаб линейки: 4 мкм).
На ФИГ.26 показаны полученные с помощью светлопольной микроскопии фотографии КВ-клеток, где в верхнем левом углу показаны необработанные КВ-клетки, в правом верхнем углу показаны КВ-клетки, обработанные раствором нанонити ZnPc в α-форме (120 мг/л), в нижнем левом углу показаны КВ-клетки, обработанные раствором (120 мг/л) нанонити ZnPc с последующим облучением светом в ближней ИК-области (808 нм, 3 Вт/см2), а в нижнем правом углу показаны КВ-клетки через 24 часа после фотообработки, при которой клетки окрашивали трипановым синим, и мертвые клетки имеют голубой цвет (масштаб линейки: 4 мкм).
На ФИГ.27 показаны количества жизнеспособных КВ-клеток в различных экспериментальных группах, где данные представлены как среднее значение ± стандартное отклонение (n=3, три повторности).
На ФИГ.28 показаны изображения экспериментов по фототерапии in vivo, где вверху показана мышь, ксенотрансплантированная опухолевыми КВ-клетками (размер опухоли: около 70 мм3), в середине показана мышь, область опухоли у которой был облучен светом в ближней ИК-области (808 нм, 3 Вт/см2), а внутрь опухоли инъекционно был введен раствор нанонити ZnPc (120 мг/л, 200 мкл), и внизу показана мышь через двадцать дней после фотообработки (эта мышь здорова и не показывает никакого аномального поведения).
На ФИГ.29 показаны данные среднего объема опухоли с течением времени, где объем опухоли регистрировали три раза в неделю, и данные выражены как среднее значение±стандартное отклонение (n=4, четыре повторности). Только для группы, получавшей как нанонить ZnPc, так и которую облучали светом в ближней ИК-области, наблюдается значительное ингибирование роста опухоли по сравнению с необработанной группой. Также показаны данные среднего объема опухоли для группы, не получавшей никакого лечения, получавшей нанонить ZnPc в α-форме и получавшей PBS+свет в ближней ИК-области (n=4, Р<0,05, двусторонний дисперсионный анализ).
На ФИГ.30 показаны репрезентативные гистологические изображения опухолевых тканей, обработанных нанонитями ZnPc в α-форме и облученные светом в ближней ИК-области (NIR), где на частях A-D показаны опухолевые ткани, окрашенные Н&Е, на которых более темные окрашенные в розовый цвет клетки представляют собой мертвые клетки, а на частях Е-Н показаны результаты теста введения концевой метки биотинилированным dUTP с использованием терминальной дезоксинуклеотидилтрансферазы (TUNEL) для выявления специфических апоптозных клеток, при этом апоптозные клетки окрашены синим цветом, а неапоптозные клетки окрашены гематоксилином (масштаб линейки: 50 мкм).
На ФИГ.31 показан композит нанонити α-формы фталоцианина цинка/фенотиазина, где на части (а) показана молекулярная структура фенотиазина, на части (b) показано изображение фенотиазиновой нанонити, полученной на кремниевой подложке в результате процесса ИКП, и показаны полученные с помощью оптического и флуоресцентного микроскопов изображения структуры нанонити, а на части (с) показаны схема процесса ИКП и изображение композита фталоцианина цинка/фенотиазина, полученного на кремниевой подложке.
На ФИГ.32 показаны СЭМ изображения композитов нанонити α-формы фталоцианина цинка/фенотиазина, полученных разными способами в зависимости от положения кремниевой подложки.
На части (а) на ФИГ.33 показаны флуоресцентные изображения раствора фенотиазиновой нанонити, раствора нанонити фталоцианина цинка в α-форме и раствора композита нанонити фталоцианина цинка в α-форме/фенотиазина при воздействии света с длиной волны 365 нм, а на части (b) на ФИГ.33 показаны спектры флуоресценции раствора фенотиазиновой нанонити, раствора нанонити фталоцианина цинка в α-форме и раствора композита нанонити фталоцианина цинка в α-форме/фенотиазина при длине волны 340 нм.
Примеры реализации изобретения
Далее настоящее изобретение будет описано более подробно со ссылкой на Примеры, Сравнительные примеры и Экспериментальные примеры. Однако следующие Примеры, Сравнительные примеры и Экспериментальные примеры предназначены только для иллюстративных целей для облегчения понимания настоящего изобретения, и объем настоящего изобретения не ограничивается ими.
Пример 1: Получение нанонитей α-формы фталоцианина цинка
С помощью транспортной реакции твердое вещество-газ, называемой процессом испарения-конденсации-перекристаллизации (ИКП), при использовании порошка ZnPc в качестве предшественника, были получены нанонити фталоцианина цинка в α-форме.
В частности, порошок ZnPc (0,05 г, Sigma-Aldrich) был загружен в керамическую лодочку, которая находилась в центре кварцевой трубки, помещенной в электрически нагреваемую печь. Перед реакцией кварцевую трубку продували аргоном со скоростью потока 800 см3/мин в течение 5 минут для удаления захваченных газов из окружающей среды и затем нагревали до 550°С при равномерном потоке Ar. Si подложка (100) (пластина, WRS materials) была помещена в концевой области печи (ниже по потоку).
В ходе реакции порошок ZnPc, помещенный в центре нагревающей печи трубчатого типа, был испарен при 550°С, и пары ZnPc переносились c помощью газа Ar дальше по потоку, где расположена Si пластина. Пары ZnPc конденсировались на Si пластине, так как температура подложки была снижена естественным образом до 180°С, при которой растут одномерные ZnPc нанонити. Реакционную смесь выдерживали в течение 40 минут для обеспечения роста нанонитей ZnPc, и затем образец охладили до комнатной температуры в токе Ar. Этот процесс ИКП схематически показан на ФИГ.1А.
Экспериментальный Пример 1: Определение характеристик нанонитей α-формы фталоцианина цинка
Был проведен следующий эксперимент для определения морфологии, химических элементов и дифрактограмм нанонитей фталоцианина цинка в α-форме, полученных в Примере 1.
1. СЭМ-измерения (Сканирующая Электронная Микроскопия)
Au было распылено на нанонити фталоцианина цинка в α-форме, полученные в Примере 1, для проведения измерений с помощью сканирующей электронной микроскопии (СЭМ, JSM-7410F, JEOL). Полученное СЭМ-изображение показано на ФИГ.1В.
Как показано на ФИГ.1 В, было установлено, что диаметр и длина нанонитей фталоцианина цинка в α-форме составляли примерно от 50 до 100 нм и примерно от 1 до 10 мкм, соответственно.
2. Измерения с помощью рентгеновской дифракции
Кристаллическая структура нанонитей фталоцианина цинка в α-форме, полученных в Примере 1, была охарактеризована с помощью порошковой рентгеновской дифракции (XRD, D/MAX-2500/PC, RIGAKU)) и просвечивающей электронной микроскопии высокого разрешения (ПЭМ ВР, JEM 2100F, JEOL)) и дифракции электронов на отдельных участках (SAED).
Дифрактограммы нанонитей ZnPc (α-форма) и порошка ZnPc ((3-форма), собранных с кремниевой (100) подложки, соответственно, показаны на ФИГ.1C и 1D.
Как показано на ФИГ.1C и 1D, в соответствии с JC-PDS картами №21-1986 и №39-1882, из результатов рентгеновской дифракции видно, что нанонити ZnPc имеют el-форму, в то время как исходный порошок ZnPc имеет (3-форму. Одним из характеристичных рентгенодифракционных пиков для ZnPc является пик (200). В то время как β-форма нанонити ZnPc имеет d(200)=7,24 А (при 29=12,22°), нанонить a-ZnPc имеет d(200)=12,6 А (при 2=7,01°), что хорошо согласуется с ранее сообщенными значениями для кристалла и тонкой пленки ZnPc в α-форме.
3. ИК-Фурье-измерение
Нанонити ZnPc в α-форме и порошок ZnPc в β-форме были охарактеризованы с помощью инфракрасной спектроскопии с Фурье преобразованием (ИК-Фурье). В частности, для ИК-Фурье-спектроскопии были подготовлены таблетки из KBr с порошкои ZnPc и нанонитями ZnPc, а ИК-Фурье-спектры были получены при использовании ИК-Фурье-спектрофотометра (VERTEX 70, Bruker Optics). Результаты показаны на ФИГ.2.
Как показано на ФИГ.2, результаты ИК-Фурье-спектроскопии также подтверждают, что нанонити действительно представляют собой нанонити ZnPc в α-форме (красная линия), поскольку в полученных спектрах наблюдаются изгибные колебания С-Н в области отпечатков пальцев при 724 см-1 и колебания центрального циклического кольца при 773 см-1. Для рентгенодифракционных измерений порошков нанонити ZnPc в α-форме в больших количествах могут быть собраны из нескольких реакционных партий.
4. Термогравиметрический анализ
Термогравиметрическое измерение нанонитей ZnPc в α-форме проводили с использованием термогравиметрического анализатора (TG-2171, Cahn Instrument Inc.). Поместили 5 мг порошка ZnPc (Sigma-Aldrich) и нагревали его от комнатной температуры до 1000°С со скоростью 4°С/мин в атмосфере Ar. Полученные результаты показаны на ФИГ.3.
Как показано на ФИГ.3, можно видеть, что тепловое испарение ZnPc начинается при 550°С.
5. Измерение с помощью просвечивающей электронной микроскопии высокого разрешения (ПЭМ ВР)
ПЭМ ВР измерение проводили с использованием образцов, полученных путем нанесения по каплям водного раствора нанонитей ZnPc в α-форме на медную сетку, имеющую покрытие из углеродной пленки (TED PELLIA Inc., США). Ре