Спироциклические аминовые производные в качестве модуляторов s1p
Иллюстрации
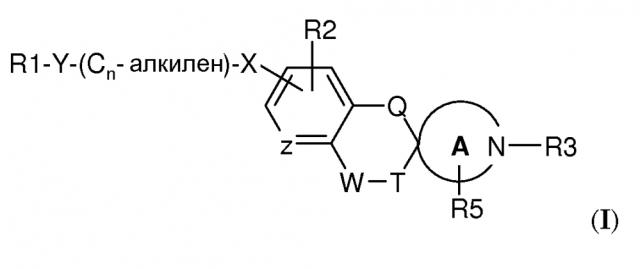
Показать всеИзобретение относится к спироциклическим аминовым производным формулы (I), где R1 выбран из циано, (2-4С)алкенила, (2-4С)алкинила, (1-4С)алкила, каждый из которых необязательно замещен CN или одним или несколькими атомами фтора, (3-6С)циклоалкила, (4-6С)циклоалкенила или (8-10С)бициклической группы, где каждая из таких групп необязательно замещена галогеном или (1-4С)алкилом, фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из галогена, (1-6С)алкила, необязательно замещенного одним или несколькими атомами фтора, (1-6С)алкокси, необязательно замещенного одним или несколькими атомами фтора, и (3-6С)циклоалкила, необязательно замещенного фенилом; бифенила, необязательно замещенного галогеном; нафтила; фенила, замещенного моноциклическим гетероциклом; моноциклического гетероцикла, необязательно независимо замещенного галогеном, (1-6С)алкилом, необязательно замещенным одним или несколькими атомами фтора, (3-6С)циклоалкилом или фенилом, необязательно замещенным (1-4С)алкилом или галогеном, и бициклического гетероцикла, необязательно замещенного галогеном или (1-4С)алкилом, необязательно замещенным одним или несколькими атомами фтора;
-Y-(Cn-алкилен)-Х- представляет собой связывающую группу, где Y присоединен к R1 и выбран из связи, -O-, -СО-, -S-, -SO-, -SO2-, -СН=СН-, -C(CF3)=CH-, -C≡C-, -СН2-О-, -CO-NH-, -NH-CO- и транс-циклопропилена; n представляет собой целое число, имеющее значение от 0 до 10; и X присоединен к фениленовой группе и выбран из связи, -О-, -S-, -SO-, -SO2-, -NH-, -СО-, -СН=СН- и транс-циклопропилена; R2 представляет собой Н или независимо выбран из одного или нескольких заместителей, выбранных из галогена, (1-4С)алкила, необязательно замещенного одним или несколькими атомами фтора; R3 представляет собой (1-4С)алкилен-R4, где алкиленовая группа может быть замещена одним или несколькими атомами галогена или (СН2)2 с образованием циклопропильной группы, или R3 представляет собой (3-6С)циклоалкилен-R4, или -CO-CH2-R4, где R4 представляет собой -ОН, -PO3H2, -OPO3H2, -СООН, -COO(1-4С)алкил или тетразол-5-ил; Q представляет собой связь; -W-T- выбран из -СН=СН-, -СН2-СН2-, -СН2-O-, -O-СН2-, -O-СН2-СН2- и -СО-O-; R5 представляет собой Н; Z представляет собой СН, CR2 или N; и А представляет собой морфолиновую кольцевую структуру или 5-, 6- или 7-членный циклический амин; или его фармацевтически приемлемым солям или одному или нескольким его N-оксидам, а также к способу их получения, фармацевтической композиции на их основе, поскольку эти соединения обладают сродством к S1P рецепторам, и их можно использовать для лечения, облегчения или предотвращения заболеваний и состояний, в которые вовлечен(ы) S1P рецептор(ы).8 н. и 20 з.п. ф-лы, 2 табл., 335 пр.
Реферат
Область изобретения
Настоящее изобретение относится к новым спироциклическим аминовым производным, обладающим сродством к S1P рецепторам, к фармацевтической композиции, содержащей указанные соединения, а также к применению указанных соединений для получения лекарственного средства для лечения, облегчения или предотвращения заболеваний и состояний, в которые вовлечен какой-либо S1P рецептор, или в которые вовлечена модуляция эндогенной S1P сигнальной системы через какой-либо S1P рецептор.
Предпосылки изобретения
Сфингозин-1-фосфат (S1P) представляет собой биоактивный сфинголипид, который опосредует множество различных клеточных ответов, таких как пролиферация, цитоскелетная организация и миграция, адгезионная и плотная соединительная сборка и морфогенез. S1P может связываться с членами семейства генов эндотелиальной клеточной дифференциации (EDG рецепторы), локализованных на плазменной мембране связанных с G-белком рецепторов. К настоящему времени идентифицировано пять членов этого семейства в качестве S1P рецепторов в различных типах клеток: S1P1 (EDG-1), S1P2 (EDG-5), S1P3 (EDG-3), S1P4 (EDG-6) и S1P5 (EDG-8). S1P может вызывать цитоскелетные перегруппировки во многих типах клеток для регулировки иммунного клеточного траффика, сосудистого гомеостаза и клеточной коммуникации в центральной нервной системе (ЦНС) и в периферических системах органов.
Известно, что S1P секретируется сосудистым эндотелием и присутствует в крови в концентрациях 200-900 наномоль и связывается альбумином и другими белками плазмы. Это обеспечивает как стабильный резервуар во внеклеточных жидкостях, так и эффективную доставку к высокоаффинным клеточно-поверхностным рецепторам. S1P связывается с низким наномолярным сродством с пятью рецепторами S1P1-5. Кроме того, тромбоциты также содержат S1P и могут локально высвобождаться, вызывая, например, вазоконстрикцию. Подтипы рецептора S1P1, S1P2 и S1P3 широко экспрессируются и являются доминирующими рецепторами в сердечно-сосудистой системе. Кроме того, S1P1 также является рецептором, присутствующим на лимфоцитах. S1P4 рецепторы присутствуют почти исключительно в гемопоэтической и лимфоидной системе. S1P5 преимущественно (но не исключительно) экспрессируется в центральной нервной системе. Экспрессия S1P5, по-видимому, ограничивается олигодентроцитами у мышей, миелинизирующими клетками головного мозга, тогда как у крыс и человека была обнаружена экспрессия на уровне астроцитов и эндотелиальных клеток, но не на олигодентроцитах.
Модуляторы S1P рецептора представляют собой соединения, которые осуществляют передачу сигнала как (ант)агонисты на одном или нескольких S1P рецепторах. Настоящее изобретение относится к модуляторам S1P5 рецептора, в частности к агонистам, и предпочтительно к агонистам с селективностью в отличие от S1P1 и/или S1P3 рецепторов, в свете нежелательных сердечно-сосудистых и/или иммуномодуляторных эффектов. К настоящему времени обнаружено, что S1P5 агонисты можно использовать в лечении когнитивных расстройств, в частности, возрастного ухудшения познавательной способности.
Хотя продолжаются исследования, направленные на разработку терапевтических средств, которые можно использовать для лечения возрастного ухудшения познавательной способности и деменции, это дало не много успешных кандидатов. Поэтому существует потребность в новых терапевтических средствах с желаемыми свойствами.
Описание изобретения
Было обнаружено, что спироциклические аминовые производные формулы (I)
где
R1 выбран из
циано,
(2-4C)алкенила, (2-4C)алкинила, (1-4C)алкила, каждый из которых необязательно замещен CN или одним или несколькими атомами фтора,
(3-6C)циклоалкила, (4-6C)циклоалкенила или (8-10C)бициклической группы, где каждая из таких групп необязательно замещена галогеном или (1-4C)алкилом,
фенила, бифенила, нафтила, каждый из которых необязательно замещен одним или несколькими заместителями, независимо выбранными из галогена, циано, (1-6C)алкила, необязательно замещенного одним или несколькими атомами фтора, (1-6C)алкокси, необязательно замещенного одним или несколькими атомами фтора, амино, ди(1-4C)алкиламино и (3-6C)циклоалкила, необязательно замещенного фенилом, который может быть замещен (1-4C)алкилом или галогеном,
фенила, замещенного фенокси, бензилом, бензилокси, фенилэтилом или моноциклическим гетероциклом, каждый из которых необязательно замещен (1-4C)алкилом, необязательно замещенным одним или несколькими атомами фтора,
моноциклического гетероцикла, необязательно независимо замещенного галогеном, (1-6C)алкилом, необязательно замещенным одним или несколькими атомами фтора, (3-6C)циклоалкилом или фенилом, необязательно замещенным (1-4C)алкилом или галогеном,
и
бициклического гетероцикла, необязательно замещенного галогеном или (1-4C)алкилом, необязательно замещенным одним или несколькими атомами фтора;
-Y-(Cn-алкилен)-X- представляет собой связывающую группу, где
Y присоединен к R1 и выбран из связи, -О-, -CO-, -S-, -SO-, -SO2-, -NH-, -CH=CH-, -C(CF3)=CH-, -C≡C-, -CH2-O-, -O-CO-, -CO-O-, -CO-NH-, -NH-CO- и транс-циклопропилена;
n представляет собой целое число, имеющее значение от 0 до 10; и
X присоединен к фениленовой/пиридильной группе и выбран из связи, -О-, -S-, -SO-, -SO2-, -NH-, -CO-, -CH=CH- и транс-циклопропилена;
R2 представляет собой H или независимо выбран из одного или нескольких заместителей, выбранных из галогена, (1-4C)алкокси и (1-4C)алкила, необязательно замещенного одним или несколькими атомами фтора; и
R3 представляет собой (1-4C)алкилен-R4, где алкиленовая группа может быть замещена одним или несколькими атомами галогена или (CH2)2 с образованием циклопропильной группы, или R3 представляет собой (3-6C)циклоалкилен-R4, -CH2-(3-6C)циклоалкилен-R4, (3-6C)циклоалкилен-CH2-R4 или -CO-CH2-R4, где R4 представляет собой -OH, -PO3H2, -OPO3H2, -COOH, -COO(1-4C)алкил или тетразол-5-ил;
Q представляет собой связь или -О-;
-W-T- выбран из -CH=CH-, -CH2-CH2-, -CH2-О-, -О-CH2-, -O-CH2- CH2- и -CO-O-;
R5 представляет собой H или независимо выбран из одного или нескольких галогенов;
Z представляет собой CH, CR2 или N; и
A представляет собой морфолиновую кольцевую структуру или 5-, 6- или 7-членный циклический амин;
или их фармацевтически приемлемые соли, сольваты или гидраты или один или несколько их N-оксидов демонстрируют сродство в отношении S1P рецепторов. В частности, соединения по настоящему изобретению демонстрируют селективное сродство в отношении S1P5 рецептора в отличие от S1P1 и/или S1P3 рецептора(рецепторов).
В документах предшествующего уровня техники раскрыты структуры спироиндолиновых производных, имеющие некоторую схожесть со структурами соединений по настоящему изобретению, например, в WO 2005063745. Однако эти соединения являются модуляторами Mas рецептора. Нет никакого предположения или раскрытия, что спироиндолиновые соединения, раскрытые в WO 2005063745, могут демонстрировать сродство в отношении S1P рецепторов.
Соединения по настоящему изобретению являются модуляторами S1P рецептора, в частности, S1P5 рецептора. Более конкретно, соединения по настоящему изобретению являются агонистами S1P5 рецептора. Соединения по настоящему изобретению являются полезными для лечения, облегчения и предотвращения заболеваний и состояний, в которые вовлечен(вовлечены) (какой-либо) S1P рецептор(рецепторы), в частности S1P5, или в которые вовлечена модуляция эндогенной S1P сигнальной системы через какой-либо S1P рецептор. В частности, соединения по настоящему изобретению можно использовать для лечения, облегчения или предотвращения расстройств ЦНС (центральной нервной системы), таких как нейродегенеративные расстройства, в частности, но не ограничиваясь этим, когнитивные расстройства (в частности, возрастное ухудшение познавательной способности) и связанные с этим состояния, болезнь Альцгеймера, (сосудистая) деменция, болезнь Ниманна-Пика и расстройства познавательной способности при шизофрении, обсессивно-компульсивное поведение, глубокая депрессия, аутизм, рассеянный склероз и боль, и т.п. Предпочтительно, соединения по настоящему изобретению можно использовать для лечения, облегчения или предотвращения когнитивных расстройств (в частности, возрастного ухудшения познавательной способности) и связанных с этим состояний.
В одном варианте воплощения настоящего изобретения соединения имеют формулу (I), где R3 выбран из -(CH2)2-OH, -CH2-COOH, -(CH2)2-COOH, -(CH2)3-COOH, -CH2-CHCH3-COOH, -CH2-C(CH3)2-COOH, -CHCH3-CH2-COOH, -CH2-CF2-COOH, -CO-CH2-COOH, 1,3-циклобутилен-COOH, -(CH2)2-PO3H2, -(CH2)3-PO3H2, -(CH2)2-OPO3H2, -(CH2)3-OPO3H2, -CH2-тетразол-5-ила, -(CH2)2-тетразол-5-ила и -(CH2)3-тетразол-5-ила. Предпочтительные группы R3 выбраны из -(CH2)2-COOH, -CH2-CHCH3-COOH, -CH2-C(CH3)2-COOH, -CHCH3-CH2-COOH, -CH2-CF2-COOH, -CO-CH2-COOH и 1,3-циклобутилен-COOH. Наиболее предпочтительным является -(CH2)2-COOH.
В другом варианте воплощения Q представляет собой связь.
В другом варианте воплощения соединения имеют формулу (I), где R2 представляет собой H, метил, хлор или фтор. В других вариантах воплощения R2 представляет собой H.
В следующем варианте воплощения настоящего изобретения Z представляет собой CH или CR2.
В другом варианте воплощения соединения имеют формулу (I). -W-T- выбран из -CH2-О-, -О-CH2-, -О-CH2-CH2- и -CO-О-. В предпочтительных вариантах воплощения -W-T- представляет собой -О-CH2-.
Кроме того, в одном варианте воплощения настоящего изобретения, в группе -Y-(Cn-алкилен)-X-, Y выбран из связи, -О-, -CO-, -CH=CH-, -C(CF3)=CH-, -C≡C- и транс-циклопропилена; n представляет собой целое число, имеющее значение от 0 до 6. Предпочтительно, Y выбран из связи, -О-, -CH=CH-, -C≡C- и транс-циклопропилена. В других вариантах воплощения X выбран из связи, -О-, -S-, -SO-, -SO2-, -NH-, -CO-, -CH=CH- и транс-циклопропилена. Предпочтительно, X выбран из связи, -О-, -S-, -SO-, -SO2-, -NH- и -CO-. В предпочтительных вариантах воплощения группа -Y-(Cn-алкилен)-X- выбрана из -CH2-O-, -CH2-S- и -CH=CH- и, в частности, представляет собой -CH2-O-.
В некоторых вариантах воплощения настоящего изобретения R1 представляет собой (1-4C)алкил, и Y представляет собой связь, n представляет собой целое число, выбранное из 1-6, и X представляет собой -O- или связь. В других вариантах воплощения R1 и -(CH2)n- вместе представляют собой линейную гексильную, гептильную или октильную группу.
В других вариантах воплощения настоящего изобретения R1 выбран из (1-4C)алкила, циклогексила, циклогексенила, бифенила, необязательно замещенного галогеном,
фенила, необязательно замещенного одним, двумя или тремя заместителями, независимо выбранными из галогена, (1-4C)алкила, (1-4C)алкокси, трифторметила, трифторметокси и циклопропила, необязательно замещенного фенилом,
тиенила, пиридила, тетрагидропиранила, каждый из которых необязательно замещен галогеном, (1-4C)алкилом, циклопропилом или фенилом, необязательно замещенным галогеном, и
индолила, дигидробензофуранила и бенздиоксанила, каждый из которых необязательно замещен галогеном или (1-4C)алкилом. В предпочтительных вариантах воплощения настоящего изобретения R1 выбран из фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из галогена, (1-4C)алкила, циклопропила и трифторметила. Более предпочтительно, R1 представляет собой 2,6-дихлорфенил.
В других вариантах воплощения настоящего изобретения R5 представляет собой H.
В предпочтительных вариантах воплощения настоящего изобретения A представляет собой пиперидиновую структуру.
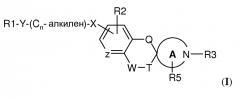
В другом варианте воплощения соединения по настоящему изобретению имеют структуру (II)
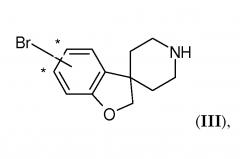
Соединения по настоящему изобретению подходящим образом можно получить способами, известными из уровня техники, и как проиллюстрировано в экспериментальном разделе настоящего описания. Были обнаружены некоторые новые и полезные промежуточные соединения для получения соединений по настоящему изобретению. Они представляют собой дополнительные варианты воплощения настоящего изобретения. Таким образом, еще один вариант воплощения настоящего изобретения представляет собой соединение формулы (III)
где Br присоединен на одном из участков, отмеченных звездочкой.
Также, один вариант воплощения настоящего изобретения представляет собой соединение формулы (IV)
где OH присоединен на одном из участков, отмеченных знаком #, и где, если OH находится в положении, обозначенном цифрой 1, соединение может быть независимо замещено (1-4C)алкилом или галогеном, выбранным из F или Cl, в одном или обоих положениях, обозначенных цифрой 2; и W-T представляет собой -O-CH2- или -CH2-CH2-; и A представляет собой морфолиновую кольцевую структуру или 5- или 6-членный циклический амин. Соединения формулы (III) являются полезными для получения соединений формулы (I), где -W-T- представляет собой -O-CH2-, а соединения формулы (IV) для получения соединений формулы (I), где -W-T- представляет собой -O-CH2- или -CH2-CH2-.
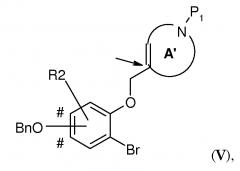
В соответствии с еще одним вариантом воплощения настоящего изобретения, очень эффективным способом получения соединения формулы (I), где R2 представляет собой H или один или два заместителя, выбранных из фтора, (1-4C)алкила и (1-4C)алкокси; -W-T- представляет собой -O-CH2-, и Z представляет собой CH или CR2, является способ, включающий стадию внутримолекулярной циклизации по методу Гека, где соединение формулы (V),
где A' представляет собой 5-, 6- или 7-членный циклический амин с двойной связью по атому углерода, указанному стрелкой, P1 представляет собой защитную группу, выбранную из -CO2-бензила и -CO2-(1-4C)алкила (предпочтительно -CO2-бензила), Bn представляет собой бензил, и BnO-группа может быть присоединена на одном из участков, отмеченных знаком #, преобразовывают в подходящем растворителе при повышенной температуре (например, в N-метил-2-пирролидоне (NMP) при 140°C), в присутствии карбоната серебра (предпочтительно в 1-2 молярных количествах в расчете на количество соединения V) и катализатора Германна-Беллера (1-10% моль., предпочтительно 3-6% моль.) в соединение формулы (VI)
где A" представляет собой 5-, 6- или 7-членный циклический амин с двойной связью в положении, смещенном на одно или (временно) два положения - в зависимости от положения атома азота в кольце - относительно кольца A', с последующим осуществлением следующих стадий способа (таких как первая процедура удаления защиты и восстановление с получением соединения в соответствии с формулой (IV)) с получением соединения формулы (I).
Термин галоген относится к фтору, хлору, брому или иоду. Предпочтительные галогены представляют собой фтор и хлор и, в частности, хлор.
Термины (1-6C) и (1-4C)алкил означают разветвленную или неразветвленную алкильную группу, содержащую 1-6 и 1-4 атомов углерода, соответственно, например, метил, этил, пропил, изопропил и бутил. Предпочтительная алкильная группа представляет собой метил.
Термин (1-4C)алкокси означает алкоксигруппу, содержащую 1-4 атома углерода, где алкильная группа имеет значение, определенное выше. Предпочтительная алкоксигруппа представляет собой метокси.
Термины (1-4C)алкилен и (Cn-алкилен) означают разветвленную или неразветвленную алкиленовую группу, содержащую 1-4 или n атомов углерода, соответственно, например, метилен, -CHCH3-, -C(CH3)2-, -CHCH3CH2- и подобные. В определении R3, который представляет собой (1-4C)алкилен-R4, один или несколько атомов углерода в алкиленовой группе может быть (среди прочих) независимо замещен группой (CH2)2 с образованием циклопропильной группы, т.е. с образованием R3 группы, такой как
Термин (2-4C)алкинил означает разветвленную или неразветвленную алкинильную группу, содержащую 2-4 атома углерода, где тройная связь может присутствовать в разных положениях в группе, например, этинил, пропаргил, 1-бутинил, 2-бутинил и т.п.
Термины 5-, 6- или 7-членный циклический амин, используемые в определении формулы (I), относятся к пирролидинилу, пиперидинилу и гексаметилениминильным структурам, соответственно.
Термин (3-6C)циклоалкил означает циклическую алкильную группу, содержащую 3-6 атомов углерода, такую как циклопропил, циклобутил, циклопентил или циклогексил. Предпочтительными являются циклопентил и циклогексил.
Термин (4-6C)циклоалкенил означает циклическую алкенильную группу, содержащую 4-6 атомов углерода и включающую одну или две двойные связи, например, циклогексенил.
Термин (3-6C)циклоалкилен означает циклическую алкильную группу, имеющую две точки присоединения. Предпочтительным является 1,3-циклобутилен, имеющий структуру
Термин (8-10C)бициклическая группа означает конденсированную кольцевую систему из двух групп, выбранных из ароматических и неароматических кольцевых структур, содержащих вместе 8-10 атомов углерода, например, - и в частности - индановая группа.
Термин моноциклический гетероцикл охватывает моноциклические гетероарильные группы и неароматические гетеромоноциклические группы, например фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, триазолил, оксадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил, тетрагидрофуранил, тетрагидропиранил, диоксанил, морфолинил и подобные.
Термин бициклический гетероцикл охватывает бициклические гетероарильные группы и неароматические гетеробициклические группы, например, индолил, индазолил, изоиндолил, индолизинил, бензимидазолил, имидазотиазолил, имидазопиридинил, бензофуранил, дигидробензофуранил, бенздиоксанил, хинолинил, изохинолинил, хинолизинил, тетрагидроизохинолинил и подобные.
Со ссылкой на заместители, термин "независимо" означает, что заместители в одной и той же молекуле могут быть одинаковыми или отличными друг от друга.
Соединения по настоящему изобретению могут содержать один или несколько асимметрических центров и, таким образом, могут существовать в виде рацематов и рацемических смесей, отдельных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров.
Дополнительные асимметрические центры могут присутствовать в зависимости от природы различных заместителей в молекуле. Каждый такой асимметрический центр независимо будет образовывать два оптических изомера, и предполагается, что все из возможных оптических изомеров и диастереомеров в смесях и в виде чистых или частично очищенных соединений включены в объем настоящего изобретения. Настоящее изобретение охватывает все такие изомерные формы этих соединений. Независимый синтез этих диастереомеров или их хроматографические разделения можно осуществить, как это известно из уровня техники, путем соответствующей модификации методологии, раскрытой в настоящей заявке. Их абсолютную стереохимию можно определить при помощи рентгеновской кристаллографии кристаллических продуктов или кристаллических промежуточных соединений, которые подвергают дериватизации, если это необходимо, с использованием реагента, содержащего асимметрический центр известной абсолютной конфигурации. Если желательно, рацемические смеси соединений можно разделить с выделением, таким образом, индивидуальных энантиомеров. Разделение можно осуществить способами, хорошо известными из уровня техники, такими как объединение рацемической смеси соединений с энантиомерно чистым соединением с образованием диастереомерной смеси, с последующим разделением индивидуальных диастереомеров стандартными способами, такими как фракционированная кристаллизация или хроматография.
Соединения могут существовать в виде полиморфов, и в таком виде они включены в настоящее изобретение. Кроме того, соединения могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями, и предполагается, что такие сольваты также охватываются объемом настоящего изобретения.
Изотопно-меченное соединение формулы (I) или его фармацевтически приемлемые соли, включая соединения формулы (I), изотопно-меченные для возможности их детекции PET или SPECT, также охватываются объемом настоящего изобретения. Это также относится к соединениям формулы (I), меченным [13C]-, [14C]-, [3H]-, [18F]-, [125I]- или другими изотопно обогащенными атомами, подходящих для исследований связывания с рецептором или метаболизма.
Термин "фармацевтически приемлемая соль" относится к таким солям, которые, согласно разумной медицинской оценке, являются подходящими для использования в контакте с тканями человека и низших животных без излишней токсичности, раздражения, аллергических реакций и т.п., и соответствуют разумному соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны из уровня техники. Они могут быть получены in situ при выделении и очистке соединений по настоящему изобретению или отдельно путем взаимодействия с фармацевтически приемлемыми нетоксичными основаниями или кислотами, включая неорганические или органические основания и неорганические или органические кислоты.
Соединения по настоящему изобретению можно вводить энтерально или парентерально. Точная доза и режим введения этих соединений и содержащих их композиций зависят от биологической активности соединения per se, возраста, массы тела и пола пациента, потребностей конкретного субъекта, которому вводят лекарственное средство, степени заболевания или необходимости в лекарственном средстве и мнения лечащего врача. Как правило, парентеральное введение требует более низких доз по сравнению с другими способами введения, которые в большей степени зависят от адсорбции. Однако дозы для человека предпочтительно составляют 0,001-10 мг на кг массы тела. Как правило, энтеральные и парентеральные дозы должны находиться в пределах от 0,1 до 1000 мг в день общего количества активных ингредиентов.
После смешивания с фармацевтически подходящими вспомогательными веществами, например, как описано в справочнике "Remington, The Science and Practice of Pharmacy" (21st edition, Lippincott Williams & Wilkins, 2005, см., в частности, часть 5: Pharmaceutical Manufacturing), соединения можно подвергнуть прессованию с получением твердой лекарственной формы, такой как пилюли или таблетки, или подвергнуть переработке с получением капсул или суппозиториев. С использованием фармацевтически подходящих жидкостей соединения также можно применять в форме раствора, суспензии или эмульсии.
Для получения отдельных дозируемых единиц, например, таблеток, предусматривается использование традиционных добавок, таких как наполнители, красители, полимерные связующие и подобные. Как правило, можно использовать любую фармацевтически подходящую добавку, которая не оказывает негативного влияния на функцию активных соединений.
Подходящие носители, с которыми можно вводить соединения по настоящему изобретению, включают, например, лактозу, крахмал, производные целлюлозы и т.п. или смеси таких веществ, используемые в подходящих количествах. Композиции для внутривенного введения могут представлять собой, например, растворы соединений по настоящему изобретению в стерильном изотоническом водном буфере. Если необходимо, внутривенные композиции могут включать, например, солюбилизирующие вещества, стабилизаторы и/или местный анестетик для облегчения боли в месте инъекции.
Фармацевтические композиции по настоящему изобретению могут быть сформулированы для любого пути введения и включать по меньшей мере одно соединение по настоящему изобретению или его фармацевтически приемлемую соль с любым фармацевтически подходящим ингредиентом, эксципиентом, носителем, адъювантом или наполнителем.
Под "фармацевтически подходящим" подразумевается, что носитель, разбавитель или эксципиент должен быть совместимым с другими ингредиентами композиции и не должен быть вредным для его реципиента.
В одном варианте воплощения настоящего изобретения обеспечивается фармацевтическая упаковка или набор, включающий один или несколько контейнеров, заполненных одной или несколькими фармацевтическими композициями по настоящему изобретению. К такому контейнеру(контейнерам) могут прилагаться различные текстовые материалы, такие как инструкции по применению или уведомление в форме, установленной правительственным органом, регулирующим производство, применение или продажу фармацевтических продуктов, где такое уведомление отражает одобрение этим органом производства, применения или продажи для введения человеку или применения в ветеринарии.
Если не определено иное, все технические и научные термины, используемые в настоящей заявке, имеют такое же значение, которое известно специалистам из уровня техники, к которому относится настоящее изобретение. Хотя способы и вещества, подобные или эквивалентные тем, которые описаны в настоящей заявке, можно использовать для практического осуществления или испытания настоящего изобретения, подходящие способы и вещества описаны в настоящем документе.
Подписи к рисунку
Фиг. 1 Процент изменения у молодых и старых самцов мышей C57BL/6J в Т-образном лабиринте с использованием либо носителя (контрольные группы), либо соединения по настоящему изобретению (доза в мг/кг; п.о.)
Следующие примеры предназначены для дальнейшей более подробной иллюстрации настоящего изобретения.
Любое новое промежуточное соединение, раскрытое в настоящей заявке, представляет собой еще один вариант воплощения настоящего изобретения.
ПРИМЕРЫ
§1. (АНАЛИТИЧЕСКИЕ) СПОСОБЫ
Спектры ядерного магнитного резонанса (1Н ЯМР) определяли в указанном растворителе с использованием Bruker Avance-I 400 с 9,4T магнита (1Н: 400 МГц, 13C: 100 МГц), снабженного BBI инверсивной широкополосной измерительной головкой с Z-градиентом и ATM, или Bruker Avance-DRX 600 с 14.1T магнитом, снабженного TXI инверсивным тройным резонансным криозондом с Z-градиентом и ATM, при 300 K, если не указано иное. Спектры определяли в дейтерированном хлороформе (CDCl3) с 99,8% атом. D; или в диметилсульфоксиде-d6 (ДМСО-d6), содержащем 0,03% об./об. тетраметилсилана; оба от компании Aldric. Химические сдвиги (δ) указаны в миллионных долях (м.д.) ниже от области тетраметилсилана. Константы взаимодействия J указаны в Гц. Конфигурации пиков в спектрах ЯМР указаны символами 'кв.' (квартет), 'д.кв.' (двойной квартет), 'т' (триплет), 'дт' (двойной триплет), 'д' (дублет), 'дд' (двойной дублет), 'с' (синглет), 'шир.с' (широкий синглет) и 'м' (мультиплет). NH и OH сигналы определяли после смешивания образца с каплей D2O.
Температуры плавления записывали на устройстве для определения температур плавления Bϋchi B-545.
Все реакции с участием влагочувствительных соединений или условий осуществляли в безводной атмосфере азота.
Реакции отслеживали с использованием тонкослойной хроматографии (ТСХ) на покрытых диоксидом кремния пластиковых пластинах (Merck с предварительным покрытием силикагелем 60 F254) с использованием указанного элюента. Визуализацию пятен осуществляли при помощи УФ освещения (254 нм) или I2.
Жидкостная хроматография - Масс-спектрометрия (ЖХ-МС)
Система A: Колонка: Acquity UPLC BEH C18 1,7 мкм, 50×2,1 мм с 1,7 мкм частицами. Колонку терморегулируют в колоночной печи при 45°C.
Детекция: Диодная матрица, от 210 до 260 нм
| Стадия | Общее время (мин) | Скорость потока (мкл/мин) | А% | B% |
| 0 | 0 | 800 | 95 | 5 |
| 1 | 0,1 | 800 | 95 | 5 |
| 2 | 4,5 | 800 | 10 | 90 |
| 3 | 5 | 800 | 10 | 90 |
| 4 | 5,01 | 800 | 95 | 5 |
A=99,9% Вода с 0,1% CH3COOH
B=99,9% CH3CN с 0,1% CH3COOH
Система B: Колонка: Waters Sunfire C18, 30×4,6 мм с 2,5 мкм частицами. Колонку терморегулируют в колоночной печи при 23°C.
Детекция: УФ/VIS измерительное устройство с длиной волны установленной на 254 нм + испарительный светорассеивающий детектор, работающий при 70° Цельсия и давлении N2 1,7 бар.
| Стадия | Общее время (мин) | Скорость потока (мкл/мин) | А% | B% |
| 0 | 0 | 1800 | 95 | 5 |
| 1 | 1,8 | 1800 | 0 | 100 |
| 2 | 2,6 | 1800 | 0 | 100 |
| 3 | 2,8 | 1800 | 95 | 5 |
| 4 | 3,0 | 1800 | 95 | 5 |
A=99,9% Вода с 0,1% HCOOH
B=99,9% CH3CN с 0,1% HCOOH
Указанное время удерживания (Rt), для Системы B, указано для пика на хроматограмме Общего Ионного Тока (TIC), который показывает массу для [M+H]+ в пределах погрешности 0,5 amu (атомные единицы массы) рассчитанного точного значения MW и имеет ассоциированный пик на хроматограмме Испарительного Светорассеивания (ELS) с относительным % площади (чистота) >85%.
§2. ОБЩИЕ АСПЕКТЫ СИНТЕЗА
Аббревиатуры
ACE-Cl 1-Хлорэтилхлорформиат
9-BBN 9-борабицикло[3.3.1]нонановый димер
CHC13 Хлороформ
CH2C12 Дихлорметан
CH3CN Ацетонитрил
CuBr2 Бромид меди(II)
DBU 1,8-Диазабицикло[5.4.0]ундец-7-ен
DIAD Диизопропилазодикарбоксилат
DIPEA N,N-Диизопропилэтиламин
DMF N,N-диметилформамид
DMSO Диметилсульфоксид
Et3N Триэтиламин
Et2O Диэтиловый эфир
EtOH Этанол
EtOAc Этилацетат
HC1 Хлористый водород
K2CO3 Карбонат калия
KHCO3 Бикарбонат калия
KI Иодид калия
KOH Гидроксид калия
KOtBu трет-бутоксид калия
MeOH Метанол
NaBH4 Боргидрид натрия
NaHCO3 Бикарбонат натрия
NaI Иодид натрия
NaOH Гидроксид натрия
NaOtBu трет-бутоксид натрия
Na2SO4 Сульфат натрия
NBS N-Бромсукцинимид
iPr2O Диизопропиловый эфир
КТ Комнатная температура
SiO2 Силикагель
TFA Трифторуксусная кислота
ТГФ Тетрагидрофуран
TMSCl Хлортриметилсилан
TMSOTf Триметилсилилтрифторметансульфонат
Подходящий синтез заявленных соединений и промежуточных соединений, содержащих пиперидиновые группы, осуществляли способами, описанными ниже; см. схему 1.
Синтез начинается с подходящим образом замещенного 2-бромфенола. Подходяще замещенные 2-бромфенолы являются коммерчески доступными, или их можно получить из других коммерчески доступных 2-бромфенолов. Соединение типа 1 можно преобразовать в соединение 3 путем взаимодействия с (1-бензил-1,2,3,6-тетрагидропиридин-4-ил)метанолом в присутствии трифенилфосфина и подходящего азо-реагента, такого как диизопропилазодикарбоксилат, в растворителе, таком как тетрагидрофуран или дихлорметан. Последующее преобразование соединения 3 в соединение 4 осуществляют Bu3SnH-опосредованным способом в присутствии AIBN и в растворителе, таком как бензол или толуол, в условиях нагревания до температуры кипения с обратным холодильником и/или в условиях микроволнового облучения. Удаление защиты у метокси-замещенного производного (соединение 4) можно осуществить с использованием HBr в уксусной кислоте, в условиях нагревания до температуры кипения с обратным холодильником, с получением 1'-бензил-2H-спиро[1-бензофуран-3,4'-пиперидин]-6-ола и/или соответствующего -5-ол аналога (5). Последующее O-алкилирование можно осуществить с использованием подходящего алкилирующего агента, такого 1-бромоктан или бензилбромид, в растворителях, таких как диметилсульфоксид (DMSO), ацетон, метанол или ацетонитрил, в присутствии основания, такого как гидроксид калия или карбонат калия, при температурах в пределах от 0°C до 60°C. Удаление N-бензильной группы в (например) соединении 1'-бензил-6-(октилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] (6) можно осуществить путем взаимодействия с ACE-Cl в растворителе, таком как 1,2-дихлорэтан, с последующим взаимодействием промежуточного карбамата с метанолом.
Полученные спиропиперидины (7) можно подвергнуть взаимодействию с эфиром (мет)акриловой кислоты в так называемой реакции присоединения по Михаэлю, в растворителе, таком как ацетонитрил, метанол или N,N-диметилформамид, при температурах в пределах от комнатной температуры до 85°C и с добавлением в конце некоторого количестве основания, такого как триэтиламин или 1,8-диазабицикло[5.4.0]ундец-7-ен, с получением соответствующих трет-бутил спиропиперидин пропаноатов (8) и -2-метилпропаноатов (9). Спиропиперидины также можно подвергнуть взаимодействию с подходящим алкилирующим реагентом, таким как трет-бутилбромацетат или трет-бутиловый эфир 4-броммасляной кислоты, в присутствии основания, такого как карбонат калия или карбонат цезия, в растворителе, таком как ацетонитрил и/или тетрагидрофуран, при комнатной температуре, с получением соединений типа 10 и 11. Соединения типа 12 можно получить через восстановительное аминирование с использованием 3-оксоциклобутан-1-карбоксилата в растворителе, таком как дихлорэтан или ТГФ, в присутствии триацетоксиборгидрида натрия.
Соединения типа 7-12 можно преобразовать в конечные соединения (I) путем щелочного или кислотного гидролиза сложного эфира, в зависимости от природы группы R1. В качестве примера, трет-бутиловые сложные эфиры можно обработать кислотой, такой как трифторуксусная кислота или хлористый водород, в растворителе, таком как CH2Cl2 или 1,4-диоксан, при комнатной температуре. В качестве еще одного примера, эти сложные эфиры можно обработать основанием, таким как гидроксид натрия или гидроксид лития, в растворителях, таких как этанол, ТГФ и/или вода, при температурах в пределах от комнатной температуры до 70°C.
В качестве еще одного примера, удаление обеих бензильных групп в соединении 1'-бензил-6-(бензилокси)-2H-спиро[1-бензофуран-3,4'-пиперидин] (4) (схема 2) можно осуществить путем гидрирования в растворителе, таком как этанол, и с использованием катализатора, такого как гидроксид палладия. Полученный спиропиперидин (13) можно подвергнуть взаимодействию с эфиром (мет)акриловой кислоты с получением трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноата (14A) и трет-бутил 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}-2-метилпропаноата (14B). Эти соединения могут быть модифицированы следующим образом: Путем взаимодействия с подходящим алкилирующим реагентом, таким как алкилбромид или алкилхлорид, в присутствии основания, такого как карбонат калия или карбонат цезия, в растворителе, таком как ацетонитрил и/или тетрагидрофуран, при комнатной температуре, с получением соединений типа 8 и 9. Альтернативно, 14A/B можно преобразовать в соединение типа 8 и 9 путем взаимодействия с подходящим спиртом, в присутствии трифенилфосфина и подходящего азо-реагента, такого как диизопропилазодикарбоксилат, в растворителе, таком как тетрагидрофуран или дихлорметан. Кроме того, 3-{6-гидрокси-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат можно преобразовать в трет-бутил 3-{6-(6-фенокси)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил}пропаноат (соединение типа 15) с использованием бромбензола и смеси ацетата палладия(II), моногидрата трехосновного фосфата калия, 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенила и фенилбороновой кислоты при 100°C, предпочтительно в течение ночи.
В другом примере и, например, из соединения 14A, соответствующий трет-бутил 3-{6-[(трифторметан)-сульфонилокси]-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат (16) можно получить с использованием трифторметансульфонимида и основания, такого как триэтиламин, в растворителе, таком как хлороформ, которое можно преобразовать в трет-бутил 3-[6-(ацетилсульфанил)-2H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил]пропаноат (20, схема 3) (van den Hoogenband A.Tetrahedron Letters 2010, 51, 6877), с использованием (R)-1-[(1SP)-2-(дициклогексилфосфино)-ферроценил]этилди-трет-бутилфосфина, (CyPF-t-Bu) и трис-(дибензилиден-ацетон)-дипалладия(0) в присутствии тиоацетата калия. Это осуществляют в растворителе, таком как толуол, при повышенной температуре. S-ацетил-защищенное производное (20) может быть гидролизовано, например, с использованием гидроксида натри