Комбинация сиросингопина и митохондриальных ингибиторов для лечения рака и для иммуносупрессии
Иллюстрации
Показать всеГруппа изобретений относится к медицине, фармакологии, фармацевтике и включает фармацевтическую композицию и комбинацию сиросингопина (СС) и митохондриального ингибитора (МИ), где указанный митохондриальный ингибитор представляет собой метформин или фенформин. Соотношение количеств (мас./мас.) СС и МИ может составлять от 1 к 10 до 1 к 1000. Данная комбинация может быть применена при лечении таких видов рака, как карцинома, саркома, лейкоз, миелома, лимфома, различные типы рака нервной системы, или аутоиммунных заболеваний кожи, нервной системы, соединительной ткани, мышц, кроветворной системы, костной ткани и внутренних органов, в качестве иммуносуппрессорной терапии. Группа изобретений также включает способ определения, является ли раковая клетка чувствительной к лечению СС. Для этого (а) получают суспензию одиночных клеток, культивируют раковые клетки в приемлемых средах, (б) инкубируют раковую клетку с СС, (в) инкубируют раковую клетку, полученную на стадии (б), с положительно заряженным флуоресцентным красителем, (г) измеряют интенсивность возбужденной флуоресценции и (д) сравнивают интенсивность флуоресценции, измеренную на стадии (г), с интенсивностью флуоресценции раковой клетки, которую инкубировали только с положительно заряженным флуоресцентным красителем. При этом относительное увеличение интенсивности флуоресценции раковых клеток, предварительно инкубированных с СС, свидетельствует, что клетки чувствительны к обработке СС. Группа изобретений также включает способ лечения рака или аутоиммунного заболевания путем введения теплокровному животному комбинации или композиции СС и указанного МИ в количестве, эффективном в отношении указанного заболевания. Упомянутые комбинации и композиции обеспечивают при использовании синергетический эффект в отношении упомянутых нарушений, прогноз которого, в свою очередь, может быть обеспечен реализацией указанного способа прогнозирования чувствительности раковой клетки к СС. 5 н. и 9 з.п. ф-лы, 12 ил., 1 пр., 1 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к комбинации сиросингопина и митохондриального ингибитора, например метформина или олигомицина, и применению комбинации сиросингопина и митохондриального ингибитора для лечения рака и для достижения клинической иммуносупрессии.
Предпосылки создания изобретения
Для противораковой терапии применяют комбинацию терапевтических вмешательств, таких как хирургия, лучевая терапия и химиотерапия. Хирургию и лучевую терапию, как правило, применяют локально в отношении основной области, в которой происходит рост опухоли, а химиотерапию используют для предупреждения повторного роста опухоли или в отношении удаленных опухолевых очагов. Химиотерапевтические средства применяют также для снижения роста опухолей с целью контроля развития болезни, когда не применяют лучевую терапию или хирургию.
Иммунодепрессанты применяют в клинических условиях для подавления патологической иммунной реакции, мишенью которой является собственный организм (аутоиммунитет), или иммунных гиперреакций, наблюдаемых при аллергии. Их применяют также для лечения отторжения трансплантата, вызываемого иммунной системой. Основой иммунных ответов является активация и пролиферация Т-клеток после антигенной стимуляции, которые в свою очередь действуют в качестве клеток-хелперов для В-клеток, регуляторных клеток или эффекторных клеток. Иммунодепрессанты, такие как рапамицин или циклоспорин А, действуют посредством ингибирования на ранней фазе Т-клеточной активации/пролиферации. Поскольку клеточная пролиферация имеет место, как при раке, так и при иммунных ответах, то некоторые средства, например рапамицин или его аналоги, которые первоначально применяли для иммуносупрессии, позднее нашли применение в качестве противораковых средств (Recher и др., Blood, 105, 2005, cc.2527-2534).
Химиотерапевтические лекарственные средства наиболее эффективно используют при осуществлении комбинированной терапии. Основная идея заключается в применении лекарственных средств с различными механизмами действия для снижения вероятности развития устойчивости раковых клеток к лекарственным средствам. Комбинированная терапия позволяет также в случае определенных комбинаций лекарственных средств применять оптимальную объединенную дозу для минимизации побочных действий. Это имеет решающее значение, поскольку мишенью действия стандартных химиотерапевтических средств являются основные клеточные процессы, такие как репликация ДНК, деление клеток или индукция повреждения ДНК, и поэтому они обладают общим цитотоксическим действием. И, наконец, комбинированное применение двух соединений может приводить к возникновению неожиданного синергизма и запускать действия, которые не индуцируются соединением при его индивидуальном применении. В последние годы лекарственные средства применяют также в качестве неоадъювантов, т.е. перед хирургическим вмешательством, для снижения массы опухоли или для повышения продолжительности выживания.
Сиросингопин представляет собой синтетическое производное резерпина, обладающее гипотензивным и антипсихотическим действием средство (J.A.M.A., т.170, №.17, 22 августа, 1959, с.2092). Сиросингопин начали применять в клинической практике в конце 1950-х годов. В настоящее время резерпины применяют редко, поскольку разработаны улучшенные лекарственные средства с меньшими побочными действиями. Резерпин действует посредством ингибирования везикулярного транспорта моноаминов, что приводит к истощению катехоламина, и указанный механизм действия, вероятно, характерен для всех производных резерпина с гипотензивным действием. Сиросингопин, несмотря на то, что его применяли в клинических условиях, изучен относительно слабо по сравнению с резерпином, и его никогда не исследовали в качестве противоракового средства.
Митохондрии содержат систему производства энергии в клетке, посредством которой электроны, образовавшиеся в результате метаболизма, проходят через комплексы I-IV электрон-транспортной цепи (ЭТЦ), приводя к вытеснению протонов из комплексов I, III и IV и к оттоку протонов через комплекс V, что сопровождается образованием химической энергии в форме аденозинтрифосфата (АТФ). Кислород служит в качестве конечного акцептора электронов и восстанавливается с образованием Н2О. Основную роль в этом процессе играет внутренняя митохондриальная мембрана, поскольку протоны, вытесняемые из комплексов, проходят через матрикс в этой мембране в межмембранное пространство, создавая положительный мембранный потенциал 150-200 мВ. Красители, такие как TMRM (сложный метиловый эфир тетраметилродамина), проходят через указанную мембрану и накапливаются в митохондриальном матриксе, при этом интенсивность флуоресцентного сигнала зависит от величины мембранного потенциала. Ряд хорошо изученных агентов ингибирует митохондриальную функцию, и их можно рассматривать в качестве обладающих токсичностью для митохондрий агентов. Так называемые разобщающие агенты, такие как FCCP (карбонилцианид-пара-трифторметоксифенилгидразон), разобщают поток протонов и синтез АТФ, это приводит к падению мембранного потенциала, в результате чего снижается синтез АТФ. Ряд хорошо изученных митохондриальных ингибиторов оказывает направленное воздействие на различные комплексы ЭТЦ, к ним относятся метформин, ротенон, эпиберберин, пиерицидин А (все являются ингибиторами комплекса I), малонат натрия и теноилтрифторацетон (ингибиторы комплекса II), антимицин А (ингибитор комплекса III), цианид калия и азид натрия (ингибиторы комплекса IV) и олигомицин (ингибитор комплекса V). Митохондрии, по-видимому, возникли в результате захвата примитивными клетками бактерий. Они содержат ДНК-геном, кодирующий несколько компонентов ЭТЦ, а также компоненты митохондриальной рибосомы. Агенты, оказывающие направленное воздействие на митохондриальный геном, такие как некоторые ингибиторы ВИЧ из класса нуклеозидных аналогов, например ставудин (D4T), являются токсичными для митохондрий, поскольку они в конце концов разрушают ЭТЦ и митохондриальную систему преобразования энергии.
Метформин представляет собой бигуанидное лекарственное средство, широко применяемое при диабете типа 2. Он родственен буформину и фенформину, двум бигуанидным производным, которые уже не применяют при диабете из-за их токсичности. Метформин является безопасным и хорошо переносимым и применяется для пролонгированного лечения диабета в течение более 50 лет и является наиболее часто предписываемым антидиабетическим лекарственным средством во всем мире. Основным клиническим благоприятным действием метформина при лечении диабета типа 2 является его способность подавлять глюконеогенез в печени, что приводит к снижению гипергликемии и улучшает чувствительность к инсулину; эти действия, вероятно, определяются метформин-зависимой стимуляцией активности АМФ-активируемой протеинкиназы (АМРК). Основой для такого действия является то, что метформин и другие бигуаниды ингибируют комплекс I дыхательной цепи (электрон-транспортной цепи) митохондрий (El-Mir и др., J Biol Chem, 275, 2000, cc.223-228). Мета-анализ, в котором сравнивали страдающих диабетом пациентов, получавших метформин, и пациентов, получавших неродственное антидиабетическое средство, продемонстрировал, что у получающей метформин группы имела место более низкая частота встречаемости рака (Evans и др., BMJ, 330, 2005, cc.1304-1305; Bowker и др., Diabetes Care, 29, 2006, cc.254-258). Эти данные стимулировали современное исследование, касающееся возможности применения метформина в качестве противоракового средства или профилактического средства, в рамках которого в настоящее время проводятся многочисленные исследования и опыты (см. Gonzalez-Angulo и др., Clin Cancer Res, 16, 2010, cc.1695-1700).
Краткое изложение сущности изобретения
В настоящем изобретении предложена комбинация сиросингопина и митохондриального ингибитора, например, метформина (и родственных бигуанидов фенформина и буформина) или олигомицина, и фармацевтические композиции, содержащие сиросингопин и митохондриальный ингибитор.
Изобретение относится также к применению комбинации сиросингопина и митохондриального ингибитора, например метформина (и родственных бигуанидов фенформина и буформина) или олигомицина, и фармацевтических композиций, содержащих сиросингопин и митохондриальный ингибитор, для лечения рака, в частности для лечения карциномы, лейкоза, миеломы и лимфомы, и для достижения иммуносупрессии в случае аутоиммунитета, в связанной с трансплантацией области медицины и в других случаях, когда требуется иммуносупрессия, например при болезнях кожи, в частности при псориазе, заболеваниях нервной системы, в частности при рассеянном склерозе, и заболеваниях гематопоэтической системы, в частности при анемиях; к применению комбинации сиросингопина и митохондриального ингибитора, например метформина (и родственных бигуанидов фенформина и буформина) или олигомицина, для приготовления фармацевтической композиции, предназначенной для лечения рака и достижения иммуносупрессии, и к способам лечения рака и достижения иммуносупрессии с использованием комбинации сиросингопина и митохондриального ингибитора, например метформина (и родственных бигуанидов фенформина и буформина) или олигомицина, или фармацевтических композиций, содержащих сиросингопин и митохондриальный ингибитор.
Кроме того, изобретение относится к способу определения, является ли раковая клетка чувствительной к лечению содержащей сиросингопин комбинацией.
Краткое описание чертежей
Фиг.1: Метформин и сиросингопин обладают синергетическим действием в отношении уничтожения опухолевых клеток in vitro
А-З: - различные клеточные линии. М обозначает метформин, S обозначает сиросингопин.
Анализ клеточной пролиферации по превращению реагента AlamarBlue
Клетки высевали в 96-луночные титрационные микропланшеты и добавляли соединения в указанной концентрации. Плотность высеянных клеток составляла от 5000 до 15000 клеток на лунку, и ее определяли эмпирически для каждого типа клеток. Планшеты инкубировали в течение 3 дней и оценивали пролиферацию по превращению AlamarBlue. Рост стандартизовали относительно необработанных контролей и выражали в виде процентов (Y-ось). На панелях А-Д представлены кривые ингибирования, полученные для панели чувствительных клеток, а на панели Е представлена кривая роста, полученная для нечувствительных клеток фибросаркомы линии НТ1080. На панелях Ж-З представлены результаты, полученные с использованием незлокачественных здоровых линий человеческих фибробластов (Fib3 и Fib4). Для каждой клеточной линии на левой панели представлены результаты титрации, полученные с использованием различных концентраций метформина, при этом пунктирной вертикальной линией обозначена концентрация (5 мМ), отобранная для совместной обработки с сиросингопином. На правой панели представлена аналогичная кривая роста, полученная при применении только сиросингопина (сплошная линия) и при обработке сиросингопином в присутствии 5 мМ метформина (пунктирная линия). Все экспериментальные точки получены по трем повторностям.
Фиг.2: Зависимость действия от времени при длительной совместной обработке метформином и сиросингопином
Клетки линий А549 и ОРМ2 высевали, используя первоначальную плотность клеток 10000 клеток/мл и 100000 клеток/мл соответственно, и добавляли соединения (М обозначает метформин, S обозначает сиросингопин) в указанных концентрациях. В качестве контроля клетки инкубировали с растворителем (0,1% ДМСО). В указанные моменты времени из лунок отбирали образцы для подсчета клеток (d обозначает дни после обработки). Данные о плотности клеток откладывали по Y-оси (× 1000 клеток/мл).
Фиг.3: Индукция апоптоза при совместной обработке метформином и сиросингопином
Клетки линии ОРМ2 и RPMI8226 высевали с плотностью 100000 клеток/5 мл среды с добавленными соединениями. ОРМ2: 5 мкМ сиросингопин (S), 2 мМ метформин (М). RPMI8226: 2 мкМ сиросингопин (S), 1 мМ метформин (М). С (т.е. контроль) обозначает отсутствие соединения, S+M обозначает комбинацию сиросингопина и метформина. Через 3 дня собирали 500 мкл культуры, и клетки отмывали и окрашивали йодидом пропидия/аннексином V для FACS-анализа (клеточный сортер с возбуждением флуоресценции). Аннексии V является маркером апоптоза и его выявляли с использованием сшитого с ФИТЦ антитела в FL1-канале. Одновременно в FL3-канале выявляли жизнеспособные клетки на основе исключения окрашивания йодидом пропидия (PI). При измерении в каждом случае негативные по PI и аннексину V клетки представляли собой популяцию жизнеспособных клеток (белые столбики). Находящиеся на ранней стадии апоптоза клетки представляли собой PI-негативные, аннексии V-позитивные (зашрихованные столбики) клетки, а находящиеся на поздней стадии апоптоза клетки представляли собой PI-позитивные, аннексии V-позитивные (черные столбики) клетки. По Y-оси отложены в виде столбиков данные, выраженные в виде процентов от общей популяции клеток.
Фиг.4: Структурно родственное соединение резерпин не обладает синергетическим действием при применении с метформином
Клетки линий 6.5 и ОРМ2 совместно обрабатывали резерпином (R) и метформином (М) с использованием диапазона концентраций, сходного с диапазоном концентраций применявшегося параллельно сиросингопина (S). На левых панелях представлено действие резерпина на развитие пролиферации при его индивидуальном применении. На правых панелях представлены данные о ингибировании роста сиросингопином (сплошная линия) или резерпином (штриховая линия) в присутствии метформина (5 мМ). Все экспериментальные точки получены по трем повторностям. Рост стандартизовали относительно соответствующих необработанных контролей и выражали в виде процентов (Y-ось).
Фиг.5: Воздействие совместной обработки сиросингопином и метформином при анализе in vivo на мышиной модели сингенной (аутологичной) опухоли
Клетки линии 6.5 (Colombi и др., Oncogene, 30, 2011, cc.1551-1565) инъецировали в боковые области иммуносовместимых мышей линии DBA. Обработку лекарственным средством начинали, когда размер опухолей достигал 100 мм2. Мышей разделяли на группы обработки и инъецировали внутрибрюшинно ежедневно в течение 15 дней ЗФР (горизонтальные полосы), сиросингопин (S, закрашенные ромбы, 2 мг/кг веса тела), метформин (М, закрашенные треугольники, 250 мг/кг веса тела) и метформин плюс сиросингопин (S+M, перечеркнутые квадраты). Мышей умерщвляли, когда размер опухолей становился чрезмерным (день 15), и опухоли иссекали для измерения. (А) На диаграмме представлена площадь опухолей (в мм2), определяемая в процессе обработки, d обозначает дни. (Б) Средняя масса тела (г) мышей в момент умерщвления. Числами (n) над каждым столбиком обозначено количество мышей на группу обработки.
Фиг.6: Сиросингопин обладает синергетическим действием при применении с бигуанидом фенформином
Левая панель: Клетки линии 6.5 обрабатывали аналогом метформина фенформином (Р) в течение 3 дней и оценивали рост с путем анализа клеточной пролиферации. Правая панель: Клетки линии 6.5 совместно обрабатывали сиросингопин (S) и возрастающими концентрациями фенформина. Y-ось: рост (в %) относительно необработанных контролей.
Фиг.7: Совместная обработка метформином и сиросингопином ингибирует стимулированную фитогемагглютинином (РНА) Т-клеточную пролиферацию по результатам измерений в день 3
Лейкоциты периферической крови человека культивировали в присутствии фитогемагглютинина или без него. В присутствии фитогемагглютинина (правая панель) комбинация сиросингопина в возрастающих концентрациях и 4 мМ метформина выраженно ингибировала Т-клеточную пролиферацию при применении сиросингопина в низких концентрациях (штриховая линия), но не ингибировала в отсутствие метформина (сплошная линия). Без стимуляции РНА (левая панель) клетки выживали (по данным микроскопического анализа), но у них отсутствовала пролиферация в день 3. Объединение сиросингопина с метформином оказывало лишь минимальное воздействие на указанное выживание (шриховая линия).
Фиг.8: Сиросингопин обладает синергетическим действием при применении с различными ингибиторами митохондриальной функции
Осуществляли титрование сиросингопина при его применении на мышиных клетках линии 6.5 индивидуально (S, сплошные линии) или в присутствии различных ингибиторов митохондриальной функции (штриховые линии): (А) ротенон 50 нМ, (Б) пиерицидин А 1,25 нМ, (В) эпиберберин 0,625 мкМ, (Г) 2-теноилтрифторацетон (TTFA) 100 мкМ, (Д) малонат натрия 30 мМ, (Е) антимицин А 5 нМ, (Ж) KCN 5 мМ, (З) азид натрия 1,25 мМ, (И) олигомицин 1 нМ, (К) карбонилцианид-пара-трифторметоксифенилгидразон (FCCP) 10 мкМ, (Л) ставудин 200 мкМ. Клетки выращивали в присутствии различных соединений, и ингибирование роста оценивали с помощью анализа пролиферации после обработки в течение 3 дней. Каждую экспериментальную точку получали по трем повторностям, и рост стандартизовали относительно роста необработанных контролей, принятых за 100%.
Фиг.9: Ингибиторы митохондриальной функции при их индивидуальном применении не уничтожают клетки линии 6.5
Изучали воздействие различных агентов, мишенью которых являются митохондрии, на рост клеток линии 6.5 при применении в концентрациях, в которых они обладали синергетическим действием в отношении уничтожения клеток при их применении в смеси с сиросингопином. Рост стандартизовали относительно роста необработанных клеток (черный столбик), который принимали за 100%. Каждую экспериментальную точку получали по трем повторностям, и рост оценивали через 3 дня с помощью анализа пролиферации. (А) ротенон, (Б) пиерицидин А, (В) эпиберберин, (Г) 2-теноилтрифторацетон, (Д) малонат натрия, (Е) антимицин А, (Ж) KCN, (З) азид натрия, (И) олигомицин, (К) карбонилцианид-пара-трифторметоксифенилгидразон (FCCP), (Л) ставудин.
Фиг.10: Синергетическое действие в отношении уничтожения человеческих раковых клеток сиросингопина и олигомицина при их применении в субнаномолярной концентрации
Определяли рост клеток с помощью анализа клеточной пролиферации (3 дня) согласно методу, описанному для фиг.1, для (А) мышиной клеточной линии 6.5, (Б) человеческой клеточной линии промиелоцитарного лейкоза HL60 и (В) человеческой клеточной линии множественной миеломы ОРМ2. Осуществляли титрование с использованием различных концентраций сиросингопина (S) в отсутствие олигомицина (сплошная линия), в присутствии 500 пМ олигомицина (пунктирная линия) и 1 нМ олигомицина (штриховая линия).
Фиг.11: Обработка сиросингопином повышает потенциал митохондриальной мембраны в зависимости от дозы
Мышиные клетки линии 6.5 обрабатывали TMRM (сложный метиловый эфир тетраметилродамина) (панели 1-6) и предварительно инкубировали с FCCP (панель 2) и, кроме того, с сиросингопином в концентрации 0,1 мкМ (панель 3), 0,5 мкМ (панель 4), 2 мкМ (панель 5) или 5 мкМ (панель 6) и измеряли интенсивность флуоресценции. Тонкие линии: интенсивность флуоресценции контрольных клеток или обработанных FCCP клеток (панель 2). Жирными линиями обозначены данные для клеток, которые дополнительно предварительно инкубировали с сиросингопином (панели 3-6). На Х-оси откладывали интенсивность флуоресценции, на Y-оси указано относительное количество клеток. Сдвиг влево пика флуоресценции после обработки FCCP (панель 2) свидетельствует об уменьшении или потере мембранного потенциала, сдвиг вправо (панель 4-6) свидетельствует об увеличении мембранного потенциала после обработки сиросингопином (ср. жирные и тонкие линии).
Подробное описание изобретения
Изобретение относится к комбинации сиросингопина и митохондриального ингибитора, например метформина или олигомицина, и к фармацевтическим композициям, содержащим сиросингопин и митохондриальный ингибитор.
Изобретение относится также к применению комбинации сиросингопина и митохондриального ингибитора и фармацевтических композиций, содержащих сиросингопин и митохондриальный ингибитор, для лечения рака, в частности для лечения карциномы, лейкоза, миеломы и лимфомы, и для лечения иммунологических нарушений, таких как аутоиммунитет.
Согласно настоящему изобретению «митохондриальные ингибиторы» представляют собой соединения, которые снижают митохондриальную активность и обладают различной по степени токсичностью для митохондрий. К митохондриальным ингибиторам относятся так называемые разобщающие агенты, которые разобщает поток протонов от синтеза АТФ в митохондриях, и ингибиторы, мишенью которых являются различные комплексы электрон-транспортной цепи (ЭТЦ) в митохондриях, например комплекс I, комплекс II, комплекс III, комплекс IV и комплекс V электрон-транспортной цепи. Другими соединениями, которые согласно изобретению рассматриваются как митохондриальные ингибиторы, являются обладающие токсичностью для митохондрий соединения, которые оказывают направленное воздействие на митохондриальный геном.
Многие из широко применяемых лекарственных средств обладают побочными действиями, которые обусловлены токсичностью для митохондрий. Эти токсичные для митохондрий лекарственные средства согласно изобретению также рассматриваются как митохондриальные ингибиторы. Указанные обладающие токсичностью для митохондрий или являющиеся митохондриальными ингибиторами лекарственные средства обладают синергетическим действием при применении с сиросингопином и представляют собой противораковые средства при их объединении с сиросингопином. Обладающие токсичностью для митохондрий лекарственные средства применяли для лечения самых различных клинических состояний (Cohen и др., Dev Disabil Res Rev, 16, 2010, сс.189-199).
Согласно изобретению митохондриальные ингибиторы представляют собой:
лекарственные средства, применяемые при заболевании печени или желчного пузыря с побочными воздействиями на митохондрий, такие как тетрациклин, ибупрофен, амиодарон, пирпрофен, тамоксифен, вальпроат, хлороквин, квинидин, хлорпромазин, кетоконазол, циклоспорин А, рифампицин и глибурин;
ингибиторы комплекса I электрон-транспортной цепи, такие как амитал, капсаицин, галоперидол, рисперидон, метформин, буформин, фенформин, бупивакаин, лидокаин, галртан, дантролен, фенитоин, клофибрат и фенофибрат;
ингибиторы комплекса II электрон-транспортной цепи, такие как циклофосфамид и кетоконазол;
ингибиторы комплекса III электрон-транспортной цепи, такие антимицин А, ацетаминофен, изофлуран и севофлуран;
ингибиторы комплекса IV электрон-транспортной цепи, такие как цефалоридин, цефазолин и цефалотин;
ингибиторы синтеза митохондриальной ДНК, такие как AZT (итовудидин), d4T (ставудин), ddI (диданозин) и ddC (залцитабин);
разобщающие агенты окислительного фосфорилирования, такие как пентамидин, индометацин, флуоксетин, пропофол, аспирин, бубивакаин, толкапон и динитрофенол;
агенты, которые восстанавливают молекулярный кислород до супероксида посредством окислительно-восстановительного механизма, такие как доксорубицин, изониазид, гентамицин и фторхинолон; и
ингибиторы транскрипции митохондриальных генов, такие как интерферон-альфа и интерферон-гамма.
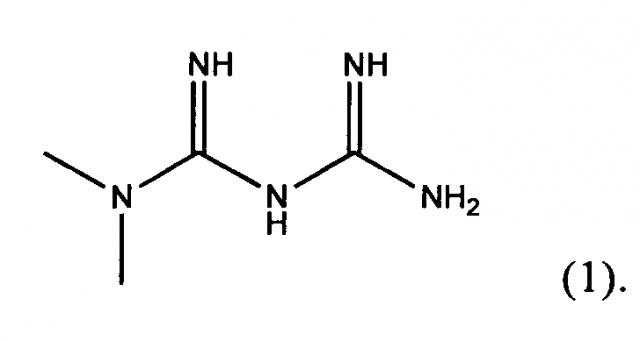
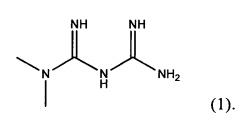
Метформин представляет собой гидрохлорид 3-(диаминометилиден)-1,1-диметилгуанидина формулы (1)
Другие рассматриваемые бигуаниды представляют собой, например, фенформин или буформин, предпочтительно фенформин.
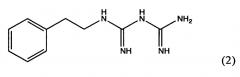
Фенформин представляет собой 1-(диаминометилиден)-2-(2-фенилэтил)гуанидин формулы (2)
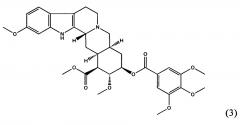
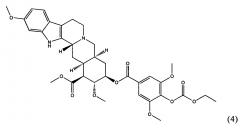
Сиросингопин является производным резерпина формулы (3),
в котором 4-метоксигруппа 3,4,5-триметоксибензоатного фрагмента резерпина замена на 4-этоксикарбонилоксигруппу, как показано в формуле (4).
Другие митохондриальные ингибиторы, для которых продемонстрировано синергетическое действие при применении с сиросингопином, представляют собой:
(5А) ротенон (ингибитор комплекса I митохондриальной электрон-транспортной цепи):
(5Б) пиерицидин А (ингибитор комплекса I):
(5В) эпиберберин (ингибитор комплекса I):
(5Г) 2-теноилтрифторацетон (ингибитор комплекса II):
(5Д) малонат натрия (ингибитор комплекса II): CH2(COONa)2,
(5Е) антимицин А (ингибитор комплекса III):
(5Ж) цианид калия (ингибитор комплекса IV): KCN,
(5З) азид натрия (ингибитор комплекса IV): NaN3,
(5И) олигомицин (ингибитор комплекса V):
(5К) карбонилцианид-пара-трифторметоксифенилгидразон (FCCP) (разобщающий агент митохондриальной мембраны):
и (5Л) ставудин (митохондриальный генотоксический агент):
Благодаря близкому сходству между основными соединениями и их кислотно-аддитивными солями, можно считать, что метформин, фенформин и другие митохондриальные ингибиторы, имеющие основный атом азота, представляют собой свободное основание или любую его кислотно-аддитивную соль. Малонат натрия, цианид калия и азид натрия являются эквивалентами других солей щелочных металлов, таких, например, как малонат калия, цианид натрия, азид калия, или также их аммониевых солей. Катионное соединение эпиберберин (5В) может нести любой фармацевтически приемлемый анион, например хлорид, кислый сульфат, метансульфонат или первичный кислый фосфат.
Аналогично этому, сиросингопин означает свободное основание или любую его кислотно-аддитивную соль. Соли предпочтительно представляют собой фармацевтически приемлемые соли сиросингопина.
Указанные соли образуются, например, в виде кислотно-аддитивных солей, предпочтительно с органическими или неорганическими кислотами. Приемлемыми неорганическими кислотами являются, например, галогенводородные кислоты, такие как соляная кислота, серная кислота или фосфорная кислота. Приемлемыми органическими кислотами являются, например, карбоновые, фосфоновые, сульфоновые или сульфаминовые кислоты, например уксусная кислота, пропионовая кислота, октановая кислота, декановая кислота, додекановая кислота, гликолевая кислота, молочная кислота, фумаровая кислота, янтарная кислота, адипиновая кислота, пимелиновая кислота, субериновая кислота, азелаиновая кислота, яблочная кислота, винная кислота, лимонная кислота, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота, малеиновая кислота, гидроксималеиновая кислота, метилмалеиновая кислота, циклогексанкарбоновая кислота, адамантанкарбоновая кислота, бензойная кислота, салициловая кислота, 4-аминосалициловая кислота, фталевая кислота, фенилуксусная кислота, миндальная кислота, коричная кислота, метан- или этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, этан-1,2-дисульфоновая кислота, бензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 1,5-нафталиндисульфоновая кислота, 2-, 3- или 4-метилбензолсульфоновая кислота, метилсерная кислота, этилсерная кислота, додецилсерная кислота, N-циклогексилсульфаминовая кислота, N-метил-, N-этил- или N-пропилсульфаминовая кислота или другие органические протонные кислоты, такие как аскорбиновая кислота.
Фармацевтические композиции, предлагаемые в изобретении, представляют собой, например, композиции для энтерального введения, такого как назальное, трансбуккальное, ректальное или предпочтительно оральное введение, и для парентерального введения, такого как внутривенное, внутримышечное или подкожное введение. Композиции содержат сиросингопин и митохондриальный ингибитор, например метформин или олигомицин, индивидуально или предпочтительно в сочетании с фармацевтически приемлемым носителем. Доза комбинации сиросингопина и митохондриального ингибитора зависит от подлежащего лечению заболевания и от вида пациента, его возраста, веса и индивидуального состояния, индивидуальных фармакокинетических особенностей и пути введения.
Фармацевтические композиции содержат комбинацию сиросингопина и митохондриального ингибитора, например метформина или олигомицина, в количестве от примерно 1 до примерно 95%, формы введения в виде одной дозы, содержащие в предпочтительном варианте осуществления изобретения комбинацию сиросингопина и митохондриального ингибитора в количестве от примерно 20 до примерно 90%, и формы, не относящиеся к типу однодозовых форм, которые содержат в предпочтительном варианте осуществления изобретения комбинацию сиросингопина и митохондриального ингибитора в количестве от примерно 5 до примерно 20%. Формы в виде стандартных доз представляют собой, например, таблетки с покрытием или без него, ампулы, пузырьки, суппозитории или капсулы. Другие лекарственные формы представляют собой, например, мази, кремы, пасты, пены, настойки, капли, спреи и дисперсии. Примерами являются, например, капсулы, содержащие комбинацию сиросингопина и митохондриального ингибитора в количестве от примерно 0,05 до примерно 1,0 г.
Фармацевтические композиции, предлагаемые в настоящем изобретении, приготавливают хорошо известным методом, например с помощью общепринятых процессов смешения, грануляции, нанесения покрытия, растворения или лиофилизации.
Предпочтительным является применение растворов комбинации сиросингопина и митохондриального ингибитора, например метформина или олигомицина, а также суспензий или дисперсий, прежде всего изотонических водных растворов, дисперсий или суспензий, которые, как, например, в случае использования лиофилизированных композиций, содержащих комбинацию сиросингопина и митохондриального ингибитора индивидуально или в сочетании с носителем, например маннитом, можно приготавливать перед применением. Фармацевтические композиции могут быть стерилизованы и/или могут содержать эксципиенты, например консерванты, стабилизаторы, смачивающие вещества и/или эмульгаторы, солюбилизаторы, соли для регулирования осмотического давления и/или буферы, и их приготавливают с помощью хорошо известного метода, например с помощью общепринятых процессов растворения и лиофилизации. Указанные растворы или суспензии могут содержать агенты, повышающие вязкость, как правило, натриевую соль карбоксиметилцеллюлозы, карбоксиметилцеллюлозу, декстран, поливинилпирролидон или желатины, или также солюбилизаторы, например Tween 80® (полиоксиэтилен(20)сорбитанмоноолеат).
Суспензии в масле содержат в виде масляного компонента растительные, синтетические или полусинтетические масла, которые можно применять для инъекций. В этой связи специально следует упомянуть жидкие эфиры жирных кислот, которые содержат в качестве кислотного компонента жирную кислоту с длинной цепью, имеющую от 8 до 22, прежде всего от 12 до 22 атомов углерода. Спиртовой компонент указанных эфиров жирных кислот содержит максимум 6 атомов углерода и является одновалентным или многовалентным, например одно-, двух- или трехвалентным спиртом, прежде всего, представляет собой гликоль и глицерин. В качестве смесей эфиров жирных кислот предпочтительно применять растительные масла, такие как хлопковое масло, миндальное масло, оливковое масло, касторовое масло, кунжутное масло, соевое масло и арахисовое масло.
Приготовление предназначенных для инъекций препаратов, как правило, осуществляют в стерильных условиях, как, например, в том случае, когда ими заполняют, например, ампулы или пузырьки и запечатывают контейнеры.
Приемлемыми носителями для предпочтительных твердых оральных лекарственных форм являются, прежде всего, наполнители, такие как сахара, например лактоза, сахароза, маннит или сорбит, препараты целлюлозы и/или фосфаты кальция, например трикальций фосфат или вторичный кислый фосфат кальция, а также связующие вещества, такие как крахмалы, например кукурузный, пшеничный, рисовый или картофельный крахмал, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон, и/или при необходимости разрыхлители, такие как вышеуказанные крахмалы, а также карбоксиметилкрахмал, сшитый поливинилпирролидон, альгиновая кислота или ее соль, такая как альгинат натрия. Дополнительными эксципентами являются, прежде всего, регуляторы текучести и замасливатели, например кремневая кислота, тальк, стеариновая кислота или ее соли, такие как стеарат магния или кальция, и/или полиэтиленгликоль, или их производные.
На ядра таблеток можно наносить приемлемые необязательно энтеросолюбильные покрытия, используя среди прочего, концентрированные растворы сахара, которые могут содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, или растворы для нанесения покрытия в приемлемых органических растворителях или смесях растворителей, или для получения энтеросолюбильных покрытий растворы пригодных препаратов целлюлозы, таких как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы. К таблеткам или покрытиям для таблеток можно добавлять красители или пигменты, например, с целью идентификации или для обозначения различных доз комбинации сиросингопина и митохондриального ингибитора.
Фармацевтические композиции для орального введения представляют собой также твердые капсулы, состоящие из желатина, а также мягкие запечатываемые капсулы, состоящие из желатина и пластификатора, такого как глицерин или сорбит. Твердые капсулы могут содержать комбинацию сиросингопина и митохондриального ингибитора в форме гранул, например, в смеси с наполнителями, такими как кукурузный крахмал, связующими веществами и/или веществами, улучшающими скольжение, такими как тальк или стеарат магния, и необязательно стабилизаторами. В мягких капсулах комбинация сиросингопина и митохондриального ингибитора предпочтительно растворена или суспендирована в приемлемых жидких эксципиентах, таких как жирные масла, парафиновое масло или жидкие полиэтиленгликоли или эфиры жирных кислот и этилен- или пропиленгликоля, к которым можно добавлять также стабилизаторы и поверхностно-активные вещества, например, типа эфира жирной кислоты и полиоксиэтиленсорбитана.
Фармацевтические композиции, пригодные для ректального введения, представляют собой, например, суппозитории, которые состоят из комбинации сиросингопина и митохондриального ингибитора, например метформина или олигомицина, и основы суппозитория. Приемлемыми основами суппозитория являются, например, природные или синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие жирные спирты.
Для парентерального введения наиболее приемлемыми являются водные растворы, содержащие комбинацию сиросингопина и митохондриального ингибитора, или водные предназначенные для инъекции суспензии, которые содержат повышающие вязкость субстанции, например натриевую соль карбоксиметилцеллюлозы, сорбит и/или декстран, и при необходимости стабилизаторы. Комбинация сиросингопина и митохондриального ингибитора, необязательно в сочетании с эксципиентами, может находиться также в форме лиофилизата, из которого можно приготавливать раствор перед парентеральным введением путем добавления приемлемых растворителей. Растворы, предназначенные, например, для парентерального введения, можно использовать также в качестве растворов для инфузии.
Предпочтительными консервантами являются, например, антиоксиданты, такие как аскорбиновая кислота, или бактерициды, такие как сорбиновая кислота или бензойная кислота.
С помощью исследований, описанных более подробно ниже, установлено, что комбинация митохондриального ингибитора, например, метформина формулы (1), фенформина формулы (2) или других митохондриальных ингибиторов формулы (5), в частности, олигомицина формулы (5И), и сиросингопина формулы (4), а также фармацевтические композиции, содержащие митохондриальн