Штамм бактерий escherichia coli - продуцент янтарной кислоты (варианты) и способ получения янтарной кислоты с использованием этого штамма
Иллюстрации
Показать всеПредложены варианты бактерий Escherichia coli, являющихся продуцентами янтарной кислоты. Бактерия Escherichia coli модифицирована таким образом, что гены асkА, pta, рохВ, ldhA, adhE, ptsG в ней инактивированы, экспрессия генов galP и glk усилена, и бактерия обладающий активностью пируват карбоксилазы. Также предложен вариант бактерии Escherichia coli, обладающий инактивированными генами ackA, pta, poxB, ldhA, adhE, ptsG, iclR, усиленной экспрессией генов galP и glk, и активностью пируват карбоксилазы. Также предложен вариант бактерии Escherichia coli, обладающий инактивированными генами ackA, pta, рохВ, ldhA, adhE, ptsG, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и активностью пируват карбоксилазы. Также предложен вариант бактерии Escherichia coli, обладающий инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и активностью пируват карбоксилазы. Также предложен вариант бактерии Escherichia coli, обладающий инактивированными генами асkА, pta, рохВ, IdhA, adhE, ptsG, pflB, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и активностью пируват карбоксилазы. Также предложен вариант бактерии Escherichia coli, обладающий инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, iclR, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и активностью пируват карбоксилазы. Предложен способ получения янтарной кислоты с использованием указанных вариантов. Группа изобретений обеспечивает увеличение выхода янтарной кислоты. 7 н. и 12 з.п. ф-лы, 2 табл., 2 пр.
Реферат
Настоящее изобретение относится к биотехнологии, в частности к штаммам бактерий Escherichia coli - продуцентам янтарной кислоты, способным к эффективной продукции янтарной кислоты из глюкозы, а так же к способу получения янтарной кислоты, с использованием этих штаммов, с улучшенными показателями коэффициента конверсии субстрата в целевой продукт, приближенными к максимально теоретически возможным значениям.
Янтарная кислота рассматривается как один из важнейших "строительных блоков" для получения широкого спектра химических веществ с высокой добавленной стоимостью, таких как органические растворители, пластификаторы, биодеградируемые пластики и др. (Cukalovic A., Stevens C.V., Feasibility of production methods for succinic acid derivatives: a marriage of renewable resources and chemical technology. Biofuels, Bioprod Bioref., 2008, 2(6):505-529). Потенциальный объем рынка янтарной кислоты и ее производных оценивается в 6 млн. тон/год.
Традиционно, янтарную кислоту получают нефтехимическим синтезом из малеинового ангидрида, однако, в последние годы значительный прогресс был достигнут в коммерциализации и промышленной реализации процессов микробиологического синтеза янтарной кислоты из возобновляемого сырья (Jansen M.L., van Gulik W.M. Towards large scale fermentative production of succinic acid. Curr Opin Biotechnol., 2014, 30:190-197). Основу этих процессов составляет ферментация углевод-содержащих субстратов высокоэффэктивными микробными штаммами, полученными с помощью направленной метаболической инженерии. В силу относительной дешевизны и значительных объемов производства, предпочтительным субстратом для микробиологического получения янтарной кислоты является глюкоза, наиболее распространенный углевод в составе растительной биомассы (Song Н. Lee S.Y., Production of succinic acid by bacterial fermentation. Enz. Microbial Technol., 2006, 39(3):352-361). Наилучшие показатели конверсии глюкозы в янтарную кислоту демонстрируют штаммы-продуценты, созданные на основе бактерий Escherichia coli (Cheng К.К., et al. Improved succinate production by metabolic engineering. 2013 Biomed Res Int. doi: 10.1155/2013/538790).
Факультативно анаэробная бактерия Escherichia coli способна синтезировать янтарную кислоту в ограниченном наборе биохимических реакций. К ним относятся реакции оксидативного цикла трикарбоновых кислот, реакции одной из ветвей смешаннокислотного брожения, известной как восстановительная ветвь цикла трикарбоновых кислот, и реакци глиоксилатного шунта.
Наиболее эффективным процессом микробиологического получения янтарной кислоты является анаэробное сбраживание глюкозы, с формированием целевого вещества в восстановительной ветви цикла трикарбоновых кислот. В данном процессе максимально возможный коэффициент конверсии субстрата в продукт в расчете на углерод составляет 2 моль/моль. Это обуславливается фиксацией СО2 на стадии образования из гликолитических интермидиатов оксалоацетата - предшественника в анаэробном пути сбраживания глюкозы в янтарную кислоту. Однако практической реализуемости данного процесса препятствует его окислительно-восстановительная несбалансированность. Конверсия каждой из двух молекул оксалоацетата, полученных из интермедиатов гликолитической утилизации глюкозы, в янтарную кислоту требует 2-х восстановленных эквивалентов (NADH), в то время как в ходе гликолиза формируется лишь половина необходимых эквивалентов (1 NADH на одну молекулу оксалоацетата). Этим обуславливается то, что лучшие показатели продукции янтарной кислоты специально полученными мутантными штаммами достигаются в процессах биосинтеза, представляющих сочетание двух биохимических путей - восстановительной ветви цикла трикарбоновых кислот и глиоксилатного шунта. С участием глиоксилатного шунта две молекулы янтарной кислоты могут быть синтезированы из одной молекулы оксалоацетата, двух молекул Ацетил-СоА и одного NADH. Глиоксилатный шунт, потребляющий меньшее количество NADH на каждую синтезируемую молекулу янтарной кислоты выступает в данном случае как донор "остаточных" гликолитических NADH для высокопродуктивного формирования целевого вещества в восстановительной части цикла трикарбоновых кислот. Однако, поскольку в глиоксилатный шунт, наряду с оксалоацетатом, вовлечены 2 молекулы Ацетил-СоА, формирующиеся из гликолитического предшественника с потерей СО2, вклад этого процесса в общий биосинтез янтарной кислоты приводит к снижению суммарного выхода продукта. Конечный выход целевого продукта определяется, таким образом, соотношение вкладов каждого из путей в биосинтез янтарной кислоты. В то время как ключевые реакции биосинтеза оксалоацетата из трехуглеродных гликолитических предшественников являются NADH независимыми, образование Ацетил-СоА из гликолитически сформированной пировиноградной кислоты может сопровождаться дополнительной генерацией NADH. В клетках Ε. coli окисление пирувата в Ацетил-СоА, в зависимости от условий аэрации, катализируется либо пируват дегидрогеназой, либо пируват формат лиазой. Конверсия пировиноградной кислоты в Ацетил-СоА под действием пируватформатлиазы не сопровождающаяся формированием NADH, в то время как действие пируватдегидрогеназы приводит к формированию дополнительной молекулы NADH на каждый образующийся Ацетил-СоА. В зависимости от участия конкретных ферментов в формировании Ацетил-КоА, биосинтез янтарной кислоты из глюкозы при совместном действии восстановительной ветви цикла трикарбоновых кислот и глиоксилатного шунта может осуществляться в трех окислительно-восстановительно сбалансированных режимах, характеризующихся различными значениями максимального теоретически возможного выхода продукта.
При формировании Ацетил-СоА под действием пируват формат лиазы, окислительно-восстановительно сбалансированный анаэробный биосинтез янтарной кислоты из глюкозы возможен в результате совместного действия восстановительной ветви цикла трикарбоновых кислот и глиоксилатного шунта с распределением потока углерода между двумя путями в соотношении 60:40, обуславливающим максимально возможный коэффициент конверсии субстрата в целевой продукт 1,6 моль/моль. При формировании Ацетил-СоА под действием как пируват формат лиазы, так и пируват дегидрогеназы, анаэробный биосинтез янтарной кислоты из глюкозы может быть окислительно-восстановительно сбалансирован при распределении потока углерода между восстановительной ветвью цикла трикарбоновых кислот и глиоксилатным шунтом в соотношении 50:50, обуславливающем максимально возможный коэффициент конверсии субстрата в целевой продукт 1,6(6) моль/моль. В случае формирования ацетил-СоА под действием исключительно пируват дегидрогеназы, распределение потока углерода между восстановительной ветвью цикла трикарбоновых кислот и глиоксилатным шунтом в соотношении 57,14:42,86 обеспечивает окислительно-восстановительно сбалансированный анаэробный биосинтез янтарной кислоты из глюкозы и обуславливает максимально возможный коэффициент конверсии субстрата в целевой продукт 1,71 моль/моль.
Следует отметить, что в E. coli конверсия пировиноградной кислоты в Ацетил-СоА в анаэробных условиях осуществляется под действием пируват формат лиазы, в то время как экспрессия генов пируват дегидрогеназного комплекса при анаэробиозе репрессирована (см., например, Soini J. et al., Norvaline is accumulated after a down-shift of oxygen in Escherichia coli W3110. Microb Cell Fact., 2008, 7:30, doi: 10.1186/1475-2859-7-30). Таким образом, вовлечение пируват дегидрогеназы в анаэробный биосинтез ацетил-СоА требует соответствующего усиления экспрессии генов, кодирующих компоненты указанного ферментативного комплекса.
Среди штаммов Е. coli продуцентов янтарной кислоты, полученных с помощью направленной метаболической инженерии без привлечения методов мутагенеза и селекции, репрезентативными штаммами характеризующимися максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту 1,6 моль/моль являются SBS550MG [pHL413] (Sánchez AM et al., Novel pathway engineering design of the anaerobic central metabolic pathway in Escherichia coli to increase succinate yield and productivity. Metab Eng. 2005, 7(3), 229-239; Cox S.J. et al., Development of a metabolic network design and optimization framework incorporating implementation constraints: A succinate production case study. Metab Eng., 2006, 8:46-57), SGM1.0 [pPYC] и SGM1.1 [pPYC] (RU 2528056). Штаммами Ε. coli продуцентами янтарной кислоты характеризующимися максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту 1,6(6) моль/моль являются SGM2.0 [pPYC] и SGM2.1 [pPYC] (RU 2528056). Штаммам-продуцентам характеризующимися максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту 1,71 моль/моль соответствуют NZ-041 (Zhu X. et al. Metabolic evolution of two reducing equivalent-conserving pathways for high-yield succinate production in Escherichia coli. Metab Eng., 2014, doi: 10.1016/j.ymben.2014.05.003), SGM3.0 [pPYC] и SGM3.1 [pPYC] (RU 2528056).
Штаммы Ε. coli SBS550MG [pHL413], SGM1.0 [pPYC], SGM1.1 [pPYC]; SGM2.0 [pPYC] и SGM2.1 [pPYC], а также NZ-041, SGM3.0 [pPYC] и SGM3.1 [pPYC] рассматриваем в качестве ближайших аналогов завляемых штаммов продуцентов янтарной кислоты.
Следует отметить, что направленные генетические модификации, приводящие к получению штаммов Е. coli продуцентов янтарной кислоты, способных синтезировать целевое вещество с выходами приближенными к соответствующим теоретическим значениям, могут различаться по своему набору. Рациональный выбор генов мишений, основанный только на анализе доступной информации о функционировании целевых биохимических путей, не может надежно предопределить успеха в улучшении продукции янтарной кислоты сконструированными штаммами. Более того, неочевидным является сохранение сконструированными штаммами способности к анаэробной утилизации глюкозы, при объединении в них генетических модификаций, влияющих на глобальную координацию метаболизма углерода и окислительно-восстановительного баланса клетки в условиях анаэробиоза. При этом, реально достигаемые показатели коэффициентов конверсии глюкозы в янтарную кислоту для штаммов характеризующихся различными максимально возможными значениями выходов разнятся в зависимости от набора конкретных модификаций внесенных в соответствующие штаммы.
В штамме SBS550MG [pHL413] инактивированны гены асkА, pta, ldhA, adhE, iclR, кодирующие ацетат киназу, фосфотрансацетилазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу и белок транскрипционный репрессор экспрессии генов, кодирующих ферменты глиоксилатного шунта и экспрессирован ген рус Lactococcus lactis, кодирующий пируват карбоксилазу. Вместе с тем, данный штамм содержит интактный ген рохВ, кодирующий пируват оксидазу, конкурирующую с биосинтезом янтарной кислоты за метаболит-предшественник пировиноградную кислоту. Конверсия пировиноградной кислоты в Ацетил-СоА в штамме SBS550MG [pHL413] осуществляется под действием пируват формат лиазы, что обуславливает максимально возможный коэффициент конверсии глюкозы в янтарную кислоту - 1,6 моль/моль (Сох S.J. et al., Development of a metabolic network design and optimization framework incorporating implementation constraints: a succinate production case study. Metab. Eng., 2006, 8:46-57). В богатых комплексных средах штамм SBS550MG [pHL413] синтезирует янтарную кислоту из глюкозы с коэффициентом конверсии 1,59 моль/моль (Sánchez A.M. et al., Novel pathway engineering design of the anaerobic central metabolic pathway in Escherichia coli to increase succinate yield and productivity. Metab Eng. 2005, 7(3):229-239), 1,4 моль/моль (PCT/FR 2010/050230) и 1,25 моль/моль (Martínez I. et al., Metabolic impact of the level of aeration during cell growth on anaerobic succinate production by an engineered Escherichia coli strain. Metab Eng., 2010, 12:499-509) в зависимости от условий культивирования. Данные коэффициенты конверсии достигнуты при продукции штаммом янтарной кислоты в среде LB, содержащей значительное количество аминокислот. В условиях анаэробиоза окислительное дезаминирование аминокислот, сопровождающееся генерацией NADH, способно обеспечить дополнительные к гликолитическим восстановленные эквиваленты необходимые для формирования янтарной кислоты в восстановительной ветви цикла трикарбоновых кислот. При исчерпании в среде аминокислот, штамм лишается дополнительного источника восстановленных эквивалентов для эффективного биосинтеза янтарной кислоты. Действительно, при осуществлении процесса анаэробного биосинтеза янтарной кислоты из глюкозы штаммом SBS550MG [pHL413] в минимальной солевой среде с глюкозой коэффициент конверсии субстрата в целевой продукт составляет 1,3 моль/моль (WO 2009/083756).
В штаммах SGM1.0 [pPYC] и SGM1.1 [pPYC] инактивированны гены асkА, pta, рохВ, ldhA, adhE, кодирующие ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу и экспрессирован ген русА Bacillus subtilis, кодирующий пируват карбоксилазу. В штамме SGM1.1 [pPYC] также инактивирован ген iclR, кодирующий белок транскрипционный репрессор экспрессии генов, кодирующих ферменты глиоксилатного шунта. Конверсия пировиноградной кислоты в Ацетил-СоА в штаммах SGM1.0 [pPYC] и SGM1.1 [pPYC] осуществляется под действием пируват формат лиазы, что обуславливает максимально возможный коэффициент конверсии глюкозы в янтарную кислоту - 1,6 моль/моль. В минимальной солевой среде штаммы SGM1.0 [pPYC] и SGM1.1 [pPYC] синтезируют янтарную кислоту из глюкозы с коэффициентами конверсии 1,31 моль/моль и 1,32 моль/моль, соответственно (RU 2528056).
В штаммах SGM2.0 [pPYC] и SGM2.1 [pPYC] инактивированны гены ackA, pta, poxB, ldhA, adhE, кодирующие ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, усилена экспрессия генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, и экспрессирован ген рус А Bacillus subtilis, кодирующий пируват карбоксилазу. В штамме SGM2.1 [pPYC] также инактивирован ген iclR, кодирующий белок транскрипционный репрессор экспрессии генов, кодирующих ферменты глиоксилатного шунта. Конверсия пировиноградной кислоты в Ацетил-СоА в штаммах SGM2.0 [pPYC] и SGM2.1 [pPYC] осуществляется под действием как пируват формат лиазы, так и пируват дегидрогеназы, что обуславливает максимально возможный коэффициент конверсии глюкозы в янтарную кислоту - 1,6(6) моль/моль. В минимальной солевой среде штаммы SGM2.0 [pPYC] и SGM2.1 [pPYC] синтезируют янтарную кислоту из глюкозы с коэффициентами конверсии 1,42 моль/моль и 1,49 моль/моль, соответственно (RU 2528056).
В штамме NZ-041 инактивированны гены асkА, pta, ldhA, pflB, ptsl, кодирующие ацетат киназу, фосфотрансацетилазу, лактат дегидрогеназу, пируват формат лиазу и фермент I фосфоенолпируват зависимой системы транспорта сахаров, а также усилена экспрессия генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, гена pck, кодирующего фосфоенолпируват карбоксикиназу, и гена galP, кодирующего Н+-симпортер галактозы. Вместе с тем, данный штамм содержит интактные гены рохВ и adhE, кодирующие пируват оксидазу и альдегид/алкоголь дегидрогеназу, конкурирующие с биосинтезом янтарной кислоты за метаболиты-предшественники - пировиноградную кислоту и ацетил-СоА, соответсвенно. Конверсия пировиноградной кислоты в Ацетил-СоА в штамме NZ-041 осуществляется под действием пируват дегидрогеназы, что обуславливает максимально возможный коэффициент конверсии глюкозы в янтарную кислоту - 1,71 моль/моль. В минимальной солевой среде штамм NZ-041 синтезирует янтарную кислоту из глюкозы с коэффициентом конверсии 1,31 моль/моль (Zhu X. et al. Metabolic evolution of two reducing equivalent-conserving pathways for high-yield succinate production in Escherichia coli. Metab Eng., 2014, doi: 10.1016/j.ymben.2014.05.003).
В штаммах SGM3.0 [pPYC] и SGM3.1 [pPYC] инактивированны гены ackA, pta, poxB, ldhA, adhE, pflB, кодирующие ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, пируват формат лиазу, усилена экспрессия генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, и экспрессирован ген русА Bacillus subtilis, кодирующий пируват карбоксилазу. В штамме SGM3.1 [pPYC] также инактивирован ген iclR, кодирующий белок транскрипционный репрессор экспрессии генов, кодирующих ферменты глиоксилатного шунта. Конверсия пировиноградной кислоты в Ацетил-СоА в штаммах SGM3.0 [pPYC] и SGM3.1 [pPYC] осуществляется под действием пируват дегидрогеназы, что обуславливает максимально возможный коэффициент конверсии глюкозы в янтарную кислоту - 1,71 моль/моль. В минимальной солевой среде штаммы SGM3.0 [pPYC] и SGM3.1 [pPYC] синтезируют янтарную кислоту из глюкозы с коэффициентами конверсии 1,46 моль/моль и 1,66 моль/моль, соответственно (RU 2528056).
Задача заявляемого изобретения состоит в расширении ассортимента штаммов бактерий Escherichia coli - продуцентов янтарной кислоты, способных синтезировать целевое вещество с повышенной эффективностью, и способов получения янтарной кислоты с использованием этих штаммов.
Задача решена путем
- констрирования штаммов Escherichia coli - продуцентов янтарной кислоты:
1. MSG1.0 [pPYC], обладающего инактивированными генами ackA, pta, poxB, ldhA, adhE, ptsG, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу и пермеазу глюкозы, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, а также активностью пируват карбоксилазы;
2. MSG1.1 [pPYC], обладающего инактивированными генами ackA, pta, poxB, ldhA, adhE, ptsG, iclR, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, пермеазу глюкозы и транскрипционный репрессор генов, кодирующих ферменты глиоксилатного шунта, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, а также активностью пируват карбоксилазы;
3. MSG2.0 [pPYC], обладающего инактивированными генами ackA, pta, poxB, ldhA, adhE, ptsG, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу и пермеазу глюкозы, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, усиленной экспрессией генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, а также активностью пируват карбоксилазы;
4. MSG2.1 [pPYC], обладающего инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, пермеазу глюкозы и транскрипционный репрессор генов, кодирующих ферменты глиоксилатного шунта, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, усиленной экспрессией генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, а также активностью пируват карбоксилазы;
5. MSG3.0 [pPYC], обладающего инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, пермеазу глюкозы и пируват формат лиазу, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, усиленной экспрессией генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, а также активностью пируват карбоксилазы;
6. MSG3.1 [pPYC], обладающего инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, iclR, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, пермеазу глюкозы, пируват формат лиазу и транскрипционный репрессор генов, кодирующих ферменты глиоксилатного шунта, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, усиленной экспрессией генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, а также активностью пируват карбоксилазы;
- разработки способа получения янтарной кислоты с использованием заявляемых штаммов.
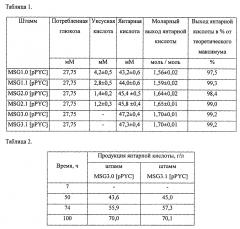
Конверсия пировиноградной кислоты в Ацетил-СоА осуществляется в заявляемых штаммах либо под действием пируват формат лиазы, либо под действием пируват формат лиазы и пируват дегидрогеназы, либо под действием исключительно пируват дегидрогеназы что обуславливает максимально возможные коэффициенты конверсии глюкозы в янтарную кислоту - 1,6 моль/моль, 1,6(6) моль/моль, 1,71 моль/моль. Заявляемые штаммы способны анаэробно синтезировать янтарную кислоту из глюкозы с коэффициентами конверсии, приближенными к максимальным теоретически возможным значениям.
Объектом настоящего изобретения являются штаммы бактерий вида Escherichia coli, обладающие способностью к эффективной конверсии глюкозы в янтарную кислоту.
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, усиленной экспрессией генов galP и glk, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,6 моль/моль;
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, усиленной экспрессией генов galP и glk, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,6 моль/моль;
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, асе F и lpdA, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,6(6) моль/моль;
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,6(6) моль/моль;
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,71 моль/моль;
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, iclR, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,71 моль/моль;
Также объектом настоящего изобретения являются штаммы бактерий Escherichia coli, описанные выше, при этом активность пируват карбоксилазы обеспечивается за счет введения в бактерию молекулы ДНК, содержащей ген, кодирующий фермент, обладающий активностью, классифицируемой как К.Ф. 6.4.1.1.
Также объектом настоящего изобретения являются штаммы бактерий Escherichia coli, описанные выше, в которых экспрессия генов galP и glk усилена за счет замены в хромосомах штаммов нуклеотидных последовательностей природных промоторов, контролирующих экспрессию генов galP и glk, на более сильные промоторы.
Также объектом настоящего изобретения являются рекомбинантные штаммы бактерий Escherichia coli, в которых экспрессия генов асеЕ, aceF и lpdA усилена за счет замены в хромосомах штаммов нуклеотидной последовательности природного промотора, контролирующего экспрессию генов aceEF-lpdA оперона, на более сильный промотор.
Также объектом настоящего изобретения является способ получения янтарной кислоты, включающий стадии культивирования штаммов, описанных выше, в питательной среде; и выделения произведенной и накопленной янтарной кислоты из культуральной жидкости.
Также объектом настоящего изобретения является, описанный выше способ, в котором процесс культивирования рекомбинантных штаммов включает в себя аэробную стадию накопления биомассы и анаэробную стадию продукции янтарной кислоты.
Штамм, согласно настоящему изобретению, - это штамм бактерий вида Escherichia coli, сконструированный в результате направленных генно-инженерных манипуляций.
Термин «штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG означает, что указанная бактерия была модифицирована таким образом, что в результате модификации такая бактерия содержит пониженное количество белков AckA, Pta, РохВ, LdhA, AdhE, PtsG по сравнению с немодифицированной бактерией, или указанная бактерия не способна синтезировать белки AckA, Pta, РохВ, LdhA, AdhE, PtsG.
Термин «штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR» означает, что указанная бактерия была модифицирована таким образом, что в результате модификации такая бактерия содержит пониженное количество белков AckA, Pta, РохВ, ldhA, AdhE, PtsG и lclR по сравнению с немодифицированной бактерией, или указанная бактерия не способна синтезировать белки AckA, Pta, РохВ, LdhA, AdhE, PtsG и IclR.
Термин «штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB» означает, что указанная бактерия была модифицирована таким образом, что в результате модификации такая бактерия содержит пониженное количество белков AckA, Pta, РохВ, LdhA, AdhE, PtsG и PflB по сравнению с немодифицированной бактерией, или указанная бактерия не способна синтезировать белки AckA, Pta, РохВ, LdhA, AdhE, PtsG и PflB.
Термин «штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, iclR» означает, что указанная бактерия была модифицирована таким образом, что в результате модификации такая бактерия содержит пониженное количество белков AckA, Pta, РохВ, LdhA, AdhE, PtsG, PflB и IclR по сравнению с немодифицированной бактерией, или указанная бактерия не способна синтезировать белки AckA, Pta, РохВ, LdhA, AdhE, PtsG, PflB и IclR.
Термин «инактивация генов асkА, pta, рохВ, ldhA, adhE, ptsG» означает, что естественная экспрессия модифицированных участков ДНК невозможна из-за делеций данных генов или их частей или модификации примыкающих к генам областей, которые включают последовательности, контролирующие экспрессию соответствующих генов, такие как промоторы, энхансеры, аттенуаторы, и т.д.
Термин «инактивация гена iclR» означает, что естественная экспрессия модифицированного участка ДНК невозможна из-за делеций данного гена или его части или модификации примыкающих к гену областей, которые включают последовательности, контролирующие экспрессию гена, такие как промоторы, энхансеры, аттенуаторы, и т.д.
Термин «инактивация гена pflB» означает, что естественная экспрессия модифицированного участка ДНК невозможна из-за делеций данного гена или его части или модификации примыкающих к гену областей, которые включают последовательности, контролирующие экспрессию гена, такие как промоторы, энхансеры, аттенуаторы, и т.д.
Наличие или отсутствие генов асkА, pta, рохВ, ldhA, adhE, ptsG, а также iclR и/или pflB на хромомсоме бактерии можно определить известными методами, включая ПЦР, блоттинг по Саузерну, и т.п. Кроме того, уровни экспрессии гена можно оценить определением количества транскрибируемой с гена РНК с использованием различных известных методов, включая блоттинг по Нозерну, количественную ОТ-ПЦР, и т.п. Количества или молекулярные массы кодируемых генами белков могут быть определены известными методами, включая SDS-ПААГ-электрофорез с последующим иммуноблотингом ПЦР (блоттинг по Вестерну) и т.п.
Ген асkА (синонимы: ЕСК2290, b2296) кодирует белок АсkА (синоним: В2296), проявляющий активность ацетаткиназы, классифицируемую как К.Ф. 2.7.2.1. Ген асkА (нуклеотиды с 2,411,492 по 2,412,694 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между открытой рамкой считывания yfbV и геном pta на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена ackA и аминокислотная последовательность AckA, кодируемого геном асkА, приведены в Перечне последовательностей под номерами 1 (SEQ ID NO: 1) и 2 (SEQ ID NO: 2) соответственно. Ген pta (синонимы: ЕСК2291, b2297) кодирует белок Pta (синоним: В2297), проявляющий активность фосфотрансацетилазы, классифицируемую как К.Ф. 2.3.1.8. Ген pta (нуклеотиды с 2,412,769 по 2,414,913 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном асkА и открытой рамкой считывания yfcC на хромосоме штамма Е. coli Κ12. Нуклеотидная последовательность гена pta и аминокислотная последовательность Pta, кодируемого геном pta, приведены в Перечне последовательностей под номерами 3 (SEQ ID NO: 3) и 4 (SEQ ID NO: 4) соответственно. Ген poxB (синонимы: ЕСК0862, b0871) кодирует белок РохВ (синоним: В0871), проявляющий активность пируватоксидазы, классифицируемую как К.Ф. 1.2.5.1. Ген рохВ (нуклеотиды комплементарные нуклеотидам с 908,554 по 910,272 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном ltaE и геном hcr на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена рохВ и аминокислотная последовательность РохВ, кодируемого геном рохВ, приведены в Перечне последовательностей под номерами 5 (SEQ ID NO: 5) и 6 (SEQ ID NO: 6) соответственно. Ген ldhA (синонимы: ЕСК1377, b1380) кодирует белок ldhA (синоним: В1380), проявляющий активность лактатдегидрогеназы, классифицируемую как К.Ф. 1.1.1.28. Ген ldhA (нуклеотиды комплементарные нуклеотидам с 1,439,878 по 1,440,867 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном hslJ и открытой рамкой считывания ydbH на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена ldhA и аминокислотная последовательность LdhA, кодируемого геном ldhA, приведены в Перечне последовательностей под номерами 7 (SEQ ID NO: 7) и 8 (SEQ ID NO: 8) соответственно. Ген adhE (синонимы: ЕСК1235, b1241) кодирует белок AdhE (синоним: В1241), проявляющий активность алкоголь дегидрогеназы и альдегид дегидрогеназы, классифицируемые как К.Ф. 1.1.1.1. и К.Ф. 1.2.1.3. Ген adhE (нуклеотиды комплементарные нуклеотидам с 1,294,669 по 1,297,344 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между открытой рамкой считывания ychG и открытой рамкой считывания ychE на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена adhE и аминокислотная последовательность AdhE, кодируемого геном adhE, приведены в Перечне последовательностей под номерами 9 (SEQ ID NO: 9) и 10 (SEQ ID NO: 10) соответственно. Ген ptsG (синонимы: ЕСК1087, b1101) кодирует белок PtsG (синоним: В1101), проявляющий активность пермеазы глюкозы фосфоенолпируват зависимой системы транспорта Сахаров. Ген ptsG (нуклеотиды с 1,157,092 по 1,158,525 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между открытой рамкой считывания ycfH и геном fhuE на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена ptsG и аминокислотная последовательность белка PtsG, кодируемого геном ptsG, приведены в Перечне последовательностей под номерами 11 (SEQ ID NO: 11) и 12 (SEQ ID NO: 12) соответственно. Ген iclR (синонимы: ЕСК4010, b4018) кодирует белок IclR (синоним: В4018) являющийся транскрипционным репрессором асеВАК оперона, кодирующего ферменты глиоксилатного шунта. Ген iclR (нуклеотиды комплементарные нуклеотидам с 4,220,827 по 4,221,651 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном arpA и геном metH на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена iclR и аминокислотная последовательность IclR, кодируемого геном iclR, приведены в Перечне последовательностей под номерами 13 (SEQ ID NO: 13) и 14 (SEQ ID NO: 14) соответственно. Ген pflΒ (синонимы: ЕСК0894, b0903) кодирует белок PflB (синоним: В0903), проявляющий активность пируватформатлиазы, классифицируемую как К.Ф. 2.3.1.54. Ген pflB (нуклеотиды комплементарные нуклеотидам с 950,495 по 952,777 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном pflA и геном focA на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена pflB и аминокислотная последовательность PflB, кодируемого геном pfl, приведены в Перечне последовательностей под номерами 15 (SEQ ID NO: 15) и 16 (SEQ ID NO: 16) соответственно.
Поскольку у представителей различных штаммов вида Escherichia coli возможны некоторые вариации в нуклеотидных последовательностях, понятие инактивируемого гена не ограничивается генами, последовательности которых приведены в Перечне последовательностей под номерами 1 (SEQ ID NO: 1), 3 (SEQ ID NO: 3), 5 (SEQ ID NO: 5), 7 (SEQ ID NO: 7), 9 (SEQ ID NO: 9), 11 (SEQ ID NO: 11), 13 (SEQ ID NO: 13), 15 (SEQ ID NO: 15), но также может включать и гены, гомологичные SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, кодирующие варианты белков AckA, Pta, РохВ, LdhA, AdhE, PtsG, IclR и PflB. Термин «вариант белка» в значении, в котором он используется в настоящем изобретении, означает белок, имеющий изменения в аминокислотной последовательности, а именно делеции, вставки, добавления или замены аминокислот. Количество изменений в варианте белка зависит от положения аминокислотного остатка в трехмерной структуре или его типа. Количество изменений может быть от 1 до 30, предпочтительно от 1 до 15 и наиболее предпочтительно от 1 до 5 изменений в последовательностях SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14 и SEQ ID NO: 16. Данные изменения в вариантах белка являются консервативными мутациями, при которых сохраняется функция белка. Другими словами, данные изменения могут иметь место в областях белка, некритичных для его трехмерной структуры. Это становится возможным благодаря тому, что некоторые аминокислоты обладают высокой гомологией друг к другу, и поэтому третичная структура при таких заменах не нарушается. Консервативная мутация - это мутация, при которой имеют место взаимные замены среди Phe, Trp, Tyr, если сайт замены - ароматическая аминокислота; среди Leu, Ile, Val, если сайт замены - гидрофобная аминокислота; между Gln, Asn, если сайт замены - положительно заряженная аминокислота; среди Lys, Arg, His, если сайт замены - основная аминокислота; между Asp, Glu, если сайт замены - кислая аминокислота и между Ser, Thr, если это аминокислота с гидроксильной группой. Консервативные замены являются типичными консервативными мутациями. Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp, и замену Val на Met, Ile или Leu. Описанные выше замены, делеции, вставки, добавления, перестановки и т.п. одного или нескольких аминокислотных остатков включают природные мутации (мутант или вариант) в зависимости от видовых различий или индивидуальных различий микроорганизмов, содержащих гены асkА, pta, рохВ, ldhA, adhE, ptsG, iclR и pflB. Такие гены могут быть получены модифицированием нуклеотидной последовательности, показанной в SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13 и SEQ ID NO: 15 с использованием, например, сайт-специфического мутагенеза, таким образом, что сайт-специфический аминокислотный остаток в соответствующем кодируемом белке включает замены, делеции, вставки или добавления.
Следовательно, варианты белков, кодируемых генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR и pflB, могут иметь гомологию не менее 80%, предпочтительно не менее 90%, и наиболее предпочтительно не менее 95%, по отношению к полной аминокислотной последовательности, показанной в Перечне последовательностей под номерами SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14 и SEQ ID NO: 16, соответственно.
В связи с этим гены асkА, pta, рохВ, ldhA, adhE, ptsG, iclR и pflB могут быть вариантами, которые гибридизуются в жестких условиях с нуклеотидными последовательностями, приведенными в Перечне последовательностей под номерами 1 (SEQ ID NO: 1), 3 (SEQ ID NO: 3), 5 (SEQ ID NO: 5), 7 (SEQ ID NO: 7), 9 (SEQ ID NO: 9), 11 (SEQ ID NO: 11), 13 (SEQ ID NO: 13), 15 (SEQ ID NO: 15), или с зондом, который может быть синтезирован на основе указанной нуклеотидной последовательности. «Жесткие условия» включают такие условия, при которых специфические гибриды, например, гибриды с гомологией не менее 60%, предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительно не менее 90%, и наиболее предпочтительно не менее 95%, образуются, а неспецифические гибриды, например, гибриды с меньшей гомологией, чем указано выше, - не образуются. Практическим примером жестких условий является однократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°С. Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, такова, как рекомендовано производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны Hybond™ N+(Amersham) при строгих условиях-15 минут. Предпочтительна двух- трехкратная отмывка. Длина зонда может быть выбрана в зависимости от условий гибридизации, обычно от 100 н.п. до 1000 н.п.
Гомология между последовательностям