Способ получения белков семейства цистеиновых протеаз пшеницы (triticum aestivum) и препарат белка тритикаин-альфа, полученный этим способом
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ получения усеченной формы тритикаина-альфа пшеницы, имеющей последовательность SEQ ID NO: 2 (shortTRIT-α), рекомбинантно экспрессирующейся в бактериальной системе, заключающийся в том, что проводят культивирование клеток E. coli JM109, трансформированных плазмидой pQE80L_shortTRIT-α, содержащей последовательность ДНК, кодирующей белок shortTRIT-α, в среде LB с добавлением ампициллина при 37°С в аэробных условиях в течение 12-14 ч, посевным материалом инокулируют питательную среду, растят культуру до достижения оптической плотности А600 0.6-0.8, индуцируют 1 мМ изопропилтио-β-D-галактозидом и растят еще 2.5-3 часа; очистку целевого белка shortTRIT-α проводят методом аффинной металл-хелатной хроматографии: осажденную центрифугированием клеточную биомассу экспрессионной культуры ресуспендируют в буфере, содержащем 0.01 М Трис-HCl, рН 8.0 и гомогенизируют на ультразвуковом дезинтеграторе в течение 1 мин при 4°С, полученный после центрифугирования лизата осадок промывают исходным буфером и растворяют в буфере А, состоящем из 6 М гуанидин-хлорида и 0.05 М Трис-HCl, рН 7.8, раствор осветляют центрифугированием и наносят на колонку с активированной ионами никеля иминодиацетат-сефарозой, уравновешенную буфером А, сорбент последовательно промывают уравновешивающим буфером А и тем же буфером с содержанием 8 М мочевины и 0.005 М имидазола, белок элюируют буфером А с содержанием 8 М мочевины и 0.25 М имидазола, затем элюат добавляют в охлажденный буфер 0.05 М Трис-HCl, 0.5 М аргинин-хлорид, 2 М мочевина, рН 7.8 в соотношении 1:5 и перемешивают 1 ч при 4°С, раствор диализуют против 0.05 М Трис-HCl, рН 7.8 при 4°С, супернатант, полученный после центрифугирования диализата, концентрируют на ячейке Amicon с мембраной РМ-10 (Millipore), с последующим диализом против фосфатно-солевого буфера PBS, рН 7.4, при 4°С, определяют концентрацию белка shortTRIT-α, аликвотируют по стеклянным флаконам, замораживают и лиофилизуют. Изобретение позволяет получить чистый белковый препарат с активностью тритикаина-альфа пшеницы с высокой степенью эффективности. 2 н. и 1 з.п. ф-лы, 6 ил., 4 пр.
Реферат
Изобретение относится к области молекулярной биологии, препаративной биохимии, биотехнологии, биофармакологии, а именно к созданию способа получения рекомбинантных белков семейства цистеиновых протеаз пшеницы (Triticum aestivum) и препарат белка тритикаина-альфа, состоящий из усеченной формы тритикаина-альфа пшеницы. Изобретение может быть использовано в медицине для разработки ферментных терапевтических препаратов.
Тритикаины (triticain-α, -β, -γ) - высококонсервативные папаин-подобные цистеиновые эндопротеазы пшеницы, состоящие из сигнального (лидерного) пептида, удаляющегося при активации про-пептидного домена, гранулин-подобного домена [GenBank АВ267407] и каталитического домена с каталитической триадой Cys-His-Asn [1]. Цистеиновые протеазы распространены в растениях и экспрессируются в их различных органах [2, 3]. Предполагается, что эти ферменты участвуют в стадиеспецифическом расщеплении и пост-трансляционных модификациях запасающих белков [4, 5]. Среди папаин-подобных цистеиновых протеаз растений наиболее широко изучены ферменты риса и ячменя - оризаины (oryzain-α, -β, -γ) и эндопептидазы ЕРВ (barley cysteine proteinase B-1, -2) [6, 7], однако протеазы пшеницы начали изучать относительно недавно [1, 8].
Основным преимуществом папаин-подобных цистеиновых протеиназ из семян растений на данный момент являетя их эндопептидазная активность, в частности глютеназная активность - способность эффективно гидролизовать пептиды глютена (запасного белка пшеницы, состоящего из смеси мономерных глиадинов и полимерных глютенинов) или родственных запасных белков ржи и ячменя. Это свойство растительных ферментов позволяет считать их перспективными объектами при разработке лекарственных средств для борьбы с целиакией. Целиакия (глютеновая энтеропатия) представляет собой комплексное воспалительное заболевание человека, которое развивается при наличии соответствующей генетической предрасположенности в ответ на обогащенные остатками пролина и глутамина пептиды, являющиеся продуктами происходящего в пищеварительном тракте частичного протеолиза глютена [9, 10]. Распространенность глютеновой энтеропатии во взрослой популяции большинства стран мира оценена как 1:100 - 1:250 или 0.5-1% от общей популяции [11]. Доказанной эффективной терапией целиакии является пожизненная строгая безглютеновая диета, позволяющая предотвратить развитие осложнений и исключить клинические симптомы заболевания [12]. Однако главным недостатком безглютеновой диеты является сложность ее соблюдения из-за ее ограничительного характера, обусловленного как высокой стоимостью, так и сложностью подбора глютен-несодержащих продуктов питания.
В связи с этим, исследование и разработка способов получения высокоспецифичных протеаз, стабильных и активных в присутствии эндогенных ферментов желудочно-кишечного тракта человека (т.е. в месте предполагаемого действия лекарственного препарата на их основе), имеет большое значение в терапевтических целях. В рамках данного изобретения была выбрана протеаза пшеницы Triticum aestivum - тритикаин-альфа, т.к. пшеница играет существенную роль как источник питания в России, а значит, наиболее подходящую для разработки отечественных терапевтических препаратов для лечения целиакии.
Молекула полноразмерного тритикаина-альфа состоит из 461 аминокислотного остатка с молекулярным весом 50.4 кДа. Впервые фермент был клонирован и экспрессирован в зародыше и алейроновом слое пшеницы для выяснения его роли в процессе созревания семян [1].
Однако биосинтез рекомбинантного тритикаина-альфа для исследования его протеолитических функций до сих пор не был осуществлен. Обеспечение эффективного источника получения высокоочищенного и активного белка является одной из важных задач, возникающих при создании ферментных препаратов. Поэтому возникает необходимость разработки новых технологий получения таких белков и получения высококачественных целевых препаратов. В связи с этим, нами был разработан способ получения усеченной формы полноразмерного тритикаина-альфа, соответствующей его каталитическому домену (т.е. без лидерного пептида и гранулин-подобного домена) с высоким выходом и уровнем протеолитической активности.
Известны работы по разработке метода получения проэнзимной формы ЕР-В2 (proEP-В2) [13, патент WO 2008115428 А2], который можно считать наиболее близкой по технической сущности к заявленному изобретению. В данной работе решалась задача получения проэнзима цистеиновой протеазы ячменя Hordeum vulgare ЕР-В2 в E. coli.
Технической задачей настоящего изобретения является разработка способа получения белков семейства цистеиновых протеаз пшеницы (Triticum aestivum) в препаративных количествах для исследовательских целей и высокоочищенного препарата тритикаина-альфа, состоящего из усеченной формы тритикаина-альфа пшеницы, для использования в составе ферментных терапевтических средств.
Поставленная задача решается следующим образом:
1. Способ получения усеченной формы тритикаина-альфа пшеницы, имеющей последовательность SEQ ID NO: 2 (shortTRIT-α), рекомбинантно экспрессирующейся в бактериальной системе, заключающийся в том, что проводят культивирование клеток E. coli JM109, трансформированных плазмидой pQE80L_shortTRIT-α, содержащей последовательность ДНК, кодирующей белок shortTRIT-α, в среде LB с добавлением ампициллина при 37°С в аэробных условиях в течение 12-14 ч, посевным материалом инокулируют питательную среду, растят культуру до достижения оптической плотности А600 0.6-0.8, индуцируют 1 мМ изопропилтио-β-D-галактозидом, и растят еще 2.5-3 часа; очистку целевого белка shortTRIT-α проводят методом аффинной металл-хелатной хроматографии: осажденную центрифугированием клеточную биомассу экспрессионной культуры ресуспендируют в буфере, содержащем 0.01 М Трис-HCl, рН 8.0 и гомогенизируют на ультразвуковом дезинтеграторе в течение 1 мин при 4°С, полученный после центрифугирования лизата осадок промывают исходным буфером и растворяют в буфере А, состоящем из 6 М гуанидин-хлорида и 0.05 М Трис-HCl, рН 7.8, раствор осветляют центрифугированием и наносят на колонку с активированной ионами никеля иминодиацетат-сефарозой, уравновешенную буфером А, сорбент последовательно промывают уравновешивающим буфером А и тем же буфером с содержанием 8 М мочевины и 0.005 М имидазола, белок элюируют буфером А с содержанием 8 М мочевины и 0.25 М имидазола, затем элюат добавляют в охлажденный буфер 0.05 М Трис-HCl, 0.5 М аргинин-хлорид, 2 М мочевина, рН 7.8 в соотношении 1:5 и перемешивают 1 ч при 4°С, раствор диализуют против 0.05 М Трис-HCl, рН 7.8 при 4°С, супернатант, полученный после центрифугирования диализата, концентрируют на ячейке Amicon с мембраной РМ-10 (Millipore), с последующим диализом против фосфатно-солевого буфера PBS рН 7.4 при 4°С, определяют концентрацию белка shortTRIT-α, аликвотируют по стеклянным флаконам, замораживают и лиофилизуют.
2. Способ по п. 1, отличающийся тем, что плазмида pQE80L_shortTRIT-α, содержащая последовательность ДНК, кодирующую белок shortTRIT-α, может быть модифицирована добавлением последовательности, кодирующей лидерный пептид и/или гранулин-подобный домен тритикаина-альфа.
3. Биологически активный белковый препарат, полученный способом по п. 1, чистота которого составляет не менее 85% с выходом не менее 55 мг с литра бактериальной культуры, характеризующийся тем, что он обладает высокой специфической ферментативной активностью и имеет аминокислотную последовательность SEQ ID NO: 2.
Требуемый технический результат заявленного изобретения заключается в разработке способа получения белка семейства цистеиновых протеаз пшеницы (Triticum aestivum) путем создания последовательности ДНК, кодирующей фрагмент полноразмерного тритикаина-альфа пшеницы (так называемой усеченной формы) в бактериальной системе экспрессии (SEQ ID NO: 2), биосинтеза усеченной формы тритикаина-альфа пшеницы в клетках E. coli, а также получении препарата тритикаина-альфа, состоящего из усеченной формы тритикаина-альфа пшеницы, с высоким выходом, уровнем очистки и протеолитической активности.
Изобретение иллюстрируется следующими чертежами:
на фиг. 1 - аминокислотная и нуклеотидная последовательности рекомбинантного полноразмерного тритикаина-альфа, экспрессирующегося в E. coli (TRIT-α, курсивом выделена последовательность от экспрессионной плазмиды рЕТ-42а(+); курсивом и подчеркиванием выделены сайты узнавания рестриктазами; подчеркиванием выделен лидерный пептид; курсивом и цветом выделена каталитическая триада Cys-His-Asn, определяющая принадлежность белка к цистеиновым протеазам; цветом выделен гранулин-подобный домен; подчеркиванием выделены сайты узнавания рестриктазами);
на фиг. 2 - аминокислотная и нуклеотидная последовательности рекомбинантного усеченного тритикаина-альфа, экспрессирующегося в E. coli (shortTRIT-α; курсивом выделена последовательность от экспрессионной плазмиды pQE-80L; подчеркиванием выделены сайты узнавания рестриктазами);
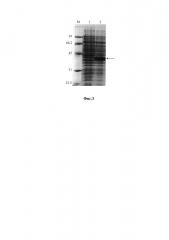
на фиг. 3 - электрофореграмма лизатов клеток штамма-продуцента E. coli JM109/pQE_shortTRIT-α до индукции (дорожка 1), лизатов клеток штамма-продуцента E. coli JM109/pQE_shortTRIT-α после индукции изопропилтио-β-D-галактозидом (дорожка 2), в 12% полиакриламидном геле в присутствии SDS (М - белковые маркеры молекулярной массы, кДа; стрелкой указан рекомбинантный усеченный тритикаин-альфа, shortTRIT-α);
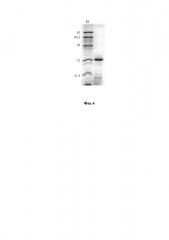
на фиг. 4 - рекомбинантный усеченный тритикаин-альфа (shortTRIT-α, экспрессированный в клетках E. coli) после хроматографического выделения в 14% полиакриламидном геле в присутствии SDS (М - белковые маркеры молекулярной массы, кДа);
на фиг. 5 - электрофореграмма протеолитического расщепления глютена (дорожка 2) рекомбинантным усеченным тритикаином-альфа (shortTRIT-α, дорожка 1) при условиях реакции: 37°С, рН 5.6, 10 мин (дорожка 3), в 14% полиакриламидном геле в присутствии SDS (М - белковые маркеры молекулярной массы, кДа; стрелкой указан рекомбинантный усеченный тритикаин-альфа, shortTRIT-α);
на фиг. 6 - электрофореграмма протеолитического расщепления коллагена (дорожка 2) рекомбинантным усеченным тритикаином-альфа (shortTRIT-α, дорожка 1) при условиях реакции: 37°С, рН 5.6, 10 мин, в 14% полиакриламидном геле в присутствии SDS (М - белковые маркеры молекулярной массы, кДа; стрелкой указан рекомбинантный усеченный тритикаин-альфа, shortTRIT-α);
Изобретение иллюстрируется следующими примерами.
Пример 1. Клонирование гена тритикаин-альфа пшеницы и его усеченного фрагмента
На основе известной последовательности мРНК пшеницы (Triticum aestivum), кодирующей полноразмерный ген тритикаина-альфа (GeneBank АВ267407), синтезируют комплементарную ДНК (кДНК) с использованием обратной транскриптазы мышиного вируса лейкемии Молони и праймера на 3′-нетранслируемую область мРНК 5′-gggggatccttacgcgctacttttcttgccg. Амплификацию кодирующей транслируемую область гена полноразмерного тритикаина-альфа ДНК, фланкированную сайтами рестрикции NdeI и BamHI (фиг. 1), проводят с использованием следующих прямого и обратного праймеров: 5′-ccccatatgcatcatcatcatcatcatgccatgaggagctccatggccctc и 5′-gggggatccttacgcgctacttttcttgccg (сайты рестрикции NdeI и BamHI выделены подчеркиванием). Продукт амплификации и плазмидную ДНК рЕТ-42а(+) обрабатывают рестриктазами NdeI и BamHI, соединяют при помощи лигазной реакции, после чего реакционную смесь трансфицируют в компетентные клетки E. coli BL21-CodonPlus(DE3)-RIL. Трансформированные клетки высевают на агаризованную среду LB, содержащую канамицин (до конечной концентрации 50 мг/мл). Из отобранных методом ПЦР (с помощью универсальных праймеров для рЕТ-векторов) клонов выделяют целевую плазмидную ДНК (pET_TRIT-α). Нуклеотидную последовательность встроенного фрагмента подтверждают секвенированием по Сенгеру. Отобранные клоны наращивают для оценки продуктивности, устойчивости к антибиотикам и стабильности трансформации.
Конструирование новой последовательности ДНК, кодирующей усеченный фрагмент гена тритикаина-альфа (shortTRIT-α, без лидерного пептида и гранулин-подобного домена, фиг. 2) для экспрессии в бактериальной системе, осуществляют на основе плазмидной ДНК pET_TRIT-α в качестве матрицы и праймеров: 5′-atggatccatcgtgtcgtacggggag (сайт рестрикции BamHI выделен подчеркиванием) и 5′-tattaagcttttagcccgtcttcgtcggg (сайт рестрикции HindIII выделен подчеркиванием). Продукт амплификации клонируют в экспрессионную плазмиду pQE-80L по сайтам рестрикции BamHI и HindIII, используя штамм E. coli JM109. Скрининг колоний проводят методом рестрикционного анализа и последующего секвенирования.
Пример 2. Синтез усеченной формы тритикаина-альфа пшеницы (рекомбинантного усеченного тритикаина-альфа, препарата shortTRIT-α) в клетках E. coli
Штамм E. coli JM109, трансформированный плазмидой pQE80L_shortTRIT-α, выращивают в среде LB при 37°С в аэробных условиях с добавлением ампициллина (до конечной концентрации 100 мг/мл) в течение 12-14 ч (посевной материал), инокулируют новую порцию питательной среды в соотношении 1:50, растят культуру до достижения оптической плотности А600 0.6-0.8, индуцируют 1 мМ изопропилтио-β-D-галактозидом (ИПТГ) и растят еще 2.5-3 часа. При индукции ИПТГ происходит биосинтез рекомбинантного shortTRIT-α (37.45 кДа, фиг. 3), который накапливается в клетках в нерастворимой форме. Отбирают пробы клеточной суспензии до и после индукции в количестве, соответствующем 0.1 оптических единиц (о.е.), осаждают центрифугированием, суспендируют в лизирующем буфере (0.03 М Трис-HCl, рН 6.8, 10% глицерин, 1% додецилсульфат натрия, 3% меркаптоэтанол, 0.005% бромфеноловый синий), нагревают 5 мин при 95°С, и образцы объемом 20 мкл анализируют электрофорезом в 12% полиакриламидном геле с додецилсульфатом натрия. Гель прокрашивают кумасси R-250 по стандартной методике и сканируют для определения относительного количества белка в полосе целевого белка (фиг. 3). По данным сканирования содержание рекомбинантного shortTRIT-α составляет 15-20% от всех клеточных белков.
Пример 3. Очистка препарата рекомбинантного shortTRIT-α из E. coli
Очистку целевого белка shortTRIT-α проводят методом аффинной (металл-хелатной) хроматографии. Получение рекомбинантного shortTRIT-α из клеток штамма-продуцента JM109/pQE80L_shortTRIT-α включает несколько стадий. Осажденную центрифугированием клеточную биомассу экспрессионной культуры ресуспендируют в буфере, содержащем 0.01 М Трис-HCl, рН 8.0, и гомогенизируют на ультразвуковом дезинтеграторе в течение 1 мин при 4°С. Полученный после центрифугирования лизата (16000х g, 4°С, 10 мин) осадок промывают исходным буфером и растворяют в буфере А, состоящем из 6 М гуанидин-хлорида и 0.05 М Трис-HCl, рН 7.8. Раствор осветляют центрифугированием (16000х g, 4°С, 1 ч) и наносят на колонку (диаметр 1.5 см) с активированной ионами никеля иминодиацетат-сефарозой, уравновешенную буфером А. Процесс хроматографии проводят на системе BioLogic (BioRad) с детекцией при 280 нм. Сорбент последовательно промывают уравновешивающим буфером А и тем же буфером с содержанием 8 М мочевины и 0.005 М имидазола. Белок элюируют буфером А с содержанием 8 М мочевины и 0.25 М имидазола, добавляют в охлажденный 0.05 М Трис-HCl, рН 7.8 с 0.5 М аргинин-хлорида и 2 М мочевиной в соотношении 1:5 и перемешивают 1 ч при 4°С. Раствор диализуют против 0.05 М Трис-HCl, рН 7.8 при 4°С в течение 18 ч, трижды производя замену буфера на свежий. Супернатант, полученный после центрифугирования диализата (10000х g, 4°С, 30 мин), концентрируют на ячейке Amicon с мембраной РМ-10 (Millipore) с последующим диализом против фосфатно-солевого буфера (PBS, рН 7.4, 4°С, 18 ч). Концентрацию целевого белка определяют с помощью ВСА-реагента (бицинхониновой кислоты), аликвотируют по стеклянным флаконам, замораживают и лиофилизуют.
Выход полученного таким способом рекомбинантного shortTRIT-α составляет не менее 55 мг с 1 л бактериальной культуры с чистотой не менее 85% (по данным электрофоретического анализа). Следует отметить, что целевой белок shortTRIT-α, проявляющий протеазную активность, подвергается автопротеолизу в процессе выделения и вследствие этого детектируется в электрофорезном геле в виде мажорной полосы размером около 31 кДа (так называемая процессированная форма) и низкомолекулярных фрагментов (фиг. 4).
Пример 4. Определение протеолитической активности рекомбинантного shortTRIT-α
Ферментативную (протеолитическую) активность рекомбинантного усеченного тритикаина-альфа shortTRIT-α определяют по способности расщепления белковых субстратов. В качестве субстратов используют глютен пшеницы (Sigma) и выделенный из дермы крупного рогатого скота коллаген. Расщепление указанных белков имеет большое значение в терапевтических (лечение целиакии, ферментативного очищения некротических тканей, коллаген-индуцированного артрита и др. [12, 14, 15]), диагностических [16] и некоторых технологических (гидролиз белков соединительных тканей [17]) целях. Протеолитическую реакцию проводят путем инкубирования глютена или коллагена с препаратом shortTRIT-α в массовом соотношении 20:1 при 25 и 37°С в течение 10-15 мин в 0.2 М глициновом (рН 3.4), 0.2 М ацетатном (рН 5.6) или 0.2 М фосфатном (рН 7.0) буферах. Результаты протеолиза анализируют электрофорезом белков в 14% полиакриламидном геле с додецилсульфатом натрия (фиг. 5, 6). Рекомбинантный shortTRIT-α проявляет оптимальную активность при значениях рН 5-7 всего за 10 мин в диапазоне указанных температур.
Преимуществами заявленного технического решения являются, во-первых, возможность получения усеченного фрагмента тритикаина-альфа в бактериях за счет создания соответствующей конструкции плазмидной ДНК; во-вторых, упрощенная методика выделения рекомбинантного белка из E. coli за счет введения в состав полипептидной цепи шести остатков гистидина; в-третьих, получение протеолитически активного препарата тритикаина-альфа, состоящего из усеченной формы полноразмерного тритикаина-альфа, который может быть основой для создания ферментных лекарственных средств в терапии некоторых заболеваний (в частности, целиакии).
Источники информации
1. Т. Kiyosaki, Т. Asakura, I. Matsumoto, et al. J Plant Physiol, 2009, 1, 166(1), 101-106.
2. K. Muntz, M.A. Belozersky, Y.E. Dunaevsky, et al. J Exp Bot, 2001, 52, 1741-1752.
3. J.Q. Ling, T. Kojima, M. Shiraiwa, et al. Biochim Biophys Acta, 2003, 1627, 129-139.
4. A. Capocchi, M. Cinollo, L. Galleschi, et al. JAgric Food Chem, 2000, 48, 6271-6279.
5. T. Okamoto, T. Shimada, I. Hara-Nishimura, et al. Plant Physiol, 2003, 132, 1892-1900.
6. A. Mikkonen, I Porali, M. Cercos, et al. Plant Mol Biol, 1996, 31 (2), 239-254.
7. H. Kondo, K. Abe, I. Nishimura, et al. J Biol Chem, 1990, 15, 265(26), 15832-15837.
8. T. Kiyosaki, I. Matsumoto, T. Asakura, et al. FEBS J, 2007, 274, 1908-1917.
9. N. McGough, J.H. Cummings. Proc Nutr Soc, 2005, 64(4), 434-450.
10. J.S. Leeds, A.D. Hopper, D.S. Sanders. Br Med Bull, 2008, 88(1), 157-170.
11. WGO - OMGE: Practice guidelines. World Gastroenterology News, 10 (2, 2), 2005, 1-8.
12. S. Rashtak, J.A. Murray. Aliment Pharmacol Ther, 2012, 35(7), 768-781.
13. H. Vora, J. McIntire, P. Kumar, et al. Biotechnol Bioeng, 2007, 1, 98(1), 177-185.
14. D.P. Orgill, P.Y. Liu, L.S. Ritterbush, et al. J Burn Care Rehabil, 1996, 17, 311-322.
15. S. Khare, С. Krco, M. Griffiths, et. al. J Immunol, 1995, 155, 3653-3659.
16. T. Mazda, K. Makino, R. Yabe, et al. Transfus Med, 1995, 5, 43-50.
17. R.A. Lawrie, Meat Science, Pergamon Press, Oxford, 1991, p. 212.
1. Способ получения усеченной формы тритикаина-альфа пшеницы, имеющей последовательность SEQ ID NO: 2 (shortTRIT-α), рекомбинантно экспрессирующейся в бактериальной системе, заключающийся в том, что проводят культивирование клеток E. coli JM109, трансформированных плазмидой pQE80L_shortTRIT-α, содержащей последовательность ДНК, кодирующей белок shortTRIT-α, в среде LB с добавлением ампициллина при 37°С в аэробных условиях в течение 12-14 ч, посевным материалом инокулируют питательную среду, растят культуру до достижения оптической плотности А600 0.6-0.8, индуцируют 1 мМ изопропилтио-β-D-галактозидом и растят еще 2.5-3 часа; очистку целевого белка shortTRIT-α проводят методом аффинной металл-хелатной хроматографии: осажденную центрифугированием клеточную биомассу экспрессионной культуры ресуспендируют в буфере, содержащем 0.01 М Трис-HCl, рН 8.0 и гомогенизируют на ультразвуковом дезинтеграторе в течение 1 мин при 4°С, полученный после центрифугирования лизата осадок промывают исходным буфером и растворяют в буфере А, состоящем из 6 М гуанидин-хлорида и 0.05 М Трис-HCl, рН 7.8, раствор осветляют центрифугированием и наносят на колонку с активированной ионами никеля иминодиацетат-сефарозой, уравновешенную буфером А, сорбент последовательно промывают уравновешивающим буфером А и тем же буфером с содержанием 8 М мочевины и 0.005 М имидазола, белок элюируют буфером А с содержанием 8 М мочевины и 0.25 М имидазола, затем элюат добавляют в охлажденный буфер 0.05 М Трис-HCl, 0.5 М аргинин-хлорид, 2 М мочевина, рН 7.8 в соотношении 1:5 и перемешивают 1 ч при 4°С, раствор диализуют против 0.05 М Трис-HCl, рН 7.8 при 4°С, супернатант, полученный после центрифугирования диализата, концентрируют на ячейке Amicon с мембраной РМ-10 (Millipore), с последующим диализом против фосфатно-солевого буфера PBS, рН 7.4, при 4°С, определяют концентрацию белка shortTRIT-α, аликвотируют по стеклянным флаконам, замораживают и лиофилизуют.
2. Способ по п. 1, отличающийся тем, что плазмида pQE80L_shortTRIT-α, содержащая последовательность ДНК, кодирующую белок shortTRIT-α, может быть модифицирована добавлением последовательности, кодирующей лидерный пептид и/или гранулин-подобный домен тритикаина-альфа.
3. Биологически активный белковый препарат, полученный способом по п. 1, чистота которого составляет не менее 85% с выходом не менее 55 мг с литра бактериальной культуры, характеризующийся тем, что он обладает высокой специфической ферментативной активностью и имеет аминокислотную последовательность SEQ ID NO: 2.