Фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к способам и композициям для терапевтического и диагностического применения в лечении заболеваний и нарушений, которые вызваны или ассоциированы с нейрофибриллярными клубками. Описаны антитела, которые специфично узнают и связываются с фосфорилированными патологическими конформерами тау-белка, а также способы и композиции, включающие указанные антитела, для терапевтического и диагностического применения в лечении таупатий, включающих болезнь Альцгеймера (БА). Антитела по изобретению связываются фосфо-эпитопом на Tau-белке млекопитающего с константой диссоциации менее чем 10 нМ и не связываются с соответствующим нефосфорилированным эпитопом. Изобретение расширяет арсенал средств для лечения таупатий. 11 н. и 10 з.п. ф-лы, 10 ил., 13 табл., 8 пр.
Реферат
Настоящее изобретение относится к способам и композициям для терапевтического и диагностического применения в лечении заболеваний и нарушений, которые вызваны или связаны с нейрофибриллярными клубками. В частности, изобретение относится к антителам, которые специфично узнают и связываются с фосфорилированными патологическими конформерами Tau-белка, а также к способам и композициям, включающим указанные антитела для терапевтического и диагностического применения в лечении таупатий, включая болезнь Альцгеймера (БА).
Нейрофибриллярные клубки и нейропильные нити (NT) являются основными нейропатологическими признаками болезни Альцгеймера (БА). Они состоят из ассоциированного с микротрубочками Tau-белка, который подвергся посттрансляционным модификациям, включающим фосфорилирование, деамидирование и изомеризацию по аспарагинильным или аспартильным остаткам. Они образуются в результате агрегации гиперфосфорилированного Tau-белка и его конформеров. БА разделяет такую патологию со многими нейродегенеративными таупатиями, в особенности с определенными типами лобно-височной деменции (FTD).
Tau-белок представляет собой свободнорастворимый, "несвернутый" в нативной форме белок, который сильно связывается с микротрубочками (MT), обеспечивая их сборку и стабильность. MT имеют большое значение для цитоскелетной целостности нейронов и, таким образом, для правильного формирования и функционирования нейронных цепей и, следовательно, для обучения и памяти. Связывание Tau с MT контролируется динамическим фосфорилированием и дефосфорилированием, как продемонстрировано главным образом in vitro и на ненейронных клетках. Из-за большого количества возможных сайтов фосфорилирования (>80), точный вклад каждого и идентичность ответственных киназ остаются в значительной степени неопределенными in vivo.
В мозге при БА Tau-патология развивается после, и поэтому вероятно в ответ на амилоидную патологию, которая составляет сущность гипотезы амилоидного каскада. Это основано на и показано исследованиями у пациентов с БА и синдромом Дауна, а также подтверждено исследованиями на трансгенных мышах с комбинированной амилоидной и Tau-патологией (Lewis et al., 2001; Oddo et al., 2004; Ribe et al., 2005; Muyllaert et al., 2006; 2008; Terwel et al., 2008).
Точное определение сроков обоих патологий у пациентов с БА, а также механизмов, которые связывают амилоидную с Tau патологией, остаются в значительной степени невыясненными, но, как предполагается, включают активацию путей сигнализации нейронов, которые действуют на или посредством GSK3 и cdk5 как главных "Tau-киназ" (см. обзор Muyllaert et al., 2006, 2008).
Гипотеза, согласно которой таупатия является не безвредным побочным эффектом, а главной причиной патологии при БА, основывается на обоснованных генетических, патологических и экспериментальных наблюдениях, которые полностью подтверждают друг друга:
- в случаях семейной БА с ранним началом, которая обусловлена мутациями в белке-предшественнике амилоида (APP) или пресенилине, непременной причиной патогенного процесса является накопление амилоида, но при этом патология неизменно включает коллатеральную таупатию, идентичную таупатии при спорадических случаях БА с поздним началом;
- тяжесть когнитивной дисфункции и деменции коррелирует с таупатией, а не с амилоидной патологией, что недавно подтверждалось несколькими клиническими исследованиями фазы 1 и 2, которые включают PiB ПЭТ-визуализацию амилоида и идентифицируют множество "ложноположительных случаев": лица с нормальной когнитивной функцией, имеющие высокую амилоидную нагрузку мозга;
- при семейной FTD, таупатия вызывается мутантным Tau и непосредственно вызывает нейродегенерацию, без амилоидной патологии;
- в экспериментальных моделях на мышах, когнитивные нарушения, вызванные амилоидной патологией, почти полностью устраняются при отсутствии Tau-белка (Roberson et al., 2007).
Взятые вместе аргументы подтверждают гипотезу, что Tau-белок является ведущим фактором когнитивного нарушения при БА и связанных нейродегенеративных таупатиях.
Новым значительным методом лечения БА является пассивная иммунотерапия специфичными mAb, устраняющая амилоидные пептиды и их агрегаты, которые, как предполагают, являются нейротоксичными или синаптотоксичными.
Иммунотерапия, направленная против Tau-патологии, предложенная в настоящей заявке, как ожидают, будет противодействовать патологическим конформерам Tau-белка, которые, как известно или предполагается, вызывают синаптическую дисфункцию и нейродегенерацию. Амилоидная патология, вызываемая внутринейронными агрегатами гиперфосфорилированного Tau-белка, как предполагается, действует синергически в когнитивном и дегенеративном каскаде патологических событий, которые ведут от умеренного когнитивного нарушения (MCI) к тяжелой деменции при БА. Комбинация tau-направленного лечения с амилоидо-направленным (или любым другим) лечением, таким образом, составляет предпочтительное и по существу более эффективное лечение БА, в противоположность существующей монотерапии.
Другие терапевтические методы, которые направлены на Tau-белок, неэффективны и включают главным образом:
- ингибиторы киназ, которые, как предполагают, увеличивают фосфорилирование Tau до патологических уровней;
- соединения, которые блокируют цитоплазматическую агрегацию гиперфосфорилированного Tau-белка.
Указанные подходы имеют различные недостатки специфичности и эффективности, что характеризует проблему, которую они разделяют с попытками модифицировать метаболизм APP и амилоида, и подчеркивает важность непрерывного поиска дополнительных вариантов лечения, включая иммунотерапию против Tau.
Фактически никаких усилий не предпринимали для определения - не считая мишени - патологических Tau-конформеров in vivo. В клиническом испытании фазы II Αβ42, клубковая патология, по-видимому, не была хорошо ни изучена, ни проанализирована более тщательно (Nicoll et al., 2003; Masliah et al., 2005). С другой стороны, экспериментальная иммунотерапия против амилоида в доклинической мышиной модели с комбинированной БА-подобной патологией также продемонстрировала эффект в отношении Tau-патологии, хотя Tau агрегаты сохранились (Oddo et al., 2004).
Некоторые сомнения прозвучали по поводу возможности достижения внутриклеточного Tau-белка иммунотерапией. Этому противоречило новое экспериментальное исследование в модели таупатии на мышах (Asuni et al., 2007). Было показано уменьшение клубковой патологии и функциональные улучшения при вакцинировании полученным на основе Tau-белка фосфо-пептидом. Эти данные подтверждают предыдущие сообщения касательно иммунотерапии, направленной на α-синуклеин при болезни Паркинсона (БП) и модели болезни телец Леви (Masliah et al., 2005, 2011) и супероксиддисмутазу в модели амиотрофического бокового склероза (АБС) (Urushitiani et al., 2007). Указанные заболевания являются примерами, в которых внутриклеточные белки приводят к синаптическим дефектам и нейродегенерации посредством пока еще не полностью изученных механизмов. С другой стороны, рекомбинантный полноразмерный Tau-белок, продуцируемый в бактериях и выделенный из них, оказался неподходящим в качестве вакцины, хотя используемые адъюванты, а именно полный адъювант Фрейнда и токсин коклюша, возможно, способствовали получению отрицательного результата в данном исследовании (Rosenmann et al., 2006).
Существует неудовлетворенная потребность в пассивных и/или активных иммунотерапиях, которые противодействуют патологическим белковым конформерам, которые, как известно, или как предполагается, вызывают нейродегенеративные нарушения, такие как амилоидную патологию при БА, вызванную, например, внутринейронными агрегатами гиперфосфорилированного Tau-белка, которые так же типичны для БА, как и амилоид.
Указанная неудовлетворенная потребность может быть удовлетворена в рамках настоящего изобретения посредством предоставления связывающих белков, узнающих и связывающихся с главными патологическими фосфо-эпитопами Tau-белка. В частности настоящее изобретение предоставляет специфичные антитела против линейных и конформационных, простых и сложных фосфо-эпитопов на Tau-белке, в особенности на агрегированном Tau-белке, которые, как предполагают, ответственны за синапто- и нейротоксичность при таупатиях, включая БА.
Таким образом, настоящее изобретение в одном варианте осуществления относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, где связывающий пептид или белок, или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с фосфо-эпитопом на агрегированном Tau-белке, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело обладают высокой аффинностью связывания с растворимым и нерастворимым Tau-белком, и модулируют уровни растворимого и нерастворимого Tau, в особенности в мозге, в частности с константой диссоциации по меньшей мере 10 нМ, в частности по меньшей мере 8 нМ, в частности по меньшей мере 5 нМ, в частности по меньшей мере 2 нМ, в частности по меньшей мере 1 нМ, в частности по меньшей мере 500 пМ, в частности по меньшей мере 400 пМ, в частности по меньшей мере 300 пМ, в частности по меньшей мере 200 пМ, в частности по меньшей мере 100 пМ, в частности по меньшей мере 50 пМ.
Во втором варианте осуществления настоящее изобретение относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности к связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело обладают константой скорости ассоциации 104 М-1с-1 или больше, в частности 3-5 × 104 М-1с-1 или больше, в частности 105 М-1с-1 или больше; в частности 2-9 × 105 М-1с-1 или больше; в частности 106 М-1с-1 или больше, в частности 1-4 × 106 М-1с-1 или больше, в частности 107 М-1с-1 или больше.
В третьем варианте осуществления настоящее изобретение относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело обладают высокой аффинностью связывания с константой диссоциации по меньшей мере 4 нМ и константой скорости ассоциации 105 М-1с-1 или больше, в частности константой диссоциации по меньшей мере 3 нМ и константой скорости ассоциации 106 М-1с-1 или больше, в частности константой диссоциации по меньшей мере 2 нМ и константой скорости ассоциации 104 М-1с-1 или больше, в частности константой диссоциации по меньшей мере 1 нМ и константой скорости ассоциации 105 М-1с-1 или больше, в частности константой диссоциации по меньшей мере 200 пМ и константой скорости ассоциации 105 М-1с-1 или больше, в частности константой диссоциации по меньшей мере 100 пМ и константой скорости ассоциации 106 М-1с-1 или больше.
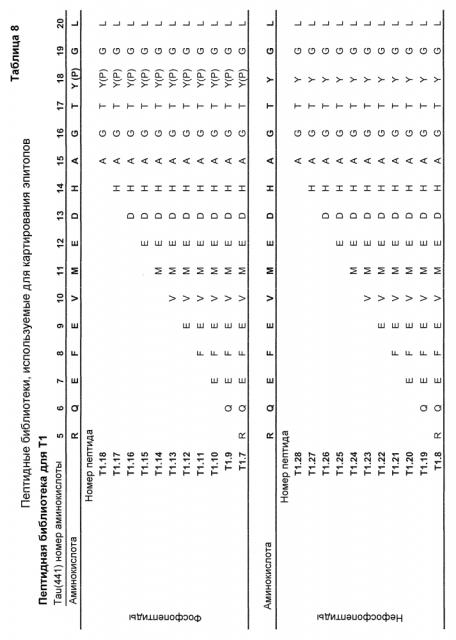
Один вариант осуществления (4) настоящего изобретения относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело связываются с эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека, показанном в SEQ ID NO: 67, выбранным из группы, состоящей из Tau а/к 15-20, включающих фосфорилированный Tyr в положении 18 (Y18), Tau а/к 405-412, включающих фосфорилированный Ser в положении 409 (pS409), Tau а/к 405-411, включающих фосфорилированный Ser в положении 409 (pS409); и Tau а/к 208-218, включающих фосфорилированный Thr в положении 212 (pT212) и фосфорилированный Ser в положении 214 (pS214).
Один вариант осуществления (5) относится к связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где указанный пептид связывается с эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека, но прежде всего на Tau-белке человека, показанном в SEQ ID NO: 67, включающем Tau а/к 15-20 с фосфорилированным Tyr в положении 18 (Y18).
Один вариант осуществления (6) относится к связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где указанный пептид связывается с эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека, но прежде всего на Tau-белке человека, показанном в SEQ ID NO: 67, включающем Tau а/к 405-412 с фосфорилированным Ser в положении 409 (pS409).
Один вариант осуществления (7) относится к связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где указанный пептид связывается с эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека, но прежде всего на Tau-белке человека, показанном в SEQ ID NO: 67, включающем Tau а/к 405-411 с фосфорилированным Ser в положении 409 (pS409).
Один вариант осуществления (8) относится к связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где указанный пептид связывается с эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека, но прежде всего на Tau-белке человека, показанном в SEQ ID NO: 67, включающем Tau а/к 208-218 с фосфорилированным Thr в положении 212 (pT212) и фосфорилированным Ser в положении 214 (pS214).
В другом варианте осуществления (9) настоящее изобретение относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело включают первый связывающий домен, который содержит, в частности в последовательности, CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 21, 24, 27, 28, 29, 32, 73, 81, 93, 101, 106, или аминокислотной последовательностью, по меньшей мере на 70%, в частности по меньшей мере на 80%, в частности по меньшей мере на 85%, в частности по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, в частности по меньшей мере на 95%, в частности по меньшей мере на 96%, в частности по меньшей мере на 97%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% или на 100% идентичной указанным последовательностям; CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 22, 25, 30, 33, 74, 82, 94, 102, 107, или аминокислотной последовательностью, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, в частности по меньшей мере на 95%, в частности по меньшей мере на 96%, в частности по меньшей мере на 97%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% или на 100% идентичной указанным последовательностям, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 23, 26, 31, 34, 75, 83, 95, 103, 108, или аминокислотной последовательностью, по меньшей мере на 60%, в частности по меньшей мере на 70%, в частности по меньшей мере на 80%, в частности по меньшей мере на 85%, в частности по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, в частности по меньшей мере на 95%, в частности по меньшей мере на 96%, в частности по меньшей мере на 97%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% или на 100% идентичной указанным последовательностям; и/или второй связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, 15, 18, 70, 78, 89, 98, или аминокислотной последовательностью, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, в частности по меньшей мере на 95%, в частности по меньшей мере на 96%, в частности по меньшей мере на 97%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% или на 100% идентичной указанным последовательностям; CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 13, 16, 19, 71, 79, 90, 99, 115, или аминокислотной последовательностью, по меньшей мере на 80%, в частности по меньшей мере на 85%, в частности по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, в частности по меньшей мере на 95%, в частности по меньшей мере на 96%, в частности по меньшей мере на 97%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% или на 100% идентичной указанным последовательностям, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 14, 17, 20, 72, 80, 91, 100, или аминокислотной последовательностью, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, в частности по меньшей мере на 85%, в частности по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, в частности по меньшей мере на 95%, в частности по меньшей мере на 96%, в частности по меньшей мере на 97%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% или на 100%, идентичной указанным последовательностям.
Один вариант осуществления (10) настоящего изобретения относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело включают первый связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 21, 24, 27, 28, 29, 32, 73, 81, или аминокислотной последовательностью, по меньшей мере на 85% идентичной указанным последовательностям; CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 22, 25, 30, 33, 74, 82, или аминокислотной последовательностью, по меньшей мере на 95% идентичной указанным последовательностям, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 23, 26, 31, 34, 75, 83, или аминокислотной последовательностью, по меньшей мере на 80% идентичной указанным последовательностям; и/или домен антитела, который содержит CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, 15, 18, 70, 78, или аминокислотной последовательностью, по меньшей мере на 95% идентичной указанным последовательностям: CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 3, 16, 19, 71, 79, или аминокислотной последовательностью, по меньшей мере на 85% идентичной указанным последовательностям, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 14, 17, 20, 72, 80, или аминокислотной последовательностью, по меньшей мере на 85% идентичной указанным последовательностям.
Один вариант осуществления (11) настоящего изобретения относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело включают первый связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 21, 24, 27, 28, 29, 32, 73, 81, или аминокислотной последовательностью, по меньшей мере на 90% идентичной указанным последовательностям; CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 22, 25, 30, 33, 74, 82, или аминокислотной последовательностью, по меньшей мере на 95% идентичной указанным последовательностям, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 23, 26, 31, 34, 75, 83, или аминокислотной последовательностью, по меньшей мере на 90% идентичной указанным последовательностям; и/или второй связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, 15, 18, 70, 78, или аминокислотной последовательностью, по меньшей мере на 95% идентичной указанным последовательностям; CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 13, 16, 19, 71, 79, или аминокислотной последовательностью, по меньшей мере на 95% идентичной указанным последовательностям, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 14, 17, 20, 72, 80, или аминокислотной последовательностью, по меньшей мере на 90% идентичной указанным последовательностям.
Один вариант осуществления (12) настоящего изобретения относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело включают первый связывающий домен (домен антитела), который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 21, 24, 27, 28, 29, 32, 73, 81, или аминокислотной последовательностью, по меньшей мере на 90% идентичной указанным последовательностям; CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 22, 25, 30, 33, 74, 82, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 23, 26, 31, 34, 75, 83, или аминокислотной последовательностью, по меньшей мере на 90% идентичной указанным последовательностям; и/или второй связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, 15, 18, 70, 78, CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 13, 16, 19, 71, 79, или аминокислотной последовательностью, по меньшей мере на 95% идентичной указанным последовательностям, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 14, 17, 20, 72, 80, или аминокислотной последовательностью, по меньшей мере на 90% идентичной указанным последовательностям.
Один вариант осуществления (13) настоящего изобретения относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело включают первый связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 21, 24, 27, 28, 29, 32, или аминокислотной последовательностью, по меньшей мере на 98% идентичной указанным последовательностям; CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO:; 22, 25, 30, 33, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 23, 26, 31, 34, или аминокислотной последовательностью, по меньшей мере на 95% идентичной указанным последовательностям; и/или второй связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, 15, 18, CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 13, 16, 19, или аминокислотной последовательностью, по меньшей мере на 95% идентичной указанным последовательностям, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 14, 17, 20, или аминокислотной последовательностью, по меньшей мере на 90% идентичной указанным последовательностям.
Один вариант осуществления (14) настоящего изобретения относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело включают первый связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 21, 24, 27, 28, 29, 32, или аминокислотной последовательностью, по меньшей мере на 98% идентичной указанным последовательностям; CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 22, 25, 30, 33, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 23, 26, 31, 34, или аминокислотной последовательностью, по меньшей мере на 98% идентичной указанным последовательностям; и/или второй связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, 15, 18, CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 13, 16, 19, или аминокислотной последовательностью, по меньшей мере на 98% идентичной указанным последовательностям, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 14, 17, 20, или аминокислотной последовательностью, по меньшей мере на 90% идентичной указанным последовательностям.
Один вариант осуществления (15) настоящего изобретения относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело включают первый связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 21, 24, 27, 28, 29, 32, 73, 81, 93, 101 или 106, CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 22, 25, 30, 33, 74, 82, 94, 102 или 107, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 23, 26, 31, 34, 75, 83, 95, 103 или 108, и/или второй связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, 15, 18, 70, 78, 89 или 98, CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 13, 16, 19, 71, 79, 90, 99 или 115, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 14, 17, 20, 72, 80, 91 или 100.
Один вариант осуществления (16) настоящего изобретения относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело включают первый связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 21, или аминокислотной последовательностью, по меньшей мере на 76%, в частности по меньшей мере на 80%, в частности по меньшей мере на 85%, в частности по меньшей мере на 90%, в частности по меньшей мере на 95%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% идентичной указанной последовательности, CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 22, или аминокислотной последовательностью, по меньшей мере на 95%, в частности на 98%, в частности на 99% идентичной указанной последовательности, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 23, или аминокислотной последовательностью, по меньшей мере на 66%, в частности по меньшей мере на 70%, в частности по меньшей мере на 75%, в частности по меньшей мере на 80%, в частности по меньшей мере на 85%, в частности по меньшей мере на 90%, в частности по меньшей мере на 95%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% идентичной указанной последовательности, и/или второй связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, или аминокислотной последовательностью, по меньшей мере на 95%, в частности на 98%, в частности на 99% идентичной указанной последовательности, CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 13, или аминокислотной последовательностью, по меньшей мере на 88%, в частности по меньшей мере на 90%, в частности по меньшей мере на 95%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% идентичной указанной последовательности, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 14, или аминокислотной последовательностью, по меньшей мере на 66%, в частности по меньшей мере на 70%, в частности по меньшей мере на 75%, в частности по меньшей мере на 80%, в частности по меньшей мере на 85%, в частности по меньшей мере на 90%, в частности по меньшей мере на 95%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% идентичной указанной последовательности.
Один вариант осуществления (17) настоящего изобретения относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, в особенности связывающему пептиду или антителу согласно любому из предыдущих вариантов осуществления, где связывающий пептид или антитело узнают и специфично связываются с фосфо-эпитопом на Tau-белке млекопитающего, в особенности на Tau-белке человека или на его фрагменте, в особенности с патологическим конформером Tau-белка, но, в одном варианте осуществления, не связываются с соответствующим нефосфорилированным эпитопом и/или с другими эпитопами, где указанный связывающий пептид или антитело включают первый связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 24, или SEQ ID NO: 27, или SEQ ID NO: 28, или аминокислотной последовательностью, по меньшей мере на 88%, в частности по меньшей мере на 85%, в частности по меньшей мере на 90%, в частности по меньшей мере на 95%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% идентичной указанным последовательностям, CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 25, или аминокислотной последовательностью, по меньшей мере на 95%, в частности на 98%, в частности на 99%, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 26, или аминокислотной последовательностью, по меньшей мере на 66%, в частности по меньшей мере на 70%, в частности по меньшей мере на 75%, в частности по меньшей мере на 80%, в частности по меньшей мере на 85%, в частности по меньшей мере на 90%, в частности по меньшей мере на 95%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99%, идентичной указанной последовательности, и/или второй связывающий домен, который содержит в последовательности CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, или аминокислотной последовательностью, по меньшей мере на 95%, в частности на 98%, в частности на 99% идентичной указанной последовательности, CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 13, или аминокислотной последовательностью, по меньшей мере на 88%, в частности по меньшей мере на 90%, в частности по меньшей мере на 95%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% идентичной указанной последовательности, и CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 14, или аминокислотной последовательностью, по меньшей мере на 66%, в частности по меньшей мере на 70%, в частности по меньшей мере на 75%, в частности по меньшей мере на 80%, в частности по меньшей мере на 85%, в частности по меньшей мере на 90%, в частности по меньшей мере на 95%, в частности по меньшей мере на 98%, в частности по меньшей мере на 99% идентичной указанной последовательности.
Один вариант осуществления (18) настоящего изобретения относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, согласно варианту осуществления (15), включающим первый связывающий домен, где CDR1 имеет аминокислотную последовательность, которая показана в SEQ ID NO: 27, или аминокислотную последовательность, по меньшей мере на 88% идентичную указанной последовательности.
Один вариант осуществления (19) настоящего изобретения относится к связывающему пептиду или белку, или их функциональной части, в особенности к антителу, в особенности моноклональному антителу или его функциональной части, согласно варианту осуществления (15), включающим первый связывающий домен, где CDR1 имеет аминокислотную последовательность, которая показана в SEQ ID NO: 28, или аминокислотную последовательность, по меньшей мере на 88% идентичную указанной последовательности.
Один вариант осуществления (20) настоящего изобретения отно