Трансгенное растение осины с пониженной скоростью разложения древесины
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к трансгенному растению осины, которое демонстрирует пониженную скорость разложения древесины по сравнению с нетрансформированным растением, содержащему XegA трансген, который кодирует фермент ксилоглюканазу гриба Penicillium canescens с сигнальным пептидом целлюлазы тополя белого. Использование настоящего изобретения позволит значительно упростить технологии деревообрабатывающей промышленности и сделать строительство более рентабельным. 6 ил., 1 табл.
Реферат
Изобретение относится к области генной инженерии и биотехнологии растений и может быть использовано в лесном хозяйстве, строительстве и других отраслях народного хозяйства, использующих осину в качестве сырья.
Разложение древесины (гниение) - естественный процесс, в котором участвуют разрушающие дерево грибы и некоторые бактерии. Скорость гниения древесины во многом определяет ее ценность особенно для строительства. Поселяясь на деревянных частях домов и других построек, на штабелях лесоматериалов, грибы со временем приводят древесину в полную негодность. В этой связи существуют различные способы обработки древесных изделий, для снижения скорости их разложения. Однако создание древесных растений с изначально пониженной скоростью разложения, то есть воздействия микроорганизмов, поможет значительно упростить технологии деревообрабатывающей промышленности и строительство сделать более рентабельным.
Осина - мягколиственная древесная порода, все больше используемая в строительстве, которая является ценной лесной породой благодаря хорошей скорости роста и нетребовательности к условиям произрастания.
В патентных базах отсутствуют документы, касающиеся патентования отдельных технических решений, используемых для уменьшения скорости разложения древесных растений. Однако существует большое количество наработок, охватывающих область повышения устойчивости к грибам и почвенным бактериям. Найдено несколько стратегий повышения устойчивости растений к грибному воздействию: иммунизация и предварительная обработка семян, изменение агротехники и внесение в геном растения рекомбинантных конструкций.
Известен патент на изобретение №2249363 (10.04.2005) «Композиция для иммунизации растений», патентообладатель: Новартис АГ (СН). В изобретении описывается агент, предназначенный для индуцирования у растений устойчивости к фитопатогенным грибам, который представляет собой экстракт из биомассы нефитопатогенных микроорганизмов. Способ получения агента включает следующие стадии: ресуспендирование от 50 г до 200 г (сухой вес) биомассы нефитопатогенных микроорганизмов в 1 л неорганического или органического растворителя, перемешивание при комнатной температуре, инкубацию, ресуспендирование, охлаждение до комнатной температуры при выстаивании. Введение описанной композиции ведет к появлению устойчивости к различным видам микроорганизмов.
Известна заявка на изобретение №2002128414 (20.08.2004) «Способ получения трансгенных растений с повышенной устойчивостью к фитопатогенам», заявитель: Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова Российской Академии Наук (RU). Способ получения трансгенных растений земляники садовой с повышенной устойчивостью к фитопатогенам, включает в себя трансформацию стартовых эксплантов бактериальной суспензией Agrobacterium tumefaciens, содержащей по крайней мере один вектор, в состав которого входит по крайней мере один представляющий интерес ген (PR1, PR2, PR3, PR4, PR5).
В патенте РФ №2173519 (20.09.2001) «Способ получения индуктора устойчивости растений к грибковым заболеваниям», патентообладатель: Егоров И.В.; Чекасина Е.В., описывается способ повышения устойчивости к различным видам грибов, путем предварительной обработки семян индуктором устойчивости растений, извлекаемый из культуральной жидкости гриба Sclerotinia sclerotiorum. Величина иммунного ответа при биотестировании индукторами, полученными из культуральных жидкостей гриба, выращенного для получения каждого индуктора на определенной питательной среде для семян подсолнечника, составила 32,8-62,2, для семян огурца - 29,3-60,3%. Процент поражения почвенным грибами уменьшился до 20-29,1%.
Известно изобретение РФ №2080788 (10.06.1997), патентообладатель: Агафонов Ю.В. «Средство, повышающее устойчивость сельскохозяйственных культур к грибной инфекции». В изобретении описывается способ повышения устойчивости к грибам посредством реализации подхода по стимулированию у растений собственных защитных механизмов. Использовалась реализация перспективного направления иммунизации растений не живыми биологическими объектами, а продуктами их метаболизма - алкеновые кислоты С22-ряда, содержащие 4-6 двойных связей, в концентрации 10-8-10-7. Изменения в устойчивости растений на искусственном инфекционном фоне выявляли с помощью многократных заражений и последующего вычисления индекса поражения картофеля. Результаты заражения учитывали через 10 дней. В среднем в опыте: индекс поражения листовой поверхности 4, балл устойчивости 7, в контроле: индекс поражения листовой поверхности 10, балл устойчивости 3.
В патенте РФ №2240680 (27.11.2004) «Способ создания устойчивых к корневым гнилям и пожарам смешанных лесов», описано другое техническое решение для повышения устойчивости к литическим грибам. Вначале проводят осеннюю полосную обработку почвы вдоль склонов с образованием посадочных кулис и необработанных полос. На посадочных кулисах рядами высаживают кустарники и сопутствующие породы с оставлением мест под посадку главных пород. В местах под посадку главных пород готовят посадочные ямы, засыпают их смесью лесной земли, песка, гумусового горизонта и торфа ниже уровня почвы до 10 см. Поздней осенью высаживают главные породы, образуя ряды с чередованием кустарника, сопутствующих и главных пород. Это позволит создать тип высокопродуктивных устойчивых к корневым гнилям и пожарам смешанных лесов на землях мелиоративного фонда.
Подобное техническое решение описано в патенте РФ №2513751 (20.11.2013) «Способ совместного выращивания дубово-хвойных пород с качественной древесиной», заявитель: Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Марийский государственный технический университет". Способ представляет собой совместное выращивание дубово-хвойных пород с качественной древесиной, включает полосную обработку почвы глубоким рыхлением и высаживание рядами главных пород с чередованием кустарника и сопутствующих пород. Одновременно выращивают три главные породы - сосну, ель и дуб. Между рядами сосны и дуба располагают буферный ряд из лиственных пород и ряды ели. В 5-летнем возрасте производят отбор качественных деревьев с обрезкой ветвей в нижней части кроны и удаляют примесь порослевого возобновления. В 15-летнем возрасте у качественных деревьев проводят обрезку мертвых сучьев и живых не ассимилирующих ветвей. Способ обеспечивает возможность совместного выращивания главных пород: сосны, ели и дуба, устойчивых к поражению корневыми и стволовыми гнилями, с высоким качеством древесины.
Альтернативный способ повышения устойчивости к разлагающим грибам описано в патенте Южной Кореи KR 20000029948 (2000-05-25) «Peptide with inhibitory activity towards plant pathogenic fungi», приводится технология создания трансгенных растений, устойчивых к действию грибов посредством экспрессии пептида из гена бычьего Lactoferricin. Для указанного пептида было обнаружено, что он обладает противогрибковой активностью в отношении различных грибных фитопатогенов.
В международном патенте WO 2007000579 (2007-01-04) «Transgenic plants over-expressing extensin with increased plant pathogenresistance», для появления устойчивости к некоторым грибам предлагается также введение рекомбинантного гена. Авторы полагают, что геном растительной клетки, модифицированной для сверхэкспрессии экстенсина по сравнению с нетрансгенной клетке контрольного того же вида, будет иметь большую устойчивость.
Известен патент США № US 2011107457 (2011-05-05) «Method for producing а transgenic plant cell, a plant or a part thereof with increased resistance to plant disease», где также рассматривается способы получения трансгенных растений с повышенной устойчивостью к грибковым возбудителям, экспрессирующие векторы, содержащие полинуклеотиды, кодирующие функциональные белки.
В международном патенте WO 2004097023 (2004-11-11) «Plants with pathogen resistance», были разработаны трансгенные растительные клетки и непосредственно сами трансгенные растения, имеющие устойчивость к биотическим факторам, указанных растений устойчивы к ранней атаке патогена. В основе изобретения лежит введение в генетическую конструкцию промотора, помогающего оперативно реагировать на внедрение патогена, а также выработку защитных веществ. Описанный промотор является тканеспецифичным, продукты экспрессии локализуются в корневой системе.
В патенте США US 6781036 (2004-08-24) «Enhancing lignin biosynthesis in transgenic plants», авторы Martin F. Yanofsky, Sarah Liljegren, предлагается еще одно техническое решение проблемы уменьшения скорости разложения древесины. Настоящее изобретение относится к способам повышения биосинтеза лигнина в растениях. Изобретение обеспечивает увеличение одревеснения в растении путем эктопически экспрессирующих молекулу нуклеиновой кислоты, кодирующую генный продукт AGL1-подобные, или генный продукт AGL1, как и продукт гена AGL5, в растении. Увеличение содержания лигнина в древесине приводит к уменьшению воздействия различных видов грибов.
Наиболее близким техническим решением из описанных в области создания растений с пониженной скоростью разложения древесины является международный патент № WO 2000071670 (30.11.2000) «Method for enhancing cellulose and modifying lignin biosynthesis in plants», авторы Daniel T. Carraway, Joshi P. Chandrashekhar, Vincent L. Chiang, Luguang Wu. В качестве рекомбинантного использовался белок CelA синтазы целлюлозы древесных пород, ген находится по контролем индуцируемого промотора целлюлозной синтазы (CelAP) из растений осины. Синтаза целлюлозы осины содержит около 978 аминокислот и имеет молекулярную массу около 110 кДа и pi около 6,58. Конструкция имела в своем составе ген β-глюкуронидазы (GUS) для дальнейшей идентификации трансгенов. Внесение гена был проведено с помощью агробактериальной трансформации. Изобретение позволяет получить трансгенные древесные растения с повышенным содержанием целлюлозы, пониженным содержанием лигнина, а следовательно, улучшенными характеристиками свойств древесного волокна. Кроме того, изобретение обеспечивает новую экспериментальную систему для изучения экспрессии гена CelA и их функционирования в деревьях. Активный биосинтез целлюлозы сопровождается удлинением клеток, вызванной утолщением стенки, указывает на высокую экспрессию синтазы целлюлозы в клетках первичной ксилемы. В начале вторичного роста у зрелых междоузлий было отмечено, что экспрессия синтазы целлюлозы также исключительно локализована в клетках ксилемы. Вместо удлинения дистальных междоузлий наблюдается рост в основном в радиальном направлении, связанном с утолщением клеточных стенок вторичной ксилемы. Результаты показывают, что повышение экспрессии синтазы целлюлозы приводит к увеличению биосинтеза более высококристаллической целлюлозы. Это обеспечивает получение деревьев с повышенной прочностью древесины. Возможное повышение прочности древесины напрямую может придать устойчивость к различным факторам среды. Однако конкретных исследований по разложению древесины таких растений не проводилось. Выводы основаны лишь на косвенных фактах.
Целью предлагаемого изобретения является внедрение в дикий генотип осины Pt (Populus tremula L.) трансгена, влияющего на толщину клеточной стенки и понижение скорости разложения древесины, что позволит получить необходимый для использования растительный материал без дополнительных обработок. Экономия достигается за счет снижения времени и трудозатрат на получение древесины необходимого качества.
Поставленная цель достигается за счет изменения структуры клеточной стенки растений. Это связано с тем, что воздействие разлагающих агентов зависит от толщины клеточной стенки. Толщина клеточной стенки напрямую зависит от содержания в ней целлюлозы. Ксилоглюкан является полисахаридом гемицеллюлозы растительной клеточной стенки, который поперечно сшивает прилегающие микрофибриллы целлюлозы, обеспечивая формирование прочного каркаса. Известно, что образование целлюлозы ограничено степенью связывания с ксилоглюканом, его расщепление может повлиять на увеличение биосинтеза целлюлозы (Bauman M.J., Eklo G., Michel M., Kallas T.T., Teeri M., Czjzek, H. Brumer. Structural Evidence for the Evolution of Xyloglucanase Activity from Xyloglucan Endo-Transglycosylases // Biological Implications for Cell Wall Metabolism. The Plant Cell. - 2007. - V. 19. - P. 1947-1963). Ксилоглюканаза - один из таких ферментов, относящийся к группе карбогидраз, который, гидролизуя ксилоглюканы, разрушает поперечную «сшивку» целлюлозных микрофибрилл, что приводит к увеличению содержания целлюлозы (Видягина Е.О., Ковалицкая Ю.А., Улько Д.О., Шестибратов К.А. Анализ перспективных клонов растений осины с рекомбинантным геном ксилоглюканазы //Материалы V Международного симпозиума РКСД «Строение, свойства и качество древесины - 2014» //Сборник трудов - М.: МГУЛ, 2015, с. 34-39).
Суть изобретения состоит в том, что в геном осины был интегрирован химерный ген XegA из гриба Penicillium canescens с сигнальным пептидом целлюлазы тополя белого (SEQ ID NO: 1, SEQ ID NO: 2). Для трансформации осины использовали штамм Agrobacterium tumefaciens СВЕ21 с Ti-плазмидой рСВЕ21. Агробактериальный штамм содержал бинарный вектор pBI-Xeg, содержащий ген XegA под контролем 35S промотора.
Анализ известных биоинженерных продуктов, проведенный по научно-технической и патентной документации, показал, что совокупность существенных признаков заявляемого продукта неизвестна из уровня техники, следовательно, продукт соответствует условию патентоспособности изобретения «новизна».
Предлагаемый продукт получают следующим образом.
Агробактериальная трансформация осины:
1. В 50 мл жидкой среды Luria-Bertoni (LB) (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl), дополнительно содержащей 50 мг/л канамицина, добавляют 100 мкл суспензии агробактериальных клеток и инкубируют при 27-28°С в течение суток. Суспензию наросших клеток осаждают центрифугированием, промывают и ресуспендируют в 50 мл жидкой среды MS (Murashige T. & Skoog F., A revised medium for rapid growth and bioassays with tobacco tissue culture. // Physiol. Plant, 15 (1962) 473-497).
2. В чашки Петри заливают по 25 мл агаризованной модифицированной среды MS (соли MS + 20 мМ KNO3 + 10 мМ NH4NO3) с добавлением 0,5 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-Д).
3. Нарезают экспланты из междоузлий микрорастений осины длиной 5-10 мм.
4. Экспланты заливают агробактериальной суспензией в среде MS и инкубируют 20 минут при комнатной температуре.
5. Затем экспланты подсушивают на фильтровальной бумаге и помещают на модифицированную среду MS.
6. Экспланты инкубируют на свету в течение 48 часов, после чего промывают их в дистиллированной воде с добавлением цефотаксима (1 г/л) в течение 20-30 минут.
7. Отмытые экспланты подсушивают на фильтрах и раскладывают на модифицированную среду MS, содержащую 0,5 мг/л зеатина, 30 мг/л канамицина и 500 мг/л цефотаксима. На данной среде производят регенерацию и селекцию трансформантов.
Регенерировавшие растения, которые демонстрировали нормальный рост в присутствии селективного агента канамицина, проверяли на наличие вставки гена XegA, используя метод полимеразной цепной реакции (ПЦР), также регенераты оценивают на наличие агробактериальной контаминации. Для этого из микрорастений выделяют тотальную растительную ДНК по стандартной методике Rogers и Benedich (Rogers S.О., Bendich A.J. (1994). Extraction of DNA from plant, fungal and algal tissues. In:, Gelvin SB, Schilperoort RA (eds) Plant Molecular Biology Manual. Boston, MA: Kluwer Academic Publishers, D 1: 1-8.)
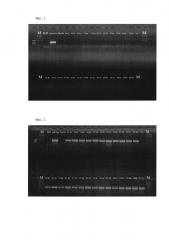
ПЦР анализ ДНК отдельных регенерантов проводят в следующих условиях: реакционная смесь содержала 16 мМ (NH4)2SO4, 0,01% бычий сывороточный альбумин, 200 мкМ каждого дНТФ, 0,4 мкМ каждого праймера, 0,05 ед./мкл Taq-полимеразы, 1-5 нг/мкл растительной ДНК. Реакции проводят на амплификаторе MJ MiniTM Gradient Thermal Cycler (BIO-RAD). Режим амплификации: 3 мин денатурация при 96°С, 45 сек денатурация при 94°С, 45 сек отжиг при 58°С, элонгация 1 мин при 72°С, 5 мин достройка при 72°С, 31 цикл амплификации. Все линии осины в первую очередь анализируют на наличие агробактериальной контаминации. Геномную ДНК анализируют на присутствие агробактериального гена VirB. Для этого бралась пара праймеров Vir-B1 (SEQ ID NO: 3). и VirB2 (SEQ ID NO: 4). Размер амплифицируемого фрагмента 670 п. н. Результаты анализа показали, что все двадцать пять анализируемых линий не были контаминированы агробактериями (фиг. 1).
После этого все двадцать пять линий, проверенные на агробактериальную контаминацию ранее, были проанализированы на наличие вставки гена XegA с использованием пары праймеров xeg-up (SEQ ID NO: 5) и xeg-low (SEQ ID NO: 6). Размер амплифицируемого фрагмента 762 п. н. Анализ препаратов геномной ДНК регенерировавших растений показал, что во всех линиях содержалась вставка гена XegA (фиг. 2).
Трансформанты с подтвержденной вставкой гена XegA были размножены в условиях in vitro и после укоренения адаптированы к естественным условиям окружающей среды. Через 2 года для растений трансгенных линий осины (PtXVXeg1b, PtXVXe3b), а также растений контрольной нетрансформированной линии (Pt) было определено содержание целлюлозы, определена толщина клеток ксилемы и скорость разложения. Используя азотно-спиртовой метод (Оболенская А.В., Ельницкая З.П., Леонович А.А. Лабораторные работы по химии древесины. // М.: «Экология». - 1991. - С. 320), было определено содержание целлюлозы в линиях PtXVXeg1b и PtXVXeg3b. Скорость разложении определяли путем оценки потери массы и эмиссии СО2. Эксперименты заложены в трехкратной повторности (80, 50 и 20% от предельной влагоемкости). Для оценки потери массы 300 мг растительной ткани (стебли, корни, листья) помещали в слой песка (50 г) в стеклянных банках объемом 300 мл и добавляли воду до 80, 50 и 20% от полной влагоемкости песка. Разложение проходило при 22-24°С, потерю массы определяли через 0,5 (только для листьев), 1, 2, 3,5, 5, 7, 9 и 12 месяцев. Для оценки эмиссии СО2 100 мг ткани (стебли, корни, листья) смешивали с 2 г песка, помещали в пробирки на 9 мл и добавляли воду до 80, 50 и 20% от полной влагоемкости песка. Разложение проходило при 22, 12 или 2°С. Эмиссию СО2 определяли с помощью газового хроматографа (21 проба в течение 365 дней).
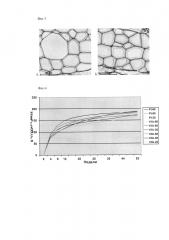
Содержание целлюлозы в линиях было выше, чем в контрольных (таблица 1). Была проведена электронная микроскопия ксилемы двухлетних растений осины, которая показала увеличение толщины клеточной стенки в выбранных клонах. Толщина клеток ксилемы в растениях первого года вегетации для клона PtXVXeg3b в среднем составляла 1,47 мкм, для растений клона PtXVXeg1b - 1,80 мкм, для нетрансгенного контроля - 1,16 мкм; для растений второго года вегетации - 1,84 мкм, 1,91 мкм и 1,76 мкм, соответственно (Фиг. 3).
Эксперименты показали, что скорость разложения листьев, стеблей и корней трансгенных растений осины с генами XegA ожидаемо уменьшалась (примерно в 2 раза) с понижением температуры с 22 до 2°С. Уровень влажности (80, 50 или 20%) не оказал существенного влияния на разложение различных органов растений осины, но наблюдались различия между трансгенными и контрольными растениями. Скорости разложения листьев с различных клонов и контролей отличались между собой незначительно, всего на 10% (Фиг. 4). Стебли клонов осины с геном XegA разлагались медленнее контроля примерно в 2 раза (Фиг. 5). Эмиссия СО2 корней клонов с геном XegA и контроля была схожей (Фиг. 6).
Таким образом, были получены трансгенные линии осины, обладающие пониженной скоростью разложения древесины. Преимуществом полученных растений являются улучшенные свойства древесного волокна: повышенное содержание целлюлозы и увеличение толщины клеточной стенки.
Перечень последовательностей:
Целевой ген - химерный ген из сигнального пептида целлюлазы тополя белого (фрагмент 1) и кодирующей последовательности ксилоглюканазы Penicillium canescens (фрагмент 2).
SEQ ID No: 1. Фрагмент 1
SEQ ID No: 2. Фрагмент 2
SEQ ID No: 3. Нуклеотидная последовательность праймера Vir-B1:
SEQ ID No: 4. Нуклеотидная последовательность праймера Vir-B2:
SEQ ID No: 5. Нуклеотидная последовательность праймера Xeg-up:
SEQ ID No: 6. Нуклеотидная последовательность праймера Xeg-low:
Краткое описание чертежей
Фиг. 1. Результаты ПЦР-анализа двадцати пяти трансгенных линий осины на присутствие агробактериального гена VirB
Размер ожидаемого амплифицируемого фрагмента 670 п.о. М - молекулярный маркер, total СВЕ21К - геномная ДНК агробактерий (положительный контроль), Pt - нетрансформированное растение (отрицательный контроль), H2O - вода, Gus5a - трансформированное растение (отрицательный контроль), 141а-168b - трансгенные линии осины.
Фиг. 2. Результаты ПЦР-анализа двадцати пяти трансгенных линий осины на присутствие гена XegA
Размер ожидаемого амплифицируемого фрагмента 762 п.о. М - молекулярный маркер, pBI-Xeg - плазмидная ДНК (положительный контроль), Pt - нетрансформированное растение (отрицательный контроль), Н2О - вода, Gus5a - трансформированное растение (отрицательный контроль), 141а-168b - трансгенные линии осины.
Фиг. 3. Микрофотография срезов клеток ксилемы растений второго года вегетации (А) дикий тип Pt, (Б) клон PtXVXeg1b.
Фиг. 4. Эмиссия СО2 при разложении листьев растений осины.
Pt-80 - растения контроля Pt при уровне влажности 80%, Pt-50 - растения контроля Pt при уровне влажности 50%, Pt-20 - растения контроля Pt при уровне влажности 20%, X1b-80 - растения контроля PtXVXeg1b при уровне влажности 80%, X1b-50 - растения контроля PtXVXeg1b при уровне влажности 50%, X1b-20 - растения контроля PtXVXeg1b при уровне влажности 20%, X3b-80 - растения контроля PtXVXeg3b при уровне влажности 80%, X3b-50 - растения контроля PtXVXeg3b при уровне влажности 50%, X3b-20 - растения контроля PtXVXeg3b при уровне влажности 20%.
Фиг.5. Эмиссия СО2 при разложении стеблей растений осины.
Pt-80 - растения контроля Pt при уровне влажности 80%, Pt-50 - растения контроля Pt при уровне влажности 50%, Pt-20 - растения контроля Pt при уровне влажности 20%, X1b-80 - растения контроля PtXVXeg1b при уровне влажности 80%, X1b-50 - растения контроля PtXVXeg1b при уровне влажности 50%, X1b-20 - растения контроля PtXVXeg1b при уровне влажности 20%, X3b-80 - растения контроля PtXVXeg3b при уровне влажности 80%, X3b-50 - растения контроля PtXVXeg3b при уровне влажности 50%, X3b-20 - растения контроля PtXVXeg3b при уровне влажности 20%.
Фиг. 6. Эмиссия СО2 при разложении корней растений осины.
Pt-80 - растения контроля Pt при уровне влажности 80%, Pt-50 - растения контроля Pt при уровне влажности 50%, Pt-20 - растения контроля Pt при уровне влажности 20%, X1b-80 - растения контроля PtXVXeg1b при уровне влажности 80%, X1b-50 - растения контроля PtXVXeg1b при уровне влажности 50%, X1b-20 - растения контроля PtXVXeg1b при уровне влажности 20%, X3b-80 - растения контроля PtXVXeg3b при уровне влажности 80%, X3b-50 - растения контроля PtXVXeg3b при уровне влажности 50%, X3b-20 - растения контроля PtXVXeg3b при уровне влажности 20%.
Перечень последовательностей
Целевой ген - химерный ген из сигнального пептида целлюлазы тополя белого (фрагмент 1) и кодирующей последовательности ксилоглюканазы Penicillium canescens (фрагмент 2).
SEQ ID No: 1. Фрагмент 1
5'-CTAGTGGATCCTTTGGAGGGGGGAA ATG GCTAATGCCACTACATTTTCAC
TAATGTTGCAGTTTTTCTTCGTAACTTTTTGTTGTCTGAGCTATTTTAG
CTTTGCCTTCACTTCTCTAGACTATGCT-3'
SEQ ID No: 2. Фрагмент 2
5'-GCTGCCAGTCTAGAGCGTCGTGCCGACTTCTGTGACCAGTGGGG T TCCACCACTACTGGCAGCTACATCGTCTACAATGACCTCTGGGGCCAGAGCTCCGACACCTCCGGCACCCAATGCACTGGCGTTGACTCGCTGAGCGGCAGCACTATTGCCTGGCACACCTCCTACTCCTGGTCCGGTGCTTCCAGCCAGGTCAAGAGCTTCGCCAACGTCGCGCTGCAGTTCACCGCAAAGACTCTGAGCAGCATTAGCAGCATCAAGTCTACCTGGAAGTGGTACTCGACCACCAACATCGTGGCCGATGTTGCCTACGACATGTTCCTGAGCTCCAGTGCATCCGGCTCCAACGAGTACGAGATCATGGTTTGGCTTGCTGCTCTGGGCGGTGCTGGACCTATCTCCTCCACCGGCTCGGCCATTGCTACTACCACCATCAACGGTGTTACCTGGAAGCTGTACAAGGGCCCCAATGGCTCCATGACCGTCTACAGCTTTGTCGCTGAGTCCACTGTTACTAGCTTCTCTGGTGACATGCTTGCCTTCTTCACCTACCTCATCAAAAACCAGGGTCTGAGCTCTAGCCTCTACCTTGTTGATGTCCAGGCTGGCACCGAGCCCTTCACTGGTACTGCCAAGCTGACAGCCTCTTCTTACTCTGCCGATGTTGCC TAA ATGCGAGGTTGANGGAAGTTGATAGTTGGTGCGGTGGAAATGAAACCCGGGATCG-3'
SEQ ID No: 3. Нуклеотидная последовательность праймера Vir-B1:
5'- GGCTACATCGAAGATCGTATGAATG-3'
SEQ ID No: 4. Нуклеотидная последовательность праймера Vir-B2:
5'- GACTATAGCGATGGTTACGATGTTGAC-3'
SEQ ID No: 5. Нуклеотидная последовательность праймера Xeg-up:
5'- GAAATGGCTAATGCCACTACATT-3'
SEQ ID No: 6. Нуклеотидная последовательность праймера Xeg-low:
5'- GATTTAGGCAACATCGGCAG-3'
Трансгенное растение осины, которое демонстрирует пониженную скорость разложения древесины по сравнению с нетрансформированным растением, содержащее XegA трансген, который кодирует фермент ксилоглюканазу гриба Penicillium canescens (SEQ ID No: 2. 5′-GCTGCCAGTCTAGAGCGTCGTGCCGACTTCTGTGACCAGTGGGGTTCCACCACTACTGGCAGCTACATCGTCTACAATGACCTCTGGGGCCAGAGCTCCGACACCTCCGGCACCCAATGCACTGGCGTTGACTCGCTGAGCGGCAGCACTATTGCCTGGCACACCTCCTACTCCTGGTCCGGTGCTTCCAGCCAGGTCAAGAGCTTCGCCAACGTCGCGCTGCAGTTCACCGCAAAGACTCTGAGCAGCATTAGCAGCATCAAGTCTACCTGGAAGTGGTACTCGACCACCAACATCGTGGCCGATGTTGCCTACGACATGTTCCTGAGCTCCAGTGCATCCGGCTCCAACGAGTACGAGATCATGGTTTGGCTTGCTGCTCTGGGCGGTGCTGGACCTATCTCCTCCACCGGCTCGGCCATTGCTACTACCACCATCAACGGTGTTACCTGGAAGCTGTACAAGGGCCCCAATGGCTCCATGACCGTCTACAGCTTTGTCGCTGAGTCCACTGTTACTAGCTTCTCTGGTGACATGCTTGCCTTCTTCACCTACCTCATCAAAAACCAGGGTCTGAGCTCTAGCCTCTACCTTGTTGATGTCCAGGCTGGCACCGAGCCCTTCACTGGTACTGCCAAGCTGACAGCCTCTTCTTACTCTGCCGATGTTGCCTAAATGCGAGGTTGANGGAAGTTGATAGTTGGTGCGGTGGAAATGAAACCCGGGATCG-3′) с сигнальным пептидом целлюлазы тополя белого (SEQ ID No: 1. 5′- CTAGTGGATCCTTTGGAGGGGGGAAATGGCTAATGCCACTACATTTTCACTAATGTTGCAGTTTTTCTTCGTAACTTTTTGTTGTCTGAGCTATTTTAGCTTTGCCTTCACTTCTCTAGACTATGCT-3′).