Новый способ получения дифференцированных клеток
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ получения зрелых мегакариоцитарных клеток. Способ включает принудительную экспрессию онкогена, выбранного из генов семейства MYC, и гена, выбранного из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8, в гемопоэтических клетках-предшественниках, CD34-положительных клетках, или мегакариоцитарных клетках-предшественниках без мульти-полиплоидизации, и культивирование и выращивание указанных клеток; и дифференцировку выращенных клеток в зрелые мегакариоцитарные клетки. Также описан способ получения препарата тромбоцитов, включающий: получение зрелых мегакариоцитарных клеток описанным выше способом; извлечение из культуры мегакариоцитарных клеток фракции культурального раствора, которая изобилует тромбоцитами, высвобожденными из мегакариоцитарных клеток; и удаление из указанной фракции иных компонентов клеток крови, отличных от тромбоцитов. Представлены препараты клеток для получения зрелых мегакариоцитарных клеток и тромбоцитов, содержащие мегакариоцитарные клетки-предшественники без мульти-полиплоидизации или зрелые мегакариоцитарные клетки, в которые введен онкоген, выбранный из генов семейства MYC, и ген, выбранный из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8. Описаны наборы для получения мегакариоцитарных клеток-предшественников на стадии премультинуклеации, для получения зрелых мегакариоцитарных клеток, для получения тромбоцитов. 9 н. и 2 з.п. ф-лы, 20 ил., 4 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения специфических дифференцированных клеток, и к клеткам, полученным данным способом. В частности, настоящее изобретение относится к способу получения дифференцированных клеток крови, и к клеткам крови, полученным указанным способом.
Предшествующий уровень техники
Когда для лечения заболевания требуются специфические клетки, необходимо обеспечить достаточное количество клеток для достижения лечебных задач. Однако получить достаточное количество клеток, используемых для лечения, из живых организмов трудно. Поэтому были разработаны такие способы, как способ приготовления целевых клеток ex vivo путем индукции дифференцировки клеток-предшественников или подобные ему.
При лечении гематологических заболеваний или выполнении хирургических процедур, требуются клетки крови, используемые для указанного лечения. Из клеток крови особенно востребованы тромбоциты, необходимые для коагуляции крови (гемостаза), и мегакариоцитарные клетки, ответственные за продукцию протромбоцитов и последующее образование тромбоцитов. В частности, тромбоциты особенно востребованы при лечении лейкемии, при трансплантации костного мозга, терапии онкологических заболеваний, и поэтому имеется существенная потребность в стабильных поставках тромбоцитов. Способы, используемые для получения тромбоцитов, включают не только способ сбора крови от доноров, но также способ применения ТПО-миметических продуктов, способ дифференцировки мегакариоцитарных клеток из пуповинной крови или миелоидных клеток, и так далее. Кроме того, созданы такие способы, как способ приготовления клеток крови из гемопоэтических стволовых клеток или гемопоэтических клеток-предшественников после размножения этих клеток- предшественников ex vivo. Примеры описанных способов включают способ получения линии гемопоэтических клеток из эмбриональных стволовых клеток мыши (патентный документ 1), способ дифференцировки эмбриональных стволовых клеток у приматов в гемопоэтические клетки (патентный документ 2), и способ легкого и стабильного размножения С034-позитивных/С038-негативных клеток, поддерживающих отсутствие дифференцировки гемопоэтических стволовых клеток ех vivo (патентный документ 3).
При индукции дифференцировки клеток, особенно удобными являются плюрипотентные стволовые клетки. Плюрипотентные стволовые клетки, такие как ЭС (эмбриональные стволовые) клетки и ИПС (индуцированные плюрипотентные стволовые) клетки, могут применяться в качестве источника искусственно получаемых клеток крови, таких как тромбоциты. В последние годы получение ИПС клеток способствовало повышению внимания к использованию плюрипотентных стволовых клеток в качестве важного источника для клеточной терапии в регенеративной медицине. Например, Takayama и др. индуцировали дифференцировку человеческих ЭС клеток в мегакариоцитарные клетки и тромбоциты, обеспечив возможность применения тромбоцитов, дифференцированных из ЭС клеток, в качестве источника трансфузии тромбоцитов (патентный документ 4 и не патентный документ 1). Авторы указанного изобретения дополнительно разработали способ получения мегакариоцитарных клеток и тромбоцитов из ИПС клеток, что сделало возможным решение проблемы совместимости человеческого лейкоцитарного антигена (HLA), неизбежной при трансфузии тромбоцитов, полученных из ЭС клеток. Хотя стабильная поставка достаточного количества тромбоцитов из крови доноров обычно затруднена из-за таких факторов, как хронический дефицит доноров, эта проблема кажется разрешимой путем индукции дифференцировки тромбоцитов из ЭС клеток или ИПС клеток. В соответствии с предполагаемыми способами, однако, лишь небольшое количество тромбоцитов можно получить из ИПС клеток или ЭС клеток, и кроме того, каждый раз нужно проводить ряд операций для их получения. Таким образом, необходимо обеспечить усовершенствованный, эффективный способ для обеспечения стабильного количества тромбоцитов.
Проблема, которую необходимо решить для обеспечения стабильного запаса достаточного количества клеток крови, таких как мегакариоцитарные клетки и тромбоциты, также существует при получении других типов клеток.
Таким образом, даже в случае получения необходимых клеток путем индукции дифференцировки клеток, нелегко приготовить клетки-предшественники для необходимых клеток в большом количестве, так что в настоящее время трудно обеспечить достаточное количество терминально-дифференцированных необходимых клеток.
Документы из предшествующего уровня техники
Патентные документы
Патентный документ 1: Опубликованная Японская патентная заявка №2006-141356
Патентный документ 2: Опубликованная Японская патентная заявка №2004-350601
Патентный документ 3: Опубликованная Японская патентная заявка №2006-61106
Патентный документ 4: WO 2008/041370
Не патентные документы
Не патентный документ 1: Takayama et al.. Blood, 111: 5298-5306, 2008.
Изложение сущности изобретения
Проблемы, решаемые настоящим изобретением
В отношении клеток крови, авторы настоящего изобретения разработали способ получения мегакариоцитов и тромбоцитов из ИПС клеток. Однако перед клиническим применением данного способа его необходимо усовершенствовать так, чтобы было возможно получать мегакариоциты и тромбоциты в большом количестве. Также важно обеспечить быстрое и стабильное получение тромбоцитов в соответствии с потребностью для реализации будущих клинических приложений.
С учетом вышеизложенных обстоятельств, настоящее изобретение обеспечивает способ получения целевых клеток посредством индукции дифференцировки клеток путем увеличения способности клеток к росту на необходимой стадии дифференцировки и размножения клеток для получения целевых клеток из этих клеток.
Настоящее изобретение также обеспечивает необходимые дифференцированные клетки крови с применением этого способа. В частности, настоящее изобретение обеспечивает мегакариоцитарную клетку-предшественник с высокой способностью к росту, которая служит в качестве источника зрелых мегакариоцитарных клеток и тромбоцитов, и способ получения таких мегакариоцитарных клеток-предшественников.
Кроме того, настоящее изобретение имеет своей задачей обеспечение способа получения зрелых мегакариоцитарных клеток и тромбоцитов из мегакариоцитарных клеток-предшественников стабильно в больших количествах, а также обеспечение зрелых мегакариоцитарных клетков, полученных этим способом, и тромбоциты, дифференцированные при индукции из зрелых мегакариоцитарных клеток.
Настоящее изобретение также имеет своей задачей обеспечение способа получения эритроидных клеток и эритроидных клеток, полученных этим способом, поскольку стабильный запас эритроидных клеток требуется в такой же степени, как и для тромбоцитов.
Кроме того, настоящее изобретение имеет своей задачей обеспечение долговременной консервации мегакариоцитарных клеток-предшественников, т.е. мегакариоцитарных клеток в незрелом состоянии, являющихся клетками-предшественниками тромбоцитов. Средства решения проблемы В результате сравнения мегакариоцитарной и тромбоцитарной продуктивности ИПС клеток, полученных с применением четырех генов (ОСТ3/4, SOX2, K.LF-4, c-MYC), и ИПС клеток с применением трех генов (ОСТ3/4, SOX2, KLF-4), отличных от c-MYC, авторы настоящего изобретения установили, что ИПС клетки с четырьмя генами продуцируют мегакариоциты и тромбоциты значительно более эффективно. Авторы настоящего изобретения также установили, что хотя экспрессия четырех генов, введенных в ходе создании линии, подавляется в ИПС клетках, реактивация гена c-MYC индуцируется с мегакариоцитарной дифференцировкой, что связано с увеличением продукции мегакариоцитов. Авторы настоящего изобретения далее установили, что мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, в которых принудительно экспрессируется ген c-MYC, приобретают высокую способность к росту.
Обычно в случае когдаонкоген, такой как c-MYC, экспрессируется в клетках в избыточном количестве, наблюдается развитие клеточного цикла и активация роста. Известно, что эти клетки воспринимают рост как стресс, и индуцируют защитный ответ (онкоген-индуцированное старение: ОИС) для подавления стресса, препятствуя таким образом избыточному клеточному росту. Авторы настоящего изобретения заметили данное явление и в дальнейшем открыли способ получения специфических дифференцированных клеток в большом количестве путем регуляции ОИС клеток на стадии дифференцировки.
Настоящее изобретение было выполнено на основе вышеупомянутых открытий.
Таким образом, настоящее изобретение относится к следующим аспектам (1)-(30).
(1) Способ получения специфических клеток путем индукции дифференцировки клеток, где онкоген принудительно экспрессируется в клетках на необходимой стадии дифференцировки для размножения клеток на необходимой стадии дифференцировки.
(2) Способ получения специфических клеток по вышеуказанному пункту (1), в котором супрессируется онкоген-индуцированное старение, которое индуцируется усиленной экспрессией онкогена в клетках на необходимой стадии дифференцировки.
(3) Способ получения специфических клеток в соответствии с вышеуказанными пунктами (1) или (2), в котором супрессия онкоген-индуцированного старения достигается путем экспрессии гена polycomb.
(4) Способ получения специфических клеток в соответствии с любым из вышеуказанных пунктов (1)-(3), где клетки на необходимой стадии дифференцировки являются клетками, полученными при индукции дифференцировки из ЭС клеток или ИПС клеток.
(5) Способ получения специфических клеток по любому из вышеуказанных пунктов (1)-(4), в котором на необходимой стадии дифференцировки в клетки вводят экзогенный онкоген, или онкоген и ген polycomb, и принудительно экспрессируют введенный онкоген или введенные онкоген и ген polycomb.
(6) Способ получения специфических клеток в соответствии с вышеупомянутым пунктом (5), в котором на необходимой стадии дифференцировки в клетки-предшественники вводят экзогенный онкоген или ген polycomb, и принудительно экспрессируют введенный онкоген или введенные онкоген и ген polycomb.
(7) Способ получения специфических клеток по любому из вышеуказанных пунктов (5) или (6), в котором онкоген и/или ген polycomb каждый функционально связан со стороной индуцируемого промотора в направлении транскрипции, и сцепленный онкоген или сцепленные онкоген и ген polycomb принудительно экспрессируются за счет индукции.
(8) Способ получения специфических клеток по любому из вышеуказанных пунктов (5)-(7), в котором на необходимой стадии дифференцировки в клетках супрессируется экспрессия онкогена или экспрессия онкогена и гена polycomb для стимулирования дифференцировки клеток на необходимой стадии дифференцировки.
(9) Способ получения специфических клеток в соответствии с вышеупомянутым пунктом (8), в котором супрессия экспрессии онкогена или экспрессии онкогена и гена polycomb достигается путем функционального связывания онкогена или онкогена и гена polycomb со стороной супрессирующего промотора в направлении транскрипции, подавленяя таким образом экспрессию онкогена или экспрессии онкогена и гена polycomb.
(10) Способ получения специфических клеток по любому из вышеуказанных пунктов (1)-(9), в котором онкогеном является ген семейства MYC.
(11) Способ получения специфических клеток по любому из вышеуказанных пунктов (3)-(10), в котором геном polycomb является BMI1.
(12) Способ получения специфических клеток по любому из вышеупомянутых пунктов (6)-(11), в котором клетками-предшественниками для клеток на необходимой стадии дифференцировки являются гемопоэтические клетки-предшественники, клетками на необходимой стадии дифференцировки являются мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, а специфическими клетками являются зрелые мегакариоцитарные клетки.
(13) Способ получения специфических клеток по любому из вышеупомянутых пунктов (6)-(11), в котором клетками-предшественниками для клеток на необходимой стадии дифференцировки являются гемопоэтические клетки-предшественники, клетками на необходимой стадии дифференцировки являются мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, а специфическими клетками являются тромбоциты.
(14) Способ получения специфических клеток по любому из вышеупомянутых пунктов (12) или (13), в котором гемопоэтические клетки-предшественники расположены в сетчатой структуре, изготовленной из ЭС клеток или ИПС клеток.
(15) Зрелая мегакариоцитарная клетка, являющаяся специфической клеткой, полученной способом по любому из вышеупомянутых пунктов (12) или (14).
(16) Тромбоцит, являющийся специфической клеткой, полученной способом по любому из вышеупомянутых пунктов (13) или (14).
(17) Продукт крови, содержащий в качестве активного ингредиента тромбоцит по вышеупомянутому пункту (16).
(18) Набор для получения зрелой мегакариоцитарной клетки по вышеупомянутому пункту (15) или тромбоцита по вышеупомянутому пункту (16).
(19) Клетка крови на необходимой стадии дифференцировки, в которой принудительно экспрессируется онкоген.
(20) Клетка крови по вышеупомянутому пункту (19), в которой также принудительно экспрессируется ген polycomb.
(21) Клетка крови по любому из вышеупомянутых пунктов (19) или (20), при этом указанная клеткой крови на необходимой стадии дифференцировки является клетка, полученная при индукции дифференцировки из ЭС клетки или ИПС клетки.
(22) Клетка крови по любому из вышеупомянутых пунктов (19)-(21), при этом в клетку крови на необходимой стадии дифференцировки введены экзогенный онкоген или онкоген и ген polycomb, и введенный онкоген или введенные онкоген и ген polycomb принудительно экспрессируются.
(23) Клетка крови по вышеупомянутому пункту (22), при этом в клетку-предшественник для клетки крови на необходимой стадии дифференцировки введены экзогенный онкоген или ген polycomb, и введенный онкоген или введенные онкоген и ген polycomb принудительно экспрессируются.
(24) Клетка крови по любому из вышеупомянутых пунктов (22) или (23), где онкоген и/или ген polycomb каждый функционально связаны со стороной индуцируемого промотора в направлении транскрипции, и связанный онкоген или связанные онкоген и ген polycomb принудительно экспрессируются за счет индукции.
(25) Клетка крови по любому из вышеупомянутых пунктов (19)-(24), в которой онкогеном является ген семейства МУС.
(26) Клетка крови по любому из вышеупомянутых пунктов (20)-(25), в которой геном polycomb является BMI 1.
(27) Клетка крови по любому из вышеупомянутых пунктов (23)-(26), в которой клеткой-предшественником для клетки крови на необходимой стадии дифференцировки является гемопоэтическая клетка-предшественник, а клеткой крови на необходимой стадии дифференцировки является мегакариоцитарная клетка-предшественник с пре-мультинуклеацией.
(28) Клетка крови по вышеупомянутому пункту (27), при этом гемопоэтическая клетка-предшественник расположена в сетчатой структуре, изготовленной из ЭС клетки или ИПС клетки.
(29) Замороженная клеточная композиция, содержащая клетку крови по любому из вышеупомянутых пунктов (19)-(28).
(30) Набор для получения мегакариоцитарной клетки-предшественника с премультинуклеацией, являющейся клеткой крови в соответствии с вышеупомянутыми пунктами (27) или (28).
Полезный эффект изобретения
В соответствии с настоящим изобретением можно размножать клетки на необходимой стадии дифференцировки, а также получать в большом количестве специфические клетки, дифференцированные из размноженных клеток.
В дополнение к этому, при применении настоящего изобретения для получения дифференцированных клеток крови, можно стабильно в большом количестве получать клетки крови, такие как мегакариоцитарные клетки и тромбоциты, из плюрипотентных стволовых клеток.
Кроме того, клетки крови, полученные в соответствии с настоящим изобретением, можно подвергать криоконсервированию. Например, когда в качестве клеток крови получают мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, указанные клетки можно подвергать криоконсервации. Следовательно, можно производить зрелые мегакариоцитарные клетки и тромбоциты, полученные из того же самого источника мегакариоцитарных клеток-предшественников.
В частности, в способе в соответствии с настоящим изобретением мегакариоцитарные клетки-предшественники без мульти-полиплоидизации (клетки-предшественники зрелых мегакариоцитарных клеток), которые можно подвергать криоконсервации, могут быть получены из ИПС клеток в большом количестве. С применением этих мегакариоцитарных клеток-предшественников без мульти-полиплоидизации в качестве источника, можно получать и наладить производство достаточного количества тромбоцитов для многократного переливания крови, устраняя в то же время проблему совпадения по HLA (человеческим лейкоцитарным антигенам).
Кроме того, в соответствии с настоящим изобретением обеспечивается способ стабильного получения эритроидных клеток in vitro.
Краткое описание чертежей
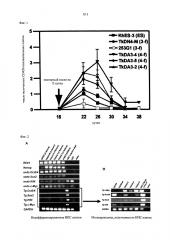
Фиг.1 является графиком для сравнения числа мегакариоцитарных клеток, полученных от четырехфакторных ИПС клеток и трехфакторных ИПС клеток. По вертикальной оси представлено число СD42b-положительных мегакариоцитарных клеток, полученных из каждой клетки, где число полученных из ЭС клетки CD42b-положительных мегакариоцитарных клеток на 22 день культивирования установлено равным 1. По горизонтальной оси представлено число дней после инкубации культуры ИПС клеток и ЭС клеток. «3-f» указывает на клеточную линию, полученную из треефакторной ИПС клетки, «4-f» - указывает на клеточную линию, полученную из четырехфакторной ИПС клетки, а «ЭС» указывает на ЭС клетки.
Фиг.2 является изображением для подтверждения реактивации трансгенов в мегакариоцитарных клетках человека, полученных из ИПС клетки. Экспрессию каждого трансгена (ОСТЗ/4, SOX2, KLF-4, c-MYC) в четырехфакторных ИПС клетках (TkDA3-2, TkDA3-4, и TkDA3-5) и трехфакторных ИПС клетках (TkDN4-M) оценивали для недифференцированных ИПС клеток и дифференцированных мегакариоцитарных клеток. Также оценивали экспрессию каждого гена, введенного в человеческие дермальные фибробласты (HDF) в качестве контроля введения гена. «Эндо» указывает на эндогенный ген, a «Tg» указывает на трансген. Также оценивали экспрессию REX1 и NANOG для недифференцированных ИПС клеток.
На Фиг.3 показано повышение числа мегакариоцитарных клеток за счет принудительной экспрессии c-MYC в гемопоэтических клетках-предшественниках, полученных из ЭС клеток. Клетки-предшественники крови экстрагировали из сетечатой структуры на 15 сутки культивирования ЭС клеток человека, каждый из генов (ОСТЗ/4, SOX2, KLF-4, c-MYC) по отдельности вводили в клетки-предшественники крови, и подсчитывали число мегакариоцитарных клеток, полученных со временем. По вертикальной оси представлено число С042b-положительных мегакариоцитарных клеток, полученных из каждой клетки, где число СВ42b-положительных мегакариоцитарных клеток, полученных из гемопоэтической клетки-предшественника (имитации), в которую был введен только один вирусный вектор, установлено равным 1. По горизонтальной оси представлено число дней после начала культивирования ЭС клеток.
Фиг.4 является графиком для сравнения числа тромбоцитов, полученных из четырехфакторных ИПС клеток и трехфакторных ИПС клеток. По вертикальной оси представлено число тромбоцитов, полученных из каждой клетки, где число тромбоцитов, полученных из ЭС клеток на 21 сутки культивирования, установлено равным 1. По горизонтальной оси представлено число дней после начала культивирования ИПС клеток и ЭС клеток. «3-f» указывает на клеточную линию, полученную из трехфакторной ИПС клетки, «4-f» - указывает на клеточную линию, полученную из четырехфакторной ИПС клетки, а «ЭС» указывает на ЭС клетки.
На Фиг.5 показан эксперимент по трансфузии на мышиной модели с применением тромбоцитов, полученных из ИПС клеток. Иммунодефицитные мыши с моделью тромбоцитопении были получены при предварительном облучении (А). Тромбоциты, полученные из клеточной линии TkDA3-4, вводили через хвостовую вену иммунодефицитной мыши. На Фиг.5 В показаны зависимые от времени изменения после трансфузии (30 минут, 2 часа, 24 часа). «РВ» указывает на периферическую кровь человека.
Фиг.6 является изображением для подтверждения тромбообразующей способности тромбоцитов, полученных из ИПС клеток человека, т vivo. Тромбоциты, полученные из ИПС клеток человека, окрашивали тетраметилродамин-этиловым эфиром (ТМРЭ, красный пигмент), смешанным с гематопорфирином, и вводили через хвостовую вену мыши. Состояние формирования тромба в кровеносном сосуде спустя 0 секунд, 6 секунд, 13 секунд и 20 секунд после облучения брыжеечной артерии лазером наблюдали с помощью замедленной конфокальной микроскопии. «Кровоток» указывает на кровообращение.
На Фиг.7 схематически показан протокол введения генов в гемопоэтические клетки-предшественники, полученные из ЭС клеток.
На Фиг.8 показаны результаты анализа сортировки клеток с активированной флуоресценцией (FACS) спустя 9 суток после введения гена c-MYC в гемопоэтические клетки-предшественники, полученные из ЭС клеток. «А» показывает результаты FACS анализа, «В» показывает микрофотографии клеток на 9 сутки после введения c-MYC. В качестве контроля были использованы клетки, в которые ввели только MYC вирусный вектор.
На Фиг.9 показана способность к росту мегакариоцитарных клеток-предшественников, экспрессирующих ген c-MYC. На вертикальной оси представлено число СВ42b-положительных клеток. На горизонтальной оси представлено число дней после введения гена c-MYC в клетки, «■» указывает на результаты контроля, в котором вместо c-MYC был введен только вирусный вектор.
На Фиг.10 показаны результаты FACS анализа мегакариоцитарных клеток-предшественников, в которые были введены ген c-MYC и ген BMI1. «c-MYC/BMI1» (верхнее изображение) показывает результаты FACS анализа клеток, в которые были введены как ген c-MYC, так и ген BMI1, в то время как «c-MYC» (изображение внизу) показывает результаты FACS анализа клеток, в которые был введен только ген c-MYC.
На Фиг.11 показаны результаты FACS анализа клеток, в которые были введены ген c-MYC и ген BMI1, на 35 сутки культивирования. «А» схематически показывает специфические функциональные молекулы мегакариоцитов, а «В» показывает результаты FACS анализа.
На Фиг.12 показаны результаты оценки способности к росту MYC/BMI1-экспрессирующих клеток. По вертикальной оси представлено число клеток. По горизонтальной оси представлено число дней после введения генов в клетки.
На Фиг.13 показано изображение тромбоцитов, высвобожденных из мегакариоцитарных клеток-предшественников, полученных из c-MYC/BMI1 -экспрессирующих клеток, по наблюдениям, полученным с помощью электронного микроскопа.
На Фиг.14 показаны результаты FACS анализа клеток на 105 сутки после введения гена c-MYC и гена НОХА2 в гемопоэтические клетки-предшественники, полученные из ЭС клеток (KhES), и на 27 сутки после введения гена c-MYC и гена BCLXL в гемопоэтические клетки-предшественники, полученные из ЭС клеток (KhES).
Фиг.15 является изображением для подтверждения системы регуляции экспрессии гена с помощью вектора рМХ tet-off. Конструкцию, в которой c-MYC и BMI1 были сцеплены с рМХ tet-off вектором с помощью 2А между ними, экспрессировали в клетках 293 GPG, чтобы изучить, имеются ли функции регуляции экспрессии гена. «А» показывает конструкцию вектора и механизм, а «В» показывает результаты оценки экспрессии с-MYC в клетках в состоянии, когда были добавлены или не добавлены тетрациклин и бета-эстрадиол, с применением проточного цитометра. По горизонтальной оси на «В» представлен уровень экспрессии c-MYC. «293GPG» указывает результаты для клеток 293GPG в контроле.
На Фиг.16 показаны результаты исследования способности к росту и способности к дифференцировке для регуляции гена в клеточных линиях, экспрессирующих вектор. «А» демонстрирует результаты оценки способности к росту клеток, экспрессирующих c-MYC и BMI1 с помощью различных векторов. По вертикальной оси показано число клеток, а по горизонтальной оси представлено число дней после введения генов в клетки. «В» демонстрирует результаты анализа клеток, окрашенных анти-С042b (GPIb-альфа) антителами и анти-С041а (интегрин альфа-ПЬ/бета-3 комплекс) антителами (изображение вверху), и анти-гликофорин-а антителами и анти-СВ41а антителами (изображение внизу), с применением проточного цитометра. Как на верхнем, так и на нижнем изображении на чертеже «В», показаны результаты для клеток, принудительно экспрессирующих рМХ с-MYC и Dsam BMI1 по отдельности на левой стороне, и результаты для клеток, экспрессирующих рМХ tet-offc-MYC 2A BMI1 на правой стороне.
На Фиг.17 показано исследование степени мультинуклеации мегакариоцитарной клеточной линии, экспрессирующей рМХ tet-off c-MYC 2A BMI1 в присутствии β-эстрадиола. На «А» показаны результаты контроля только с вектором (клеточной линии, не экспрессирующей гены), а на «В» показаны результаты для клеток, экспрессирующих c-MYC и BMI1.
На Фиг.18 показаны результаты выполнения анализа связывания с фибриногеном на тромбоцитах, полученных из мегакариоцитов, принудительно экспрессирующих c-MYC и BMI1. На изображении вверху (тромбоциты человека) показаны результаты для тромбоцитов, полученных из периферической крови человека, на изображении посередине (рМХ tet-off c-MYC 2A BMI1) показаны результаты для тромбоцитов, полученных из клеточной линии рМХ tet-off c-MYC 2A BMI1 в присутствии β-эстрадиола, а на изображении снизу (рМх Мус Dsam Bmil) показаны результаты для тромбоцитов, полученных из клеточной линии, принудительно экспрессирующей c-MYC и BMI1 посредством рМХ c-MYC и Dsam BMI.
На Фиг.19 показаны результаты оценки способности к активации интегрином тромбоцитов, полученных из мегакариоцитарной клеточной линии, в которой была супрессирована экспрессия c-MYC и BMI1. На изображении слева показан анализ способности к активации интегрином в отсутствие АДФ с применением проточного цитометра, а на правой стороне показан анализ способности к активации интегрином в присутствии АДФ (50 мкм) с применением проточного цитометра.
На Фиг.20 показан путь дифференцировки из ЭС клеток до мегакариоцитарной клеточной линии.
Способ осуществления изобретения
В одном варианте осуществления настоящего изобретения представлен способ получения специфических клеток путем индукции дифференцировки клеток, которые служат в качестве источника, где онкоген принудительно экспрессируется в клетках на необходимой стадии дифференцировки в процессе дифференцировки из клеток, служащих в качестве источника, в специфические клетки, для размножения (или роста) клеток на необходимой стадии дифференцировки.
Используемое здесь выражение «клетки, служащие в качестве источника» соответствует клеткам-предшественникам целевых клеток (специфических клеток), полученным путем индукции дифференцировки, и может обозначать любые клетки, сохраняющие способность к дифференцировке, отличные от окончательно дифференцированных клеток. Например, «клетки, служащие в качестве источника» могут быть полностью недифференцированными плюрипотентными стволовыми клетками, или клетками, дифференцированными до некоторой степени, но все еще сохраняющими способность к дифференцировке (например, гемопоэтические клетки-предшественники клеток крови). Далее, «специфическими клетками», полученными в данном варианте осуществления изобретения, являются клетки, отличные от полностью недифференцированных клеток (например, плюрипотентных стволовых клеотк), и могут быть клетки, имеющие до некоторой степени недифференцированное состояние. То есть, «специфическими клетками» являются клетки, которые получаются между стадией полного отсутствия дифференцировки и стадией окончательной дифференцировки, за исключением полностью недифференцированных клеток. Если в качестве примера использовать клетки крови, «специфическими клетками» в данном варианте осуществления изобретения являются зрелые мегакариоцитарные клетки, тромбоциты, эритроидные клетки или подобные им.
В данном варианте осуществления изобретения «клетками на стадии дифференцировки» для размножения (или роста) являются клетки, которые появляются между стадией полного отсутствия дифференцировки и стадией окончательной дифференцировки, т.е. клетки, отличные от клеток на стадии полного отсутствия дифференцировки (например, плюрипотентные стволовые клетки, и т.д.) и клеток на стадии окончательной дифференцировки. Если брать в качестве примера клетки крови, то «клетками на стадии дифференцировки» в данном варианте осуществления изобретения являются гемопоэтические клетки-предшественники или мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, которые являются клетками-предшественниками зрелых мегакариоцитарных клеток. Например, клетки, индуцированные из плюрипотентных стволовых клеток, таких как ЭС клетки или ИПС клетки, можно применять в качестве «клеток на стадии дифференцировки».
ЭС клетки, используемые в настоящем изобретении, не ограничиваются каким-либо образом. Обычно оплодотворенную яйцеклетку на стадии бластоцисты совместно культивируют с фидерными клетками, отделяют выросшие внутренние клетки из массы, и субкультуру воспроизводят, в итоге обеспечивая развитие ЭС клеточной линии. Таким образом, ЭС клетки обычно получают из оплодотворенной яйцеклетки. Альтернативно, можно применять ЭС-подобные клетки, полученные, например, из жировой ткани, ворсинок хориона, амниотической жидкости, плаценты, тестикулярных клеток, и тому подобных, таких как оплодотворенные яйцеклетки, обладающие характеристиками ЭС клеток и проявляющими плюрипотентность.
ИПС клетками, используемыми в настоящем изобретении, могут быть клетки любого происхождения, если они являются клетками, приобретающими плюрипотентность, эквивалентную плюрипотентности ЭС клеток, в результате введения нескольких типов генов фактора транскрипции (здесь обозначаемого как «фактор плюрипотентности») для обеспечения плюрипотнетности соматических клеток (например, фибробластов, клеток крови, и т.д.). Многие факторы уже описаны как факторы плюрипотентности. Примеры таких факторов включают семейство Oct (например, Oct3/4), семейство SOX (например, SOX2, SOX1, SOX3, SOX15, SOX 17, и т.д.), семейство Klf (например, Klf4, Kl£2, и т.д.), семейство MYC (например, c-MYC, N-MYC, L-MYC, и т.д.), NANOG, LIN28, и тому подобные, хотя настоящее изобретение не ограничивается ими. Способы получения ИПС клеток описаны во многих документах, на которые можно сослаться (см., например, Takahashi et al.. Cell 2006, 126: 663-676; Okita et al.. Nature 2007, 448: 313-317; Wemig et al.. Nature 2007, 448: 318-324; Maherali et al.. Cell Stem Cell 2007, 1: 55-70; Park et al.. Nature 2007, 451: 141-146; Nakagawa et al., Nat Biotechnol 2008, 26: 101-106; Wemig et al, Cell Stem Cell 2008, 10: 10-12; Yu et al.. Science 2007, 318: 1917-1920; Takahashi et al.. Cell 2007,131: 861-872; Stadtfeld et al.. Science 2008, 322: 945-949, и др.).
Онкогеном, используемым в настоящем изобретении, является ген, который индуцирует перерождение клетки, в которой присутствует указанный ген, в раковую клетку. Примеры указанного гена включают гены семейства MYC, гены семейства SRC, гены семейства RAS, гены семейства RAF, гены семейства протеинкиназы, такие как с-Kit, PDGFR, и Аb1, и подобные им, хотя настоящее изобретение не ограничивается ими.
В настоящем изобретении принудительная экспрессия онкогена или нижеупомянутого гена polycomb в клетках на необходимой стадии дифференцировки может достигаться способом, при котором вводят онкоген или ген polycomb в клетки на необходимой стадии дифференцировки и принудительно экспрессируют ген таким способом, чтобы ввести ген в клетки-предшественники клеток на необходимой стадии дифференцировки, принудительно экспрессировать ген, и провести дифференцировку при сохранении экспрессии таким образом, чтобы состояние принудительной экспрессии гена поддерживалось в клетках на необходимой стадии дифференцировки, или способом, при котором вводят ген в клетки-предшественники клеток на необходимой стадии дифференцировки и, когда клетки-предшественники дифференцируются в клетки на необходимой стадии дифференцировки, индуцируют принудительную экспрессию гена. Например, в случаях размножения мегакариоцитарных клеток-предшественников без мульти-полиплоидизации в качестве клеток на необходимой стадии дифференцировки, онкоген или ген polycomb может быть введен в гемопоэтические клетки-предшественники (описанные ниже), которые находятся на стадии предшественников для мегакариоцитарных клеток-предшественников без мульти-полиплоидизации, и принудительно экспрессирован. В случае принудительной экспрессии как онкогена, так и гена polycomb в клетках на необходимой стадии дифференцировки, онкоген и ген polycomb могут быть введены в клетки одновременно или в различное время.
Вариант осуществления настоящего изобретения также включает способ амплификации (или роста) клеток на необходимой стадии дифференцировки, в котором онкоген-индуцированное старение, индуцированное принудительной экспрессией онкогена в клетках на необходимой стадии дифференцировки, супрессируется.
Онкоген-индуцированное старение (ОИС) является старением, вызванным стрессом, индуцированным аномальными ростовыми стимулами и тому подобным посредством онкогена, такого как RAS или MYC. Когда онкогенный продукт экспрессируется в клетках в избыточном количестве, индуцируется экспрессия продукта гена супрессора опухоли, такого как р16 или р19, закодированного в локусе CDKN2a (INK4a/ARF). Это индуцирует старение клеток и апоптоз, вызывая снижение ростовой активности клеток. Таким образом, ожидается, что высокая ростовая способность клеток может поддерживаться за счет устранения ОИС, индуцированного указанным онкогеном.
Например, онкоген-индуцированное старение может супрессироваться за счет экспрессии гена polycomb в клетках, в которых экспрессирован онкоген. Ген polycomb (polycomb группа: PcG) отрицательно регулирует CDKN2a (INK4a/ARF) локус, и способствует предупреждению старения (см., например, Oguro et al., "Regulation of stem cell senescence by polycomb group protein complex". Regenerative Medicine, vol. 6, №4, pp.26-32; Jseus et al.. Nature Reviews Molecular Cell Biology, vol. 7, pp.667-677, 2006; Proc. Natl. Acad. Sci. USA, vol. 100, pp.211-216, 2003). Соответственно, за счет экспрессии гена polycomb в клетках в дополнение к онкогену, такому как ген семейства MYC, можно избежать онкоген-индуцированного старения, и можно еще больше усилить влияние продукта онкогена на рост клеток.
Примеры генов группы polycomb, используемых в настоящем изобретении, включают BMI1, Меl18, Ring1a/b, Phc1/2/3, Cbx2/4/6/7/8, Ezh2, Eed, Suz12, HADC, Dnmtl/За/ЗЬ и подобные им. Особо предпочтительным геном группы polycomb является ген BMI1.
Онкоген-индуцированное старение можно также супрессировать посредством экспрессии гена НОХА2 или гена BCLXL.
Для принудительной экспрессии онкогена и гена polycomb в клетках можно применять любые способы, известные специалистам в данной области техники. Например, экзогенный онкоген или экзогенный ген polycomb можно ввести в клетки с помощью системы введения генов, такой как лентивирус или ретровирус, и экспрессировать. В случае экспрессии гена с помощью вирусного вектора для введения генов, ген может быть функционально связан со стороной подходящего промотора в направлении экспрессии, который затем вставляют в вектор для введения гена и вводят в клетку для экспрессии целевого гена. Указанная здесь «функциональная» связь означает, что промотор и целевой ген связаны так, что целевой ген цис-доминирован промотором, и реализуется необходимая экспрессия целевого гена. В варианте осуществления настоящего изобретения, например, целевой ген может конститутивно экспрессироваться с использованием ЦМВ промотора, EF1 промотора и подобного им. В качестве альтернативы, подходящий промотор (индуцируемый промотор) может быть помещен под контроль элемента, чья активность регулируется транс-фактором, например, элементом лекарственного ответа, таким как элемент ответа на тетрациклин, где целевой ген индуцируемо экспрессируется за счет регуляции посредством добавления лекарства или тому подобного. В качестве такой системы экспрессии гена на основе лекарства, подходящая система легко может быть выбрана специалистом в да