Способ выделения циркулирующих днк из плазмы или сыворотки крови
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и диагностической медицины. Предложен способ выделения циркулирующих ДНК из плазмы или сыворотки крови. Способ включает обработку образца равным объемом 0,5÷1,5 М гуанидин изотиоцианата, осаждение нецелевых полимеров добавлением равного объема буферного раствора, содержащего 1 М натрия ацетата, рН6,0, и 0,5-2,5% октановую кислоту, и центрифугирование. К полученному супернатанту добавляют 1/5 объема 96% этанола и наносят на колонку со стекловолокнистым сорбентом. Сорбент отмывают от балластных биополимеров, и цДНК элюируют водой. Изобретение обеспечивает повышение выхода цДНК. 2 з.п. ф-лы, 1 ил., 2 табл., 2 пр.
Реферат
Изобретение относится к области молекулярной биологии и диагностической медицины и может быть использовано для выделения циркулирующих ДНК из плазмы или сыворотки крови.
Анализ циркулирующих ДНК (цДНК) является перспективным направлением диагностики различных заболеваний, в том числе инфекционных, онкологических и патологий беременности. В последнее время проводится большое количество исследований, направленных на внедрение анализа цДНК в клиническую практику. Однако остается ряд неразрешенных проблем, затрудняющих создание и широкое использование тест-систем на основе циркулирующих нуклеиновых кислот крови. Большой влияние на чувствительность и специфичность методов анализа цДНК вносят такие ее особенности, как низкая концентрация в биологических жидкостях, низкое содержание опухолевой ДНК, а так же ее фрагментированность (1).
Несмотря на достаточно большое количество работ по анализу ДНК в плазме или сыворотке, до сих не существует единого протокола пробоподготовки и выделения цДНК, что приводит к отсутствию сходимости результатов между различными лабораториями. Последние данные международного проекта SPIDIA (Standardisation and improvement of pre-analytical procedures for in vitro diagnostics) указывают на то, что создание единого протокола выделения цДНК требует большого внимания со стороны исследователей.
Основным препятствием в выделении цДНК крови является высокое содержание в исходном материале биополимеров ненуклеотидной природы (белки, липопротеины, липиды и их комплексы), в том числе образующих прочные комплексы с ДНК, присутствие в них ингибиторов ферментов, используемых в последующем анализе (например, ПЦР), а также высокое содержание ферментов, расщепляющих нуклеиновые кислоты.
Таким образом, получение высокоочищенных препаратов цДНК, пригодных для последующего анализа (ПЦР, микрочиповый анализ, полногеномное секвенирование) является актуальной проблемой в молекулярной биологии и диагностической медицине.
В настоящее время существует несколько принципиально различных подходов к выделению ДНК из биологических образцов: способ ферментативного расщепления белков, органическая экстракция, экстракция с помощью силикатных сорбентов.
Способ ферментативного расщепления белков заключается в добавлении к препарату сериновой протеазы широкого спектра (протеиназы К), которая гидролизует пептидные связи, находящиеся рядом с карбоксильной группой алифатических и ароматических аминокислот (2). Однако такой способ не обеспечивает достаточную очистку препаратов нуклеиновых кислот от белков и других примесей, что затрудняет проведение дальнейших манипуляции с образцом. В частности, полученный раствор часто обладает не оптимальным для хранения ДНК значением pH, загрязнение образца продуктами неполного гидролиза часто приводит к деградации ДНК. Кроме того, неполная термоинактивация протеиназы К может приводить к ингибированию прохождения различных ферментативных реакций (например, ПЦР, бисульфитная конверсия), что может явиться причиной ложно отрицательных результатов исследований.
В способе органической экстракции используют смесь фенола, хлороформа и изоамилового спирта для экстракции белков и других примесей ненуклеотидной природы из раствора ДНК. При добавлении смеси фенол/хлороформ к образцу происходит разделение фаз раствора на органическую (содержащую белки) и водную (содержащую нуклеиновые кислоты). В дальнейшем ДНК из водной фазы извлекают путем спиртовой преципитации (3). К недостаткам данного способа относятся трудоемкость, длительное время обработки образца, высокие требования к квалификации персонала. Кроме того, при использовании способа органической экстракции образуются токсичные отходы, которые должны подвергаться специальной утилизации. Все это делает способ неприменимым для работы с большим количеством образцов, а значит, применением в рутинной клинической практике.
Способы выделения цДНК с использованием силикатных сорбентов основаны на способности силикатных сорбентов связывать молекулы нуклеиновых кислот в присутствии хаотропных агентов. Хаотропные агенты (напрмер, гуанидина хлорид) способны разрушить гидратную оболочку нуклеиновой кислоты, что приводит к эффективному связыванию нуклеиновых кислот с поверхностью силикатного сорбента. Процесс сорбции ДНК на силикатных носителях идет наиболее активно при значениях pH около 5 и высокой ионной силе раствора (4). После сорбции, ДНК подвергают промывке и последующей элюции раствором с низкой ионной силой. Способ, основанный на сорбции ДНК на силикатных сорбентах, имеет несколько различных форматов: суспензионный (метод «glass-milk», сорбент на поверхности ферро-магнитных микросфер) и в виде твердой матрицы (микроколонки).
На рынке доступны несколько коммерческих наборов для выделения цДНК. Наиболее популярными среди исследователей являются наборы фирмы Qiagen: QIAamp DNA Blood Mini Kit и QIAamp Circulating Nucleic Acid Kit (3). В результате большого количества проведенных исследований были накоплены данные о существенных недостатках этих наборов. Например, в работе (5) было показано, что использование набора QIAamp DNA Blood Mini Kit для выделения ДНК из плазмы крови приводило к уменьшению эффективности выделения ДНК два раза по сравнению с фенольной экстракцией. Низкая эффективность выделения связана со сниженной эффективностью связывания сорбентом фрагментов ДНК<200 п.н., а также недостаточно эффективной элюцией нуклеиновой кислоты с сорбента.
Эффективное выделение коротких фрагментов цДНК с длиной менее 200 п. н. является отдельной актуальной задачей. По последним данным именно эта фракция цДНК является целевой для анализа, то есть фракция коротких ДНК содержит наибольшее количество ДНК-мишеней (опухолеспецифичная ДНК, плодная ДНК).
Наиболее близким к предлагаемому способу - прототипом, является способ выделения цДНК, заключающийся в следующем. К 200 мкл плазмы крови здоровых доноров добавляли равный объем буфера для очистки (1 М NaCl, 10mM Tris-HCl, pH 8.2, 25 мМ EDTA pH 8.0, 2% SDS). Полученную смесь перемешивали и инкубировали 2 часа при 56°C. Затем к смеси добавляли 200 мкл 6 М NaCl, инкубировали 1 час при комнатной температуре. Смесь центрифугировали 15 мин при 16.000g, супернатант переносили в новую пробирку и добавляли 2 объема 96% этанола. Пробирку инкубировали 20 мин при -20°C и центрифугировали 15 мин при 16.000g. Супернатант удаляли, осадок промывали 70% этанолом, сушили на воздухе и растворяли в 120 мкл воды (6). Выход цДНК составлял не более 70%.
Недостатками прототипа являются недостаточный выход и низкая степень очистки цДНК (содержание ингибиторов ПЦР), низкая воспроизводимость, а также длительность и необходимость наличия персонала высокой квалификации.
Задачей изобретения является повышение эффективности выделения цДНК, в том числе коротких фрагментов с длиной менее 200 п.н., из плазмы или сыворотки крови.
Технический результат: повышение выхода целевого продукта, сокращение материальных и временных затрат на выделение цДНК.
Поставленная задача достигается предлагаемым способом, заключающимся в следующем.
К образцу плазмы крови последовательно добавляют равный объем денатурирующего раствора, содержащего 0,5-1,5 М гуанидин изотиоцианат, затем добавляют равный объем буфера для осаждения, содержащего в конечных концентрациях 1 М натрия ацетат pH 6.0, и 0,5-2,5% октановую кислоту. Смесь перемешивают, инкубируют в течение 3-5 минут при комнатной температуре и центрифугируют при 9.000-16.000g. В полученный супернатант добавляют 1/5 объема 96% этанола и наносят на колонку со стекловолокнистым сорбентом «Биосилика» (BioSilica Ltd, Россия) методом вакуумной фильтрации или центрифугированием. Сорбент промывают от примесей биополимеров ненуклеотидной природы сначала буферным раствором, содержащим 0,5 М гуанидин изотиоцианат, 10 мМ Трис-ацетат pH 6.5, 20% этанол, а затем буферным раствором, содержащим 10 мМ Tris-HCl pH 7.5, 0,1 М NaCl, 75% этанол. Элюцию ДНК с сорбента осуществляют стерильной водой.
Определяющими отличительными признаками предлагаемого способа, по сравнению с прототипом, являются:
1. ДНК-содержащие комплексы в составе образца плазмы или сыворотки денатурируют раствором, содержащим 0,5-1,5 М гуанидин изотиоцианат, что позволяет создать условия для последующей эффективной диссоциации ДНК из нуклеопротеиновых комплексов и сократить время выделения.
2. Осаждение нецелевых биополимеров осуществляют буферным раствором, содержащим 1 М натрия ацетат pH 6.0 и 0,5-2,5% октановую кислоту с последующим центрифугированием, что позволяет дополнительно выделить цДНК из нуклеопротеиновых комплексов, осадить нецелевые биополимеры и, в результате, повысить выход целевого продукта.
3. К полученному супернатанту добавляют 1/5 объема 96% этанола, что позволяет повысить эффективность связывания цДНК с сорбентом, а также способствует денатурации оставшихся белков и липопротеинов, дополнительной диссоциации нуклеопротеиновых комплексов. Это способствует обогащению по содержанию в препарате малых фрагментов цДНК, увеличивает чистоту и выход продукта.
4. Отмывку сорбента от несвязавшихся биополимеров осуществляют последовательно сначала буферным раствором, содержащим 0,5 М гуанидин изотиоцианат, 10 мМ Трис-ацетат, pH 6.5, 20% этанол, а затем буферным раствором, содержащим 10 мМ Tris-HCl pH 7.5, 0,1 М NaCl, 75% этанол, что обеспечивает эффективное удаление примесей ненуклеотидной природы с поверхности сорбента и повышает чистоту получаемого препарата ДНК.
Таким образом, предлагаемый способ позволяет быстро и эффективно выделять цДНК из плазмы или сыворотки крови.
Изобретение иллюстрируется следующими примерами конкретного выполнения способа.
Пример 1. Выделение цДНК из плазмы крови.
Выделение цДНК из плазмы крови 10 здоровых доноров проводили с использованием способа-прототипа и предлагаемого способа. Согласно методике способа-прототипа к 200 мкл плазмы крови здоровых доноров добавляли равный объем буфера для очистки (1 М NaCl, 10 mM Tris-HCl, pH 8.2, 25 мМ EDTA рН 8.0, 2% SDS). Полученную смесь перемешивали и инкубировали 2 часа при 56°C. Затем к смеси добавляли 200 мкл 6 М NaCl, инкубировали 1 час при комнатной температуре. Смесь центрифугировали 15 мин при 16.000g, супернатант переносили в новую пробирку и добавляли 2 объема 96% этанола. Пробирку инкубировали 20 мин при -20°C и центрифугировали 15 мин при 16.000g. Супернатант удаляли, осадок промывали 70% этанолом, сушили на воздухе и растворяли в 120 мкл воды.
Согласно предлагаемому способу к 200 мкл плазмы крови здоровых доноров добавляли 200 мкл денатурирующего раствора, содержащего 0,5 М гуанидин изотиоцианат. Затем добавляли 200 мкл буфера для осаждения, содержащего в конечной концентрации 1 М ацетат натрия рН 6.0 и 0,5% октановую кислоту. После добавления каждого реагента перемешивали раствор на встряхивателе в течение 3-5 секунд, полученный раствор инкубировали в течение 5 минут при комнатной температуре и осаждали получившийся преципитат центрифугированием при 16.000g (Thermo Scientific, США) в течение 3-х минут. К полученному супернатанту добавляли 1/5 объема 96% этанола. Супернатант наносили на колонку производства ООО «БиоСилика», представляющую собой пластиковую емкость цилиндрической формы, закрывающуюся крышкой, с отверстием в конусном дне, на котором находится 10-15 мг стекловолокнистого сорбента, состоящего из волокон щелочного стекла, диаметр которых составляет 0,4-1 микрон. Для нанесения супернатанта использовали центрифугу (Thermo Scientific, США) при 400g. Сорбент промывали 300 мкл буфера, содержащего 0,5 М гуанидин изотиоцианат, 10 мМ Трис-ацетат рН 6.5, 20% этанол. Затем сорбент промывали 300 мкл буфера, содержащего 10 мМ Трис-HCl рН 7.5, 0,1 М NaCl, 75% этанол и элюировали ДНК добавлением 120 мкл воды (центрифугированием при 400g, 1 мин, 20 сек при 16.200g).
Концентрацию цДНК, выделенной разными способами, определяли с помощью количественной ПЦР на L1 элементы (7).
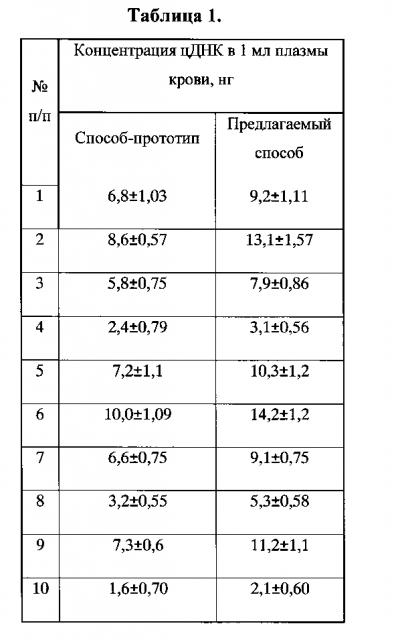
Результаты исследования представлены в таблице 1.
Как видно из таблицы 1, использование предлагаемого способа выделения цДНК из плазмы крови позволяет увеличить выход цДНК в среднем на 31%. При этом, экономия времени составляет около 3 часов. Данный пример иллюстрирует возможность использования разработанного способа в клинических лабораториях, применяющих поточные методы с высокой воспроизводимостью.
Пример 2. Выделение цДНК из сыворотки крови.
Для оценки эффективности выделения коротких фрагментов цДНК проводили выделение ДНК из сыворотки 10 здоровых доноров с использованием предлагаемого способа, способа-прототипа и коммерческого набора QIAamp Circulating Nucleic Acid Kit (Qiagen).
Для этого к 1 мл сыворотки крови добавляли 1 мл денатурирующего раствора, содержащего 1,5 М гуанидин изотиоцианат. Затем добавляли 1 мл буфера для осаждения, содержащего в конечной концентрации 1 М ацетат натрия рН 6.0 и 2,5% октановую кислоту. После добавления каждого реагента перемешивали раствор на встряхивателе в течение 3-5 секунд, полученный раствор инкубировали в течение 3 минут при комнатной температуре и осаждали получившийся преципитат центрифугированием при 9.000g в течение 3-х минут. К полученному супернатанту добавляли 1/5 объема 96% этанола. Супернатант наносили на колонку производства ООО «БиоСилика» с использованием центрифуги (Thermo Scientific, США) при 400g. Промывку сорбента и элюцию ДНК проводили, как указано в примере 1.
Выделение цДНК с использованием способа-прототипа проводили аналогично примеру 1.
Все операции выделения цДНК коммерческим набором QIAamp Circulating Nucleic Acid Kit выполняли, как рекомендовано производителем.
Концентрацию цДНК, выделенной разными способами, определяли с помощью количественной ПЦР на L1 элементы (7). Распределение длин фрагментов выделенной ДНК определяли с использованием системы электрофоретического анализа нуклеиновых кислот на микрочипах Bioanalyzer 2100 (Agilent).
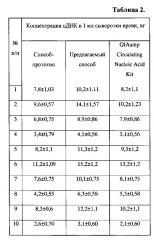
Результаты сравнения эффективности выделения цДНК с использованием разных способов представлены в таблице 2.
Как видно из таблицы 2, использование предлагаемого способа выделения цДНК из сыворотки крови позволяет увеличить выход цДНК в среднем на 28%.
Результаты исследования распределения длин фрагментов цДНК, выделенной разными способами, представлена на фиг. 1. Из полученных данных следует, что разработанный способ позволяет более эффективно выделять низкомолекулярную ДНК (короткие фрагменты ДНК с длиной менее 200 п.н.), по сравнению с набором QIAamp Circulating Nucleic Acid Kit.
Использование предлагаемого способа позволит повысить эффективность выделения цДНК из плазмы или сыворотки крови, увеличить выход цДНК в среднем на 28-31%, сократить время выделения цДНК на 3 часа.
Источники информации
1. Fleischhacker, М., Schmidt, В., Circulating nucleic acids (CNAs) and cancer-a survey. Biochim. Biophys. Acta, 2007. 1775(1): p. 181-232.
2. Loayza M.F., Villavicencio F.X., Santander S.C., M., Ponce L.K., Salvador I., Vivar N. Improved method for extraction and detection of Helicobacter pylori DNA in formalin-fixed paraffin embedded gastric biopsies using laser micro-dissection. MethodsX. 2014. p. 1-7.
3. Xue X., Teare M.D., Holen I., Zhu Y.M., Woll P.J. Optimizing the yield and utility of circulating cell-free DNA from plasma and serum. Clin Chim Acta. 2009. 404. P. 100-104.
4. Parida, S.K., et al., Adsorption of organic molecules on silica surface. Adv. Colloid Interface Sri., 2006. 121(1-3): p. 77-110.
5. Schmidt, В., et al., Improved method for isolating cell-free DNA. Clin Chem, 2005. 51(8): p. 1561-1563.
6. Davoudi, A., et al., Evaluation of two DNA extraction methods from maternal plasma for using in non-invasive bovine fetus gender determination. Iran J Reprod Med, 2012. 10(6): p. 523-530.
7. Morozkin E.S., Babochkina T.I., Vlassov V.V., Laktionov P.P. The effect of protein transport inhibitors on the production of extracellular DNA. // Ann N.Y. Acad. Sci. - 2008. - V. 1137. - P. 31-35.
1. Способ выделения цДНК из плазмы или сыворотки крови, включающий обработку образца денатурирующим буферным раствором, осаждение нецелевых биополимеров с последующим инкубированием и центрифугированием смеси и отделением супернатанта, добавление к последнему спирта с последующим выделением и очисткой целевого продукта, отличающийся тем, что образец обрабатывают равным объемом денатурирующего буферного раствора, содержащего 0,5÷1,5 М гуанидин изотиоцианата, осаждают нецелевые биополимеры добавлением равного объема буферного раствора, содержащего 1 М натрия ацетат, рН 6.0, и 0,5-2,5% октановую кислоту, к полученному супернататанту добавляют 1/5 объема 96% этанола и наносят на колонку со стекловолокнистым сорбентом, а отмывку сорбента от несвязавшихся биополимеров осуществляют сначала буферным раствором, содержащим 0,5 М гуанидин изотиоцианата, 10 мМ Трис-ацетат рН 6.5, 20% этанол, а затем буферным раствором, содержащим 10 мМ Трис-HCl рН 7.5, 0,1 M NaCl, 75% этанол.
2. Способ по п. 1, отличающийся тем, что для выделения цДНК используют колонки со стекловолокнистым сорбентом производства ООО «БиоСилика».
3. Способ по п. 1, отличающийся тем, что смесь инкубируют при комнатной температуре в течение 3-5 минут и центрифугируют при 9000-16000g.