Способ оценки эффективности антимикробного воздействия антисептиков на бактерии, существующие в форме биопленки
Иллюстрации
Показать всеИзобретение относится к клинической микробиологии и может быть использовано при определении эффективных мер лечения хронических инфекционных заболеваний кожи и слизистых оболочек человека. Предложен способ оценки эффективности антимикробного воздействия антисептиков на бактерии, существующие в форме биопленки. Способ предусматривает создание модели бактериальной биопленки из любых бактериальных культур, выделенных из клинического материала пациента, подборе доз воздействия антисептиков. Регистрацию воздействия антисептиков на биопленку проводят дополнительно по изменению цвета питательной среды и ее помутнению с помощью микропланшетного фотометра, дополнительно проводят высев содержимого лунок на питательный агар. Оценка антимикробного эффекта рассчитывается как отношение рабочей концентрации антисептика к его минимальной подавляющей концентрации, и при величине индекса 2-4 считают антисептик активным. Изобретение повышает достоверность наличия воздействия антисептика, позволяет определить бактерицидный или бактериостатический тип действия антисептика на биопленочные формы бактерий, а оценка эффективности по индексу активности антисептика повышает точность оценки результатов. 3 ил., 1 пр.
Реферат
Изобретение относится к экспериментальной медицине, а именно к способам испытания материалов на антимикробную активность, и может быть использовано при определении эффективных мер лечения хронических инфекционных заболеваний кожи и слизистых оболочек человека в условиях моделирования в доклинических экспериментах.
Одним из вариантов устойчивости бактерий к антибактериальным препаратам является способность микроорганизмов образовывать биопленку - трехмерную упорядоченную структуру, которая препятствует доступу антисептиков к нижним слоям клеток микроорганизмов, снижая эффективность антисептики. Установлено, что большинство стойких раневых бактериальных инфекций характеризуется наличием биопленок. Так, например, результаты электронной микроскопии показали, что 60% биоптатов, взятых из хронических ран, содержали биопленки. Формирование микробных биопленок на поверхности дренажных полимеров (катетерах, дренажных и интубационных трубках и т.д.) является частой причиной бактериальных инфекций у пациентов хирургических отделений. Трудности лечения хронических инфекций сводятся к тому, что бактерии в составе биопленки приобретают качественно новые свойства по сравнению с микроорганизмами, находящимися в планктонной форме. Кроме того, биопленки, как правило, состоят из микроорганизмов разных видов, что осложняет выбор эффективного антисептика и требует разработки методики, способной оценить антибактериальный эффект по отношению к микробным ассоциациям.
Важным требованием к антисептикам является конечный результат противомикробного действия, который может быть бактерицидным и бактериостатическим. При лечении острых инфекций достаточно бактериостатического действия антисептика, при котором антисептик задерживает рост микроорганизмов, а факторы иммунной системы заканчивают работу, начатую антисептиком, то есть тем или иным способом уничтожают поврежденные антисептиком микробные особи. Однако при лечении хронических, катетер ассоциированных и других инфекций, связанных с формированием микробных биопленок, необходимо использовать препараты с бактерицидным действием, так как иммунная система не в состоянии справиться с биопленкой и полностью элиминировать ее с поверхности слизистых оболочек и (или) дренажных полимеров.
Определение эффективности антисептиков необходимо для оптимального индивидуального подбора антисептических средств при лечении и профилактике инфекций.
Известен способ оценки эффективности антимикробного воздействия антибиотиков на патогенные бактерии, существующие в форме биопленки, представленный в патенте РФ №2457354, кл. C12Q 1/04, C12N 13/00, заявл. 22.02.2011, опубл. 27.07.2012 г.
Известный способ оценки эффективности антимикробного воздействия антибиотиков и ультразвукового излучения на патогенные бактерии, существующие в форме биопленки, заключается в создании модели бактериальной биопленки, подборе доз воздействия антибиотиков и ультразвукового излучения на бактериальную биопленку, регистрации и оценке антимикробного эффекта и отличается тем, что в качестве модели бактериальной биопленки используют биопленку из биолюминесцентных бактерий Vibrio fischeri, при этом регистрацию воздействия антибиотиков и ультразвукового излучения на биопленку проводят путем измерения интенсивности свечения биолюминесцентных бактерий Vibrio fischeri, а антимикробный эффект оценивают по степени подавления интенсивности свечения по сравнению с контролем.
Недостатком известного способа является использование в качестве модели биопленки из Vibrio fischeri - симбионта головоногих моллюсков и рыб. Эти бактерии обитают в световых органах гавайских кальмаров и глубоководных рыб, обеспечивая им свечение. Инфекции у человека Vibrio fischeri не вызывает, поэтому полученные данные об антимикробной активности препаратов в отношении биопленки из Vibrio fischeri трудно экстраполировать на биопленки из клинических штаммов. Известно, что разные виды микроорганизмов отличаются разной степенью природной и приобретенной устойчивости к антибактериальным препаратам. Так, например, биопленка, сформированная из Pseudomonas aeruginosa, содержит в своем составе клетки - персистеры, обладающие множественной устойчивостью к антибактериальным препаратам. Более того, в одном биотопе (например, в гнойной ране) могут находиться варианты возбудителей, различающиеся по спектру и уровню чувствительности к антибактериальным препаратам. Поэтому важно определять активность антисептиков по отношению к биопленкам, сформированным из тех видов микроорганизмов (или микробных ассоциаций), которые циркулируют в конкретном лечебном учреждении и выделены из клинического материала пациентов, нуждающихся в адекватном подборе активных антисептических средств.
Кроме того, указанный способ усложняет необходимость использования эталонного штамма Vibrio fischeri (который необходимо постоянно поддерживать на специальных питательных средах) и биолюминометра (этим дорогостоящим прибором оснащена далеко не каждая бактериологическая лаборатория). Использование воздействия ультразвука возможно и повышает эффективность воздействия антибиотиков, однако также усложняет сам способ.
Наиболее близким по технической сущности к заявляемому является способ оценки эффективности средств местного антисептического воздействия, описанный Тепляковой О.В., Соседовой Е.В и др. в материалах 2-й научно-практической школы-семинара молодых ученых по мероприятию «Поддержка развития внутрироссийской мобильности научных и научно-педагогических кадров путем выполнения научных исследований молодыми учеными и преподавателями в научно-образовательных центрах» Тольятти 18-21 декабря 2012 г. и выбранный в качестве прототипа.
Известный способ оценки эффективности средств местного антисептического воздействия заключается в изучении пленкообразующей способности микроорганизмов, определении чувствительности планктонных и диспергированных ультразвуком биопленочных форм микроорганизмов к антисептикам, смешанных с питательным бульоном в соотношении один к четырем, при этом регистрацию воздействия антисептика на микроорганизмы проводят путем определения наличия роста в опытной и контрольной (без антисептика) пробирках: при наличии роста в контрольной и отсутствии в опытной - культуру относят к клинически чувствительной, при наличии роста в обеих пробирках - к клинически устойчивой к изучаемому антисептику. При этом в качестве модели бактериальной биопленки используют биопленку из любых бактериальных культур и их ассоциаций, выделенных из клинического материала пациентов, которую выращивают на дренажных полимерах.
Недостатком способа являются его низкая достоверность и не вполне удовлетворительная точность, обусловленные тем, что регистрацию чувствительности бактерий к антисептикам производят только визуально, эффективность препаратов оценивают только в одной концентрации, поэтому способ не позволяет выявить штаммы микроорганизмов, обладающие биологической устойчивостью к препаратам, т.е. устойчивостью к низким концентрациям. Между тем, ценность выявления биологической устойчивости заключается в том, что, обнаружив биологически устойчивые штаммы, можно заранее, до появления клинической устойчивости, ограничить или на какое-то время прекратить использовать в стационаре такой антисептик.
Кроме того, указанный способ не позволяет проводить дифференциацию бактерицидного и бактериостатического типа воздействия антисептика.
Задачей заявляемого способа является расширение возможностей оценки эффективности антисептиков за счет обеспечения возможности дифференциации бактерицидного и бактериостатического типа действия, повышение точности и достоверности оценки результатов.
Поставленная задача решается тем, что в способе оценки эффективности антимикробного воздействия антисептиков на бактерии, существующие в форме биопленки, заключающемся в создании модели бактериальной биопленки, в качестве которой используют биопленку из любых бактериальных культур и их ассоциаций, выделенных из клинического материала пациентов, которую выращивают на дренажных полимерах, в подборе доз воздействия антисептиков, регистрации и оценке антимикробного эффекта, проводимой по наличию роста микроорганизмов на питательном бульоне, СОГЛАСНО ИЗОБРЕТЕНИЮ регистрацию воздействия антисептиков на биопленку проводят дополнительно по изменению цвета питательной среды, ее помутнению в лунках планшета визуально и с помощью микропланшетного фотометра, дополнительно проводят высев содержимого лунок на питательный агар, по наличию или отсутствию роста на питательном агаре после воздействия антисептика определяют бактериостатический или бактерицидный тип действия на биопленочные формы бактерий, а эффект оценивают по индексу активности антисептика, который рассчитывают как отношение рабочей концентрации антисептика к его минимальной подавляющей концентрации, и при величине индекса 2-4 считают антисептик активным.
Комплексная регистрация воздействия антисептиков с учетом, помимо визуальных признаков наличия роста микроорганизмов, также изменения цвета питательной среды и ее помутнения с помощью микропланшетного фотометра повышает достоверность наличия воздействия, дополнительный высев содержимого лунок на питательный агар позволяет определить бактерицидный или бактериостатический тип действия антисептика на биопленочные формы бактерий, а оценка эффективности по индексу активности антисептика повышает точность оценки результатов.
Технический результат - расширение эксплуатационных возможностей за счет обеспечения дифференциации бактерицидного и бактериостатического действия антисептиков, повышение достоверности и точности оценки воздействия антисептика на бактерии, существующие в форме биопленки.
Заявляемый способ обладает новизной в сравнении с прототипом, отличаясь от него такими существенными признаками, как проведение не только более полной визуальной, но и колориметрической регистрации воздействия антисептиков на биопленку по изменению цвета питательной среды и ее помутнению в лунках планшета, определением бактерицидного или бактериостатического типа воздействия антисептика, оценкой эффекта по индексу активности антисептика, который рассчитывают как отношение рабочей концентрации антисептика к его минимальной подавляющей концентрации, и при величине индекса 2-4 считают антисептик активным, обеспечивающими в совокупности достижение заданного результата.
Хотя такие признаки, как регистрация воздействия антисептиков на бактерии по изменению цвета питательной среды, ее помутнению в лунках планшета, сами по себе и известны, однако одновременное их использование в совокупности с определением бактерицидного или бактериостатического типа действия антисептика дает возможность существенно расширить возможности оценки эффективности действия антисептика, повысить достоверность регистрации такого воздействия для проведения последующей оценки эффекта воздействия по индексу активности антисептика, обеспечивающего более высокую точность оценки, поэтому заявитель считает, что заявляемый способ соответствует критерию «изобретательский уровень».
Заявляемый способ может найти применение в экспериментальной медицине как средство испытания материалов на антимикробную активность и может быть использован при определении эффективных мер лечения хронических инфекционных заболеваний кожи и слизистых оболочек человека в условиях моделирования в доклинических экспериментах, а потому соответствует критерию «промышленная применимость».
Изобретение иллюстрируется чертежами, где представлены на:
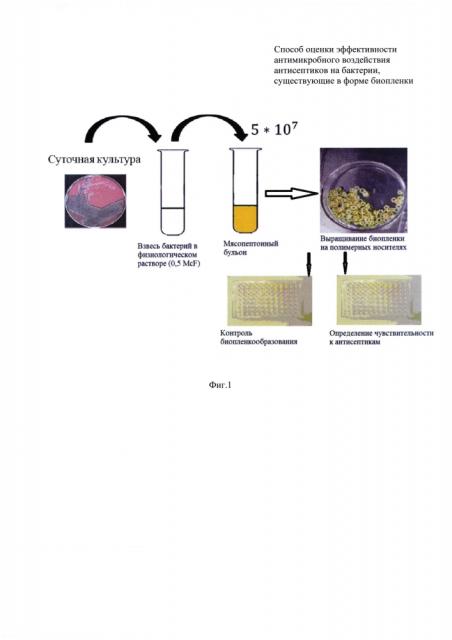
фиг. 1 - схема этапов исследования;
фиг. 2 - схема титрования антисептика;
фиг. 3 - определение минимальной бактериостатической концентрации и индекса активности антисептика у антисептиков с разной рабочей концентрацией.
Заявляемый способ заключается в следующем.
Для оценки эффективности антимикробного воздействия антисептиков на бактерии, существующие в форме биопленки, создают модель бактериальной биопленки, в качестве которой используют биопленку из любых бактериальных культур и их ассоциаций, выделенных из клинического материала пациентов, которую выращивают на дренажных полимерах. Затем воздействуют на биопленку различными концентрациями антисептиков. Далее регистрируют воздействие антисептиков на биопленку по наличию роста микроорганизмов в питательном бульоне, по изменению цвета питательной среды, ее помутнению в лунках планшета визуально и с помощью микропланшетного фотометра. Определяют бактерицидный или бактериостатический тип действия антисептика по отсутствию или наличию роста бактерий на питательном агаре. Эффект воздействия оценивают по индексу активности антисептика, который рассчитывают как отношение рабочей концентрации антисептика к его минимальной подавляющей концентрации, и при величине индекса 2-4 считают антисептик активным.
Ниже описан пример практического осуществления способа с указанием используемых материалов, средств и технологии выполнения необходимых действий.
1. Используемые материалы
1.1. Жидкая цветная питательная среда
Основой служит питательный бульон из панкреатического гидролизата с добавлением 0,5% глюкозы и 0,002% индикатора бром-крезолового пурпурного. С помощью раствора 1%-ного NaOH pH цветной питательной среды доводят до 7,6-7,7. Среду стерилизуют в автоклаве при 120°С в течение 20 мин. Стерильная питательная среда имеет pH 7,2-7,4, окрашена в яркий сиреневый цвет. При температуре 4-6°С среда сохраняется не менее 3 лет.
Цветная питательная среда способна поддерживать рост единичных клеток эталонных культур бактерий - Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa, Bacillus subtilis, Bacillus cereus и других видов аэробных бактерий.
1.2. Испытуемая культура микроорганизмов
Бактериальную культуру выращивают на питательном агаре 20-24 часа при оптимальной для данного вида бактерий температуре. Микробный урожай снимают с поверхности агара стерильной бактериологической петлей и готовят инокулят в физиологическом растворе, по стандарту мутности соответствующему 0,5 McFarland (1×108 КОЕ/мл).
2. При этом используют следующие материалы и средства.
2.1. Стерильные одноразовые 96-луночные пластиковые планшеты с плоским дном, объем лунок 200 мкл.
2.2. Автоматические восьми- и одноканальные пружинные пипетки объемом от 10 до 200 мкл.
2.3. Стерильные съемные наконечники.
2.4. Испытуемые антисептики.
2.5. Стерильные диски из полимерных носителей.
Для изготовления дисков используют катетеры «Нелатона» диаметром 14 мм из поливинилхлорида или катетеры Фолея диаметром 30 мм из латекса.
Площадь поверхности каждого кусочка из поливинилхлорида рассчитывают по формуле: S=π(R2-r2). Так как каждый кусочек делят пополам площадь поверхности рассчитывают по формуле S=π(R2-r2)/2. Таким образом, площадь каждого кусочка равна 0,25 см2.
Дренажные полимеры нарезают в стерильных условиях в ламинарном боксе. После нарезки кусочки помещают под ультрафиолетовую лампу на 30 минут.
2.6. Стерильные одноразовые пластиковые квадратные (120×120 мм) чашки Петри или круглые чашки Петри (диаметром 140 мм).
2.7. Прозрачный питательный агар (можно Мюллер Хингтон).
2.8. Трафарет на 96 зон.
Трафарет представляет собой кусок плотной белой бумаги, формой и величиной равный дну квадратной или круглой чашки Петри. На трафарете отпечатывают смоченные тушью наконечники, надетые на 8-канальную автоматическую пипетку. Затем места отпечатков на бумаге нумеруют, присваивая буквенный и цифирный код согласно нумерации лунок планшета.
2.9. Стерильные чашки Петри.
2.10. Мясопептонный бульон (МПБ) для выращивания биопленки на полимерных носителях.
2.11. Бактериологические петли, спиртовка.
2.12. Дезинфицирующий раствор.
2.13. Микропланшетный фотометр с длиной волны 450 нм.
3. Этапы исследования
Схема этапов исследования представлена на фиг. 1. Для тестирования одного антисептика используют два планшета: один для приготовления разведений антисептика, второй для выращивания биопленки. Число микроорганизмов, включенных в испытание - 8 штук, что соответствует числу горизонтальных рядов планшета.
3.1. Стерильные диски из полимерных носителей кладут в стерильную чашку Петри.
3.2. Испытуемую культуру микроорганизмов (108 КОЕ/мл) смешивают с мясопептонным бульоном (МПБ) в соотношении 1:1 (конечная концентрация клеток - 5×107 КОЕ/мл) и разливают в чашки Петри со стерильными полимерными носителями. Количество бульона подбирается опытным путем (уровень жидкости должен полностью скрывать кусочки полимеров). Количество чашек Петри зависит от количества дней исследования: если биопленку выращивают 3 дня, то на каждый вид микроорганизма по 3 чашки (подписать первые сутки, вторые, третьи).
3.3. Разведения антисептика готовят в стерильном планшете в день окончания инкубации биопленки. Схема титрования антисептика представлена на фиг. 2. Во все лунки планшета 8-канальной автоматической пипеткой со стерильными съемными наконечниками вносят по 100 мкл цветной питательной среды.
3.4. В первые лунки вертикального ряда и в лунку А12 вносят по 100 мкл антисептика в концентрации, рекомендованной для практики.
3.5. В лунках горизонтальных рядов методом титрования готовят двукратные убывающие разведения антисептика в цветной питательной среде, последовательно перенося по 100 мкл смеси среды и антисептика с первого по девятый ряд лунок (10, 11 и 12 ряды лунок оставляют для контроля). Из девятой лунки 100 мкл смеси антисептика в питательной среде сливают в дезинфицирующий раствор.
3.6. В лунках А12-D12 методом титрования готовят двукратные разведения препарата для контроля изменения цвета среды антисептиком.
3.7. Кусочки дренажных полимеров с биопленкой переносят из чашки Петри в планшет с приготовленными разведениями антисептика. Для каждого вида микроорганизмов 1 горизонтальный ряд лунок (с 1 по 11). 12 ряд остается для контроля.
3.8. Планшет накрывают крышкой и переносят в термостат с температурой, оптимальной для данного вида бактерий (как правило, 37°С) на 24 часа. Следят за тем, чтобы жидкость в лунках не касалась крышки.
3.9. Разливают питательный агар Мюллер Хингтон в стерильные квадратные или круглые чашки Петри.
3.10. На поверхность чашки накладывают трафарет и маркером наносят зоны, соответствующие каждой лунке планшета.
3.11. После инкубации содержимое всех лунок планшета с помощью восьмиканальной пипетки (по 10 мкл) или бактериологической петли высевают на поверхность агара в соответствии с нанесенной маркировкой.
3.15. Подсушивают капли посевной жидкости на агаре и убирают чашки в термостат 37°С на 24 часа.
4. Учет результатов анализа.
О наличии роста бактерий в лунках с соответствующим разведением антисептика судят по изменению цвета среды с сиреневого на желтый. Некоторые антисептики (например, «Бетадин» и «Йодопирон») могут искажать цвет питательной среды. Поэтому, кроме изменения цвета, учитывают еще один признак - помутнение питательной среды в лунках. Учет результатов дополнительно проводят инструментальным способом: по окончании экспозиции планшет помещают в микропланшетный фотометр с длиной волны 450 нм (например, аппарат типа Multiscan, ридер BIO-RAD Model 680 или любой другой микропланшетный фотометр для иммуноферментного анализа и биохимических исследований с диапазоном длин волн 400-750 нм) и получают в распечатке цифровые интенсивности цвета в лунках.
Использование мутности для учета результатов невозможно для тех антисептиков, которые при добавлении к цветной питательной среде образуют выраженную опалесценцию. В таком случае возможна регистрация минимальной бактерицидной концентрации по наличию роста на агаре Мюллер Хингтон после высева содержимого лунок с соответствующим разведением антисептика.
В лунках, где цвет среды не менялся и цифровые интенсивности цвета соответствовали контролю, а высев на чашке давал рост, антисептик проявлял бактериостатическое действие, т.е. задерживал рост бактерий. В лунках, где цвет среды не менялся, цифровые интенсивности цвета соответствовали контролю и высев на чашке не давал рост, антисептик проявлял бактерицидную активность.
4.1. Оценка результата анализа
Для каждого исследованного штамма микроорганизма определяют минимальную бактериостатическую концентрацию препарата (фиг. 3). Минимальную подавляющую концентрацию (МПК) определяют по отсутствию роста в лунке с максимальным разведением препарата. МПК зависит от начального разведения антисептика, и у антисептиков с различной концентрацией активного вещества эта величина будет отличаться, даже если эти препараты проявляют одинаковую активность. Поэтому для оценки эффективности антисептических средств лучше пользоваться индексом активности антисептика (ИАА).
Для каждой культуры ИАА рассчитывают как отношение рабочей концентрации антисептика к его МПК. Таким образом, если МПК - это величина, числовые значения которой для каждого антисептика будут различны, то числовые значения ИАА, по сути, отражают кратность разведения антисептика, при которой он способен подавлять рост бактерий. По данным литературы, активность антисептиков в ранах и на слизистых оболочках в результате разбавления, резорбции, инактивации и ингибиции снижается в среднем в 4 раза. Исходя из этого, терапевтическая концентрация составляет 1/4 рабочей, которая и является дифференцирующей бактерии на клинически чувствительные и устойчивые. То есть антисептик можно считать эффективным, если он способен подавлять рост бактерий в четырехкратном разведении (ИАА=4), а микроорганизмы, рост которых подавляется указанным разведением антисептика, следует относить к чувствительным.
4.2. Статистическая обработка результатов исследования
На практике часто возникает ситуация, когда разные антисептики по результатам исследований могут быть признаны активными, но для одних значения ИАА чуть больше или равны 4, а для других ИАА много больше 4. Для сравнительной характеристики активности различных антисептиков очень удобно использовать средние значения ИАА с вычислением 95%-ных доверительных интервалов (95% ДИ). Расчет среднего геометрического значения ИАА с вычислением 95% доверительных интервалов (ДИ) для оценки значимости различий в активности антисептиков можно проводить с использованием программ Past, Microsoft Exel, Statistica или других статистических программ. Оценка значимости различий в активности антисептиков проводится методом оценки гипотез с расчетом уровня p и методом доверительных интервалов (ДИ). Если два доверительных интервала не имеют общих значений и уровень значимости p меньше 0,05, различия между группами признаются статистически значимыми.
Используя программу KyPlot (или другую статистическую программу), строят графики, характеризующие активность антисептиков по отношению к микроорганизмам в составе биопленки.
5. Контроль пленкообразующей активности микроорганизмов
Для оценки способности микроорганизмов к образованию биопленок диски с выросшей биопленкой вносят в лунки стерильного планшета 1 горизонтальный ряд - 1 культура (из одной чашки Петри).
Производят промывку содержимого лунок (для удаления непрочно связавшихся с полимерным носителем клеток микроорганизмов) физиологическим раствором: внесение в каждую лунку по 100 мкл физраствора с последующим удалением в дезинфицирующий раствор.
Проводят окрашивание содержимого лунок планшета 1%-ной метиленовой синью (вносят по 50 мкл красителя и выдерживают 10 минут).
Краситель удаляют из лунок, трехкратно промывают физиологическим раствором (по 100 мкл в лунку).
Готовят спиртовую вытяжку красителя закрепившегося в матриксе биопленки. Для этого в каждую лунку добавляют 96% этиловый спирт по 100 мкл. Выдерживают при комнатной температуре в течение десяти минут.
После приготовления спиртовой вытяжки полимерные носители удаляют из лунок в дезинфицирующий раствор.
Для оценки степени интенсивности биопленкообразования измеряют оптическую плотность спиртовой вытяжки красителя в микропланшетном фотометре при длине волны 450 нм. Интенсивность окрашивания свидетельствует о степени биопленкообразования исследуемых культур: за условную единицу (у.е.) интенсивности биопленкообразования (БПО) принимается соотношение оптической плотности в опыте и контроле (OD питательного бульона). Если интенсивность биопленкообразования OD=0,25, то культура считается способной к биопленкообразованию.
6. Меры предосторожности
Все манипуляции, связанные с определением активности антисептиков, проводят в специальных лотках (кюветах), которые вместе с содержимым переносят в термостат. По окончании анализа все материалы подлежат обеззараживанию посредством погружения в дезинфицирующий раствор. Многократно промытые водой предметы стерилизуют при 120°С в течение 45 мин в автоклаве. Предметы однократного пользования обеззараживают и утилизируют.
В сравнении с прототипом заявляемый способ является более достоверным и точным, позволяя определить бактерицидный или бактериостатический тип действия антисептика, подобрать минимальные дозы использования антисептика, выявить наличие биологической устойчивости к препаратам, что позволяет заранее, до появления клинической устойчивости, ограничить или на какое-то время прекратить использовать в стационаре такой антисептик, вследствие чего имеет более широкие эксплуатационные возможности.
Способ оценки эффективности антимикробного воздействия антисептиков на бактерии, существующие в форме биопленки, заключающийся в создании модели бактериальной биопленки, в качестве которой используют биопленку из любых бактериальных культур и их ассоциаций, выделенных из клинического материала пациентов, которую выращивают на дренажных полимерах, подборе доз воздействия антисептиков, регистрации и оценке антимикробного эффекта, проводимой по наличию роста микроорганизмов на питательном бульоне, отличающийся тем, что регистрацию воздействия антисептиков на биопленку проводят дополнительно по изменению цвета питательной среды и ее помутнению в лунках планшета с помощью микропланшетного фотометра, дополнительно проводят высев содержимого лунок на питательный агар, по наличию или отсутствию роста на питательном агаре после воздействия антисептика определяют бактериостатический или бактерицидный тип действия на биопленочные формы бактерий, а эффект оценивают по индексу активности антисептика, который рассчитывают как отношение рабочей концентрации антисептика к его минимальной подавляющей концентрации, и при величине индекса 2-4 считают антисептик активным.