Бискраунсодержащие дистирилбензолы в качестве флуоресцентных молекулярных сенсоров для определения катионов щелочных, щелочноземельных металлов, аммония и способ их получения
Иллюстрации
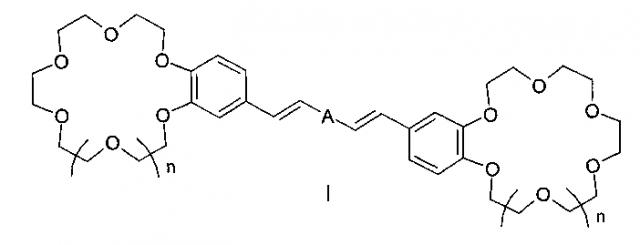
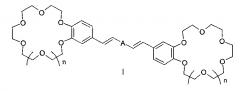
Показать всеИзобретение относится к органической химии и к области химии материалов, а именно к новому типу соединений - бискраунсодержащим дистирилбензолам общей формулы I, в которой A - бензольный фрагмент формулы II или III:
где n=0, 1, а также к способу получения соединений формулы I, заключающемуся в том, что бисфосфонаты общей формулы IV, в которых A имеет вышеуказанные значения, R - низший алкил, подвергают взаимодействию с формильными производными бензокраун-эфиров общей формулы V, где n=0, 1, и процесс проводят в среде органического растворителя или смеси органического растворителя с водой. Соединения формулы I и материалы на их основе могут быть использованы в составе оптических хемосенсоров для флуоресцентного определения катионов щелочных, щелочноземельных металлов и аммония, например для определения микроколичеств указанных ионов в биологических жидкостях, в промышленных водах и стоках. 2 н. и 1 з.п. ф-лы, 2 ил., 4 пр.
Реферат
Изобретение относится к органической химии и химии материалов, а именно к новому типу соединений - к дистирилбензолам, имеющим два краун-эфирных фрагмента, общей формулы I:
в которой A- бензольный фрагмент формулы II или III:
где n=0, 1.
Полученные соединения и композитные материалы на их основе могут быть использованы в составе оптических хемосенсоров для люминесцентного определения катионов щелочных, щелочноземельных металлов и аммония, например, для определения микроколичеств указанных ионов в биологических жидкостях, в промышленных водах и стоках, для мониторинга окружающей среды. Изобретение относится также к способу получения таких соединений.
Указанный тип соединений, их свойства и способ получения в литературе не описаны.
Заявляемый новый тип соединений имеет структуру, не относящуюся ни к одному из известных типов структур. Предложенный тип соединений содержит неизвестное ранее сочетание фрагментов незамещенного 1,3- и 1,4-дистирилбензола и двух краун-эфиров, конденсированных таким образом, что атомы кислорода макрогетероциклов находятся в сопряжении с бензольными циклами и в мета- и параположениях к этиленовым группам, что предопределяет их спектральные свойства и позволяет отнести эти соединения к новому типу дистирилбензолов.
Известны 1,3- и 1,4-дистирилбензолы [Haramoto Y., Патент WO 2012108484 A1, 2012; Yanagisawa Т., Tanaka M., Патент US 4371475 A, 1983; Pommer Н., Stilz W., Stolp F., Патент DE 1108220, 1961; Mochida S., Hirano K., Satoh Т., Miura M., J. Org. Chem., 2011, 76, 3024; Ha Y.M., Lee H.J., Park D., Jeong H.O., Park J.Y., Park Y.J., Lee K.J., Lee J.Y., Moon H.R., Chung H.Y., Biol. Pharm. Bull, 2013, 36, 55; Wong M.S., Li Z.H., Shek M.F., Chow К.H., Tao Y., D′Iorio M., J. Mater. Chem., 2000, 10, 1805; Barthram A.M., Cleary R.L., Jeffery J.C., Couchman S.M., Ward M.D., Inorg. Chim. Acta, 1998, 267, 1], особенностью строения которых является симметричное расположение заместителей в стириловых остатках и их отсутствие в центральном бензольном фрагменте и у этиленовых групп. Эти дистирилбензолы не способны к комплексообразованию с катионами щелочных, щелочноземельных металлов и аммония, поскольку не имеют макрогетероциклического фрагмента.
В литературе описаны дистирилбензолы, в которых стириловые остатки соединены с двумя остатками аза-15-краун-5-эфира, атомы азота которых находятся в сопряжении с бензольными циклами [Motoyoshiya J., Fengqiang Z., Nishii Y., Aoyama H., Spectrochim. Acta, A, 2008, 69, 167; Pond S.J.K., Tsutsumi O., Rumi M., Kwon O., Zojer E., Bredas J.L., Marder S.R., Perry J.W., J. Am. Chem. Soc., 2004, 126, 9291]. Для них характерно поглощение в области 420-470 нм и способность к комплексообразованию с катионами щелочных и щелочноземельных металлов. Однако константы устойчивости таких комплексов с катионами металлов невысоки из-за слабого участия атомов азота макроциклов в координации катионов металла и из-за конформационной подвижности аза-15-краун-5-эфирных остатков. Это не позволяет использовать дистирилбензолы с остатками аза-15-краун-5-эфира в качестве эффективных оптических молекулярных сенсоров на катионы металлов и аммония.
Известны 1,4-дистирилбензолы, в которых стириловые остатки соединены с двумя краун-эфирными фрагментами, атомы кислорода которых находятся в сопряжении с бензольными циклами в пара- и метаположениях к этиленовым группам [Strehmel В., Henbest К.В., Sarker А.М., Malpert J.Н., Chen D.Y., Rodgers M.A.J., Neckers D.C., J. Nanosci. Nanotech, 2001, 1, 107; Xia W.-S., Schmehl R.H., Li C.-J., Mague J. Т., Luo C.-P., Guldi D.M., J. Phys. Chem. B, 2002, 106, 833]. Однако они имеют заместители у двойных связей дистирилбензола или в центральном бензольном ядре, синтезируются из более труднодоступных соединений, с невысокими выходами или не были испытаны в качестве флуоресцентных молекулярных сенсоров на катионы металлов и аммония.
Целью настоящего изобретения является новый тип соединений - бискраунсодержащие 1,3- и 1,4-дистирилбензолы, имеющие незамещенный центральный бензольный цикл, в которых атомы кислорода, входящие в состав двух фрагментов 18(15)-краун-6(5)-эфиров, находятся в сопряжении с бензольными циклами в пара- и метаположениях к незамещенным этиленовым группам. Задачей изобретения является также разработка способа получения целевых продуктов, доказательство их строения и изучение комплексообразующих и ионофлуорохромных свойств.
Поставленная цель достигается структурой заявляемого нового типа дистирилбензолов общей формулы I и способом их получения, заключающимся в том, что бисфосфонаты общей формулы IV:
где A имеет указанные выше значения для формулы I, R - низший алкил,
подвергают взаимодействию с формильными производными бензо-18(15)-краун-6(5)-эфиров общей формулы V:
где n имеет указанные выше значения для формулы I.
Процесс проводят в среде органического растворителя, например, диметилформамида, в присутствии оснований, таких как, например, трет-бутилат натрия, гидрид натрия или гидроксид калия, при температурах 0-50°C.
Конденсация указанных бисфосфонатов общей формулы IV с формильными производными бензокраун-эфиров общей формулы V до настоящего времени не была известна. Согласно предлагаемому способу синтез дистирилбензолов общей формулы I осуществляют конденсацией активированных в бисфосфонатах IV α-метиленовых групп с карбонильными группами двух формильных производных бензокраун-эфиров общей формулы V с образованием двух двойных углерод-углеродных связей.
Строение полученных соединений общей формулы I доказано с помощью спектроскопии ЯМР 1H и 13C, электронной спектроскопии, масс-спектрометрии, а также данными элементного анализа (примеры 1-4).
Пример 1. 15,15′-{1,3-Фениленбис[(E)-этен-2,1-диил]}бис-2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-бензопентаоксациклопентадецин.
В трехгорлую колбу, на 15 мл снабженную обратным холодильником, помещают 26 мг (1.11 ммоля) металлического Na, избыток трет-бутанола и кипятят реакционную смесь при перемешивании в токе аргона до его растворения. Избыток трет-бутанола отгоняют в вакууме. К остатку при охлаждении добавляют раствор 98 мг (0.26 ммоля) тетраэтил[1,3-фениленди(метилен)]бис(фосфоната) в 0.42 мл ДМФА и реакционную смесь перемешивают в течение 45 мин. Затем добавляют по каплям при охлаждении раствор 153 мг (0.52 ммоля) 4′-формилбензо-15-краун-5-эфира в 0.42 мл ДМФА. Температуру реакционной смеси поднимают до комнатной и выдерживают при перемешивании 75 ч. К реакционной смеси добавляют 5 мл воды, выпавший осадок отфильтровывают, промывают 3 мл воды, высушивают на воздухе. Получают 132 мг (выход 77%) бис(15-краун-5)содержащего 1,3-дистирилбензола в виде светло-бежевых мелких кристаллов, т. пл. 179-180°C. 0.54 (бензол - EtOAc (1:5) с добавлением 2-3 капель пирролидина, DC-Alufolien Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1H (500 МГц, в CD2Cl2, 27°C): 3.64-3.73 (м, 16 Н, 5, 5′, 6, 6′, 8, 8′, 9, 9′-CH2O); 3.82-3.89 (м, 8 Н, 3, 3′, 11, 11′-CH2O); 4.08-4.12 (м, 4 Н, 2, 2′-CH2O); 4.12-4.17 (м, 4 Н, 12, 12′-CH2O); 6.85 (д, 2 Н, J=8.1 Гц, С(17)Н, С(17′)Н); 6.99 (д, 2 Н, J=16.3 Гц, 2 C(2)H=CH); 7.03-7.12 (м, 6 Н, 2 СН=С(1)H, С(14)Н, С(14′)Н, С(16)Н, С(16′)Н); 7.29-7.40 (м, 3 Н, С(4)Н, С(5)Н, С(6)Н); 7.61 (с, 1 Н, C(2)H).
Спектр ЯМР 13C (125 МГц, в CD2Cl2, 30°C): 68.12, 68.25 (2, 2′, 12, 12′-CH2O); 68.70, 68.77 (3, 3′, 11, 11′-CH2O); 69.55, 69.58 (5, 5′, 9, 9′-CH2O); 70.19 (6, 6′, 8, 8′-CH2O); 110.76 (С(14)Н, С(14′)Н); 113.00 (С(17)Н, С(17′)Н); 119.69 (С(16)Н, С(16′)Н); 123.52 (С(2)Н); 124.54 (С(4)Н, С(6)Н); 125.90 (2 C(2)Н=СН); 128.00 (С(5)Н); 128.35 (2 СН=С(1)Н); 130.06 (С(15), С(15′)); 137.34 (С(1), С(3)); 148.59, 148.66 (С(13a), С(13a′), С(17a), С(17a′)).
УФ-спектр (C=1×10-5 моль·л-1, MeCN - CH2Cl2 (10:1)), нм: 330 (ε=60500).
Флуоресценция (C=1×10-6 моль·л-1, MeCN - CH2Cl2 (10:1)): λex 344 нм, λf max 426 нм.
Масс-спектр (m/z): 662.0 [M]+, 685.0 [M+Na]+, 701.0 [M+K]+.
Найдено, %: C 68.70; H 6.69.
C38H46O10.
Вычислено, %: C 68.86; H 7.00.
Пример 2. 18,18′-{1,3-Фениленбис[(E)-этен-2,1-диил]}бис-2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин.
В трехгорлую колбу, на 15 мл снабженную обратным холодильником, помещают 29 мг (1.25 ммоля) металлического Na, избыток трет-бутанола и кипятят реакционную смесь при перемешивании в токе аргона до его растворения. Избыток трет-бутанола отгоняют в вакууме. К остатку при охлаждении добавляют раствор 111 мг (0.30 ммоля) тетраэтил[1,3-фениленди(метилен)]бис(фосфоната) в 0.40 мл ДМФА и реакционную смесь перемешивают в течение 45 мин. Затем добавляют по каплям при охлаждении раствор 200 мг (0.59 ммоля) 4′-формилбензо-18-краун-6-эфира в 0.40 мл ДМФА. Температуру реакционной смеси поднимают до комнатной и выдерживают при перемешивании 75 ч. К реакционной смеси добавляют 10 мл воды, экстрагируют дихлорметаном (3×15 мл), экстракт высушивают Na2SO4 и упаривают в вакууме. Получают 270 мг прозрачного кристаллизующегося масла. Масло промывают 5 мл пентана, затем растирают с 3 мл Et2O. Получают 113 мг (выход 50%) бис(18-краун-6)содержащего 1,3-дистирилбензола в виде светло-бежевых мелких кристаллов, т. пл. 118-119°C. 0.34 (бензол - EtOAc (1:5) с добавлением 2-3 капель пирролидина, DC-Alufolien Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1H (500 МГц, в CD2Cl2, 27°C): 3.60 (с, 8 Н, 8, 8′, 9, 9′-CH2O); 3.62-3.72 (м, 16 Н, 5, 5′, 6, 6′, 11, 11′, 12, 12′-CH2O); 3.80-3.92 (м, 8 Н, 3, 3′, 14, 14′-CH2O); 4.15 (м, 4 H, 2, 2′-CH2O); 4.20 (м, 4 Н, 15, 15′-CH2O); 6.85 (д, 2 Н, J=8.1 Гц, С(20)Н, С(20′)Н); 6.99 (д, 2 Н, J=16.3 Гц, 2 C(2)H=СН); 7.03-7.13 (м, 6 Н, 2 СН=С(1)H, С(17)Н, С(17′)Н, С(19)Н, С(19′)Н); 7.29-7.34 (м, 1 Н, С(5)Н); 7.34-7.40 (м, 2 Н, С(4)Н, С(6)Н); 7.61 (с, 1 Н, С(2)Н).
Спектр ЯМР 13C (125 МГц, в CD2Cl2, 30°C): 67.94 (2, 2′, 15, 15′-CH2O); 68.72, 68.76 (3, 3′, 14, 14′-CH2O); 69.69-70.01 (5, 5′, 6, 6′, 8, 8′, 9, 9′, 11, 11′, 12, 12′-CH2O); 110.22 (С(17)Н, С(17′)Н); 112.52 (С(20)Н, С(20′)Н); 119.51 (С(19)Н, С(19′)Н); 123.50 (С(2)Н); 124.52 (С(4)Н, С(6)Н); 125.85 (2 C(2)Н=CH); 128.02 (2 СН=С(1)H); 128.34 (С(5)Н); 129.90 (С(18), С(18′)); 137.35 (С(1), С(3)); 148.24, 148.30 (С(16а), C(16a′), C(20a), C(20a′)).
УФ-спектр (C=1×10-5 моль·л-1, MeCN - CH2Cl2 (10:1)), нм: 331 (ε=64500).
Флуоресценция (С=1×10-6 моль·л-1, MeCN - CH2Cl2 (10:1)): λex 344 нм, λf max 425 нм.
Масс-спектр (m/z): 750.19 [М]+, 773.17 [M+Na]+, 789.17 [M+K]+.
Найдено, %: C 67.37; H 7.15.
C42H54O12.
Вычислено, %: C 67.18; H 7.25.
Пример 3. 15,15′-{1,4-Фениленбис[(E)-этен-2,1-диил]}бис-2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-бензопентаоксациклопентадецин.
В трехгорлую колбу, на 15 мл снабженную обратным холодильником, помещают 27 мг (1.17 ммоля) металлического Na, избыток трет-бутанола и кипятят реакционную смесь при перемешивании в токе аргона до его растворения. Избыток трет-бутанола отгоняют в вакууме. К остатку при охлаждении добавляют раствор 106 мг (0.28 ммоля) тетраэтил[1,4-фениленди(метилен)]бис(фосфоната) в 0.42 мл ДМФА и реакционную смесь перемешивают в течение 45 мин. Затем добавляют по каплям при охлаждении раствор 165 мг (0.56 ммоля) 4′-формилбензо-15-краун-5-эфира в 0.42 мл ДМФА. Температуру реакционной смеси поднимают до комнатной и выдерживают при перемешивании 75 ч. К реакционной смеси добавляют 5 мл воды, выпавший осадок отфильтровывают, промывают 3 мл воды. Получают 135 мг (выход 73%) бис(15-краун-5)содержащего 1,4-дистирилбензола в виде ярко-желтых мелких кристаллов, т. пл. 285-289°C. 0.49 (бензол - EtOAc (1:5) с добавлением 2-3 капель пирролидина, DC-Alufolien Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1H (500 МГц, в CD2Cl2, 27°C): 3.64-3.72 (м, 16 Н, 5, 5′, 6, 6′, 8, 8′, 9, 9′-CH2O); 3.82-3.89 (м, 8 Н, 3, 3′, 11, 11′-CH2O); 4.10 (м, 4 Н, 2, 2′-CH2O); 4.15 (м, 4 Н, 12, 12′-CH2O); 6.84 (д, 2 H, J=8.3 Гц, С(17)Н, С(17′)Н); 6.96 (д, 2 Н, J=16.3 Гц, 2 C(2)H=CH); 7.02-7.08 (м, 6 Н, 2 CH=C(1)H, С(14)Н, С(14′)Н, С(16)Н, С(16′)Н); 7.49 (с, 4 Н, С(2)Н, С(3)H, С(5)Н, С(6)Н).
Спектр ЯМР 13C (125 МГц, в CD2Cl2, 30°C): 68.12, 68.23 (2, 2′, 12, 12′-CH2O); 68.73 (3, 3′, 11, 11′-CH2O); 69.55, 70.14 (5, 5′, 6, 6′, 8, 8′, 9, 9′-CH2O); 110.72 (C(14)H, С(14′)H); 113.04 (С(17)Н, С(17′)Н); 119.66 (С(16)Н, С(16′)Н); 125.72 (2 C(2)Н=CH); 125.92 (С(2)Н, С(3)Н, С(5)Н, С(6)Н); 127.48 (2 CH=C(1)Н); 130.22 (С(15), С(15′)); 136.04 (С(1), С(4)); 147.31,148.60 (С(13a), С(13a′), С(17a), С(17a′)).
УФ-спектр (С=1×10-5 моль·л-1, MeCN - CH2Cl2 (10:1)), нм: 371 (ε=56400).
Флуоресценция (С=1.4×10-6 моль·л-1, MeCN - CH2Cl2 (10:1)): λex 367 нм, λf max 442 нм.
Масс-спектр (m/z): 662.0 [M]+, 685.0 [M+Na]+, 701.0 [M+K]+.
Найдено, %: C 68.81; H 6.87.
C38H46O10.
Вычислено, %: C 68.86; H 7.00.
Пример 4. 18,18′-{1,4-Фениленбис[(E)-этен-2,1-диил]}бис-2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин.
В трехгорлую колбу, на 15 мл снабженную обратным холодильником, помещают 14 мг (0.63 ммоля) металлического Na, избыток трет-бутанола и кипятят реакционную смесь при перемешивании в токе аргона до его растворения. Избыток трет-бутанола отгоняют в вакууме. К остатку при охлаждении добавляют раствор 56 мг (0.15 ммоля) тетраэтил[1,4-фениленди(метилен)]бис(фосфоната) в 0.30 мл ДМФА и реакционную смесь перемешивают в течение 45 мин. Затем добавляют по каплям при охлаждении раствор 100 мг (0.30 ммоля) 4′-формилбензо-18-краун-6-эфира в 0.30 мл ДМФА. Температуру реакционной смеси поднимают до комнатной и выдерживают при перемешивании 75 ч. К реакционной смеси добавляют 5 мл воды, выпавший осадок отфильтровывают, промывают 3 мл воды. Получают 71 мг (выход 63%) бис(18-краун-6)содержащего 1,4-дистирилбензола в виде ярко-желтых мелких кристаллов, т. пл. 243-245°C. 0.32 (бензол - EtOAc (1:5) с добавлением 2-3 капель пирролидина, DC-Alufolien Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1H (500 МГц, в CD2Cl2, 27°C): 3,61 (с, 8 Н, 8, 8′, 9, 9′-CH2O); 3.62-3.72 (м, 16 H, 5, 5′, 6, 6′, 11, 11′, 12, 12′-CH2O); 3.83-3.89 (м, 8 Н, 3, 3′, 14, 14′-CH2O); 4.13 (м, 4 H, 2, 2′-CH2O); 4.18 (м, 4 Н, 15, 15′-CH2O); 6.85 (д, 2 Н, J=8.3 Гц, С(20)Н, С(20′)Н); 6.96 (д, 2 Н, J=16.3 Гц, 2 C(2)H=CH); 7.02-7.09 (м, 6 Н, 2 CH=C(1)H, С(17)Н, C(17′)H, C(19)H, С(19′)Н); 7.47 (c, 4 Н, С(2)Н, С(3)Н, С(5)Н, С(6)Н).
Спектр ЯМР 13C (125 МГц, в CD2Cl2, 30°C): 67.98 (2, 2′, 15, 15′-CH2O); 68.74, 68.78 (3, 3′, 14, 14′-CH2O); 69.83, 69.95 (5, 5′, 6, 6′, 8, 8′, 9, 9′, 11, 11′, 12, 12′-CH2O); 110.26 (C(17)Н, С(17′)Н); 112.61 (С(20)Н, С(20′)Н); 119.47 (С(19)Н, С(19′)Н); 125.65 (2 C(2)Н=CH); 125.91 (С(2)Н, С(3)Н, С(5)Н, С(6)Н); 127.50 (2 СН=С(1)Н)); 130.04 (С(18), С(18′)); 136.04 (С(1), С(4)); 148.23,148.34 (С(16а), С(16a′), С(20a), С(20a′)).
УФ-спектр (С=1×10-5 моль·л-1, MeCN - CH2Cl2 (10: 1)), нм: 372 (ε=58400).
Флуоресценция (С=1.1×10-6 моль·л-1, MeCN - CH2Cl2 (10:1)): λex 373 нм, λf max 440 нм.
Масс-спектр (m/z): 750.19 [M]+, 773.17 [M+Na]+, 789.17 [M+K]+.
Найдено, %: C 67.16; H 7.15.
C42H54O12.
Вычислено, %: C 67.18; H 7.25.
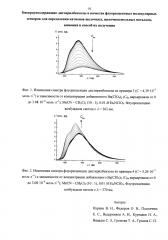
Изучены комплексообразующие и ионофлуорохромные свойства полученных дистирилбензолов I из примеров 3 и 4 в MeCN - CH2Cl2 (10:1).
Полученные данные, представленные на фиг. 1, 2, убедительно свидетельствуют о том, что бискраунсодержащие дистирилбензолы способны действовать как флуоресцентные сенсоры.
Предварительные результаты исследования бискраунсодержащих дистирилбензолов общей формулы I показали, что в апротонной среде они способны с хорошим флуоресцентным откликом связывать катионы щелочных, щелочноземельных металлов и аммония, то есть проявляют свойства флуоресцентных молекулярных сенсоров. Эти свойства позволяют создать на основе полученных дистирилбензолов флуоресцентные хемосенсорные материалы.
Таким образом, получен новый тип дистирилбензолов - бискраунсодержащие дистирилбензолы, содержащие неизвестное ранее сочетание фрагментов дистирилбензола и двух краун-эфиров, конденсированных таким образом, что атомы кислорода макрогетероциклов находятся в сопряжении с бензольными циклами в мета- и параположениях к этиленовым группам, и обнаружена их выраженная способность к связыванию катионов щелочных, щелочно-земельных металлов и аммония, характеризующаяся существенными изменениями в спектрах испускания. Эти свойства позволяют использовать заявленные соединения в составе оптических хемосенсоров для флуоресцентного определения катионов щелочных, щелочноземельных металлов и аммония, например, в составе полимерных пленок и мембран для определения микроколичеств указанных ионов в биологических жидкостях, а также для определения микроколичеств указанных ионов в промышленных водах и стоках, в том числе для мониторинга окружающей среды. Разработан также способ получения заявленных соединений высокой степени чистоты и с хорошими выходами (до 77%).
1. Бискраунсодержащие дистирилбензолы общей формулы I: в которой А - бензольный фрагмент формулы II или III: где n=0, 1;отличающиеся тем, что содержат фрагменты незамещенного дистирилбензола и двух краун-эфиров, атомы кислорода которых находятся в сопряжении с бензольными циклами в мета- и параположениях к этиленовым группам.
2. Способ получения бискраунсодержащих дистирилбензолов формулы I по п. 1, отличающийся тем, что он включает взаимодействие бисфосфонатов формулы IV: в которых А имеет указанные в п. 1 значения, R - низший алкил,с формильными производными бензокраун-эфиров формулы V: где n имеют указанные в п. 1 значения.
3. Способ по п. 2, отличающийся тем, что процесс проводят в присутствии органического или неорганического основания.