Катализатор, способ его приготовления и способ фотокаталитического получения водорода
Иллюстрации
Показать всеИзобретение относится к способам получения катализатора на основе оксидов и гидроксидов меди и никеля, нанесенных на твердый раствор сульфидов кадмия и цинка, применяемого преимущественно в качестве фотокатализатора для процессов фотокаталитического выделения водорода из водных растворов Na2S/Na2SO3 под действием видимого излучения. Способ получения композитного фотокатализатора заключается в нанесении гидроксидов переходных металлов на твердый раствор сульфидов кадмия и цинка Cd0.3Zn0.7S с последующей сушкой. Предлагаемый способ позволяет получать композитные фотокатализаторы состава:
x%MO/M(OH)2/Cd0.3Zn0.7S, где M=Cu, Ni, x - 0,06-1,0, с высокой активностью. 3 н.п. ф-лы, 2 ил., 1 табл., 6 пр.
Реферат
Изобретение относится к области фотокатализа и может найти применение в процессах фотокаталитического выделения водорода из водных растворов неорганических веществ под действием видимого излучения.
Использование в качестве доноров электронов растворов неорганических веществ, таких как Na2S/Na2SO3 [Li Q., Meng H., Zhou P., Zheng Y., Wang J., Yu J., Gong J.R. // ACS Catal. 2013. V. 3. №5. P. 882] или Na2S/K2SO3 [Chen J., Lin Sh., Yan G., Yang L., Chen X. // Catal. Commun. 2008. V. 9. №1. P. 65], является выгодным с практической точки зрения, поскольку для получения таких растворов необходим сероводород, являющийся побочным продуктом переработки нефти, производства стали, дубления кож и отходом целлюлозно-бумажной промышленности. Кроме этого, совмещение процессов очистки растворов от сероводорода и получение водорода при освещении видимым светом экологически выгодно.
Наиболее активными фотокатализаторами выделения водорода из водных растворов Na2S/Na2SO3 являются твердые растворы сульфидов кадмия и цинка состава Cd0.3Zn0.7S [Козлова Е.А, Любина Т.П. // Кин. Кат. 2012. Т. 53. №2. С. 188]. Основным недостатком таких фотокатализаторов являются низкие каталитическая активность и фотостабильность. Для того чтобы повысить эти параметры, необходимо модифицировать методы приготовления катализаторов и вводить сокатализаторы.
Наиболее активные сокатализаторы - благородные металлы: платина, палладий, рутений, золото [Sathish M., Viswanathan В., Viswanath R.P. // Int. J. Hydrogen Energy. 2006. V. 31. №7. P. 891], однако их высокая стоимость ограничивает практическое применение.
Известны фотокатализаторы состава Cd1-xZnxS с добавками сульфидов Me, где Me - Mo, V, Al, Cs, Ti, Μn, Fe, Pd, Pt, P, Cu, Ag, Ir, Sb, Pb, Ga, и нанесенными благородными металлами, такими как Pt, Ru, Ir, Со, Rh, Cu, Pd, Ni, и нанесенными оксидами этих металлов [RU 2199390, B01J 27/04, C01B 3/06, 27.02.2001; RU 2238145, B01J 27/04, C01B 3/06, 20.06.2003; RU 2175888, B01J 27/04, C01B 3/06, 20.11.2001; CA 2332544, B01J 23/06, 22.02.2000], Cd1-xHgxS, Cd1-xZnxS с нанесенными металлами - Pt, Ni, Ru, Os [ЕР 0100299B1, C01B 3/04, B01J 27/02]. Получение фотокатализаторов в приведенных выше случаях происходит путем осаждения сульфидов из смеси растворов солей цинка, кадмия и Me, где Me - Mo, V, Al, Cs, Ti, Μn, Fe, Pd, Pt, P, Cu, Ag, Ir, Sb, Pb, Ga, водным раствором сульфида натрия или газообразным H2S с дальнейшей сушкой и нанесением благородных металлов.
Известны способы получения фотокатализаторов, не содержащих благородных металлов, состава CuS (у) - Zn1-xCdxS, где x - содержание кадмия в твердом растворе (0.3<x<0.8), у - мольная доля меди (0%<у<15.8%) [Zhang W., Rong Χ. // Int. J. Hydrogen Energy. 2009. V. 34. №20. P. 8495], и yCuS/Cd0.3Zn0.7S, где у - мольная доля меди (0<у<0.1) [Markovskaya D.V., Cherepanova S.V., Saraev Α.Α., Gerasimov Ε. Yu., Kozlova Ε.Α. // Chem. Eng. J. 2015. P. 146]. Однако сравнительные эксперименты показали, что фотокатализаторы 0.1% NiS/Cd0.4Zn0.6S являются более активными, чем 0.1% CoS/Cd0.4Zn0.6S и 0.1% CuS/Cd0.4Zn0.6S, следовательно, применение никелевых сокатализаторов более выгодно для практических целей [Wang J., Li В., Chen J., Li Ν., Zheng J., Zhao J., Zhu Ζ. // Appl. Surf. Sci. 2012. V. 259. P. 118].
В литературе описаны сокатализаторы на основе гидроксидов переходных металлов (меди, никеля, железа и кобальта), при этом наибольшую активность показали фотокатализаторы Ni(OH)2/TiO2 и Cu(ОН)2/TiO2 [Υan Ζ., Yu X., Zhang Y., Jia H., Sun Ζ., Du P. // Appl. Cat. В. 2014. V. 160-161. P. 173].
Известно применение гидроксида никеля в качестве сокатализаторов для сульфидных композитных систем [Ran J., Yu J., Jaroniec M. // Green Chem. 2011. V. 13. №10. P. 2708]. Комплексный анализ различных сокатализаторов на основе соединений никеля (Ni, NiO, Ni(OH)2, NiS) также описан в литературе, причем каталитическая активность выделения водорода из водного раствора триэтаноламина снижалась в ряду 0.6% Ni(OH)2/Zn0.8Cd0.2S>0.6% Ni/Zn0.8Cd0.2S>0.6% NiS/Zn0.8Cd0.2S>0.6% NiO/Zn0.8Cd0.2S>Zn0.8Cd0.2S [Ran J., Zhang J., Yu J., Qiao S.Ζ. // Chemsuschem. 2014. V. 7. №12. P. 3426].
Наиболее близкими к данному изобретению являются фотокатализаторы 0.6% Ni(OH)2/Zn0.8Cd0.2S и 0.6% NiO/Zn0.8Cd0.2S [Ran J., Zhang J., Yu J., Qiao S.Ζ. // Chemsuschem. 2014. V. 7. №12. P. 3426]. Основным недостатком последних фотокатализаторов является исследование их активности только в органических средах, соответственно, остаются невыясненными возможность переноса этой зависимости на неорганическую донорную систему Na2S/Na2SO3 и максимально достигаемая каталитическая активность в такой системе. Существенным недостатком известных катализаторов является также сложный метод синтеза с применением автоклавирования и термопрограммируемого нагрева.
Изобретение решает задачу повышения эффективности работы катализатора и упрощения методики его приготовления.
Технический результат - высокая активность в процессе фотокаталитеского получения водорода из водного раствора Na2S/Na2SO3 под действием видимого излучения.
Задача решается катализатором для процесса фотокаталитического получения водорода из водных растворов неорганических веществ под действием видимого излучения следующего состава: x%MO/M(OH)2/Cd0.3Zn0.7S, где M=Cu, Ni, x - массовая доля нанесенного сокатализатора, равная 0,06-1,0.
Задача решается также способом приготовления этого катализатора, заключающимся в том, что на поверхность твердого раствора сульфидов кадмия и цинка состава Cd0.3Zn0.7S наносят гидроксид никеля или меди путем осаждения растворимой соли гидроксидом натрия. Сушка при 80°С позволяет получить смесь МО/М(ОН)2 (М=Cu, Ni) на поверхности твердого раствора сульфида кадмия и цинка.
Задача решается также способом получения водорода из водного раствора Na2S/Na2SO3 под действием видимого излучения, который осуществляют в присутствии фотокатализатора следующего состава: x%MO/M(OH)2/Cd0.3Zn0.7S, где M=Cu, Ni, x - массовая доля нанесенного сокатализатора, равная 0,06-1,0.
Оксиды меди и никеля являются полупроводниками, поэтому в изучаемых системах возможны гетеропереходы, увеличивающие скорость фотокаталитического процесса [Helaili Ν., Bessekhouad Y., Bouguelia Α., Trari M. // J. Hazard. Mat. 2009. V. 168. №1. P. 484; Ji Z., Natu G., Wu Y. // ACS Appl. Mater. Inter. 2013. V. 5. №17. P. 8641; Reguig Β.Α., Khelil A., Cattin L., Morsli M., Bernede J.С. // Appl. Sur. Sci. 2007. V. 253. №9. P. 4330].
Гидроксиды никеля и меди вовлекают фотогенерированные заряды в химические превращения, повышая разделение зарядов и время их жизни [Не Н., Xiao P., Zhou M., Zhang Y., Lou Q., Dong Χ. II Int. J. Hydrogen Energy. 2012. V. 37. №6. P. 4967; Kaluta S., Abe T. // Electrochemical and Solid State Letters. 2009. V. 12. №3. P. Р1]. К тому же, одновременное присутствие в системе оксидов и гидроксидов переходных металлов может приводить к синергетическому эффекту, как в случае многокомпонентных фотокатализаторов Pt/Cd1-xZnxS/ZnO/ε-Zn(OH)2/2D β-Ζn(ΟΗ)2 [Kozlova Ε.Α., Markovskaya D.V., Cherepanova S.V., Saraev Α.Α., Gerasimov Ε. Yu., Perevalov T.V., Kaichev V.V., Parmon V.N. // Int. J. Hydrogen Energy. 2014. V. 39. №33. P. 18758]. Перечисленные выше эффекты позволяют достичь образцам состава NiO/Ni(OH)2/Cd0.3Zn0.7S и CuO/Cu(OH)2/Cd0.3Zn0.7S высокой каталитической активности.
Сущность изобретения иллюстрируется следующими примерами.
Примеры 1-4 (сравнительные)
Пример 1
Готовят растворы Zn(NO3)2, CdCl2, NaOH, Na2S с концентраций 0.1 моль/л. В коническую колбу объемом 500 мл помещают 30 мл раствора хлорида кадмия и 70 мл раствора нитрата цинка, перемешивают в течение 5 мин. Затем добавляют в колбу 100 мл раствора гидроксида натрия, полученную суспензию перемешивают 20 мин, после чего добавляют 150 мл сульфида натрия. Процесс перемешивания продолжают в течение 1 ч, после чего осадок промывают несколько раз дистиллированной водой и сушат при температуре 80°С на воздухе.
Получают катализатор состава: Cd0.3Zn0.7S.
Пример 2
Аналогичен примеру 1, кроме того, что на полученный высушенный осадок наносят металлическую медь по следующей методике: 0.4 г Cd0.3Zn0.7S суспендируют в 10 мл воды, после чего по каплям добавляют 63 мкл раствора нитрата меди с концентрацией 0.1 моль/л, смесь перемешивают 5 мин и добавляют избыток боргидрида натрия (2.5 по молям). Перемешивание продолжают в течение 0.5 ч, после чего осадок промывают дистиллированной водой и сушат при температуре 80°С на воздухе.
Получают катализатор состава 0.1% CuZCd0.3Zn0.7S.
Пример 3
Аналогичен примеру 2, кроме того, что вместо раствора нитрата меди добавляют 832 мкл раствора хлорида никеля, а вместо боргидрида натрия используют раствор сульфида натрия с концентрацией 0.1 моль/л.
Получают катализатор состава: 1% NiS/Cd0.3Zn0.7S.
Примеры 4-6 иллюстрируют предлагаемое техническое решение.
Пример 4
Готовят растворы Zn(NO3)2, CdCl2, NaOH, Na2S с концентраций 0.1 моль/л. В коническую колбу объемом 500 мл помещают 30 мл раствора хлорида кадмия и 70 мл раствора нитрата цинка, перемешивают в течение 5 мин. Затем добавляют в колбу 100 мл раствора гидроксида натрия, полученную суспензию перемешивают 20 мин, после чего добавляют 150 мл сульфида натрия. Процесс перемешивания продолжают в течение 1 ч, после чего осадок промывают несколько раз дистиллированной водой и сушат при температуре 80°С на воздухе.
На полученный высушенный осадок наносят металлическую смесь оксида и гидроксида никеля по следующей методике: 0.4 г Cd0.3Zn0.7S суспендируют в 10 мл воды, после чего по каплям добавляют 300 мкл раствора хлорида никеля с концентрацией 0.1 моль/л, смесь перемешивают 5 мин и добавляют трехкратный избыток NaOH с концентрацией 0.1 моль/л. Перемешивание продолжают в течение 0.5 ч, после чего осадок промывают дистиллированной водой и сушат при температуре 80°С на воздухе.
Получают катализатор состава: 0.06% NiO/Ni(OH)2/Cd0.3Zn0.7S.
Пример 5
Аналогичен примеру 4, кроме того, что вместо хлорида никеля добавляют 63 мкл нитрата меди с концентрацией 0.1 моль/л.
Получают катализатор состава: 0.1% CuO/Cu(OH)2/Cd0.3Zn0.7S.
Пример 6
Аналогичен примеру 4, кроме того, что объем раствора хлорида никеля равен 5 мл.
Получают катализатор состава: 1.0% NiO/Ni(OH)2/Cd0.3Zn0.7S.
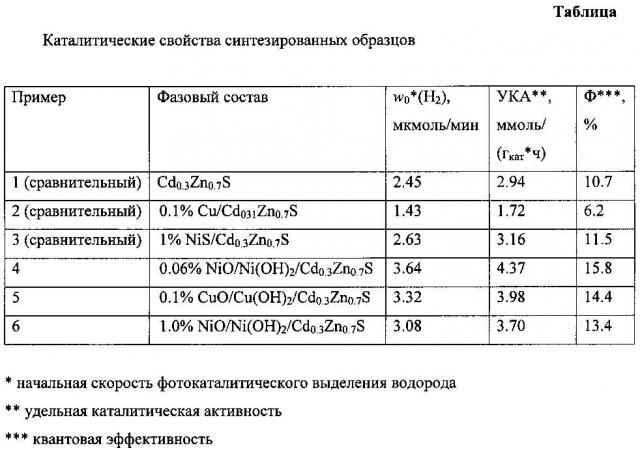
Каталитические свойства катализаторов приведены в таблице.
Способ получения водорода из водного раствора Na2S/Na2SO3 под действием видимого излучения проводят при следующих условиях: C(Na2S)=0.1 М, C(Na2SO3)=0.1 М, Скат=0.5 г/л, Vсуспензия=0.1 л, Т=20°С, источник освещения - светодиод 450 LED (30 Вт, 32.7 мВт/см2), один цикл освещения длился 1.5 ч.
Данные ИК-спектроскопии, подтверждающие фазовый состав нанесенных компонентов, показаны на Фиг. 1 (ИК-спектр Ni(OH)2 и нанесенного никельсодержащего фотокатализатора в области 430-650 см-1) и Фиг. 2 (ИК-спектр Cu(ОН)2 и нанесенного медьсодержащего фотокатализатора в области 430-650 см-1).
Видно, что нанесение смеси оксидов и гидроксидов никеля повышает активность твердого раствора Cd0.3Zn0.7S в фотокаталитическом выделении водорода, при этом нанесение металла (пример 2) или сульфида металла (пример 3) понижает или не влияет на активность твердого раствора.
1. Катализатор для процесса фотокаталитического получения водорода из водных растворов неорганических веществ под действием видимого излучения, содержащий твердый раствор сульфидов кадмия и цинка и сокатализатор, отличающийся тем, что в качестве сокатализатора он содержит фазы оксида и гидроксида переходного металла М и имеет следующий состав: x%MO/M(OH)2/Cd0.3Zn0.7S, где M=Cu, Ni, x - массовая доля нанесенного сокатализатора, равная 0,06-1,0.
2. Способ приготовления катализатора для процесса фотокаталитического получения водорода из водных растворов неорганических веществ под действием видимого излучения, отличающийся тем, что на поверхность твердого раствора сульфидов кадмия и цинка состава Cd0.3Zn0.7S наносят композитный сокатализатор гидроксид никеля и оксид никеля или гидроксид меди и оксид меди путем осаждения растворимой соли гидроксидом натрия с последующей сушкой, в результате чего получают фотокатализатор состава: x%MO/M(OH)2/Cd0.3Zn0.7S, где M=Cu, Ni, x - массовая доля нанесенного сокатализатора, равная 0,06-1,0.
3. Способ получения водорода из водного раствора Na2S/Na2SO3 под действием видимого излучения в присутствии катализатора, содержащего твердый раствор сульфидов кадмия и цинка и сокатализатор, отличающийся тем, что процесс осуществляют в присутствии фотокатализатора по п. 1 или приготовленного по п. 2.