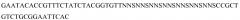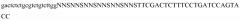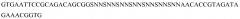Композиции на основе стабилизированных фибронектиновых доменов, способы и области их применения
Иллюстрации
Показать всеИзобретения касаются способа конструирования библиотеки белков, полученных из консенсусной последовательности домена фибронектина типа III (FN3) с повышенной стабильностью, и библиотеки, полученной таким способом. Способ включает стадии: предоставление полинуклеотидной последовательности, кодирующей полипептид, содержащий консенсусную последовательность домена фибронектина типа III (FN3) с повышенной стабильностью, выбранную из группы, состоящей из SEQ ID NO: 142-151; введение рандомизированных кодонов в полинуклеотидную последовательность в выбранных положениях; и размножение копий указанной полинуклеотидной последовательности с получением библиотеки полинуклеотидов, кодирующих варианты каркасных белков. Изобретения могут быть использованы в биофармацевтческой промышленности. 2 н. и 2 з.п. ф-лы, 9 ил., 5 табл., 4 пр.
Реферат
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Настоящее изобретение относится к белковым каркасам с новыми характеристиками, включая возможность связывания с клеточными мишенями. Более конкретно, настоящее изобретение относится к белковому каркасу, основанному на консенсусной последовательности повтора фибронектина типа III (FN3).
Описание области применения
Когда необходимо добиться высокой аффинности и специфичности к молекуле-мишени, наиболее широко используется класс терапевтических белков - моноклональные антитела. Однако для биофармацевтической промышленности большой интерес также представляет конструирование не являющихся антителами белков, которые способны связываться с такими мишенями. Данные «альтернативные белковые» каркасы могут иметь преимущества перед традиционными антителами в связи с малым размером, отсутствием дисульфидных связей, высокой стабильностью и возможностью экспрессирования в прокариотических клетках-хозяевах. Для их очистки активно используют новые способы; они легко соединяются с лекарственными средствами/токсинами, эффективно проникают в ткани, и их можно без труда использовать в качестве полиспецифических связующих веществ (Skerra 2000 J Mol Recognit 13(4): 167-87; Binz and Pluckthun 2005 Curr Opin Biotechnol 16(4): 459-69).
Одним из таких альтернативных белковых каркасов является укладка цепи иммуноглобулинов (Ig). Данная укладка цепи встречается в вариабельных участках антител, а также в тысячах белков, не являющихся антителами. Исследования показывают, что один из таких белков Ig, десятый повтор фибронектина типа III (FN3) из фибронектина человека, может допускать ряд мутаций в поверхностных петлях при сохранении общей структуры укладки цепи Ig. Таким образом, в последовательности данных петель были встроены библиотеки аминокислотных вариантов, а также был проведен отбор специфических связующих веществ, выбранных для ряда разных мишеней (Koide et al. 1998 J Mol Biol 284(4): 1141-51; Karatan et al. 2004 Chem Biol 11(6): 835-44). Как было обнаружено, такие сконструированные домены FN3 связываются с мишенями с высокой аффинностью, сохраняя при этом свои важные биофизические характеристики (Parker et al. 2005 Protein Eng Des Sel 18(9): 435-44).
Желательные физические характеристики, которые должны иметь потенциальные альтернативные каркасные молекулы, включают в себя высокую термостабильность и обратимость термического свертывания и развертывания. Для повышения эффективной термостабильности белков и ферментов использовали несколько способов, включая детальный проект, основанный на сравнении с термостабильными последовательностями с высокой степенью сходства, конструирование стабилизирующих дисульфидных мостиков, создание мутаций для повышения склонности к образованию альфа-спирали, создание солевых мостиков, изменение поверхностного заряда белка, направленную эволюцию и изменение композиции консенсусных последовательностей (Lechmann and Wyss 2001 Curr Opin Biotechnol 12(4): 371-5). Высокая термостабильность относится к числу желательных характеристик таких каркасов, поскольку она может увеличивать выход полученного рекомбинантного белка, повышать растворимость очищенной молекулы, повышать активность внутриклеточных каркасов, снижать иммуногенность и сводить к минимуму потребность в «холодовой цепи» при производстве.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет белковый каркас на основе белка с повтором фибронектина типа III (FN3), кодирующие или комплементарные нуклеиновые кислоты, векторы, клетки-хозяева, композиции, комбинации, составы, устройства и способы их получения и применения. В предпочтительном варианте осуществления белковый каркас содержит консенсусную последовательность множества доменов FN3 из тенасцина-C человека (в дальнейшем - «тенасцин»). В дополнительном предпочтительном варианте осуществления белковый каркас, составляющий предмет настоящего изобретения, представляет собой консенсусную последовательность 15 доменов FN3 (SEQ ID NO: 1-15) или ее вариант. В конкретном аспекте настоящего изобретения белковый каркас, составляющий предмет настоящего изобретения, имеет замещающие остатки, что повышает устойчивость каркасного белка к термической и химической денатурации. Белковые каркасы, составляющие предмет настоящего изобретения, можно сконструировать с использованием известных специалистам в данной области способов, включая вставку остатков в выбранных петлевых участках внутри каркаса, для получения связывающих доменов, селективных по отношению к партнеру по связыванию. Партнер по связыванию может представлять собой растворимую молекулу или закрепленную на клетке молекулу, например, внеклеточный домен рецепторного белка.
В одном варианте осуществления специфические замены остатков в консенсусной последовательности SEQ ID NO: 16 (Tencon), описанной в настоящем документе и выбранной за свойственную ей химическую и термостабильность, повышают термостабильность каркаса Tencon до 11°C и сдвигают среднюю точку индуцированной GdmCl денатурации с 3,4 М до более чем 5 М. В одном варианте осуществления специфические замены в последовательности SEQ ID NO: 16 (Tencon) являются одиночными, такие как N46V, E14P и E86I, тогда как в альтернативном варианте осуществления замены являются множественными, такие как N46V и E86I, все из замен E14P и N46V и E86I, а также все из замен L17A и N46V и E86I. Полипептиды на основе Tencon с повышенной стабильностью позволяют получить каркасы, допускающие более простые способы очистки, рецептуру и больший срок годности. Сконструированные партнеры по связыванию с повышенной общей стабильностью можно получить путем введения рандомизированных пептидов в петли стабилизированного каркаса.
Белковые каркасы, составляющие предмет настоящего изобретения, могут применяться в виде мономерных звеньев или быть связаны с получением полимерных структур с такой же или другой специфичностью к партнеру по связыванию. Молекулы на основе белковых каркасов Tencon можно дополнительно модифицировать для улучшения одной или более их характеристик in vivo, связанных с биораспределением, временем жизни в организме или терапевтической эффективностью, такой как способность ассоциироваться с молекулами, которые изменяют скорость поглощения клетками, в частности, клетками эпителия, например, участком Fc антитела или молекулами, выполненными с возможностью связывания с белками сыворотки, такими как альбуминсвязывающий домен. В дополнительных вариантах осуществления белковые каркасы, составляющие предмет настоящего изобретения, могут быть связаны с молекулой нуклеиновой кислоты, которая может кодировать белковый каркас.
Настоящее изобретение также представляет по меньшей мере один способ экспрессии по меньшей мере одного белкового каркасного полипептида, чья последовательность относится к консенсусной последовательности множества доменов FN3 в клетке-хозяине, включающий культивирование клетки-хозяина, как описано в настоящем документе в условиях, которые позволяют экспрессировать по меньшей мере один белковый каркас в количествах, допускающих детекцию и/или восстановление.
Настоящее изобретение также представляет по меньшей мере одну композицию, содержащую (a) белковый каркас на основе консенсусной последовательности множества доменов FN3 и/или кодирующей нуклеиновой кислоты, как описано в настоящем документе; и (b) пригодный и/или фармацевтически приемлемый носитель или разбавитель.
Настоящее изобретение дополнительно включает способ образования библиотек белкового каркаса на основе повтора фибронектина типа III (FN3), предпочтительно консенсусной последовательности множества доменов FN3, а более предпочтительно - консенсусной последовательности множества доменов FN3 тенасцина человека с повышенной химической и термостабильностью. Библиотеки можно образовать путем изменения аминокислотной композиции одной петли, одновременного изменения множества петель или дополнительных положений каркасной молекулы. Изменяемые петли можно соответствующим образом удлинить или укоротить. Такие библиотеки можно образовать так, чтобы они включали в себя все возможные аминокислоты в каждом положении или заданное подмножество аминокислот. Элементы библиотеки можно использовать для скрининга путем фенотипирования, такого как фенотипирование in vitro (ДНК, РНК, рибосомное фенотипирование и т.д.), дрожжевое, бактериальное и фаговое фенотипирование.
Белковые каркасы, составляющие предмет настоящего изобретения, обеспечивают улучшенные биофизические характеристики, такие как стабильность в условиях высокой осмотической силы и растворимость в высоких концентрациях. Домены каркасных белков не сшиты дисульфидными связями, что дает белкам возможность экспрессирования и сворачивания в системах, где отсутствуют ферменты, необходимые для образования дисульфидных связей, включая прокариотические системы, такие как E. coli, и в системах для транскрипции/трансляции in vitro, таких как система лизата ретикулоцитов кролика.
В дополнительном аспекте настоящее изобретение предоставляет способ образования каркасной молекулы, способной связываться с конкретной мишенью, включающий в себя пэннинг библиотеки каркаса, составляющей предмет настоящего изобретения, относительно мишени и выявление связующих веществ. В других связанных аспектах настоящее изобретение включает способы скрининга, которые можно использовать для образования или аффинного созревания белковых каркасов с желательной активностью, например, способных связываться с белками-мишенями с определенной аффинностью. Аффинного созревания можно достигнуть многократными итерационными циклами мутагенеза и селекции при помощи таких систем, как фаговое фенотипирование или фенотипирование in vitro. Мутагенез в ходе данного процесса может являться результатом сайтнаправленного мутагенеза по специфическим остаткам каркаса, неспецифического мутагенеза из-за ПЦР пониженной точности, перестановки в ДНК и/или комбинации данных способов. Настоящее изобретение дополнительно представляет любые изобретения, описанные в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Анализ очищенного Tencon методом ДСН-ПААГ, используя бис-трис-гель NuPAGE 4-12% (Invitrogen) и окрашивание Кумасси синим. N означает нативные условия, R - условия восстановления.
На фигуре 2 представлены результаты анализа кругового дихроизма Tencon в PBS.
На фигуре 3 представлены результаты анализа кругового дихроизма третьего домена FN3 из тенасцина и Tencon в PBS, в котором получили температуры плавления 54°C и 78°C соответственно.
На фигуре 4 представлена конструкция фагемидной плазмиды pTencon-pIX. Экспрессию стимулируют промотор Lac и секреция посредством сигнальной последовательности OmpA.
На фигуре 5 представлено, как myc-Tencon можно фенотипировать на фаге M13 с помощью твердофазного иммуноферментного анализа (ИФА), демонстрируя связывание фага с лунками, покрытыми анти-Myc, CNTO95, а также лунками без покрытия.
На фигуре 6 представлена схема, показывающая петлевую структуру третьего домена FN3 тенасцина человека.
На фигуре 7 представлены результаты скрининга с помощью твердофазного иммуноферментного анализа (ИФА) результатов селекции IgG, в котором отдельные клоны тестировали на связывание с биотинилированным IgG или биотинилированным HSA в качестве контроля.
На фигурах 8A-B представлены графики, показывающие индуцированную GdmCl денатурацию одиночных мутантов (A) и комбинаторных мутантов (B) по измерению флуоресценции с возбуждением на 280 нм и эмиссией на 360 нм.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Сокращения
ADCC = антителозависимая клеточная цитотоксичность; CDC = комплементозависимая цитотоксичность; DSC = дифференциальная сканирующая калориметрия; ΔG = свободная энергия Гиббса; IgG = иммуноглобулин G; Tm = температура плавления.
Определения и объяснение терминологии
Термин «антитело» или «фрагмент антитела» означает антитела, продукты расщепления, указанные части и их варианты, включая без ограничений миметики антител или составные части антител, имитирующие структуру и/или функцию антитела или его указанного фрагмента либо части, включая без ограничений одноцепочечные антитела, однодоменные антитела, миниантитела, а также их фрагменты. Функциональные фрагменты включают в себя антигенсвязывающие фрагменты, которые обеспечивают связывание с представляющим интерес антигеном-мишенью. Например, фрагменты антитела, способные связываться с антигеном-мишенью или его участками, включая без ограничений фрагменты Fab (например, при расщеплении папаином), Fab' (например, при расщеплении пепсином и неполном восстановлении) и F(ab')2 (например, при расщеплении пепсином), facb (например, при расщеплении плазмином), pFc' (например, при расщеплении пепсином или плазмином), Fd (например, при расщеплении пепсином, неполном восстановлении и повторной агрегации), Fv или scFv (например, при помощи методов молекулярной биологии), включены в настоящее изобретение под термином «антитело». Антитело или фрагмент можно получить из любого млекопитающего, такого как без ограничений человек, мышь, кролик, крыса, грызун, примат, верблюд, коза или любая их комбинация, и они включают в себя выделенные антитела человека, примата, грызуна, млекопитающего, химерные, гуманизированные и/или CDR-привитые антитела, иммуноглобулины, продукты расщепления и другие указанные части и их варианты.
Термин «эпитоп» означает белковую детерминанту, способную специфически связываться с антителом, или сконструированный связывающий домен, такой как одна или более петель белков на основе каркасов. Эпитопы обычно состоят из химически активных поверхностно расположенных групп молекул, таких как аминокислотные или сахарные боковые цепи, а также обычно имеют специфическую трехмерную структуру, а также специфические зарядовые характеристики. Конформационные и неконформационные эпитопы различаются тем, что в присутствии денатурирующих растворителей теряется связывание с первыми, но не теряется связывание со вторыми. Конформационные эпитопы образуются в результате конформационного сворачивания молекулы-мишени, происходящего тогда, когда аминокислоты из разных участков линейной последовательности молекулы-мишени оказываются в трехмерном пространстве в непосредственной близости друг к другу. Такие конформационные эпитопы, как правило, распределены по внеклеточной стороне плазматической мембраны.
Используемые в настоящем документе термины «Fc», «Fc-содержащий белок» или «Fc-содержащая молекула» относятся к мономерным, димерным или гетеродимерным белкам, имеющим по меньшей мере домен CH2 и CH3 иммуноглобулина. Домены CH2 и CH3 могут образовывать по меньшей мере часть димерного участка белка или молекулы (например, антитела).
Используемый в настоящем документе термин «стабильность» относится к способности молекулы сохранять свернутое состояние в физиологических условиях, так чтобы сохранять по меньшей мере одну из своих обычных функциональных активностей, например, способность связываться с молекулой-мишенью, такой как цитокин или белок сыворотки. Измерение стабильности белка и лабильности белка можно рассматривать как один и тот же или как разные аспекты целостности белка. Белки чувствительны или «лабильны» к денатурации, вызванной нагревом, ультрафиолетовым или ионизирующим облучением, изменением осмолярности и pH при нахождении в жидком растворе, механической силой сдвига, вызванной фильтрованием через поры малого размера, ультрафиолетовым облучением, ионизирующим облучением, таким как гамма-облучение, химической или термической дегидратацией или любым другим воздействием или силой, которые могут привести к разрушению структуры белка. Стабильность молекулы можно определить стандартными способами. Например, стабильность молекулы можно определить путем измерения ее температуры теплового плавления («TM»). TM представляет собой температуру в градусах Цельсия (°C), при которой ½ молекул переходит в развернутое состояние. Как правило, чем выше TM, тем более стабильной является молекула. Помимо нагрева способность белка сохранять конкретную трехмерную структуру также можно изменять в зависимости от химического окружения.
Химическую денатурацию можно также измерить различными способами. Химический денатурирующий агент представляет собой агент с известной способностью разрушать нековалентные взаимодействия и ковалентные связи внутри белка, включая водородные связи, электростатические связи, Ван-дер-Ваальсовы силы, гидрофобные взаимодействия или дисульфидные связи. Химические денатурирующие агенты включают в себя гидрохлорид гуанидиния, тиоцианат гуанидиния, мочевину, ацетон, органические растворители (DMF, бензол, ацетонитрил), соли (сульфат аммония, бромид лития, хлорид лития, бромид натрия, хлорид кальция, хлорид натрия); восстановители (например, дитиотритол, бета-меркаптоэтанол, динитротиобензол, а также гидриды, такие как борогидрид натрия), неионные и ионные моющие средства, кислоты (например, соляная кислота (HCl), уксусная кислота (CH3COOH), галогензамещенные уксусные кислоты), гидрофобные молекулы (например, фосфолипиды), а также денатурирующие агенты направленного действия (Jain R.K и Hamilton A.D., Angew. Chem. 114(4), 2002). Количественная характеризация степени денатурации может основываться на степени потери функциональной характеристики, такой как способности к связыванию с молекулой-мишенью, или на физиохимических характеристиках, таких как склонность к агрегации, открытие доступа к ранее недоступным растворителю остаткам либо разрушение или образование дисульфидных связей.
В значении потери стабильности «денатурирование» или «денатурация» белка означают процесс, в котором происходит потеря некоторой части или всей трехмерной конформации, обеспечивающей функциональные характеристики белка, с соответствующей потерей активности и/или растворимости. Разрушаемые при денатурации силы включают в себя внутримолекулярные связи, включая без ограничений электростатические, гидрофобные, Ван-дер-Ваальсовы силы, водородные связи и дисульфидные связи. Денатурацию белка можно вызвать воздействием на белок или содержащий белок раствор, таким как механическое воздействие (например, сжимающая сила или сила сдвига), тепловой, осмотический стресс, изменение pH, электрические или магнитные поля, ионизирующее облучение, ультрафиолетовое облучение и дегидратация, а также воздействием химических денатурирующих агентов.
Используемый в настоящем документе термин «терапевтически эффективное» лечение или количество относится к количеству, достаточному для очевидного уменьшения или облегчения причин расстройства или его симптомов. Термин «облегчение» относится к уменьшению отрицательного эффекта расстройства на проходящего терапию пациента. В целях настоящего изобретения под объектом предпочтительно понимается человек, однако можно предположить, что для любого животного, нуждающегося в лечении патологических состояний, расстройства или болезни, можно применять разработанный для данной цели белок на основе каркасов.
Общее описание изобретения
Настоящее изобретение представляет выделенный, рекомбинантный и/или синтетический белковый каркас на основе консенсусной последовательности белка с повтором фибронектина типа III (FN3), включая без ограничений каркас, полученный из млекопитающих, а также композиции и кодирующие молекулы нуклеиновой кислоты, содержащие по меньшей мере один полинуклеотид, кодирующий белковый каркас на основе консенсусной последовательности FN3. Настоящее изобретение дополнительно включает в себя без ограничений способы изготовления и применения таких нуклеиновых кислот и белковых каркасов, включая применение в качестве платформы для изучения, а также в диагностических и терапевтических композициях, способах и устройствах.
Белковые каркасы, составляющие предмет настоящего изобретения, обладают преимуществами по сравнению с более крупными биотерапевтическими агентами на основе иммуноглобулина благодаря своим небольшим, компактным размерам. В частности, размер и форма биологической молекулы может сказываться на возможности ее введения местным или пероральным способом, способности проходить через гематоэнцефалический барьер; возможности экспрессирования в недорогих системах, таких как E. coli; возможности встраивания в би- или полиспецифические молекулы для связывания с множеством мишеней или множеством эпитопов одной мишени, пригодности к конъюгации, например, с активными компонентами, полимерами и зондами; возможности введения композиции в высоких концентрациях; а также способности таких молекул к эффективному прохождению через пораженные ткани и опухоли.
Более того, белковые каркасы обладают многими характеристиками антител с точки зрения укладки их структуры, которая имитирует вариабельный участок антитела. Данная ориентация позволяет делать петли FN3 поверхностными подобно определяющим комплементарность участкам (CDR) антител. Предполагается, что они смогут связываться с клеточными мишенями, и петли можно будет изменять, например, подвергать аффинному созреванию, для улучшения определенных связывающих или смежных характеристик.
Три из шести петель белкового каркаса, составляющего предмет настоящего изобретения, топологически соответствуют связывающим доменам антитела, расположенным в петлях вариабельного домена, известного своей гипервариабельной природой (петли гипервариабельных доменов (HVL)), в положениях, определенных Кабатом как остатки определяющих комлементарность участков (CDR), т.е. антигенсвязывающих участков антитела, а остальные три петли являются поверхностными, подобно участкам CDR антитела. Данные петли охватывают или расположены на остатках 13-16, 22-28, 38-43, 51-54, 60-64 и 75-81 последовательности SEQ ID NO: 16, как представлено в таблице 3 ниже и на фигуре 6, или около них. Для получения специфичности связывания и аффинности предпочтительно изменяют петлевые участки на остатках 22-28, 51-54 и 75-81 или около них. Один или более данных петлевых участков перемешивают случайным образом с другими петлевыми участками и/или другими нитями при сохранении их последовательности в качестве остовных участков библиотеки, при этом из библиотеки можно выбирать потенциально связующие агенты с высокой аффинностью к конкретному белку-мишени. Один или более петлевых участков могут взаимодействовать с белком-мишенью подобно тому, как участок CDR антитела взаимодействует с белком.
Каркасы, составляющие предмет настоящего изобретения, могут включать в себя другие субъединицы, например, через ковалентное взаимодействие. Весь константный участок антитела или его часть может быть связан с каркасом для придания ему имитирующих антитело характеристик, особенно характеристик, ассоциируемых с участком Fc, например, комплементарной активности (ADCC), периода полужизни и т.п. Например, можно вводить и/или регулировать эффекторную функцию, например, путем модификации связывания с C1q и/или связывания с FcγR, тем самым изменяя активность CDC и/или активность ADCC. «Эффекторные функции» отвечают за активацию или уменьшение биологической активности (например, у объекта). Примеры эффекторных функций включают в себя без ограничений: связывание с C1q; комплементозависимую цитотоксичность (CDC); связывание с рецептором Fc; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; понижение уровня экспрессии рецепторов на клеточной поверхности (например, рецепторов B-клеток; BCR) и т.п. Такие эффекторные функции могут требовать сочетания участка Fc со связывающим доменом (например, петлями белкового каркаса) и могут количественно характеризоваться с использованием различных анализов (например, анализов связывания с Fc, анализов ADCC, анализов CDC и т.п.).
К полипептиду на основе каркаса или его варианту можно добавить или ассоциировать с ним дополнительные фрагменты, например, для получения желательных характеристик к каркасной молекуле можно присоединить конъюгаты токсинов, альбумин или связывающиеся с альбумином вещества, молекулы полиэтиленгликоля (ПЭГ). Данные фрагменты могут представлять собой встроенные в кодирующую каркас последовательность слияния и могут быть получены стандартными способами, например, путем экспрессирования слитого белка с рекомбинантным кодирующим слияние вектором, выполненным с использованием общедоступных кодирующих нуклеотидных последовательностей. В альтернативном варианте осуществления для добавления фрагментов к рекомбинантно полученному каркасному белку можно использовать химические способы.
Каркасы, составляющие предмет настоящего изобретения, можно использовать как моноспецифические в мономерной форме или как би- или полиспецифические (для разных белков-мишеней или эпитопов одного белка-мишени) в мультимерной форме. Связи между каждой каркасной единицей могут быть ковалентными или нековалентными. Например, димерный биспецифический каркас имеет одну субъединицу со специфичностью к первому белку-мишени или эпитопу и вторую субъединицу со специфичностью ко второму белку-мишени или эпитопу. Субъединицы каркаса можно соединять в различных конформациях, что может увеличить валентность и, таким образом, антигенсвязывающую авидность.
Образование и выработка каркасного белка
По меньшей мере один каркасный белок, составляющий предмет настоящего изобретения, можно необязательно получить при помощи линии клеток, смешанной линии клеток, иммортализованной клетки или клональной популяции иммортализованных клеток, как хорошо известно специалистам в данной области. См., например, публикации под ред. Ausubel, et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., NY, NY (1987-2001); Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2-е издание, Cold Spring Harbor, NY (1989); Harlow and Lane, Antibodies, a Laboratory Manual, Cold Spring Harbor, NY (1989); под ред. Colligan, et al., Current Protocols in Immunology, John Wiley & Sons, Inc., NY (1994-2001); Colligan et al., Current Protocols in Protein Science, John Wiley & Sons, NY, NY, (1997-2001).
Аминокислоты каркасного белка можно изменить, добавить и/или удалить для снижения иммуногенности или снижения, улучшения или модификации связывания, аффинности, скорости ассоциации, скорости диссоциации, авидности, специфичности, периода полужизни, стабильности, растворимости или любой другой пригодной характеристики, как известно специалистам в данной области.
Биоактивные каркасные белки можно сконструировать с сохранением высокой аффинности к антигену и других благоприятных биологических характеристик. Для достижения данной цели каркасные белки можно необязательно получить путем анализа родительских последовательностей и различных концептуальных сконструированных продуктов при помощи трехмерных моделей родительских и сконструированных последовательностей. Трехмерные модели широкодоступны и известны специалистам в данной области. Существуют компьютерные программы, иллюстрирующие и показывающие вероятные трехмерные конформационные структуры выбранных последовательностей-кандидатов и способные измерять потенциальную иммуногеничность (например, программа Immunofilter разработки Xencor, Inc., г. Монровия, штат Калифорния). Изучение данных иллюстраций позволяет проанализировать предполагаемую роль остатков в функционировании последовательности-кандидата, например, остатков, влияющих на способность каркасного белка-кандидата связывать его антиген. Таким образом, возможны селекция и комбинирование остатков из родительской и референсной последовательностей для получения желательной характеристики, например, аффинности к антигенам-мишеням. В альтернативном варианте осуществления или помимо описанных выше процедур можно использовать другие пригодные способы конструирования последовательностей.
Скрининг
Скрининговый подход к конструированию каркасных белков или библиотек, содержащих каркасные белки с варьируемыми остатками или доменами для специфического связывания с подобными белками или фрагментами, можно удобным образом реализовать с использованием библиотек нуклеотидного (ДНК или РНК) или пептидного фенотипирования, например, фенотипирования in vitro. Данный способ включает в себя скрининг больших наборов пептидов для выявления отдельных пептидов, имеющих желательную функцию или структуру. Фенотипированный пептид с нуклеотидной последовательностью или без нее может содержать в длину от 3 до 5 000 и более нуклеотидов или аминокислот, обычно от 5 до 100 аминокислот, часто от приблизительно 8 до 25 аминокислот. Помимо способов на основе прямого химического синтеза для образования библиотек пептидов описано несколько способов с использованием рекомбинантных ДНК. Один из таких способов предусматривает фенотипирование последовательности пептидов на поверхности бактериофага или клетки. Каждый бактериофаг или клетка содержит последовательность нуклеотидов, кодирующую конкретную последовательность пептидов для фенотипирования.
Белковые каркасы, составляющие предмет настоящего изобретения, могут связывать белки человека или других млекопитающих с разной степенью аффинности (KD). В предпочтительном варианте осуществления по меньшей мере один белковый каркас, составляющий предмет настоящего изобретения, может необязательно связываться с белком-мишенью с высокой аффинностью, например, с KD, меньшей либо равной приблизительно 10-7 М, такой как без ограничений в диапазоне 0,1-9,9 (или любом входящем в него диапазоне или значении)×10-8, 10-9, 10-10, 10-11, 10-12, 10-13, 10-14, 10-15, или любом входящем в него диапазоне или значении, как определено методом поверхностного плазмонного резонанса или методом Kinexa, как известно специалистам в данной области.
Аффинность или авидность белкового каркаса для антигена можно определить экспериментально любым пригодным способом (см., например, публикацию Berzofsky, et al., Antibody-Antigen Interactions, в Fundamental Immunology, под ред. Paul, W. E., Raven Press: New York, NY (1984); Kuby, Janis Immunology, W. H. Freeman and Company: New York, NY (1992); а также способы, описанные в настоящем документе). Измеренная аффинность взаимодействия в конкретной паре белковый каркас - антиген может меняться в зависимости от разных условий измерения (например, осмолярности, pH). Таким образом, измерения аффинности и других параметров связывания антигена (например, KD, Kon, Koff) предпочтительно производить при помощи стандартизированных растворов белкового каркаса и антигена, а также стандартизированного буферного раствора, например, описанного в настоящем документе.
Для определения того, какие белки, антитела и другие антагонисты конкурируют за связывание белка-мишени с белковым каркасом, составляющим предмет настоящего изобретения, и/или совместно используют один и тот же участок-эпитоп, можно провести анализ конкурентного связывания белкового каркаса, составляющего предмет настоящего изобретения. Данные анализы, как хорошо известно специалистам в данной области, предназначены для оценки степени конкуренции между антагонистами или лигандами за ограниченный ряд сайтов связывания у белка. Белок и/или антитело иммобилизуют, выделяют или фиксируют до или после конкуренции, и образец, связавшийся с белком-мишенью, отделяют от несвязавшегося образца, например, путем декантирования (если белок/антитело предварительно перевели в нерастворимую форму) или центрифугирования (если белок/антитело осадили после конкурирующей реакции). Кроме того, конкурентное связывание можно определить по степени изменения функции в результате связывания или отсутствия связывания белкового каркаса с белком-мишенью: например, молекула белкового каркаса может ингибировать или стимулировать ферментативную активность, например, метки. Для данных целей можно использовать ИФА и другие функциональные анализы, как хорошо известно специалистам в данной области.
Молекулы нуклеиновых кислот
Молекулы нуклеиновых кислот, составляющие предмет настоящего изобретения, которые кодируют белковые каркасы, могут быть в форме РНК, такой как мРНК, гяРНК, тРНК или любая другая форма, либо в форме ДНК, включая без ограничений кДНК и геномную ДНК, полученные путем клонирования или синтеза, а также любой их комбинации. ДНК может быть трехцепочечной, двухцепочечной, одноцепочечной или комбинированной. Любая часть по меньшей мере одной цепи ДНК или РНК может быть кодирующей цепью, также известной как смысловая цепь, или некодирующей цепью, также называемой антисмысловой цепью.
Выделенные молекулы нуклеиновых кислот, составляющие предмет настоящего изобретения, могут включать в себя молекулы нуклеиновых кислот, содержащие открытую рамку считывания (ORF), необязательно с одним или более интронами, например, без ограничений по меньшей мере одну указанную часть по меньшей мере одного белкового каркаса; молекулы нуклеиновых кислот, содержащие кодирующую последовательность для белкового каркаса или петлевой участок, который связывается с белком-мишенью; и молекулы нуклеиновых кислот, содержащие последовательность нуклеотидов, по существу отличающуюся от последовательностей, описанных выше, но из-за вырожденности генетического кода по-прежнему кодирующую белковый каркас, как описано в настоящем документе и/или известно специалистам в данной области. Очевидно, что генетический код хорошо известен специалистам в данной области. Таким образом, специалист в данной области без труда может образовать такие вырожденные варианты нуклеиновой кислоты, которые кодируют специфические белковые каркасы, составляющие предмет настоящего изобретения. См., например, публикацию Ausubel, et al., приведенную выше. Такие варианты нуклеиновой кислоты включены в настоящее изобретение.
Как указано в настоящем документе, молекулы нуклеиновых кислот, составляющие предмет настоящего изобретения, которые содержат нуклеиновую кислоту, кодирующую белковый каркас, могут включать в себя без ограничений молекулы, кодирующие аминокислотную последовательность самого фрагмента белкового каркаса; кодирующую последовательность всего белкового каркаса или его части; кодирующую последовательность белкового каркаса, фрагмента или части, а также дополнительные последовательности, например, кодирующую последовательность по меньшей мере одного сигнального лидерного или слитого пептида с вышеуказанными дополнительными кодирующими последовательностями или без них, например, по меньшей мере один интрон, совместно с дополнительными некодирующими последовательностями, включая без ограничений некодирующие 5'- и 3'-концевые последовательности, например, транскрибированные, не подвергшиеся трансляции последовательности, которые играют роль в транскрипции, обработке мРНК, включая сигналы сплайсинга и полиаденилирования (например, связывание рибосом и стабильность мРНК); дополнительную кодирующую последовательность, которая кодирует дополнительные аминокислоты, например, такие, которые обеспечивают дополнительные функции. Таким образом, кодирующую белковый каркас последовательность можно слить с маркерной последовательностью, такой как последовательность, кодирующая пептид, который облегчает очистку слитого белкового каркаса, содержащего фрагмент или часть белкового каркаса.
Молекулы нуклеиновых кислот
В настоящем изобретении также представлены нуклеиновые кислоты, кодирующие композиции, составляющие предмет настоящего изобретения, в виде выделенных полинуклеотидов или частей векторов экспрессии, включая векторы, совместимые с экспрессией в прокариотических, эукариотических или нитчатых фагах, выделением и/или фенотипированием композиций или их направленных мутагенов.
Выделенные нуклеиновые кислоты, составляющие предмет настоящего изобретения, можно получить при помощи:
(а) рекомбинантных способов, (b) синтетических способов, (c) способов очистки и/или (d) их комбинаций, как хорошо известно специалистам в данной области.
Полинуклеотиды, которые можно использовать в целях настоящего изобретения, кодируют функциональную часть белкового каркаса, описанного в настоящем документе. Полинуклеотиды, составляющие предмет настоящего изобретения, включают в себя последовательности нуклеиновых кислот, которые можно использовать для селективно