Циклопептидное соединение высокой чистоты, а также способ его получения и его применение
Иллюстрации
Показать всеИзобретение относится к способу получения циклопептидного соединения формулы I высокой чистоты, где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль. Соласно способу (a) растворяют соединение формулы I в воде или водном органическом растворителе (i) и контролируют pH раствора; и (b) получают циклопептидное соединение формулы I высокой чистоты путем снижения температуры и/или добавления органического растворителя (i), где на стадии (a) pH раствора поддерживают на уровне от 2, 0 до 5,9; и на стадии (а) или (b) указанный органический растворитель (i) выбирают из С1-С4 низшего спирта. Способ позволяет получать соединение формулы I, чистота которого выше или равна 99,0%. 4 з.п. ф-лы, 6 ил., 31 табл., 24 пр.
Реферат
Область техники
Настоящее изобретение относится к соединению циклопептида высокой чистоты и способу получения, а также относится к применению такого соединения циклопептида высокой степени чистоты.
Предшествующий уровень техники
Грибковая инфекция стала основной причиной высокой заболеваемости и смертности у иммунодефицитных больных. За последние 20 лет заболеваемость грибковой инфекцией значительно увеличилась. Люди с высоким уровнем риска заболеваний грибковыми инфекциями включают пациентов в критическом состоянии, хирургических пациентов и тех пациентов, которые страдают от ВИЧ-инфекции, лейкемии и других опухолей. Пациенты после трансплантации органов также подвергаются высокому риску грибковой инфекции.
Эхинокандины, как новый класс противогрибковых агентов, демонстрируют хорошие результаты в лечении инфекций, вызванных Candida или Aspergillus. Каспофунгин и Микафунгин являются представителями таких лекарственных средств. Эхинокандины угнетают грибок, подавляя образование 1,3-β гликозидной связи, и таким образом снижают вред человеческому телу и уменьшают побочные эффекты, оставаясь в то же время высокоэффективными. Таким образом, они более безопасны в использовании, чем традиционные противогрибковые агенты.
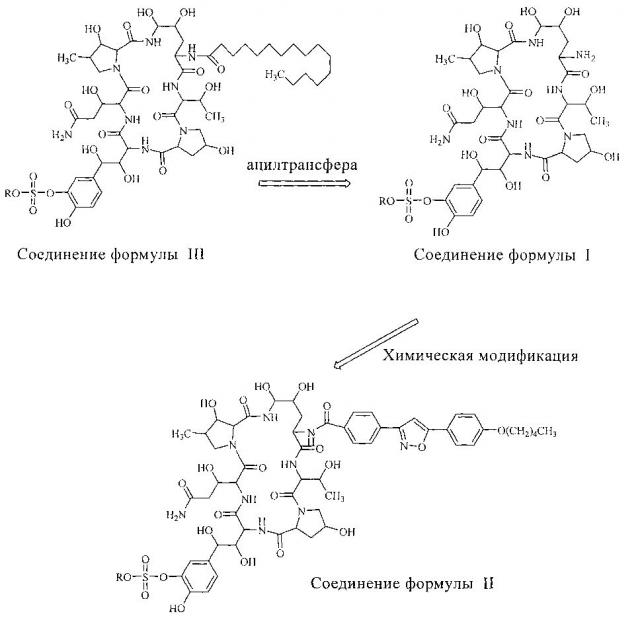
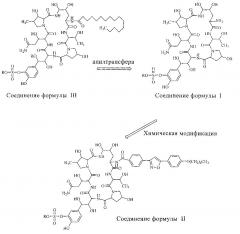
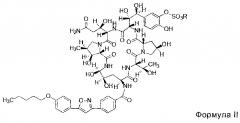
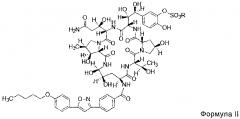
FK463 (натрия Микафунгин) является соединением формулы II (R является ионом натрия), которое разработано Japan Fujisawa Toyama Co., Ltd, Takaoka Plant под торговой маркой Mycamine, и в настоящее время продается в нескольких странах как противогрибковое средство для внутривенного введения. Его получают путем разрезания боковой цепи FR901379 как предшественника (соединение формулы III, R является ионом натрия или ионом водорода) с помощью фермента, формируя таким образом FR179642 (соединение формулы I, R является водородом или ионом натрия) (смотри патент США US 5376634, ЕР 0431350 и китайский патент CN 1161462C для конкретных способов), а затем химической модификации FR179642 (см патентную публикацию WO 9611210, WO 9857923, WO 2004014879 для конкретных способов получения и очистки).
Конкретная схема показана следующим образом:
Тем не менее, авторы настоящего изобретения провели анализ существующей формулировки Микафунгина с помощью ВЭЖХ (Высокоэффективная жидкостная хроматография) и обнаружили, что в композиции содержатся примесь 6а, примесь 7а, примесь 8а, примесь 9а и примесь 10а. И изобретатели приготовили примесь 6а, примесь 7а, примесь 8а, примесь 9а и примесь 10а с помощью препаративной колонки в небольшом количестве и подтвердили структуру примеси с помощью МС (масс-спектрометрия) и 1H-NMR (ПМР - Протонный магнитный резонанс) как формулы IVa, Va, VIa, VIIa, VIIIa соответственно:
Примесь 6a, химическое название которой 5-[(1S,2S,3S)-4-[(1S,2R)-4-амино-1-[[(2S,3S,4S)-2-карбамил-3-гидрокси-4-метил-1-пирролил]карбонил]-2-гидрокси-4-оксобутил]амино]-3-[[[(2S,4R)-1-[(2S,3R)-2-[[[(2S,4R)-4,5-дигидрокси-1-[4-[5-[4-(пентилокси)фенил]-3-изоксазолил]бензоил]-2-пирролил]карбонил]амино]-3-гидроксибутирил]-4-гидрокси-2-пирролил]карбонил]амино]-1,2-дигидрокси-4-оксобутил]-2-гидроксифенил натрия сульфат
МС и ПМР данные примеси 6а перечислены ниже:
МС: 1314,5 [M+Na]+
ПМР (ДМСО-d6 (диметилсульфоксид)): 0,81-1,03 (6H, m), 1,12 (3H, d), 1,3-1,7 (4H, m), 1,7-2,1 (5H, m), 2,11-2,41 (3H, m), 2,52-2,62 (IH, m), 3,03-3,14 (IH, m), 3,62-4,65 (15H, m), 4,70-5,22 (10H, m), 5,24 (IH, d), 5,53 (IH, d), 6,53-6,71 (3H, m), 7,12-7,70 (7H, m), 7,82 (2H, d), 7,83-8,24 (5H, m), 8,61-9,11 (2H, m)
Примесь 7a, химическое название которой 5-[(1S,2S)-2-[(3S,6S,9S,11R,15S,18S,20R,21R,24S,25S)-3-[(R)-2-карбамоил-1-гидроксиэтил]-11,20,21,25-тетрагидрокси-15-[(R)-1-гидроксиэтил]-2,5,8,14,17,23-гексакарбонил-18-[4-[5-(4-пентилоксифенил)изоксазол-3-ил]бензамид]-1,4,7,13,16,22-гексаазотрицикло[22.3.0.09,13]гептакозан-6-ил]-1,2-дигидроксиэтил]-2-гидроксифенил натрия сульфат:
МС и ПМР данные примеси 7а перечислены ниже:
MC: 1300,5 [M+Na]+
ПМР (ДМСО-d6): 0,87 (3H, t), 1,12 (3H, d), 1,42-1,65 (4H, m), 1,62-2,16 (6H, m), 2,11-2,43 (3H, m), 2,51-2,65 (IH, m), 3,04-3,11 (IH, m), 3,62-4,63 (15H, m), 4,71-5,23 (10H, m), 5,24 (IH, d), 5,69 (IH, d), 6,51-6,72 (3H, m), 7,11-7,74 (7H, m), 7,83 (2H, d), 7,84-8,11 (4H, m), 8,26 (IH, d), 8,61-9,12 (2H,m)
Примесь 8a, химическое наименование которой 5-[(1S,2S)-2-[(3S,6S,9S,11R,15S,18S,20R,21R,24S,25S,26S)-3-[(R)-2-карбамоил-1-гидроксиэтил]-11,20,21,25-тетрагидрокси-15-[(R)-1-гидроксиметил]-26-метил-2,5,8,14,17,23-гексакарбонил-18-[4-[5-(4-пентилоксифенил)изоксазол-3-ил]бензамид]-1,4,7,13,16,22-гексаазатрицикло[22.3.0.09,13]гептакозан-6-ил]-1,2-дигидроксиэтил]-2-гидроксифенил сульфат натрия
МС и ПМР данные примеси 8а перечислены ниже:
MC: 1300,4 [M+Na]+
ПМР (ДМСО-d6): 0,83-1,02 (6Н, m), 1,32-1,72 (4Н, m), 1,75-2,14 (6Н, m), 2,13-2,46 (3Н, m), 2,52-2,64 (IH, m), 3,01-3,13 (IH, m), 3,62-4,64 (15Н, m), 4,72-5,22 (10Н, m), 5,24 (IH, d), 5,53 (IH, d), 6,52-6,73 (3Н, m), 7,11-7,75 (7Н, m), 7,85 (2H, d), 7,85-8,17 (4Н, m), 8,27 (IH, d), 8,65-9,12 (2Н, m)
Примесь 9а, химическое название которой 5-[(1S,2S)-2-[(3S,6S,9S,11R,15S,18S,20R,21S,24S,25S,26S)-3-[(R)-2-карбамоил-1-гидроксиэтил]-11,20,21,25-тетрагидрокси-15-[(R)-1 -гидроксиэтил]-26-метил-2,5,8,14,17,23-18-гексакарбонил-18-[4-[5-(4-пентилоксифенил)изоксазол-3-ил]бензамид]-1,4,7,13,16,22-гексаазатрицикло[22.3.0.09,13]гептакозан-6-ил]-1,2-дигидроксиэтил]-2-гидроксифенил сульфат натрия
МС и ПМР данные примеси 9а перечислены ниже:
MC: 1314,4 [M+Na]+
ПМР (ДМСО-d6): 0,87-1,11 (6Н, t), 1,13 (3Н, d), 1,41-1,61 (4Н, m), 1,62-2,17 (6Н, m), 2,11-2,43 (3Н, m), 2,53-2,65 (IH, m), 3,05-3,11 (1Н, m), 3,62-4,63 (15Н, m), 4,71-5,23 (10Н, m), 5,26 (IH, d), 5,69 (IH, d), 6,53-6,72 (3Н, m), 7,11-7,72 (7Н, m), 7,81 (2Н, d), 7,86-8,11 (4Н, m), 8,28 (IH, d), 8,62-9,12 (2Н, m)
Примесь 10а, химическое название которой 5-[(1S,2S)-2-[(3S,6S,9S,11R,15S,18S,20R,21R,24S,25S,26S)-3-[(R)-2-карбамоил-1-гидроксиэтил]-11,21,25-тригидрокси-15-[(R)-1-гидроксиэтил]-26-метил-2,5,8,14,17,23-гексакарбонил-18-[4-[5-(4-пентилоксифенил)изоксазол-3-ил]бензамид]-1,4,7,13,16,22-гексаазатрицикло[22.3.0.09,13]гептакозан-6-ил]-1,2-дигидроксиэтил]-2-гидроксифенил сульфат натрия
МС и ПМР данные примеси 9а перечислены ниже:
MC: 1298,4 [M+Na]+
ПМР (ДМСО-d6): 0,87-1,11 (6Н, t), 1,13 (3Н, d), 1,41-1,61 (4Н, m), 1,62-2,17 (8Н, m), 2,11-2,43 (3Н, m), 2,53-2,65 (IH, m), 3,05-3,11 (IH, m), 3,62-4,63 (14Н, m), 4,71-5,23 (10Н, m), 5,26 (IH, d), 5,69 (IH, d), 6,53-6,72 (3Н, m), 7,11-7,72 (7Н, m), 7,81 (2Н, d), 7,86-8,11 (4Н, m), 8,28 (IH, d), 8,62-9,12 (2Н, m)
В композиции количество примеси 6а больше чем 0,3%, общее количество примесей 7а и 8а больше чем 0,6%, количество примеси 9а больше чем 0,2%, количество примеси 10а больше чем 0,2%, а количество микафунгина всего лишь около 98,0%. Тем не менее, в соответствии с FDA (Food and Drug Administration - Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, США), API (active pharmaceutical ingredient - активные фармацевтические ингредиенты=действующее вещество) должно содержать примесей как можно меньше, чтобы применяться безопаснее. Например: по требованиям FDA, количество конкретной примеси должно поддерживаться ниже 0,1% (см подробнее в ICH Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients, Q7A, Current Step 4 Version (November 10, 2000)).
WO03018615 описывает процесс кристаллизации Микафунгина натрия (например, соединение формулы II), который может создавать определенные эффекты очистки. Однако чистота коммерчески доступного препарата микафунгина натрия, полученного заявителем, Japan Fujisawa Pharmaceutical Company, из Микафунгина, полученного в результате этого процесса, составляет всего лишь около 98%, поэтому существует определенный клинический риск при применении препарата.
Как хорошо известно в данной области, чем выше чистота промежуточных лекарственных препаратов, тем выше чистота конечного лекарственного препарата, полученного с помощью химической модификации. Аналогично, чем выше чистота соединения формулы I в качестве промежуточного, тем выше чистота соединения формулы II (FK463), полученного путем химической модификации, после реакции. Если чистота соединения формулы II (FK463), полученного при химической модификации, является высокой, то давление на очистку соединения формулы II будет значительно освобождено, и конечный продукт, соединение формулы II (FK463), с высокой чистотой может быть получен с помощью простого процесса очистки. Из структуры структурных аналогов Микафунгина, таких как примесь 6, примесь 7, примесь 8, примесь 9, примесь 10, может быть определено, что вышеуказанные структурные аналоги, по существу, происходят из структурных аналогов соединения формулы I путем химической модификации реакции.
Тем не менее, очень трудно отделить структурные аналоги соединения формулы I, особенно если принимать во внимание одновременно чистоту и выход при очистке. В CN91104847 описана очистка соединения формулы I, где YMC GEL ODS-AM 120 использовали в качестве наполнителя для основных целей очистки, и препаративную ВЭЖХ использовали для очистки соединения формулы I. Из формулы I видно, что соединение формулы I обладает сильной полярностью и хорошей гидрофильностью, и будет слабо удерживаться на МС GEL ODS-AM 120-наполнителе. Таким образом, хорошие эффекты очистки не могут быть получены с помощью препаративной ВЭЖХ с YMC GEL ODS-AM 120-наполнителем. Чистота соединения формулы I, полученного в процессе очистки CN 91104847, составляет всего 97,51%.
Кроме того, различные процессы очистки, обычно используемые в данной области техники, включая ионообменную смолу, макропористую абсорбционную смолу и обращенно-фазовую препаративную хроматографию, связанную с силикагелем С18, и нормальную препаративную хроматографию со сферическим силикагелем, используются изобретателями для очистки соединения формулы I с помощью хроматографии. Однако соединение формулы I не может быть получено с общей чистотой более 99,0%.
С помощью некоторых способов очистки, таких как кристаллизация и/или перекристаллизация, чистота соединения формулы I была улучшена изобретателями от примерно 97% до более чем 99,0% от общей чистоты (предпочтительно, более чем 99,8% от общей чистоты), а количество каждой единичной примеси составляет менее 0,25%. И выход при кристаллизации является высоким, что очень подходит для промышленного производства.
В WO 9611210, WO 03018615 и WO 2004014879 сообщались процесс синтеза и очистки для Микафунгина. В WO 9611210 описан способ разделения с помощью препаративной колонки, однако такой метод требует большого количества органического растворителя, что вызывает серьезное загрязнение окружающей среды, и его трудно масштабировать; а чистота полученного продукта невысока. В WO 03018615, WO 2004014879 очистку выполняют с помощью кристаллизации, однако примесь 6, примесь 7, примесь 8, примесь 9 и примесь 10 не могут быть эффективно удалены путем кристаллизации.
Таким образом, авторы настоящего изобретения желают получить соединение формулы I высокой чистоты, т.е. промежуточный препарат, путем некоторых способов очистки на стадии промежуточных препаратов. А затем соединение формулы II (FK463) высокой чистоты получают путем химической модификации с тем, чтобы получить Микафунгин высокой чистоты в соответствии с требованиями FDA.
Сущность изобретения
Одним объектом настоящего изобретения является создание вещества, такого как соединение формулы I высокой чистоты.
Другим объектом настоящего изобретения является создание способа получения вещества высокой чистоты (соединение формулы I).
Третьим объектом настоящего изобретения является обеспечение применения вещества высокой чистоты (соединение формулы I).
Четвертым объектом настоящего изобретения является обеспечение способа получения другого вещества высокой чистоты (соединение формулы II).
Пятым объектом настоящего изобретения является создание способа получения другого вещества высокой чистоты (соединение формулы II).
Соединение формулы I высокой чистоты
В настоящем изобретении предусмотрено соединение формулы I высокой чистоты, и степень чистоты составляет не менее 99,0%; где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль; предпочтительно Н, ион натрия или ион диизопропилэтиламина.
В предпочтительном воплощении настоящего изобретения, чистота соединения формулы I составляет не менее 99,2%.
В предпочтительном воплощении настоящего изобретения, чистота соединения формулы I составляет не менее 99,5%.
В другом предпочтительном воплощении настоящего изобретения, чистота соединения формулы I составляет не менее 99,8%.
Чистоту соединения формулы I определяли методом ВЭЖХ.
Чистоту соединений формулы I и/или количество примесей рассчитывали следующим образом: площадь под кривой пика ВЭЖХ профиля для соединения формулы I и/или примеси делили на общую площадь под кривой профиля ВЭЖХ.
Метод ВЭЖХ перечислен ниже:
Колонка: АСЕ 3 AQ, 150×4,6 мм, 3 мкм
Подвижная фаза: А: 1000 мл воды, 10 мл метанола, 100 мкл трифторуксусной кислоты
В: 600 мл воды, 400 мл метанола, 100 мкл трифторуксусной кислоты
Скорость потока: 0,55 мл/мин
Температура колонки: 50°С
Градиент
Температура инжектора: 5°С
Длина волны детектирования: 225 нм
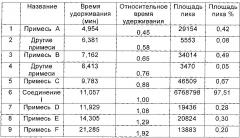
В другом предпочтительном воплощении настоящего изобретения, количество примеси А в соединении формулы I высокой чистоты составляет не более 0,25%.
В другом предпочтительном воплощении настоящего изобретения, относительное время удерживания (сокращенно RRT - relative retention time) примеси А при ВЭЖХ составляет около 0,45, то есть, 0,45±0,02.
В другом предпочтительном воплощении настоящего изобретения, количество примеси А составляет не более 0,10%.
В другом предпочтительном воплощении настоящего изобретения, количество примесей А составляет не более 0,05%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси А составляет не более 0,05%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси B в соединении формулы I высокой степени чистоты составляет не более 0,25%.
В другом предпочтительном воплощении настоящего изобретения, относительное время удерживания примеси В при ВЭЖХ составляет около 0,65, то есть 0,65±0,02.
В другом предпочтительном воплощении настоящего изобретения, количество примеси В составляет не более 0,15%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси В составляет не более 0,10%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси В составляет от 0,03% до 0,10%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси В составляет не более 0,03%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси С в соединении формулы I высокой чистоты составляет не более 0,25%.
В другом предпочтительном воплощении настоящего изобретения, относительное время удерживания примеси С при ВЭЖХ составляет около 0,88, то есть 0,88±0,02.
В другом предпочтительном воплощении настоящего изобретения, количество примеси С не больше чем 0,15%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси С не больше чем 0,10%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси С составляет от 0,02% до 0,10%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси С не более 0,02%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси D в соединении формулы I высокой степени чистоты составляет не более 0,20%.
В другом предпочтительном воплощении настоящего изобретения, относительное время удерживания примеси D при ВЭЖХ составляет около 1,08, то есть 1,08±0,02.
В другом предпочтительном воплощении настоящего изобретения, количество примеси D составляет не более 0,15%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси D составляет не более 0,10%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси D составляет от 0,04% до 0,10%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси D составляет не более 0,04%.
В другом предпочтительном воплощении настоящего изобретения, относительное время удерживания примеси Е при ВЭЖХ составляет около 1,29, то есть 1,29±0,02.
В другом предпочтительном воплощении настоящего изобретения, количество примеси Е составляет не более 0,10%.
В другом предпочтительном воплощении настоящего изобретения, количество примеси Е составляет не более 0,05%.
В следующем предпочтительном воплощении настоящего изобретения, количество примеси F в соединении формулы I высокой степени чистоты составляет не более 0,15%.
В следующем предпочтительном воплощении настоящего изобретения, относительное время удерживания примеси F при ВЭЖХ составляет около 1,92, то есть 1,92±0,02.
В следующем предпочтительном воплощении настоящего изобретения, количество примеси F составляет не более 0,10%.
В следующем предпочтительном воплощении настоящего изобретения, количество примеси F составляет не более 0,05%.
В другом предпочтительном воплощении настоящего изобретения, количество любых других соответствующих примесей в соединении формулы I высокой степени чистоты составляет не более чем 0,10%, и указанные другие соответствующие примеси относятся к примесям, отличным от примесей A-F, которые могут присутствовать.
В другом предпочтительном воплощении настоящего изобретения, количество любых других соответствующих примесей составляет не более 0,05%.
В другом предпочтительном воплощении настоящего изобретения, количество других соответствующих примесей составляет 0%.
Получение соединения формулы I высокой чистоты
После изучения авторы настоящего изобретения неожиданно обнаружили, что кристаллы с превосходной морфологией могут быть образованы из соединений формулы I путем растворения соединения в воде или смешанном растворе вода - смешиваемые с водой низшие спирты, и поддерживания раствора соединения формулы I около точки насыщения растворимости и поддержания значения рН раствора в заданном интервале. Такой процесс кристаллизации будет производить хорошие эффекты очистки, тем самым получая соединение формулы I высокой чистоты. Далее, поскольку соединение формулы I является циклопептидным соединением, пептидная связь, образуемая при конденсации аминокислоты, будет разрушена путем гидролиза в растворе при высокой температуре. Таким образом, процесс кристаллизации для соединения формулы I нужно контролировать при определенном температурном диапазоне, чтобы гарантировать, что циклопептид не будет деградировать при раскрытии кольца. Для способа получения по настоящему изобретению был выполнен большой объем работ интенсивных исследований по скринированию растворителей для кристаллизации, и было обнаружено, что кристаллы с превосходной морфологией могут быть образованы из соединений формулы I путем кристаллизации соединения в метаноле, этаноле, n-пропаноле, изопропаноле или смеси этих растворов, и процесс кристаллизации будет производить хорошие эффекты очистки. Тем не менее, при кристаллизации соединения в растворителе, таком как ацетон, ацетонитрил, этилацетат, соединение формулы I будет образовывать аморфный осадок, и эффекты очистки, такие как удаление примесей, не могут быть достигнуты за счет такого процесса осаждения.
Способ получения по настоящему изобретению включает в себя следующие этапы:
(a) растворение сырого соединения формулы I в воде или водном органическом растворителе (i) и контролирование рН раствора;
(b) получение соединения формулы I высокой чистоты путем снижения температуры и/или добавления органического растворителя (i).
На стадии (а), температура для растворения составляет от 10 до 50°С, предпочтительно от 20 до 40°С.
На стадии (а), соотношение объемов органического растворителя (i) к воде в водном растворе органического растворителя (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, более предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 10 до 500 мг/мл, предпочтительно от 100 до 400 мг/мл соединения формулы I, в расчете на общий объем раствора на стадии (а).
На стадии (а), рН раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (b), температуру понижают до температуры от -40 до 35°С, предпочтительно от -10 до 35°С, более предпочтительно от -5 до 30°С и наиболее предпочтительно от 5 до 10°С.
В стадии (b), соотношение объемов органического растворителя (i) к раствору со стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10 и наиболее предпочтительно от 1 до 5.
На стадии (а) и/или (b), указанный органический растворитель (i) представляет собой С1-С4-низший спирт; предпочтительно выбранный из: метанола, этанола, n-пропанола, изопропанола или их смеси.
Соединение формулы I высокой чистоты, полученное на стадии (b), представляет собой кристаллы.
После стадии (b), могут быть следующие стадии:
(c) центрифугирование или фильтрование;
(d) удаление растворителя и большей части воды (сушка), так, чтобы получить соединения формулы I высокой чистоты.
Стадия (а)-(b) может быть повторена один или более раз для перекристаллизации, предпочтительно от 1 до 4 раз.
В одном воплощении настоящего изобретения, соединение формулы I высокой чистоты может быть получено с помощью следующих стадий:
(a) растворение соединения формулы I в воде и контролирование рН раствора;
(b) получение кристаллов соединения формулы I путем снижения температуры раствора;
(c) центрифугирование или фильтрование;
(d) сушка, так, чтобы получить высокую чистоту соединения формулы I. На стадии (а), температура для растворения составляет от 10 до 50°С, предпочтительно от 20 до 40°С.
На стадии (а), раствор содержит от 10 до 500 мг/мл, предпочтительно от 100 до 400 мг/мл соединения формулы I, на основании общего объема раствора.
На стадии (а), рН раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (b), температуру снижают от -10 до 35°С, более предпочтительно от -5 до 30°С и наиболее предпочтительно от 5 до 10°С.
В другом воплощении настоящего изобретения, соединение формулы I высокой чистоты может быть получено с помощью следующих стадий:
(a) растворение соединения формулы I в воде и контролирование рН раствора;
(b) добавление органического растворителя (i), таким образом, чтобы полностью осадить кристаллы соединения формулы I;
(c) центрифугирование или фильтрование;
(d) сушку кристаллов, так, чтобы получить высокую чистоту соединения формулы I.
На стадии (а), температура для растворения составляет от 10 до 50°С, предпочтительно от 20 до 40°С.
На стадии (а), раствор содержит от 10 до 500 мг/мл, предпочтительно от 50 до 300 мг/мл соединения формулы I, на основе общего объема раствора.
На стадии (а), рН раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (b), указанный органический растворитель (i) представляет собой С1-С4-низший спирт; предпочтительно выбирают из: метанола, этанола, n-пропанола, изопропанола или их смесей.
В стадии (b), соотношение объемов органического растворителя (i) к раствору со стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10 и наиболее предпочтительно от 1 до 5.
В другом воплощении настоящего изобретения, соединение формулы I высокой чистоты может быть получено с помощью следующих стадий:
(a) растворение соединения формулы I в воде, и контролирование рН раствора;
(b) снижение температуры раствора и добавление органического растворителя (i), с тем, чтобы полностью осадить кристаллы соединения формулы I;
(c) центрифугирование или фильтрование;
(d) сушка кристаллов, так, чтобы получить высокую чистоту соединения формулы I.
На стадии (а), температура для растворения составляет от 10 до 50°С, предпочтительно от 20 до 40°С.
На стадии (а), раствор содержит от 10 до 500 мг/мл, предпочтительно от 50 до 300 мг/мл соединения формулы I, на основе общего объема раствора.
На стадии (а), рН раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (b), указанный органический растворитель (i) представляет собой С1-С4-низший спирт; предпочтительно выбирают из: метанола, этанола, n-пропанола, изопропанола или их смесей.
На стадии (b), температуру понижают до температуры от -40 до 35°С, предпочтительно от -10 до 35°С, более предпочтительно от -5 до 30°С и наиболее предпочтительно от 5 до 10°С.
На стадии (b), соотношение объемов органического растворителя (i) к раствору со стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10 и наиболее предпочтительно от 1 до 5.
В другом воплощении настоящего изобретения, соединение формулы I высокой чистоты может быть получено с помощью следующих стадий:
(a) растворение соединения формулы I в водном растворе органического растворителя (i) и контролирование рН раствора;
(b) снижение температуры раствора, с тем, чтобы осадить кристаллы соединения формулы I;
(c) центрифугирование или фильтрование;
(d) сушка кристаллов, так, чтобы получить высокую чистоту соединения формулы I.
На стадии (а), температура для растворения составляет от 10 до 50°С, предпочтительно от 20 до 40°С.
На стадии (а), соотношение объемов органического растворителя (i) и воды в водном растворе органического растворителя (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, и наиболее предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 10 до 500 мг/мл, предпочтительно от 100 до 400 мг/мл соединения формулы I, на основе общего объема раствора.
На стадии (а), рН раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (а), указанный органический растворитель (i) представляет собой С1-С4-низший спирт; предпочтительно выбирают из: метанола, этанола, n-пропанола, изопропанола, или их смесей.
На стадии (b) температуры понижают до температуры от -40 до 35°С, предпочтительно от -10 до 35°С, более предпочтительно от -5 до 30°С, и наиболее предпочтительно от 5 до 10°С.
В другом воплощении настоящего изобретения, соединение формулы I высокой чистоты может быть получено с помощью следующих стадий:
(a) растворение соединения формулы I в водном растворе органического растворителя (i), и контролирование рН раствора;
(b) добавление органического растворителя (i), с тем, чтобы осадить кристаллы соединения формулы I;
(c) центрифугирование или фильтрование;
(d) сушка кристаллов, так, чтобы получить высокую чистоту соединения формулы I.
На стадии (а) температура для растворения составляет от 10 до 50°С, предпочтительно от 20 до 40°С.
На стадии (а) соотношение объемов органического растворителя (i) и воды в водном растворе органического растворителя (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10 и наиболее предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 10 до 500 мг/мл, предпочтительно от 100 до 400 мг/мл соединения формулы I, на основе общего объема раствора.
На стадии (а), рН раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (b), соотношение объемов органического растворителя (i) и раствора со стадии (а) составляет от 0,1 до 10, предпочтительно от 1 до 5.
На стадии (а) и (b), указанный органический растворитель (i) представляет собой С1-С4-низший спирт; предпочтительно выбирают из: метанола, этанола, n-пропанола, изопропанола или их смесей.
В другом воплощении настоящего изобретения, соединение формулы I высокой чистоты может быть получено с помощью следующих стадий:
(a) растворение соединения формулы I в водном растворе органического растворителя (i) и контролирование рН раствора;
(b) снижение температуры раствора и добавление органического растворителя (i), так, чтобы осадить кристаллы соединения формулы I;
(c) центрифугирование или фильтрование;
(d) сушка кристаллов, так, чтобы получить высокую чистоту соединения формулы I.
На стадии (а), температура для растворения составляет от 10 до 50°С, предпочтительно от 20 до 40°С.
На стадии (а), соотношение объемов органического растворителя (i) и воды в водном растворе органического растворителя (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, и наиболее предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 10 до 500 мг/мл, предпочтительно от 100 до 400 мг/мл соединения формулы I, на основе общего объема раствора.
На стадии (а), рН раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (b), температуру снижают до температуры от -40 до 35°С, предпочтительно от -10 до 35°С, более предпочтительно от -5 до 30°С и наиболее предпочтительно от 5 to 10°С;
На стадии (b), соотношение объемов органического растворителя (i) и раствора со стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10 и наиболее предпочтительно от 1 до 5.
На стадии (а) и (b), указанный органический растворитель (i) представляет собой С1-С4-низший спирт; предпочтительно выбирают из: метанола, этанола, n-пропанола, изопропанола, или их смесей.
Соединение формулы I, полученное с помощью способа, представленного в настоящем изобретении, обладает высокой чистотой; таким образом, его будет лучше использовать для получения соединения формулы II.
Соединение формулы II высокой чистоты
В одном аспекте, соединение формулы II высокой чистоты предусмотрено в настоящем изобретении, и его чистота по ВЭЖХ составляет не менее 98,80%; предпочтительно не менее 99,0%; более предпочтительно не менее 99,5%; где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль; предпочтительно Н, ион натрия или ион диизопропилэтиламина.
Чистоту соединения формулы II определяют с помощью ВЭЖХ. Чистоту соединения формулы II и/или количество примесей рассчитывают следующим образом: площадь под кривой пика на профиле ВЭЖХ для соединения формулы II и/или примеси делят на общую площадь под кривой профиля ВЭЖХ.
Чистоту соединения формулы II в жидкой фазе определяют способом ВЭЖХ, и способ ВЭЖХ указан следующим образом:
ВЭЖХ Аналитическая колонка: YMC-ODS 250*4,6 мм, 5 мкм;
Подвижная фаза: ацетонитрил: фосфатный буфер = 70:45;
Программа элюирования: изократическая;
Скорость потока: 1,15 мл/мин;
Температура колонки: 35°С;
Длина волны детектирования: 210 нм;
Время прогона: 45 мин;
Растворитель: водный фосфатный буфер.
В одном предпочтительном воплощении настоящего изобретения количество примеси 6 (структура которой показана в формуле IV) в соединении формулы II высокой степени чистоты составляет менее 0,2%; предпочтительно менее 0,1%; более предпочтительно менее 0,05%; где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль; предпочтительно Н, ион натрия или ион диизопропилэтиламина.
В одном предпочтительном воплощении настоящего изобретения, общее количество примеси 7 (структура которой показана в формуле V) и примеси 8 (структура которой показана в формуле VI) в соединении формулы II высокой степени чистоты составляет меньше 0,5%; предпочтительно менее 0,3%; более предпочтительно менее 0,1%; где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль; предпочтительно Н, ион натрия или ион диизопропилэтиламин.
В другом предпочтительном воплощении настоящего изобретения количество примеси 9 (структура которой показана в формуле VII) в соединении формулы II высокой степени чистоты составляет менее 0,2%; предпочтительно менее 0,1%; где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль; предпочтительно Н, ион натрия или ион диизопропилэтиламина.
В другом предпочтительном воплощении настоящего изобретения, количество примеси 10 (структура которой показана в формуле VIII) в соединении формулы II высокой степени чистоты, составляет менее 0,2%; предпочтительно менее 0,1%; где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль; предпочтительно Н, ион натрия или ион диизопропилэтиламина.
В другом предпочтительном воплощении настоящего изобретения количество примеси 11 в соединении формулы II высокой степени чистоты составляет не более 0,15%; предпочтительно не более 0,1%; наиболее предпочтительно не более 0,05%. И относительное время удерживания примеси 11 при ВЭЖХ составляет около 0,96, т.е. 0,96±0,02.
В другом предпочтительном воплощении настоящего изобретения, количество любых других соответствующих примесей в соединении формулы II высокой степени чистоты составляет не более 0,02%; предпочтительно не более 0,01%; наиболее предпочтительно 0%; и указанные другие соответствующие примеси относятся к примесям, отличающимся от примесей 6-11, которые могут присутствовать.
Способ получения соединения формулы II высокой чистоты.
Способ получения соединения формулы II высокой чистоты, где циклопептидное соединение высокой чистоты по любому из пп. 1-11, используют в качестве сырья для получения соединения формулы II; где R представляет собой Н или ион диизопропилэтиламина или другие катионы, способные образовывать фармацевтически приемлемую соль.
Пути синтеза соединения были зарегистрированы в нескольких патентах, таких как WO 9611210, 9857923, 2604014879 и т.д.
Применение соединения формулы I высокой чистоты и композиций, его содержащих.
В настоящем изобретении представлено применение соединения формулы I высокой степени чистоты. В одном аспекте, оно может быть легко использовано для получения соединения формулы II высокой степени чистоты, где R представляет собой Н, диизопропилэтиламин или другие катионы, способные образовывать фармацевтически приемлемую соль.
В другом аспекте соединение формулы I высокой чистоты, представленное в данном изобретении, может быть непосредственно использовано для получения лекарственных препаратов для лечения грибковых инфекций. Также могут быть предусмотрены фармацевтическая композиция, содержащая соединение формулы I и фармацевтически приемлемый носитель.
Применение соединения формулы II высокой чистоты и композиций, его содержащих.
В настоящем изобретении представлено применение соединения формулы II высокой чистоты. Соединение формулы II высокой чистоты, представленное в настоящем изобретении, может быть непосредственно использовано для получения лекарственных препаратов для лечения грибковых инфекций. Также могут быть предусмотрены фармацевтическая композиция, содержащая соединение формулы II и фармацевтически приемлемый носитель.
В настоящем изобретении предложен способ получения фармацевтической композиции, содержащей соединение формулы II высокой чистоты:
Соединение формулы II высокой чистоты по настоящему изобретению смешивают с фармацевтически приемлемым носителем, так, чтобы получить фармацевтическую композицию, содержащую соединение формулы II высокой чистоты.
Как здесь указано, "соединение формулы I" или " формулы I соединение" можно использовать взаимозаменяемо, оба выражения относятся к соединению, имеющему следующую структурную формулу или его фармацевтически приемлемой соли:
где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль, предпочтительно Н, ион натрия или ион диизопропилэтиламина.
Предпочтительно, фармацевтически приемлемые соли включают: соли металлов, таких как соли щелочных металлов (такие как натриевая соль, калиевая соль), соли щелочноземельных металлов (такие как кальциевая соль, магниевая соль и т.п.), соли аммония, соли, образованные с органическими основаниями (например, соль триметиламина, соль триэтиламина, соль пиридина, соль пиколина, дициклогексиламиновая соль, N,N,-дибензилэтилендиаминовая соль, соль диизопропилэтиламина и т.д.), соли присоединения органической кислоты (такие как: формиат, ацетат, трифторацетат, малеат, тартрат, метансульфонат, бензолсульфонат, толуолсульфонат и т.д.), соли присоединения неорганической кислоты (например, гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат и т.д.), соли, образованные с