Очистка белка с использованием бис-трис буфера
Иллюстрации
Показать всеИзобретение относится к двухстадийному способу хроматографии для очистки белков, в частности моноклональных антител, с использованием только четырех буферных растворов, полученных из маточного раствора. Способ включает (a) первую хроматографическую стадию, включающую: прохождение указанного раствора через первую хроматографическую колонку; элюирование неочищенного белка из первой хроматографической колонки, используя первый элюционный буфер; и (b) вторую хроматографическую стадию, включающую: прохождение элюента неочищенного белка, полученного в конце стадии (а), через вторую хроматографическую колонку; извлечение очищенного белка из второй хроматографической колонки, используя второй элюционный буфер, причем каждый из буферов содержит Бис-Трис, уксусную кислоту и воду. Способ обеспечивает возможность быстрого производства партий очищенного белка и снижения времени использования систем очистки, что дает возможность очистки рекомбинантных белков в промышленном масштабе. 21 з.п. ф-лы, 6 ил., 3 табл., 7 пр.
Реферат
ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Изобретение относится к двухэтапному способу хроматографии для мелко- и крупномасштабной очистки белков, в частности, моноклональных антител, с использованием четырех буферных растворов.
УРОВЕНЬ ТЕХНИКИ
Очистка антител может представлять собой один из наиболее затратных аспектов биопродукции. Моноклональные антитела (mAb) в целом очищают трехстадийным способом хроматографии с использованием трех смол и специфической буферной системы на каждой стадии. Этот обычный способ очистки включает стадию захвата с последующей стадией ионного обмена и заключительной стадией полировки и обычно занимает от 3 до 5 рабочих дней (включая хранения и открытые фазы). С увеличением титров клеточных культур и более крупными объемами клеточных культур, используемыми для продукции, технологию производства и выделения целевого продукта рассматривают как слабое место производства. Это, в частности, относится к производству моноклональных антител, где средоточие внимания сместилось с серийного объема в сторону производительности технологии получения и выделения целевого продукта. Кроме того, исследования на ранней преклинической и клинической фазе требуют более быстрого производства бόльших количеств антител, чем это возможно в уровне техники. Поэтому в промышленности существует потребность и в уменьшении числа стадий, подлежащих использованию для очистки антител, и времени, затрачиваемого для получения партий.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Заявители обнаружили новый способ очистки антител, причем указанный способ включает ограниченные числа стадий, в то же время, обеспечивая возможность получения высоких выходов очищенных антител с превосходной степенью чистоты. Таким образом, очищенные белки пригодны для различных видов применения в медицине. Соответственно, данный способ можно применять при очистке белков для клинических испытаний и/или для реализации на рынке фармацевтической композиции, содержащей белок.
Вкратце, этот способ включает только две хроматографические стадии: одну аффинную хроматографию и одну хроматографию через колонку с мультимодальной смолой. Кроме того, было обнаружено, что все буферы, используемые во время этих двух стадий хроматографии, можно получить, начиная с того же маточного раствора. Иными словами, все буферы могут состоять из одних и тех же химических веществ, хотя концентрации указанных химических веществ могут варьироваться от одного буфера к другому. Эти буферы преимущественно содержат Бис-Трис, например, в комбинации с NaCl, уксусной кислотой и водой. Поскольку нет необходимости в каком-либо обмене буфера, способ легко осуществить, и он очень подходит для автоматизации и/или для проведения в непрерывном режиме. Кроме того, тот факт, что все буферы могут состоять из одних и тех же химических веществ, дает возможность значительно уменьшить время для подготовки хроматографических колонок, а также уменьшает потребность в ручных вмешательствах. Способ по изобретению дополнительно обеспечивает возможность уменьшения или отмены открытых фаз (т.е. стадий, где система очистки открывается для проведения ручной операции, такой как подготовка хроматографической колонки для нового буфера, разведение образца или доведение до требуемой величины его pH), посредством этого снижая риск загрязнения. Поэтому способ по изобретению обеспечивает возможность и быстрого производства партий, и снижения времени использования систем очистки. Таким образом, он пригоден для наращивания масштабов производства и очистки рекомбинантных белков в промышленном масштабе.
Две определенных последовательности операций были установлены и осуществлены для трех различных антител. В первом протоколе pH элюента неочищенного белка, полученного в конце первой хроматографической стадии, регулируют, используя раствор Бис-Трис (см. примеры 3, 4 и 5). Было показано, что этот протокол универсален в той мере, пока он дает превосходные и воспроизводимые результаты, независимо от определенного антитела, которое очищается (см. пример 6). Во втором протоколе элюент неочищенного белка, полученный в конце первой хроматографической стадии, непосредственно проходит через вторую хроматографическую колонку, т.е. без подвергания какой-либо обработке, подобной регулированию pH, обмену или разбавлению буфера (см. пример 7). В этом протоколе за указанными двумя хроматографическими стадиями может следовать прохождение через мембранный поглотитель. Этот второй протокол имеет преимущество крайне быстрого проведения (примерно 7 или 8 часов для 100 л исходного материала). Кроме того, его можно полностью автоматизировать, проводить в непрерывном режиме, и он не включает никакой открытой фазы.
Таким образом, изобретение относится к способу очистки белка из раствора, включающему первую хроматографическую стадию, включающую прохождение уравновешивающего буфера через первую хроматографическую колонку, прохождение раствора через первую хроматографическую колонку, прохождение уравновешивающего буфера через первую хроматографическую колонку, прохождение промывного и обеззараживающего буфера через первую хроматографическую колонку, прохождение уравновешивающего буфера через первую хроматографическую колонку, элюирование элюента неочищенного белка из первой хроматографической колонки, используя первый элюционный буфер, и, необязательно, регулирование pH элюента неочищенного белка, используя раствор Бис-Трис; и вторую хроматографическую стадию, включающую прохождение уравновешивающего буфера через вторую хроматографическую колонку, прохождение элюента неочищенного белка через вторую хроматографическую колонку, прохождение уравновешивающего буфера через вторую хроматографическую колонку, и извлечение очищенного белка из второй хроматографической колонки, используя второй элюционный буфер.
Изобретение также относится к способу очистки белка из раствора, включающему первую хроматографическую стадию, включающую прохождение уравновешивающего буфера через первую хроматографическую колонку, прохождение раствора через первую хроматографическую колонку, прохождение уравновешивающего буфера через первую хроматографическую колонку, элюирование неочищенного белка из первой хроматографической колонки, используя первый элюционный буфер, и, необязательно, регулирование pH элюента неочищенного белка, используя раствор Бис-Трис; и вторую хроматографическую стадию, включающую прохождение уравновешивающего буфера через вторую хроматографическую колонку, прохождение элюента неочищенного белка через вторую хроматографическую колонку, прохождение уравновешивающего буфера через вторую хроматографическую колонку, прохождение промывного и обеззараживающего буфера через вторую хроматографическую колонку, прохождение уравновешивающего буфера через вторую хроматографическую колонку, и извлечение очищенного белка из второй хроматографической колонки, используя второй элюционный буфер.
В одном варианте осуществления изобретения раствор Бис-Трис представляет собой 1М раствор Бис-Трис. В других вариантах осуществления каждый из буферов содержит Бис-Трис и/или каждый из буферов содержит варьирующиеся концентрации одних и тех же химических веществ. В другом варианте осуществления каждый буфер содержит Бис-Трис, уксусную кислоту, NaCl и воду.
В одном варианте осуществления изобретения первая хроматографическая колонка представляет собой колонку белка A, а вторая хроматографическая колонка представляет собой хроматографическую колонку с мультимодальной смолой. В другом варианте осуществления изобретения первая хроматографическая колонка представляет собой хроматографическую колонку с мультимодальной смолой, а вторая хроматографическая колонка представляет собой колонку белка A. В других вариантах осуществления изобретения способ очистки белка из раствора не включает какой-либо хроматографической стадии, которая включает прохождение раствора через анионообменную хроматографическую (AEX) колонку.
В одном варианте осуществления изобретения очищаемый белок представляет собой антитело. В другом варианте осуществления антитело представляет собой моноклональное антитело.
В одном варианте осуществления изобретения способ дополнительно включает прохождение элюента неочищенного белка через мембранный поглотитель после стадии (b). В других вариантах осуществления способ дополнительно включает стадию нанофильтрации после стадии (b) и/или стадию ультрафильтрации и диафильтрации после стадии нанофильтрации.
В определенных вариантах осуществления изобретения первый элюционный буфер содержит 20 мМ Бис-Трис и 20 мМ NaCl, pH которого доводят до 3,5 уксусной кислотой; второй элюционный буфер содержит 20 мМ Бис-Трис и 20 мМ NaCl, pH которого доводят до 4,5 уксусной кислотой; уравновешивающий буфер содержит 20 мМ Бис-Трис и 20 мМ NaCl, pH которого доводят до 7,4 уксусной кислотой; и промывной раствор и обеззараживающий буфер состоит из 20 мМ Бис-Трис и 1M NaCl, pH которого доводят до 7,4 уксусной кислотой. В других вариантах осуществления изобретения первый элюционный буфер содержит 20 мМ Бис-Трис и 20 мМ NaCl, pH которого доводят до 4,5 уксусной кислотой; второй элюционный буфер содержит 20 мМ Бис-Трис и 20 мМ NaCl, pH которого доводят до 3,5 уксусной кислотой; уравновешивающий буфер содержит 20 мМ Бис-Трис и 20 мМ NaCl, pH которого доводят до 7,4 уксусной кислотой; и промывной раствор и обеззараживающий буфер состоит из 20 мМ Бис-Трис, и 1M NaCl, pH которого доводят до 7,4 уксусной кислотой.
Изобретение относится к набору, содержащему хроматографическую колонку с мультимодальной смолой и/или колонку белка A; и по меньшей мере один буфер, содержащий или состоящий из Бис-Трис, уксусной кислоты, NaCl и воды. В некоторых вариантах осуществления набор используют для очистки белка из раствора с использованием способа по изобретению.
Изобретение также относится к набору, содержащему хроматографическую колонку с мультимодальной смолой и/или колонку белка A; и инструкции по получению по меньшей мере одного буфера, содержащего или состоящего из Бис-Трис, уксусной кислоты, NaCl и воды. В некоторых вариантах осуществления набор используют для очистки белка из раствора с использованием способа по изобретению.
Изобретение дополнительно относится к применению буфера, содержащего или состоящего из Бис-Трис, уксусной кислоты, NaCl и воды, для очистки белка из раствора по меньшей мере одной хроматографической стадией. В некоторых вариантах осуществления хроматографическая стадия представляет собой хроматографическую стадию на колонке с мультимодальной смолой и/или хроматографическую стадию на колонке белка A. Изобретение также относится к применению буфера, содержащего или состоящего из Бис-Трис, уксусной кислоты, NaCl и воды, для очистки белка из раствора способом по изобретению.
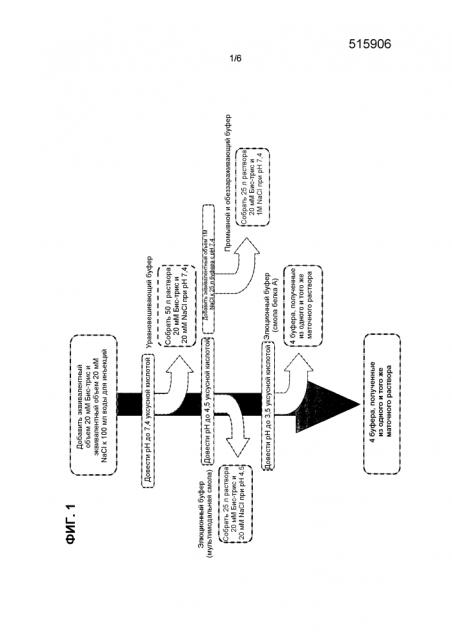
Изобретение дополнительно относится к способу получения уравновешивающего буфера, включающему создание 100 л раствора с конечной концентрацией 20 мМ Бис-Трис и 20 мМ NaCl; доведение pH раствора до 7,4 уксусной кислотой; и сбор 50 л раствора. Изобретение также относится к способу получения промывного и обеззараживающего буфера, включающему доведение pH оставшихся 50 л раствора от получения уравновешивающего буфера до 4,5 уксусной кислотой; и сбор 25 л раствора. Изобретение дополнительно относится к способу получения элюционного буфера, включающему доведение pH оставшихся 25 л раствора от получения промывного и обеззараживающего буфера до 3,5 уксусной кислотой. Изобретение дополнительно относится к способу получения элюционного буфера, включающему добавление эквивалентного объема 1M NaCl к 25 л раствора, оставшихся от получения элюционного буфера. Буферы, полученные раскрытыми здесь способами, можно использовать для очистки белка из раствора с использованием способа по изобретению.
Эти и другие признаки и преимущества описанного способа очистки станут более полно понятными из следующего подробного описания, взятого вместе с сопровождающей формулой изобретения. Следует отметить, что объем формулы изобретения определяется перечисленными в ней положениями, а не определенным обсуждением признаков и преимуществ, изложенным в описании.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующее подробное описание вариантов осуществления раскрытого способа очистки можно лучше всего понять при чтении в сочетании со ссылкой на следующие чертежи.
На фиг. 1 показана схема последовательности операций, используемой для составления буферов способа очистки, описанных в примерах 3-6.
На фиг. 2 показана схема двухстадийного способа очистки.
На фиг. 3 показана схема применения двухстадийного способа очистки для колонок крупномасштабной очистки.
На фиг. 4 показана схема крупномасштабной очистки по принципу «одна партия в день».
На фиг. 5 показаны результаты крупномасштабной очистки по принципу «одна партия в день».
На фиг. 6 показана схема последовательности операций, используемой для составления буферов способа очистки, описанных в примере 7.
ПОДРОБНОЕ ОПИСАНИЕ АСПЕКТОВ И ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
На основании доступности смол смешанного типа (также называемых мультимодальными смолами) заявители разработали новый способ очистки с использованием лишь двух хроматографических стадий. Иными словами, способ включает только две стадии, включающие прохождение через хроматографическую колонку.
Изобретение относится к способу очистки белка из раствора, включающему или состоящему из:
(a) первой хроматографической стадии, включающей:
- прохождение указанного раствора через первую хроматографическую колонку;
- элюирование неочищенного белка из первой хроматографической колонки, используя первый элюционный буфер; и
(b) второй хроматографической стадии, включающей:
- прохождение элюента неочищенного белка, полученного в конце стадии (a) через вторую хроматографическую колонку;
- извлечение очищенного белка из второй хроматографической колонки, используя второй элюционный буфер,
причем каждый из буферов содержит Бис-Трис.
Конкретнее, каждая из двух указанных выше хроматографических стадий может включать или состоять из:
- прохождения уравновешивающего буфера через хроматографическую колонку;
- прохождения раствора или элюента неочищенного белка через хроматографическую колонку (как указано выше);
- прохождения уравновешивающего буфера через хроматографическую колонку;
- необязательно, прохождения промывного и обеззараживающего буфера через хроматографическую колонку;
- необязательно, прохождения уравновешивающего буфера через хроматографическую колонку;
- элюирования элюента неочищенного белка или извлечения очищенного белка из хроматографической колонки, используя элюционный буфер (как указано выше),
причем каждый из буферов содержит Бис-Трис.
Как указано выше, упомянутый выше способ по изобретению включает только две хроматографические стадии. Конкретнее, способ может быть лишен хроматографической стадии, которая включает прохождение раствора через анионообменную хроматографическую (AEX) колонку, и/или хроматографической стадии для полировки. Даже хотя способ по изобретению включает только две хроматографические стадии, он обеспечивает возможность получения очищенных белков, которые пригодны для фармацевтических целей, и, в частности, для введения людям.
Кроме того, для уменьшения числа стадий в способе очистки с трех до двух (и, как следствие, сокращения общего времени, требуемого для завершения процесса очистки), описанный способ уменьшает число буферов, используемых для очистки, с семи до четырех. Кроме того, буферы содержат одинаковые компоненты (т.е. Бис-Трис, NaCl, уксусную кислоту и воду), что существенно облегчает получение буфера. Описанный способ очистки также упрощает очистку mAb, улучшает общий выход и уменьшает количество сырьевых материалов, стоимость готовой продукции и длительности производственного процесса, в дополнение к обеспечению возможности очистки разнообразных mAb.
В отличие от обычных способов очистки белка, как указано выше, в описанном здесь способе используют четыре буфера: уравновешивающий буфер, промывной буфер и два элюционных буфера. Буферы, используемые в описанном способе, изготавливают с таким же составом соединений, из маточного раствора, что существенно облегчает получение буфера.
Используемый в настоящем описании термин «буферы в соответствии с изобретением» относится к буферам, содержащим Бис-Трис. Бис-Трис представляет собой соединение, хорошо известное специалистам в данной области техники, названием которого по номенклатуре IUPAC (Международного Союза Чистой и Прикладной Химии) является 2-[бис(2-гидроксиэтил)амино]-2-(гидроксиметил)пропан-1,3-диол, и номером которого по реестру CAS (Службы Химической Ассоциации) является 6976-37-0. Такие буферы в соответствии с изобретением могут соответствовать уравновешивающему буферу, промывному и обеззараживающему буферу, и/или элюционному буферу.
Конкретнее, такие буферы в соответствии с изобретением могут содержать или состоять из варьирующихся концентраций одинаковых химических соединений (причем один из них представляет собой Бис-Трис). В определенном варианте осуществления буферы содержат или состоят из Бис-Трис, уксусной кислоты и воды. В более конкретном варианте осуществления буферы содержат или состоят из Бис-Трис, уксусной кислоты, NaCl и воды. Иными словами, такие буферы содержат или состоят из варьирующихся концентраций Бис-Трис, уксусной кислоты, NaCl и воды.
Элюционный буфер может, например, содержать или состоять из 15-25 мМ (например, 20 мМ) Бис-Трис и 15-25 мМ (например, 20 мМ) NaCl, с pH, доведенным до уровня от 3 до 4 (например, 3,5) уксусной кислотой. Такой элюционный буфер особенно пригоден для использования с колонкой для аффинной хроматография, такой как колонка белка A.
Элюционный буфер может также содержать или состоять из 15-25 мМ (например, 20 мМ) Бис-Трис и 15-25 мМ (например, 20 мМ) NaCl, с pH, доведенным до уровня от 4 до 5 (например, 4,5) уксусной кислотой. Такой элюционный буфер особенно пригоден для использования с хроматографической колонкой с мультимодальной смолой, такой как, например, Capto Adhere.
Элюционный буфер может также содержать или состоять из 15-25 мМ (например, 20 мМ) Бис-Трис и 150-250 мМ (например, 200 мМ) NaCl, с pH, доведенным до уровня от 8 до 9 уксусной кислотой. Такой элюционный буфер особенно пригоден для использования с хроматографической колонкой с мультимодальной смолой, такой как, например, Capto ММC.
Уравновешивающий буфер может содержать или состоять из 15-25 мМ (например, 20 мМ) Бис-Трис и 15-25 мМ (например, 20 мМ) NaCl, с pH, доведенным до уровня от 7 до 8 (например, 7,4) уксусной кислотой.
Промывной и обеззараживающий буфер может содержать или состоять из 15-25 мМ (например, 20 мМ) Бис-Трис и 0,9-1,1 мМ (например, 1M) NaCl с pH, доведенным до уровня от 7 до 8 (например, 7,4) уксусной кислотой.
Конкретнее, один уравновешивающий буфер для использования в описанном способе содержит 20 мМ Бис-Трис и 20 мМ NaCl, pH которого доводят до 7,4 2 мМ уксусной кислоты. Один промывной буфер для использования в описанном способе содержит 20 мМ Бис-Трис и 1M NaCl, pH которого доводят до 7,4 2 мМ уксусной кислоты. Первый элюционный буфер для использования в описанном способе содержит 20 мМ Бис-Трис и 20 мМ NaCl, pH которого доводят до 3,5 275 мМ уксусной кислоты. Второй элюционный буфер для использования в описанном способе содержит 20 мМ Бис-Трис и 20 мМ NaCl, pH которого доводят до 4,5 35 мМ уксусной кислоты.
Преимущества указанных выше составов включают способность продукта mAb проходить через две хроматографические колонки, используемые в описанном способе, с большей совместимостью, в то же время, сводя к минимуму нежелательные взаимодействия, ограничивая падения pH и проводимость, и содействуя увеличенному выходу в сравнении с традиционными способами очистки. В дополнение к использованию уменьшенного числа буферов, другим аспектом описанного способа является использование Бис-Трис буфера.
Используемые в настоящем описании термины «полипептид» или «белок» относятся к молекуле, имеющей последовательность нативных белков, то есть, белков, продуцируемых естественно встречающимися и, в частности, нерекомбинантными клетками, или полученными методами генной инженерии или рекомбинантными клетками, и включают молекулы, имеющие аминокислотную последовательность нативного белка, или молекулы, имеющие делеции из, добавления к и/или замещения одной или нескольких аминокислот нативной последовательности. В определенных аспектах подлежащий очистке белок представляет собой антитело.
Используемый здесь термин «антитело» относится к интактному антителу или его связывающему фрагменту, который конкурирует с интактным антителом за специфическое связывание. Связывающие фрагменты включают без ограничения F(ab), F(ab′), F(ab′)2, Fv и одноцепочечные антитела. Термин «тяжелая цепь» включает любой полипептид иммуноглобулина, имеющий последовательность вариабельной области, достаточную для придания специфичности в отношении антигена.
Используемый здесь термин «тяжелая цепь» охватывает тяжелую цепь полной длины и ее фрагменты. Тяжелая цепь полной длины включает домен вариабельной области, VH, и три домена константной области, CH1, CH2 и CH3. Домен VH находится на амино-конце полипептида, и домен CH3 находится на карбоксильном конце.
Используемый здесь термин «легкая цепь» охватывает легкую цепь полной длины и ее фрагменты. Легкая цепь полной длины включает домен вариабельной области, VL, и домен константной области, CL. Подобно тяжелой цепи, домен вариабельной области легкой цепи находится на амино-конце полипептида. Используемый здесь термин «легкая цепь» включает любой полипептид иммуноглобулина, имеющий последовательность вариабельной области, достаточную для придания специфичности в отношении антигена.
Структурные единицы естественно встречающихся антител обычно содержат тетрамер. Каждый такой тетрамер обычно составлен из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну легкую цепь полной длины (обычно имеющую молекулярную массу примерно 25 кДа) и одну тяжелую цепь полной длины (обычно имеющую молекулярную массу примерно 50-70 кДа). Амино-концевая часть каждой легкой и тяжелой цепи обычно включает вариабельную область примерно из 100-110 или более аминокислот, которая ответственна за распознавание антигена. Карбокси-концевая часть каждой цепи обычно ограничивает константную область, ответственную за эффекторную функцию. Человеческие легкие цепи обычно классифицируются как каппа и лямбда легкие цепи. Тяжелые цепи обычно классифицируются как мю, дельта, гамма альфа или эпсилон, и определяют изотип антитела как IgM, IgD, IgG, IgA и IgE, соответственно. IgG имеет несколько подклассов, включая без ограничения IgG1, IgG2, IgG3 и IgG4. IgM имеет подклассы, включая без ограничения IgM1 и IgM2. IgA аналогичным образом подразделяется на подклассы, включающие без ограничения IgA1 и IgA2. В пределах легкой и тяжелой цепей полной длины вариабельные и константные области обычно соединены областью «J» из примерно 12 или более аминокислот, причем тяжелая цепь также включает область «D» из примерно 10 или более аминокислот.
Вариабельные области каждой пары легкой/тяжелой цепи обычно образуют антиген-связывающий сайт. Вариабельные области обычно проявляют одинаковую общую структуру относительно консервативных каркасных областей (FR), соединенных тремя гипервариабельными областями, также именуемыми определяющими комплементарность областями или CDR. CDR из двух цепей каждой пары обычно совмещаются каркасными областями, которые могут обеспечить возможность связывания с определенным эпитопом. От N-конца до C-конца вариабельные области и легкой, и тяжелой цепи обычно включают домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Распределение аминокислот в каждый домен происходит в соответствии с определениями Kabat et al., 1991, Sequences of Proteins of Immunological Interest, 5th ed., U.S. Department of Health and Human Services, NIH Publication No. 91-3242. Биспецифическое или бифункциональное антитело обычно представляет собой искусственное гибридное антитело, имеющее две различные пары тяжелой цепи/легкой цепи и два различных сайта связывания.
Фрагмент F(ab) состоит из одной легкой цепи и CH1 и вариабельных областей одной тяжелой цепи. Тяжелая цепь молекулы F(ab) не может образовывать дисульфидную связь с другой тяжелой цепью молекулы. Фрагмент F(ab′) содержит одну легкую цепь и одну тяжелую цепь, которая содержит большую часть константной области между доменами CH1 и CH2, так что межцепочечная дисульфидная связь может образовываться между двумя тяжелыми цепями для образования молекулы F(ab′)2. Область Fv включает вариабельные области и из тяжелой, и из легкой цепей, но не имеет константных областей. Одноцепочечные антитела представляют собой молекулы Fv, в которых вариабельные области тяжелой и легкой цепи были соединены гибким линкером для образования одной полипептидной цепи, которая образует антиген-связывающую область. В определенных вариантах осуществления подразумевается, что бивалентное антитело, отличное от «мультиспецифического» или «мультифункционального» антитела, содержит сайты связывания, имеющие идентичную антигенную специфичность.
Моноклональные антитела (mAb), которые могут быть очищены описанным способом, можно продуцировать разнообразными технологиями, включая обычную методологию моноклональных антител, например, стандартную технологию гибридизации соматических клеток, хорошо известную в данной области техники. Хотя предпочтительны процедуры гибридизации соматических клеток, в принципе, можно использовать другие технологии продукции моноклональных антител, например, вирусную или онкогенную трансформацию B-лимфоцитов. Моноклональное антитело может, например, соответствовать мышиному, химерному, гуманизированному или полностью человеческому антителу.
В определенном варианте осуществления антитело, очищенное способом по изобретению, представляет собой моноклональное антитело, выбранное из группы, состоящей из антитела, которое специфически связывается с протофибриллярной формой человеческого β-амилоидного белка (например, гуманизированное антитело), антитело, которое специфически связывается с поли-N-ацетилглюкозамином (PNAG) бактериального поверхностного полисахарида (например, полностью человеческое антитело) и антитело, которое специфически связывается с трансмембранным гликопротеином CD38 (например, гуманизированное антитело).
Используемая здесь фраза «извлечение белка» относится к сбору белка после использования описанного способа очистки. Описанный способ очистки может быть достигнут с использованием разнообразных стандартных технологий хроматографии белка, таких как без ограничения аффинная хроматография, ионообменная хроматография, хроматография гидрофобного взаимодействия, гель-фильтрационная хроматография и хроматография с использованием мультимодальной смолы.
В определенных вариантах осуществления описанного способа первая или вторая хроматографическая колонка представляет собой колонку белка A. Колонка белка A функционирует посредством аффинитета между лигандом смолы и белком, приводя к высокоэффективному удалению примесей. Другое преимущество использования колонки белка A в описанном способе состоит том, что mAb имеют универсальный аффинитет в отношении белка A. В одном варианте осуществления описанного способа колонка белка A представляет собой смолу MabSelect Sure (GE Healthcare).
В дополнительных вариантах осуществления описанного способа первая или вторая хроматографическая колонка представляет собой хроматографическую колонку с мультимодальной (смешанного типа) смолой. Мультимодальная смола взаимодействует с представляющим интерес белком посредством нескольких механизмов при mAb:ионных, гидрофобных взаимодействиях и взаимодействиях с водородными связями. Конкретнее, в хроматографической колонке с мультимодальной смолой mAb:ионное взаимодействие представляет собой mAb:катионное взаимодействие, в отличие от mAb:анионных взаимодействий, которые происходят в классической анионообменной хроматографической (AEX) колонке.
В одном определенном варианте осуществления описанного способа мультимодальная смола представляет собой смолу Capto Adhere (GE Healthcare). Capto Adhere представляет собой мультимодальный анионный обменник с высоко поперечно сшитой агарозной матрицей основы. Характеристики Capto adhere суммированы ниже (см. GE Healthcare Life Sciences, файл данных 28-9078-88 AC).
| Матрица | Высоко поперечно сшитая агароза |
| Функциональная группа | Мультимодальный сильный анионный обменник |
| Общая ионная емкость | Среда, содержащая от 0,09 до 0,12 ммоль Cl-/мл |
| Размер частиц | 75 мкм (d50v) |
| Скорость потока | По меньшей мере 600 см/ч в колонке диаметром 1 м с высотой слоя 20 см при 20°C с использованием рабочих буферов с такой же вязкостью как вязкость воды, при <3 бар (0,3 мПа) |
| Стабильность pH | |
| Краткосрочная | от 2 до 14 |
| Долгосрочная | от 3 до 12 |
| Рабочая температура | от +4°C до +30°C |
В другом определенном варианте осуществления описанного способа мультимодальная смола представляет собой смолу Capto ММC (GE Healthcare). Capto ММC представляет собой мультимодальный катионный обменник с высоко поперечно сшитой агарозной матрицей основы. Характеристики смолы Capto ММC суммированы ниже (см. GE Healthcare Life Sciences, файл данных 11-0035-45 AA).
| Матрица | Высоко поперечно сшитая агароза |
| Функциональная группа | Мультимодальный слабый катионный обменник |
| Общая ионная емкость | Среда, содержащая от 0,07 до 0,09 ммоль H+/мл |
| Размер частиц | 75 мкм (d50v) |
| Скорость потока | По меньшей мере 600 см/ч в колонке диаметром 1 м с высотой слоя 20 см при 20°C с использованием рабочих буферов с такой же вязкостью как вязкость воды, при <3 бар (0,3 мПа) |
| Динамическое связывание | >45 мг BSA/мл среды при 30 мС/см |
| Стабильность pH | |
| Краткосрочная | от 2 до 14 |
| Долгосрочная | от 2 до 12 |
| Рабочая температура | от +4°C до +30°C |
Способ в соответствии с изобретением может включать или не включать регулирование pH элюента неочищенного белка, используя раствор Бис-Трис в конце первой хроматографической стадии.
В первом варианте осуществления pH элюента неочищенного белка при использовании раствора Бис-Трис в конце первой хроматографической стадии, например, доводят до pH, составляющего от 6 до 7 (например, 6,5). Такой раствор Бис-Трис может представлять собой 1M раствор Бис-Трис. В таком способе хроматографическая колонка с мультимодальной смолой может, например, соответствовать колонке Capto Adhere. Определенный пример этого способа описан в примерах с 3 по 6.
Во втором варианте осуществления элюент неочищенного белка, полученный в конце первой хроматографиеской стадии, непосредственно пропускают через вторую хроматографическую колонку. Конкретнее, затем между двумя стадиями не проводят обработку (такую как регулирование pH, обмен или разбавление буфера). В таком способе хроматографическая колонка с мультимодальной смолой может, например, соответствовать колонке Capto ММC. Кроме того, элюент неочищенного белка можно пропустить через мембранный поглотитель после второй хроматографической стадии, как дополнительно описано ниже. Конкретный пример этого способа описан в примере 7. В таком способе между стадиями полностью отсутствуют обработки, требующие ручного вмешательства и открытия системы очистки (например, разбавление в сосуде для инактивации, фильтрацию после инактивации и регулирование pH в сосуде для пула белка A).
Описанный здесь способ можно использовать для извлечения очищенных белков. Используемый здесь термин «очищенные» относится к чистоте, которая обеспечивает возможность эффективного использования белка in vitro, ex vivo или in vivo. Для белка, подлежащего использованию при видах применения in vitro, ex vivo или in vivo, он должен по существу не содержать загрязняющих веществ, других белков и/или химических соединений, которые могут мешать применению этого белка при таких видах применения, или включение которых с представляющим интерес белком было бы по меньшей мере нежелательно. Такие виды применения включают этот способ получения терапевтических композиций, введение белка в терапевтической композиции и другие способы, описанные здесь. Предпочтительно, указанный здесь «очищенный» белок представляет собой белок, который можно получить любым способом (т.е. прямой очисткой из натурального источника, рекомбинантно или синтетически), и который был очищен от других белковых компонентов, так что белок содержит по меньшей мере примерно 80% масс./масс. общего белка в данной композиции, а предпочтительнее, по меньшей мере примерно 85%, и предпочтительнее, по меньшей мере примерно 90%, и предпочтительнее, по меньшей мере примерно 91%, и предпочтительнее, по меньшей мере примерно 92%, и предпочтительнее, по меньшей мере примерно 93%, и предпочтительнее, по меньшей мере примерно 94%, и предпочтительнее, по меньшей мере примерно 95%, и предпочтительнее, по меньшей мере примерно 96%, и предпочтительнее, по меньшей мере примерно 97%, и предпочтительнее, по меньшей мере примерно 98%, и предпочтительнее, по меньшей мере примерно 99% масс./масс. общего белка в данной композиции.
Используемый здесь термин «неочищенный белок» относится к белку, который может быть получен любым способом (например, прямой очисткой из натурального источника, рекомбинантно или синтетически), и который был очищен от других белковых компонентов, так что белок содержит менее чем примерно 80% масс./масс. общего белка в данной композиции.
В одном варианте осуществления описанный способ дополнительно включает третью стадию, именуемую «стадией (c)», на которой элюент неочищенного белка пропускают через мембранный поглотитель после стадии (b). В частности, стадию (c) можно проводить, когда элюент неочищенного белка, полученный в конце первой хроматографической стадии, непосредственно пропускают через вторую хроматографическую колонку. Мембранный поглотитель представляет собой форму хроматографической матрицы или фильтр, в котором используются мембраны с большими порами, а не микропористые частицы. Эти поры покрывают всю площадь фильтра и способствуют очень высокой скорости потока образца, а также оптимальное связывание целевых молекул в пределах внутренней структуры мембраны. Мембраны могут быть включены в центрифужные колонки, что обеспечивает возможность легкого и селективного отделения целевых белков из сложных растворов. Выгоды использования мембранного поглотителя состоят в том, что они так же эффективны как обычные хроматографические способы связывания загрязняющих веществ; они обеспечивают возможность высоких скоростей потока при переработке, они не требуют упаковки, поверки или очистки, и являются одноразовыми, но могут использоваться повторно. Устойчивые к соли мембраны обеспечивают возможность даже большего числа типов очистки. В определенных вариантах осуществления мембранный поглотитель представляет собой толерантный к взаимодействию с солью хроматографический мембранный поглотитель (например, мембранный поглотитель Satorius STIC) или Q мембранный поглотитель.
При очистке рекомбинантных белков для фармацевтических целей за хроматографическими стадиями обычно следуют стадии фильтрации. Поэтому способ по изобретению может дополнительно включать стадию нанофильтрации после стадии (b) или (c). Стадию ультрафильтрации и диафильтрации можно дополнительно проводить после стадии нанофильтрации. Используемый здесь термин «ультрафильтрация» или «UF» относится к технологии фильтрации с использованием полупроницаемой мембраны для физического и селективного удаления частиц и/или ионов из раствора на основании размера частиц и размера пор в UF мембране. Используемый здесь термин «нанофильтрация» относится к фильтрации раствора через нанофильтр, который используется для удаления, например, вирусных частиц. Используе