Терапевтическое применение агониста tlr и комбинированная терапия
Иллюстрации
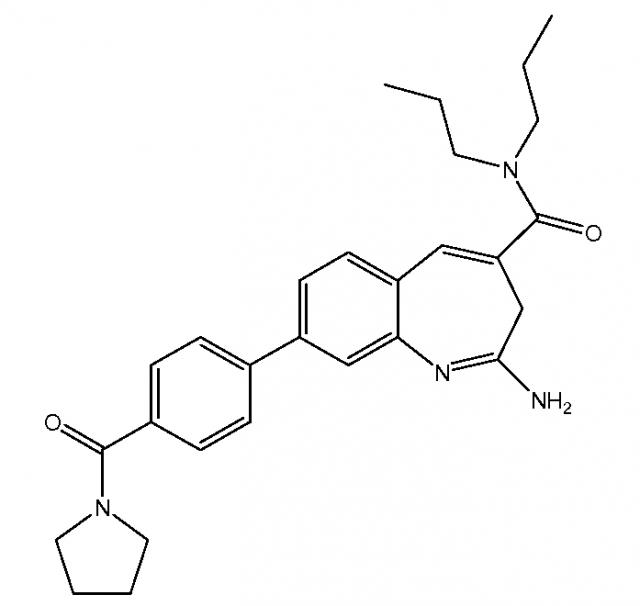
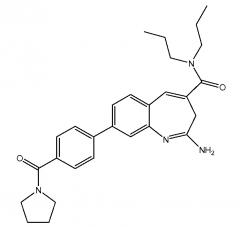
Показать всеГруппа изобретений касается химиотерапии. Предложены: способ лечения рака, включающий введение пациенту состава, содержащего бензо[b]азепиновый агонист TLR8 2-амино-N,N-дипропил-8-(4-(пирролидин-1-карбонил)фенил)-3Н-бензо[b]азепин-4-карбоксамид (VTX) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, в комбинации с доксорубицином, и набор для лечения рака, включающий контейнеры с указанными соединениями. Технический результат состоит в синергизме подавления объёма опухоли заявленным сочетанием VTX+ доксорубицин. 2 н. и 31 з.п. ф-лы, 2 табл., 24 ил.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка претендует на приоритет и привилегии предварительной заявки на патент США № 61/388953, поданной 1 октября 2010, предварительной заявки на патент США № 61/388967, поданной 1 октября 2010 и предварительной заявки на патент США № 61/390447, поданной 6 октября 2010, содержание которых включено в настоящую заявку в полном объеме с помощью ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение направлено на составы агониста TLR, предпочтительно агониста TLR8, и комбинированную терапию, включающую введение агониста TLR8 и противоракового агента, для применения в лечении рака.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Стимулирование иммунной системы, которое включает стимулирование врожденного иммунитета, адаптивного иммунитета, или обоих этих видов иммунитета, является сложным процессом, который может привести либо к защитному, либо к неблагоприятному физиологическому результату для организма хозяина. В последнее время появился повышенный интерес к механизмам, лежащим в основе врожденного иммунитета, которые, как полагают, инициируют или поддерживают адаптивный иммунитет. Этот интерес частично подогревался недавним открытием семейства рецепторных белков, распознающих высоко консервативные структуры патогенов, известных как toll-подобные рецепторы (TLRs), которые, как полагают, принимают участие во врожденном иммунитете, в качестве рецепторов молекулярных структур, связанных с патогенами (PAMPs). Таким образом, композиции и способы, применимые для модулирования врожденного иммунитета, вызывают огромный интерес, поскольку они могут влиять на терапевтические подходы к лечению болезненных состояний, в т.ч. рака, инфекционных заболеваний, аутоиммунных заболеваний, воспаления, аллергии, астмы, отторжения трансплантата, реакции трансплантата против хозяина (GvHD) и иммунодефицита.
Toll-подобные рецепторы (TLRs) представляют собой семейство трансмембранных белков I типа, активация которых in vivo инициирует врожденный иммунный ответ, в который вовлечены определенные цитокины, хемокины и факторы роста. Хотя все TLRs могут активировать некоторые внутриклеточные сигнальные молекулы, например, ядерный фактор каппа бета (NF-kB) и митоген-активируемые протеин киназы (MAP киназы), конкретный набор выделяющихся цитокинов и хемокинов, по-видимому, является уникальным для каждого вида TLR. TLR7, 8 и 9 входят в подсемейство TLRs, которые локализованы в эндосомальных или лизосомальных компартментах иммунных клеток, например, дендритных клеток и моноцитов. В противоположность TLR7 и 9, которые активно экспрессируются на плазмацитоидных дендритных клетках (pDC), TLR8 экспрессируются главным образом на миелоидных DC (mDC) и моноцитах. Это подсемейство опосредует распознавание микробных нуклеиновых кислот, например, одноцепочечных РНК. Агонисты TLR8 стимулируют выработку различных воспалительных цитокинов, в том числе интерлейкина-6, интерлейкина-12, фактора некроза опухолей-альфа и интерферона-гамма. Кроме того, эти агонисты способствуют повышенной экспрессии ко-стимулирующих молекул, например, CD40, CD80, CD83 и CD86, молекул главного комплекса гистосовместимости и хемокиновых рецепторов. Интерфероны типа I, т.е. IFNα и IFNβ также продуцируются клетками при активации агонистов TLR8.
Низкомолекулярные синтетические имидазолхинолины (с молекулярной массой менее 400 Дальтон), которые сходны с пуриновыми нуклеотидами аденозином и гуанозином, были первыми выявленными агонистами TLR7 и TLR8. Некоторые из этих соединений продемонстрировали противовирусные и противораковые свойства. Например, агонист TLR7 имиквимод (ALDARATM), был одобрен Управлением США по пищевым продуктам и лекарственным препаратам в качестве местного средства для лечения поражений кожи, вызванных определенными штаммами папиломавируса человека. Имиквимод может также применяться для лечения первичных раковых заболеваний кожи и кожных опухолей, например, базально-клеточных карцином, кератоакантом, актинического кератоза и болезни Бовена. Агонист TLR7/8 резиквимод (R-848) проходит апробацию в качестве местного средства для лечения генитального герпеса человека.
Доксорубицин является лекарственным средством, применяемым в химиотерапии для лечения рака. Он представляет собой антрациклиновый антибиотик, близко родственный природному продукту дауномицину, и подобно всем антрациклинам он действует за счет внедрения в структуру ДНК. Доксорубицин обычно применяется в лечении широкого круга раковых заболеваний, включая гематологические злокачественные заболевания, многие типы раковых заболеваний и саркомы мягких тканей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, главным образом, направлено на комбинированную терапию, включающую введение бензо[b]азепинового агониста TLR8 и одного или нескольких дополнительных средств лечения, например, противоракового агента (например, доксорубицина), предназначенную для применения в лечении, облегчении или профилактике рака, предпочтительно, солидных опухолей (например, сарком, карцином и лимфом) и для других применений, включая лечение лейкемий, лечение некоторых кожных заболеваний или состояний, например, атопического дерматита, лечения инфекционных заболеваний, предпочтительно, вирусных заболеваний, и для применения в качестве адъювантов в вакцинах, предназначенных для применения в терапии рака и в лечении инфекционных заболеваний. Конкретно, настоящее изобретение направлено на способы и композиции, включающие бензо[b]азепиновый агонист TLR8, а именно VTX-2337, и доксорубицин. В предпочтительных вариантах осуществления, VTX-2337 и доксорубицин применяются для лечения ракового заболевания, и это раковое заболевание выбрано из группы, состоящей из рака яичников, рака груди, рака головы и шейного отдела, рака почек, рака мочевого пузыря, гепатоклеточного рака, колоректального рака, меланомы и лимфомы или любой их комбинации.
Предпочтительно, VTX-2337 включают в состав в концентрации от примерно 0,001 мг/мл до примерно 50 мг/мл, от примерно 0,01 мг/мл до примерно 50 мг/мл, от примерно 0,5 мг/мл до примерно 50 мг/мл, от примерно 1 мг/мл до примерно 40 мг/мл или от примерно 2 мг/мл до примерно 15 мг/мл. В некоторых вариантах осуществления, VTX-2337 включают в состав в концентрации от примерно 0,5 мг/мл до примерно 10 мг/мл, от примерно 0,5 мг/мл до примерно 8 мг/мл, от примерно 0,5 мг/мл до примерно 6 мг/мл, от примерно 0,5 мг/мл до примерно 4 мг/мл, от примерно 0,5 мг/мл до примерно 2 мг/мл. В некоторых вариантах осуществления, VTX-2337 включают в состав в концентрации примерно 0,5 мг/мл, примерно 1 мг/мл, примерно 2 мг/мл, примерно 4 мг/мл, примерно 6 мг/мл, примерно 8 мг/мл, примерно 10 мг/мл, примерно 15 мг/мл, примерно 20 мг/мл, примерно 25 мг/мл, примерно 30 мг/мл, примерно 40 мг/мл или примерно 50 мг/мл. Предпочтительно, состав включает примерно 1-30%, 5-15% или 5-10% масса/объем циклодекстрина, предпочтительно, β-циклодекстрина и, наиболее предпочтительно, сульфобутилового эфира β-циклодекстрина. В некоторых вариантах осуществления, состав включает 1%, 5%, 10%, 15%, 20%, 25% или 30% масса/объем циклодекстрина, предпочтительно, β-циклодекстрина и, наиболее предпочтительно, сульфобутилового эфира β-циклодекстрина. В конкретном варианте осуществления, состав представляет собой водный раствор, включающий VTX-2337 в концентрации не менее 2 мг/мл. В другом варианте осуществления, состав включает 15% масса/объем циклодекстрина, предпочтительно, β-циклодекстрина и, наиболее предпочтительно, сульфобутилового эфира β-циклодекстрина. В предпочтительных вариантах осуществления, состав подходит для инъекции млекопитающему, предпочтительно, человеку. В конкретных вариантах осуществления, инъекцию осуществляют подкожным путем, внутримышечным путем или трансдермальным путем. В некоторых вариантах осуществления, состав подходит для внутривенного введения.
Предпочтительно, восстановленный состав по настоящему изобретению подходит для инъекции млекопитающему, предпочтительно, человеку. В конкретных вариантах осуществления, инъекцию осуществляют подкожным путем, внутримышечным путем или трансдермальным путем. В некоторых вариантах осуществления, состав подходит для внутривенного введения.
Далее, настоящее изобретение относится к способам лечения раковых заболеваний путем введения субъекту, предпочтительно, человеку, доксорубицина и агониста TLR8 VTX-2337, который содержит циклодекстрин. В предпочтительном варианте осуществления, VTX-2337 вводят в комбинации с одним или несколькими дополнительными средствами лечения, где указанные средства выбраны из химиотерапевтических агентов, цитокинов, антител, гормональной терапии или лучевой терапии. В одном из вариантов осуществления, VTX-2337 вводят в качестве компонента схемы лечения солидной опухоли. В другом варианте осуществления, солидная опухоль является одной из форм ракового заболевания, выбранного из рака яичника, рака груди, рака головы и шейного отдела, рака почек, рака мочевого пузыря, гепатоклеточного рака, колоректального рака или лимфомы, или любой комбинации перечисленных заболеваний. В одном из вариантов осуществления, VTX-2337 вводят в качестве компонента схемы лечения лимфомы. В одном из вариантов осуществления эта лимфома является ходжкинской лимфомой. В другом варианте осуществления, эта лимфома является неходжкинской лимфомой. В другом варианте осуществления, VTX-2337 применяется в качестве адъюванта вакцины для лечения рака. В некоторых вариантах осуществления способов лечения рака, VTX-2337 вводят инъекцией или внутривенно. В конкретных вариантах осуществления, инъекцию осуществляют подкожным путем, внутримышечным путем или трансдермальным путем. В конкретном варианте осуществления, состав вводят подкожной инъекцией.
В некоторых вариантах осуществления способов лечения рака, VTX-2337 вводят субъекту в дозировке от примерно 0,02 до 10 мг/кг (например, приблизительно 0,05-0,075 мг/кг или приблизительно от 0,04 до 5 мг/кг) массы тела субъекта. В некоторых вариантах осуществления, VTX-2337 вводят в дозировке примерно 0,02 мг/кг, примерно 0,05 мг/кг, примерно 1 мг/кг, примерно 2 мг/кг или примерно 5 мг/кг. Например, считая, что масса тела субъекта составляет приблизительно 70 кг, VTX-2337 вводят в количестве примерно 1,4-700 мг (например, 3,5-5,25 мг, или приблизительно 2,8-350 мг). В некоторых других вариантах осуществления, VTX-2337 вводят субъекту раз в неделю или раз в две недели.
Настоящее изобретение относится также к фармацевтической упаковке или набору, включающему один или несколько контейнеров, заполненных жидким или лиофилизированным VTX-2337 и противораковым агентом (например, доксорубицином) по настоящему изобретению, для лечения рака или одного или нескольких симптомов рака. Жидкий или лиофилизированный VTX-2337 и противораковый агент (например, доксорубицин) могут быть упакованы в один и тот же или различные контейнеры набора. Предпочтительно, состав VTX-2337 включает примерно 1-30%, 5-15% или 5-10% масса/объем циклодекстрина, предпочтительно, β-циклодекстрина и, наиболее предпочтительно, сульфобутилэфир β-циклодекстрина. В некоторых вариантах осуществления, состав VTX-2337 включает 2%, 5%, 10%, 15%, 20%, 25% или 30% масса/объем циклодекстрина, предпочтительно, β-циклодекстрина и, наиболее предпочтительно, сульфобутилового эфира β-циклодекстрина. В конкретном варианте осуществления, состав представляет собой водный состав VTX-2337. Предпочтительно, VTX-2337 включен в состав в концентрации не менее 2 мг/мл и состав, независимо от того, является ли он водным или восстановленным лиофилизированным составом, подходит для подкожной инъекции млекопитающим, предпочтительно, человеку.
В одном из вариантов осуществления, VTX-2337 входит в состав в концентрации не менее 2 мг/мл. Кроме того, этот состав подходит для введения субъекту, где субъект предпочтительно является человеком, с помощью инъекции, которая является подкожной, внутримышечной или трансдермальной инъекцией. В некоторых вариантах осуществления, VTX-2337 вводят субъекту в дозировке примерно от 0,02 до 10 мг/кг, примерно от 0,04 до 5 мг/кг или примерно 0,05-0,075 мг/кг. В некоторых других вариантах осуществления, VTX-2337 вводят субъекту раз в неделю или раз в две недели.
В предпочтительном варианте осуществления, VTX-2337 вводят в комбинации с одним или несколькими дополнительными средствами лечения, где эти средства выбраны из химиотерапевтических агентов, цитокинов, антител, гормональной терапии или лучевой терапии. Настоящее изобретение относится также к способам лечения инфекционных заболеваний, вызванных вирусом, где этот вирус является вирусом гепатита.
В предпочтительном варианте осуществления, доксорубицин включают в состав для инъекций, наиболее предпочтительно, для внутривенного введения. В некоторых вариантах осуществления, VTX-2337 согласно настоящему изобретению включают в состав для введения интрадермальным, трансдермальным, подкожным или внутримышечным путем.
В некоторых вариантах осуществления способов лечения рака, доксорубицин вводят субъекту в дозировке примерно от 0,02 до 10 мг/кг массы тела или примерно от 0,04 до 5 мг/кг массы тела субъекта.
Настоящее изобретение относится также к способу лечения рака с помощью составов бензо[b]азепинового агониста TLR8 в низких дозировках. Этот способ включает введение субъекту, у которого имеется такая необходимость, бензо[b]азепинового агониста TLR8 в дозировке менее 0,007 мг/кг/неделю, например, от 0,002 мг/кг/неделю до 0,006 мг/кг/неделю. В одном из вариантов осуществления, бензо[b]азепиновый агонист TLR8 представляет собой 2-амино-N,N-дипропил-8-(4-(пирролидин-1-карбонил)фенил)-3H-бензо[b]азепин-4-карбоксамид. Этот способ может включать введение бензо[b]азепинового агониста TLR8 в качестве единственного действующего ингредиента или дополнительно включает введение второго терапевтического агента, например, противоракового лекарственного средства в комбинации с составом бензо[b]азепинового агониста TLR8 в низкой дозировке. Упомянутый второй терапевтический агент может представлять собой другой бензо[b]азепиновый агонист TLR8 или молекулу лекарственного средства, раскрытого в настоящем изобретении (например, доксорубицин, гемцитабин или циклофосфамид). Этот способ можно также осуществлять в комбинации с одним или несколькими дополнительными средствами лечения (например, лучевой терапией) в схемах лечения раковых заболеваний.
В другом аспекте, настоящее изобретение относится также к дозированной форме для подкожного введения, включающей бензо[b]азепиновый агонист TLR8 для лечения рака у субъекта, где эта дозированная форма для подкожного введения, при введении человеку в дозировке 2-4 мг/м2 агониста, обеспечивает AUC0-inf агониста от примерно 55 до примерно 90 ч*нг/мл, например, от примерно 60 до примерно 80 ч*нг/мл.
В еще одном аспекте, настоящее изобретение относится также к дозированной форме для подкожного введения, включающей бензо[b]азепиновый агонист TLR8 для лечения рака у субъекта, где эта дозированная форма для подкожного введения, при введении человеку в дозировке 2-4 мг/м2 агониста, обеспечивает Cmax агониста от примерно 10 до примерно 30 нг/мл, например, от примерно 15 до примерно 25 нг/мл.
Изобретение относится также к фармацевтической композиции, включающей жидкий или лиофилизированный состав бензо[b]азепинового агониста TLR8 (например, VTX-2337) и противораковый агент (например, доксорубицин). Состав этого агониста и противораковый агент могут входить в одну и ту же фармацевтическую композицию или в различные композиции, и в последнем случае состав агониста и противораковый агент можно вводить одновременно или последовательно.
В приведенном выше описании в общих чертах изложены наиболее важные отличительные признаки настоящего изобретения, для того, чтобы можно было понять приведенное ниже подробное описание и для того, чтобы можно было лучше понять вклад настоящего изобретения в технику. Другие цели и отличительные признаки настоящего изобретения станут ясны из приведенного ниже подробного описания в сочетании с примерами.
ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
Фиг.1A представляет собой подборку FACS изображений, полученных для гематолимфоидных клеток мышей NSG-HIS. Мышам NSG вводили гематопоэтические стволовые клетки CD34+ человека, полученные из пуповинной крови. Показаны уровни энграфтмента (приживаемости) человеческих клеток (CD45+, CD45+CD14+, CD45+CD33). Мышам вводили 0,5 или 5 мг/кг VTX-2337. Показано созревание клеток CD14+ (CD83, CD86).
Фиг.1B представляет собой группу гистограмм, демонстрирующих изменение содержания маркеров активации (CD86+, MHC класса II) на моноцитах (CD45+ CD14+), mDC (CD45+ CD11c+) и pDC (CD45+ CD123+) через 6 часов после SC введения VTX-2337 мышам NSG-HIS.
Фиг.1C представляет собой группу гистограмм, демонстрирующих изменение уровней цитокинов в плазме (INF-g, TNF-альфа, IL-12 и IL-10) через 6 часов после SC введения VTX-2337 мышам NSG-HIS.
Фиг.2 представляет собой группу гистограмм, демонстрирующих изменение уровней цитокинов в плазме (INF-g, IL-10, TNF-альфа) у мышей, которым не вводили препараты (CTRL), вводили доксил в максимальной переносимой дозе (MTD, 50 мг/м2) или 5 мг/кг VTX-2337 через 5 дней после введения доксила.
Фиг.3A представляет собой схематическое изображение протокола введения доксила мышам NSG-HIS, VTX-2337 или их комбинации в модели гуманизированного мышиного (NSG-HIS) рака яичников, в которой для генерации опухоли использовались клетки рака яичника человека линии OVCAR5.
Фиг.3B представляет собой линейный график, демонстрирующий изменение размеров опухолей NSG-HIS у мышей, которым вводили доксил в дозировке 50 мг/м2, VTX-2337 в дозировке 0,5 мг/кг или их комбинацию с течением времени после прививки клеток OVCAR5.
Фиг.3C представляет подборку IHC изображений, демонстрирующих опухоли, в которые проникли клетки CD45+, из мышей, которым вводили Доксил в дозировке 50 мг/м2, VTX-2337 в дозировке 0,5 мг/кг или их комбинацию в модели гуманизированного рака яичников.
Фиг.3D представляет собой группу гистограмм, демонстрирующих изменение уровней проникающих в опухоль CD3+, CD8+, CD69+ активированных CD3+ CD8+ T клеток и CD40+ активированных макрофагов (CD45+ CD11b+), pDC (CD45+ CD123+) и mDC (CD45+ CD11c+) у мышей, которым вводили Доксил в дозировке 50 мг/м2, VTX-2337 в дозировке 0,5 мг/кг или их комбинаций в модели гуманизированного рака яичников.
Фиг.4A представляет собой линейный график, демонстрирующий изменения в числе импульсов в минуту (cpm) литических клеток OVCAR5, меченных 51Cr, подвергнутых лизису при действии TIL, извлеченных из мышей, которым вводили доксил или комбинацию VTX-2337 и доксила, в ответ на изменение отношения эффектора TIL к мишеням - клеткам OVCAR5.
Фиг.4B представляет собой линейный график, демонстрирующий изменения размера опухоли с течением времени у мышей NSG-HIS, которым прививали клетки OVCAR 5 и вводили адоптивно перенесенные TILS из мышей в эксперименте, описанном на фиг.3.
Фиг.4C представляет собой группу графиков, демонстрирующих изменения в числе импульсов литических клеток OVCAR5, меченных 51Cr, подвергнутых лизису при действии TIL, извлеченных из мышей, которым вводили доксил или комбинацию VTX-2337 и доксила, в отсутствие или присутствии антиМНС класса I (MHCI) нейтрализующего антитела.
Фиг.4D представляет собой группу гистограмм, демонстрирующих изменение уровней IFNg, высвободившегося под действием TIL, инкубированных с клетками OVCAR5 или клетками меланомы.
Фиг.5A представляет собой гистограмму, демонстрирующую изменение процентного содержания апоптотических клеток, окрашенных аннексином-V и 7AAD из числа клеток OVCAR5, обработанных кондиционированной средой из человеческих PBMCs, которые инкубировали с чистым буфером, гранулами CD3/CD28 или 1 мкг/мл VTX-2337.
Фиг.5B представляет собой гистограмму, демонстрирующую изменение количества живых клеток среди клеток OVCAR5, обработанных кондиционированной средой из человеческих PBMCs, которые инкубировали с чистым буфером, гранулами CD3/CD28 или 1 мкг/мл VTX-2337.
Фиг.5С представляет собой изображение, демонстрирующее пленку вестерн-блоттинга, показывающую экспрессию рецептора TNF-альфа 1 на клетках OVCAR5.
Фиг.5D представляет собой группу графиков, демонстрирующих FACS изображения клеток OVCAR5, обработанных TNFальфа (10 нг/мл) или Доксилом (1 мкг/мл) или их комбинацией, и итоговые изменения в процентном содержании апоптотических клеток, окрашенных аннексином-V и 7AAD.
Фиг.5E представляет собой изображение пленки вестерн-блоттинга экспрессии FLIPL на клетках OVCAR5, обработанных 0,5 или 2,5 мкг/мл Доксила.
Фиг.5F представляет собой группу графиков, демонстрирующих FACS изображения клеток OVCAR5, которые предварительно культивировали с 10 мкг/мл циклогексимида (cyclx) в течение 24 ч и затем обрабатывали 10 или 50 нг/мл TNFальфа, и итоговые изменения в процентном содержании апоптотических клеток, окрашенных аннексином-V и 7AAD.
Фиг.6 представляет собой группу графиков, демонстрирующих эффективность и селективность VTX-2337 в мононуклеарных клетках периферической крови (PBMCs) 15 здоровых доноров и также в клетках HEK293, трансфецированных TLR8 или TLR7 и NF-κB регулируемым геном-репортером.
Фиг.7 представляет собой группу графиков, демонстрирующих, что VTX-2337 стимулирует определенный набор цитокинов и хемокинов в цельной крови человека.
Фиг.8 представляет собой группу графиков, демонстрирующих, что VTX-2337 активирует моноциты и миелоидные дендритные клетки (mDCs), но не плазмацитоидные дендритные клетки (pDCs).
Фиг.9 представляет собой график, демонстрирующий фармакокинетику VTX-2337 после подкожного введения. Цифровые метки “1-8” на графике относятся к группам 1-8 соответственно.
Фиг.10A и 10B представляют собой графики, демонстрирующие устойчивую фармакодинамическую реакцию в течение неоднократных циклов введения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В приведенном ниже по тексту сопроводительном описании подробно изложены некоторые варианты осуществления настоящего изобретения. Хотя при практическом воплощении или тестировании настоящего изобретения могут применяться любые способы и материалы, аналогичные или эквивалентные описанным, в настоящей заявке приведены предпочтительные методики и материалы. Другие отличительные признаки, цели и преимущества настоящего изобретения будут ясны из приведенного описания. В данной заявке формы единственного числа включают также формы множественного числа, если контекст явно не указывает на противоположное. Если отсутствуют иные определения, все технические и научные термины, использованные в тексте, имеют те же значения, которые понимает под ними рядовой специалист в той области техники, к которой относится изобретение. В случае конфликта определений, приоритет имеет настоящее описание.
Настоящее изобретение относится к композициям и способам, в которых бензо[b]азепиновый агонист TLR8 (например, VTX-2337) и другое средство лечения (такое, как противораковый агент, например, доксорубицин) применяются для лечения, облегчения или профилактики раковых заболеваний или других расстройств, раскрытых в настоящей заявке. VTX-2337 представляет собой новый, мощный и селективный низкомолекулярный агонист TLR8. Составы VTX-2337 описаны в международной публикации PCT WO 10/014913. Составы по настоящему изобретению подходят для применения в способах лечения рака у людей, которые описаны в настоящей заявке.
Если не указано иное, следует понимать, что терминология, использованная в настоящей заявке, предназначена только для описания конкретных вариантов осуществления и не носит ограничивающего характера. Что касается данного описания и следующей за ним формулы изобретения, необходимо упомянуть ряд терминов, которые имеют приведенные ниже определения.
«Субъект» в контексте настоящего изобретения предпочтительно является млекопитающим. Млекопитающее может быть человеком, приматом, кроме человека, мышью, крысой, собакой, лошадью или коровой, но не ограничивается этими примерами. Субъект может быть мужского или женского пола. Субъект может быть субъектом, у которого ранее диагностировали или выявили наличие ракового заболевания и который необязательно уже подвергался или подвергается в настоящее время терапевтическому вмешательству с целью лечения рака, например, которому вводили Доксил или осуществляли лучевую терапию. В качестве альтернативы, субъект может являться таким субъектом, у которого ранее не диагностировали наличие ракового заболевания, но у которого имеется опасность развития такого заболевания. Например, субъект может являться таким субъектом, у которого проявляются один или несколько симптомов, характерных для рака.
Термины «заболевание», «расстройство» и «состояние» в настоящей заявке являются взаимозаменяемыми и относятся к любому нарушению нормальной деятельности организма или к появлению любого типа патологии. Этиологический агент, вызывающий это нарушение нормальной физиологии, может быть или не быть известен. Кроме того, хотя у двух пациентов может быть диагностировано одно и то же расстройство, конкретные симптомы, проявляющиеся у этих индивидуумов, могут быть или не быть идентичными.
Термин «лечение» в настоящем описании относится к уменьшению тяжести и/или частоты повторения симптомов, устранению симптомов и/или лежащей в их основе причины, предупреждению появления симптомов и/или лежащей в их основе причины, ослаблению или устранению угрозы. Например, лечение пациента путем введения противоракового агента по настоящему изобретению охватывает проведение химической профилактики у пациента, восприимчивого к развитию рака (например, имеющего повышенный риск развития рака в результате химической предрасположенности, факторов окружающей среды и т.п.), и/или людей, выживших после лечения рака, у которых имеется опасность рецидива, а также лечение ракового пациента, как за счет подавления, так и за счет обращения развития расстройства или заболевания.
Термины «облегчение» или «ослабление» в настоящем описании относятся к облегчению, как минимум, одного симптома заболевания, расстройства или состояния.
Термины «предупреждение» и «профилактика» в настоящем описании включают либо предотвращение, либо замедление наступления клинически очевидного развития заболевания, а также предотвращение или замедление наступления доклинически очевидной стадии заболевания у индивидуума, находящегося в зоне риска. Эти термины включают профилактическое лечение индивидуумов, у которых существует опасность развития заболевания.
При упоминании соединения по настоящему изобретению, заявители имеют в виду, что термин «соединение» охватывает не только указанную молекулу, но также ее фармацевтически приемлемые фармакологически активные аналоги, включая, но не ограничиваясь этим, соли, сложные эфиры, амиды, пролекарства, конъюгаты, активные метаболиты и другие подобные производные, аналоги и родственные соединения.
Под терминами «эффективное количество» и «терапевтически эффективное количество» соединения по настоящему изобретению подразумевается нетоксичное, но достаточное для обеспечения желаемого эффекта количество лекарственного средства или агента.
Под «фармацевтически приемлемым» подразумевается материал, который не является нежелательным ни с биологической, ни с какой-либо другой точки зрения, т.е. этот материал можно включить в фармацевтическую композицию, вводимую пациенту, не вызывая при этом какого-либо нежелательного биологического эффекта, или неблагоприятного взаимодействия с каким-либо другим компонентом композиции в которой содержится этот фармацевтически приемлемый материал. Если термин «фармацевтически приемлемый» используется в отношении фармацевтического носителя или эксципиента, подразумевается, что этот носитель или эксципиент соответствует требуемым стандартам токсикологических и производственных испытаний, или что он включен в Inactive Ingredient Guide (Руководство по неактивным ингредиентам), подготовленное Управлением по пищевым продуктам и лекарственным средствам США. Термин «фармакологически активный» (или просто «активный» или «действующий»), например, «фармакологически активное» производное или аналог, относится к производному или аналогу, имеющему тот же самый тип фармакологической активности, что и исходное соединение и в приблизительно эквивалентной степени.
Под фразой «при необходимости», например, «при необходимости введения» или «если имеется такая необходимость» подразумевается, что состав вводят пациенту, когда у него наблюдаются симптомы или если ожидается, что они появятся, или в любое время, когда пациент и/или лечащий врач думает, что следует лечить (терапевтически или профилактически) нежелательные симптомы (например, симптомы, возникающие при раке).
Агонисты TLR по настоящему изобретению
1.1 Состав
Составы VTX-2337 включают действующее соединение приведенной ниже структуры. Составы по настоящему изобретению подходят для подкожного введения субъекту, предпочтительно, субъекту из числа людей, но они могут применяться и для введения другими путями.
Составы VTX-2337 по настоящему изобретению включают один или несколько фармацевтически приемлемых эксципиентов. Термин «эксципиент» в настоящем описании, если говорить в общем, относится к биологически неактивному соединению, применяемому в комбинации с действующими ингредиентами состава. Эксципиент может применяться, например, в качестве солюбилизирующего агента, стабилизирующего агента, разбавителя, инертного носителя, консерванта, связующего вещества, дезинтегрирующего средства, покрытия, вкусоароматического агента или красителя. Предпочтительно, как минимум, один эксципиент выбран таким образом, чтобы придать составу одно или несколько полезных физических свойств, например, повышенную стабильность и/или растворимость действующего агента (агентов). В составах по настоящему изобретению, как указано в описании, основным действующим агентом является VTX-2337. Однако, VTX-2337 может быть включен в один состав с другими действующими агентами, например, другими агонистами TLR, противораковыми агентами или антивирусными агентами, как описано в настоящей заявке.
«Фармацевтически приемлемый» эксципиент представляет собой такой эксципиент, который был одобрен регулирующим органом штата или федерального государства для применения у млекопитающих и, предпочтительно, для применения людьми, или упомянут в фармакопее США, Европейской Фармакопее или другой общепризнанной фармакопее для применения у животных и, предпочтительно, для применения людьми.
Примеры эксципиентов включают некоторые инертные белки, например, альбумины; гидрофильные полимеры, например, поливинилпирролидон; аминокислоты, например, аспарагиновую кислоту (которая в качестве альтернативы может именоваться аспартатом), глутаминовую кислоту (которая в качестве альтернативы может именоваться глутаматом), лизин, аргинин, глицин и гистидин; жирные кислоты и фосфолипиды, например, алкилсульфонаты и каприлаты; ПАВ, например, натрий додецилсульфат и полисорбат; неионные ПАВ, например, TWEEN®, PLURONICS® или полиэтиленгликоль (ПЭГ); углеводы, например, глюкозу, сахарозу, маннозу, мальтозу, трегалозу, и декстрины, включая циклодекстрины; полиолы, например, маннит и сорбит; хелатообразующие агенты, например, ЭДТА; и противоионы, образующие соли, например, натрий.
Составы VTX-2337 могут содержать циклодекстрин, который увеличивает растворимость в воде агониста TLR. Циклодекстрины представляют собой кристаллические, негигроскопичные циклические олигомеры α-D-глюкопиранозы. В результате затрудненного вращения вокруг связей, соединяющих глюкопиранозные звенья, циклодекстрины имеют не цилиндрическую, а тороидальную форму. Из-за ограниченного вращения они имеют жесткую структуру с центральной полостью, размер которой меняется в соответствии с числом глюкопиранозных звеньев в молекуле. Тремя наиболее распространенными циклодекстринами являются α-циклодекстрин, β-циклодекстрин и γ-циклодекстрин, которые содержат шесть, семь или восемь глюкопиранозных звеньев, соответственно. Благодаря соответствующему расположению гидроксильных групп в молекуле циклодекстрина и форме молекулы, внутренняя поверхность полости является гидрофобной, тогда как внешняя поверхность является гидрофильной. Первичные гидроксильные группы расположены на более узкой (внутренней) стороне тороидальной молекулы, в то время как вторичные гидроксильные группы расположены на более широком (внешнем) краю. Это расположение позволяет размещать во внутренней полости циклодекстринов широкий круг небольших гидрофобных молекул за счет образования комплексов включения.
Циклодекстрины, которые подходят для применения в составах по настоящему изобретению, известны в технике. Например, TRAPPSOLTM и другие циклодекстрины производятся CTD, Inc. (High Springs, FL) и CAPTISOL® (сульфобутиловый эфир β-циклодекстрина) присутствует в имеющихся в продаже препаратах для инъекции, таких как ABILIFY IMTM, GEODON и VFEND IV. Предпочтительно, в составах по настоящему изобретению применяется CAPTISOL®.
Могут применяться другие водорастворимые агенты. Примеры подобных агентов включают полоксамер, повидон K17, повидон K12, твин 80, этанол, кремофор/этанол, полиэтиленгликоль 300, полиэтиленгликоль 400 и пропиленгликоль. В предпочтительных вариантах осуществления, составы по настоящему изобретению содержат менее 10% объем/объем таких агентов. В некоторых вариантах осуществления, применяется солюбилизирующие агенты на масляной основе, такие как липиодол или арахисовое масло.
В некоторых вариантах осуществления, составы VTX-2337 можно получать в жидкой или твердой форме, такой как порошок, таблетки, пилюли или капсулы. Жидкие составы могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и они могут содержать агенты, способствующие образованию состава данного типа, например, суспендирующие, стабилизирующие и/или диспергирующие агенты. В одном из вариантов осуществления, состав представляет собой водный раствор. В другом варианте осуществления, конечный состав является лиофилизированным. В следующих вариантах осуществления, состав включает коллоидные системы доставки лекарственных средств. Такие системы доставки лекарственных средств включают, например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы.
В одном из вариантов осуществления, VTX-2337 представляет собой жидкий или лиофилизированный состав, подходящий для инъекции млекопитающему, предпочтительно, человеку. В одном из вариантов осуществления, этот состав является стерильным. В другом варианте осуществления, состав является стерильным лиофилизированным составом, который подходит для инъекции после восстановления с помощью определенного количества водного носителя. В одном из вариантов осуществления, жидкий или лиофилизированный состав готовят в виде дозированной лекарственной формы, которая описана ниже. Составы могут содержать или не содержать консервант.
В некоторых вариантах осуществления, состав VTX-2337 дополнительно включает один или несколько адъювантов. Примеры подходящих адъювантов включают иммуностимуляторы, например, полученные из микробов (например, бактериальные продукты, токсины, например, холерный токсин и термолабильный токсин из E.coli, липиды, липопротеины, нуклеиновые кислоты, пептидогликаны, углеводы, пептиды), клетки, цитокины (например, дендритные клетки, IL-12 и GM-CSF), гормоны и малые молекулы. Применяемые в настоящем изобретении адъюванты включают, не ограничиваясь этим, адъюванты на масляной основе (например, адъювант Фрейнда), CpG олигонуклеотиды, адъюванты на основе солей алюминия, адъюванты на основе солей кальция, эмульсии и составы на основе ПАВ (например, MF59, ASO2, монтанид, ISA-51, ISA-720 и QA21).
Согласно некоторым вариантам осуществления, VTX-2337 включают в состав в концентрациях от примерно 0,5 до примерно 50 мг/мл. В некоторых вариантах осуществления, бензо[b]азепиновый агонист TLR включают в состав в концентрациях от примерно 1 мг/мл до примерно 5 мг/мл, от примерно 1 мг/мл до примерно 10 мг/мл, от примерно 1 мг/мл до примерно 20 мг/мл или от примерно 1 мг/мл до примерно 30 мг/мл. В других вариантах осуществления, VTX-2337 включают в состав в концентрациях о