Микрофлюидная система для контроля концентраций молекул для стимулирования клетки-мишени
Иллюстрации
Показать всеИзобретение относится к микрофлюидной системе и может быть использовано для количественного определения отклика живых клеток на определенные молекулы. Микрофлюидная система для управления картой концентраций молекул, пригодных для возбуждения клеток-мишеней, включает: микрофлюидное устройство (1); камеру (8) или дополнительный микрофлюидный канал, содержащий основание (6), предназначенное для приема клетки-мишени; микропористую мембрану (5), покрывающую сеть отверстий (47, 470); одно или несколько средств снабжения для снабжения одного или каждого из микрофлюидных каналов текучей средой, причем по меньшей мере одна из этих текучих сред содержит стимулирующие молекулы клетки-мишени. При этом микрофлюидное устройство содержит nc≥1 микрофлюидных каналов, снабженных по меньшей мере одним входным отверстием (21, 22) для текучей среды и по меньшей мере одним выходным отверстием для текучей среды; а также n0≥2 отверстий (47, 470) в микрофлюидном канале (4, 40) или распределенных по нескольким микрофлюидным каналам. При этом количества nc микрофлюидных каналов и n0 отверстий связаны соотношением , где 1<i<nc, a n0/ci - количество отверстий на канал Ci. Изобретение позволяет повысить точность анализов и сократить время проведения анализа. 14 з.п. ф-лы, 12 ил.
Реферат
Настоящее изобретение относится к области микрофлюидов.
Микрофлюид применяют в системах микрометрических размеров, величина которых в основном составляет от нескольких десятков до нескольких сотен микрон.
Эти системы находят свое применение в многочисленных областях, таких как испытания клеточной диагностики, разработка медикаментов, фундаментальная биология или косметология.
В этих областях существует все возрастающий запрос на микрофлюидные системы для количественного определения отклика живых клеток на определенные молекулы и, в частности, отклика на карту концентраций, контролируемую в пространстве и во времени.
Например, речь может идти об измерении отклика раковых клеток на молекулы, используемые для химиотерапии. Для точного определения этого отклика необходимо осуществлять контроль за применением молекул, которые будут порождать этот отклик. Этот контроль может относиться к количеству молекул, взаимодействующих с раковыми клетками, карте концентраций молекул которых раковые клетки подчиняются, к изменению во времени количества этих молекул и/или к карте концентраций этих молекул, применяемых для раковых клеток, и т.д.
В области косметологии микрофлюидные системы могут служить для испытаний на токсичность определенных молекул на живых клетках и/или на клеточных тканях. Контроль количества молекул, в известных случаях токсичных, вводимых в клетки, и способа, посредством которого эти молекулы вводят, необходим для определения порога токсичности.
Пример микрофлюидной системы, широко используемой для стимулирования живых клеток, представлен в документе US 7374906. Эта микрофлюидная система позволяет в значительной мере подчинить живые клетки градиенту концентраций молекул, карта которых здесь представляет собой линейный профиль, стабильный во времени. Большое неудобство этого типа микрофлюидной системы состоит в том, что живые клетки подчинены потоку, порождающему усилия искаженной деформации сдвига. Этот эффект деформации сдвига, в частности, создает помехи при попытке исследования хемотаксического отклика на конус роста нервных клеток. На самом деле, поток порождает напряжения, вызываемые деформацией сдвига, которые модифицируют отклик клеток-мишеней в лучших случаях, которые даже провоцируют гибель или отрывание клеток.
Физиологическое поведение живых клеток, исследуемых указанным образом, при использовании системы, изложенные в настоящем документе, было искажено.
Решения, которые, таким образом, были предложены для подчинения живых клеток карте концентраций молекул и/или сочетаниям нескольких карт концентраций для различных молекул так, чтобы они не были искажены потоком.
Одна такая микрофлюидная система, например, представлена в статье «Microfluidic device for the combinatorial application and maintenance of dynamically imposed diffusional gradients», R.L. Smith & al., (2010) 9: 613-622 («Микрофлюидное устройство для комбинаторного применения динамически налагаемых диффузионных градиентов», Р.Л. Смит и др. (2010), 9, стр. 613-622). Эта микрофлюидная система включает микрофлюидное устройство 100 и средства (не представленные) для снабжения устройства текучими средами.
Микрофлюидное устройство 100, раскрытое в настоящем документе, представлено на Фигуре 1, в виде перспективного изображения в разобранном виде.
Оно включает структуру, изготовленную из полидиметилсилоксана, в которой сформировано множество каналов снабжения текучей средой 130а, 130b, 130с, 130d, независимых друг от друга.
Самая верхняя стенка 120 каждого из этих каналов 130а, 130b, 130с, 130d содержит одно или несколько отверстий 110, пересекающих эту стенку. Со стороны стенки 120, противоположной микрофлюидным каналам, расположена культивационная камера 140, предназначенная для живых клеток, заполненная средой культуры 150, представленной в форме геля, такого как агароза. Таким образом, стенка 120 образует мембрану в той мере, в какой она позволяет разделять две среды, а именно микрофлюидные каналы 130а, 130b, 130с, 130d, по которым текучая среда должна циркулировать, а также культивационную камеру 140.
Стеклянная пластинка 160 позволяет закрывать культивационную камеру 140 в ее верхней части.
Средства снабжения текучими средами не представлены. Однако следует отметить, что в каждый из каналов 130а, 130b, 130с, 130d может быть введена одна или несколько текучих сред, причем эти текучие среды содержат молекулы, предназначенные для стимулирования живых клеток, таким образом, чтобы они проходили через стенки 120, образованные из PDMS, через отверстия для диффузии 110.
Для контроля культивирования живых клеток в пространстве можно с помощью микрофлюидного устройства 100 выбрать каналы, в которые можно отправлять текучую среду, содержащую стимулирующие молекулы живых клеток. Можно также точно выбирать отверстия 110, при прохождении которых эти молекулы будут диффундировать в культивационную камеру 140.
Наряду с этим, для контроля культивирования живых клеток во времени можно развести во времени снабжение текучей средой различных каналов 130а, 130b, 130с, 130d.
Устройство 100 также предоставляет возможность большой гибкости в выборе стимулирующих молекул, которые могут быть использованы в той мере, в какой в каждом из каналов снабжения текучей средой 130а, 130b, 130с, 130d предусмотрено средство снабжения, которое для него подходит.
Однако эта микрофлюидная система представляет некоторые неудобства. Необходимо использовать культивационную камеру 140, содержащую культурную среду 150 в форме геля, для предотвращения протекания текучей среды из каналов снабжения текучей средой в культивационную камеру.
В особых случаях в эффективно изготовленном и протестированном устройстве представлены квадратные отверстия размером 20 мкм × 20 мкм. Эти размеры являются достаточно важными и благоприятствуют прохождению текучей среды к культивационной камере 140.
Авторы уточняют, что могут быть воплощены квадратные отверстия 110 с меньшими размерами, например 4 мкм × 4 мкм. Тем не менее, используемая технология изготовления (DRIE, Deep Reactive Ion Etching, глубокое реактивное ионное травление (англ.)) предназначена для того, чтобы не допускать образования отверстий ниже максимального соотношения размеров, как правило, 1:20, причем это соотношение размеров определяется здесь соотношением между размерами со стороны отверстия на глубину этого отверстия. Для размеров, заданных со стороны отверстие 110, это максимальное соотношение размеров ограничивает глубину отверстия и, следовательно, гидравлическое сопротивление, которое может быть придано этому отверстию. Таким образом, повышается риск прохождения текучей среды из канала 130а, 130b, 130с, 130d к культивационной камере 140.
Что касается размеров отверстий, предполагается, таким образом, что текучая среда будет проходить к культивационной камере 140 в отсутствие культурной среды 150, имеющей форму геля.
Наряду с этим следует отметить, что необходимое присутствие геля привносит неудобства в функционирование микрофлюидного устройства 100.
На самом деле, гель замедляет диффузию стимулирующих молекул к живым клеткам-мишеням. Также стабилизация карты концентраций этих стимулирующих молекул внутри культивационной камеры 140 становится медленной.
Кроме того, следует отметить, что стимулирующие молекулы диффундируют в гель по всем направлениям.
Соответственно для каждого отверстия 110, взятого независимо от других, стимулирующие молекулы распределяются на уровне клетки-мишени, расположенной в геле, по поверхности, большей, чем поверхность канала отверстия 110, расположенного в стенке 120. Стимулирование клетки-мишени специфическими молекулами, таким образом, является менее точным, чем оно было теоретически установлено путем предварительного выбора для определения размеров отверстий. На уровне клетки-мишени, таким образом, теряется пространственное разрешение относительно пространственного разрешения, теоретически обеспечиваемого размерами отверстия. С другой стороны, следует отметить, что отверстия для диффузии 110 представляют определенную поверхностную плотность по поверхности стенки 120, которую с трудом можно повысить. В особых случаях расстояние между двумя смежными отверстиями, созданными в стенке 120 согласно PDMS, составляет 300-400 мкм.
С другой стороны, плотность отверстий 110, которые можно получать с помощью способа изготовления, используемого в настоящей работе, является ограниченной. На самом деле, способ DRIE, используемый в настоящей работе для изготовления микрофлюидного устройства, устанавливает пределы, относящиеся к плотности микрофлюидных каналов, которые могут быть получены. Каждый из этих микрофлюидных каналов согласно концепции выходит наружу, оканчиваясь единичным отверстием 110, в результате чего поверхностная плотность отверстий 110, таким образом, становится также ограниченной.
Это неудобство добавляется к тому факту, что точность стимулирования клетки-мишени теоретически определяется размерами отверстия, что отличается от точности, достигаемой в реальности на уровне клетки-мишени.
Целью изобретения является ослабление по меньшей мере одного из этих неудобств.
Для достижения этой цели в изобретении предложена микрофлюидная система для управления картой концентраций молекул, пригодных для стимулирования клетки-мишени, например, образованной за счет образования скопления живых клеток, характеризующаяся тем, что система включает:
- микрофлюидное устройство, содержащее:
nc≥1 микрофлюидных каналов, причем один или каждый из каналов снабжен по меньшей мере одним входным отверстием по меньшей мере для одной текучей среды и по меньшей мере одним выходным отверстием для этой текучей среды;
n0≥2 отверстий, образованных в микрофлюидном канале или распределенных по нескольким микрофлюидным каналам, причем упомянутые отверстия расположены в одной и той же плоскости таким образом, что они образуют сеть в этой плоскости, причем количества nc микрофлюидных каналов и n0 отверстий связаны соотношением , где 1≤i≤nc, a n0/ci - количество отверстий на канал Ci (термин Σ соответствует оператору «сумма»);
по меньшей мере одну микропористую мембрану, покрывающую сеть отверстий, причем клетка-мишень должна быть расположена со стороны мембраны, которая расположена напротив микрофлюидного (микрофлюидных) канала (каналов);
- одно или несколько средств снабжения текучей средой для снабжения одного или каждого микрофлюидного канала текучей средой, причем по меньшей мере одна из этих текучих сред содержит стимулирующие молекулы клетки-мишени.
Таким образом, когда средство снабжения подает в микрофлюидный канал или в каждый из микрофлюидных каналов по меньшей мере одну из указанных текучих сред, молекулы, пригодные для стимулирования клеток-мишеней, после прохождения по меньшей мере одной микропористой мембраны диффундируют через камеру или упомянутый дополнительный микрофлюидный канал, в результате чего можно контролировать карту концентраций молекул, пригодных для стимулирования клеток-мишеней в указанной камере или в указанном дополнительном микрофлюидном канале.
В системе могут быть предусмотрены и другие характерные технологии, взятые по отдельности или в сочетании друг с другом:
- микропористая мембрана снабжена порами, гидравлический диаметр которых составляет 0,05-12 мкм, предпочтительно 0,05-3 мкм;
- поверхностная плотность пор микропористой мембраны составляет 103-1010 пор/см2;
- микропористая мембрана выполнена из материала, выбранного из: стекла, поликарбоната, сложного полиэфира, полиэтилентерефталата, кварца, кремния, кремнезема или карбида кремния;
- предусмотрена крышка для микрофлюидных каналов, причем упомянутая крышка выполнена из материала, выбранного из: стекла или кремния, неэластомерного полимера с поперечными связями, образованными под действием облучения, металла, электропроводящего или полупроводникового сплава, керамики, кварца, сапфира, эластомера;
- в крышке образовано упомянутое по меньшей мере одно входное отверстие и упомянутое по меньшей мере одно выходное отверстие для текучих сред;
- каждый из микрофлюидных каналов содержит, по меньшей мере, стенку из фотоотверждаемой и/или термоотверждаемой смолы;
- предусмотрена закрытая культивационная камера для упомянутой клетки-мишени или микрофлюидный канал, расположенный со стороны микропористой мембраны, которая расположена напротив микрофлюидного (микрофлюидных) канала (каналов), причем клетка-мишень также находится в камере или в упомянутом другом микрофлюидном канале;
- камера или микрофлюидный канал включает основание, выполненное из оптически прозрачного материала, причем это основание расположено с другой стороны камеры или микрофлюидного канала относительно микропористой мембраны;
- камера или микрофлюидный канал включает боковые стенки из фотоотверждаемой и/или термоотверждаемой смолы;
- предусмотрено множество средств снабжения микрофлюидных каналов, причем каждое этих средств снабжения снабжает один из микрофлюидных каналов;
- предусмотрено средство оптической визуализации;
- в средстве оптической визуализации воплощена технология микроскопии локализации, осуществляемая за счет фотоактивации, или технология истощения носителями зарядов, осуществляемая за счет вынужденного излучения;
- отверстия образуют двумерную сеть в плоскости, которой они принадлежат;
- соответствующие центры двух смежных отверстий расположены друг от друга на расстоянии, составляющем 10-250 мкм.
Другие характеристики, цели и преимущества изобретения станут ясными из подробного описания, приведенного ниже со ссылкой на следующие Фигуры:
- Фигура 2 представляет собой схему микрофлюидного устройства, соответствующего изобретению, в виде частичного разреза перспективного изображения;
- Фигуры 3(a)-3(d) представляют собой, в зависимости от каждого конкретного случая, этапы процедуры изготовления микрофлюидного устройства, представленного на Фигуре 2, или промежуточные структуры, полученные по окончанию определенных этапов этой процедуры;
- Фигуры 4(а)-4(с) представляют собой промежуточные структуры, полученные в ходе изготовления комплекта, образованного основанием и боковыми стенками устройства, причем упомянутый комплект предназначен для образования части микрофлюидного устройства согласно Фигуре 2;
- Фигура 5(a) представляет собой текучие среды, текущие по микрофлюидным каналам микрофлюидного устройства согласно изобретению, представленному на Фигуре 2, причем одна из этих текучих сред содержит стимулирующие молекулы, предназначенные для клеток-мишеней, а Фигура 5(b) представляет собой профиль концентраций стимулирующих молекул в камере устройства согласно Фигуре 2;
- Фигура 6 представляет собой другое микрофлюидное устройство согласно изобретению, представленное в виде разреза;
- Фигуры 7(a), 7(b), 7′(а), 7′(b) и 7(с)-7(f) представляют собой этапы изготовления микрофлюидного устройства согласно Фигуре 6 или промежуточные структуры, полученные при изготовлении этого микрофлюидного устройства;
- Фигура 8 представляет собой схему, отображающую микрофлюидное устройство согласно Фигуре 6, представленную как частичный вид снизу;
- Фигура 9 представляет собой перспективное изображение микрофлюидных каналов микрофлюидного устройства согласно Фигуре 6, которые расположены таким образом, что каждый микрофлюидный канал содержит несколько отверстий;
- Фигура 10 представляет собой вид сверху микрофлюидных каналов микрофлюидного устройства согласно варианту Фигуры 6, причем эти каналы расположены таким образом, что каждый микрофлюидный канал содержит отверстие, выходящее на микропористую мембрану этого устройства;
- Фигура 11 представляет собой этап изготовления устройства, представленного на Фигуре 10;
- Фигуры 12(a)-12(d) представляют собой, в зависимости от каждого конкретного случая, этапы процедуры изготовления в соответствии с вариантом воплощения микрофлюидного устройства согласно изобретению или промежуточные структуры, полученные по окончанию определенных этапов этой процедуры.
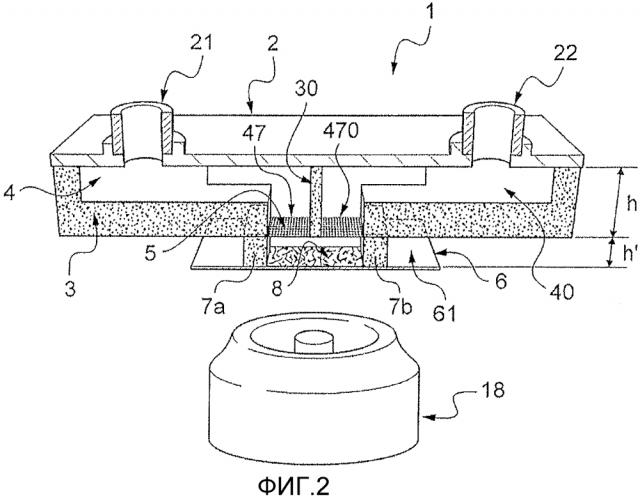
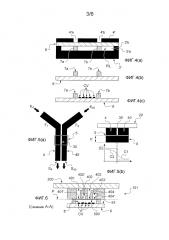
Для начала мы представляем микрофлюидное устройство 1 на основе Фигуры 2 согласно изобретению, содержащее два микрофлюидных канала, где каждый из этих каналов снабжен отверстиями, выходящими на мембрану, а также процедуру его изготовления согласно Фигурам 3(a)-3(d) и 4(а)-4(с).
Это микрофлюидное устройство 1 включает крышку 2, благоприятно жесткую, снабженную отверстиями 21, 22 для осуществления циркуляции текучих сред по микрофлюидным каналам, боковую стенку 3 и центральную стенку 30, обе из которых успешно выполнены из фотоотверждаемой и/или термоотверждаемой смолы. В частности, боковая стенка 3 устройства 1 установлена в единственном слое фотоотверждаемой и/или термоотверждаемой смолы.
Микрофлюидное устройство 1 включает также в своей нижней части два отверстия 47, 470, перекрытых микропористой мембраной 5, простирающейся перпендикулярно к основанию боковой стенки 3 и центральной стенки 30. Посредством отверстия 47, 470 можно достичь периферийной поверхности канала, который простирается между стенками устройства и который должен быть перекрыт мембраной 5. Отверстия 47, 470 расположены в одной и той же плоскости и могут быть включены в сеть отверстий, в данном случае по одному направлению в этой плоскости. В рамках изобретения термин «сеть» отверстий просто означает, что существует несколько отверстий, без необходимости в наличии связи между этими отверстиями и/или специального расположения этих отверстий в плоскости, которой они принадлежат.
Например, на Фигуре 1 отверстия 47, 470 обеспечены двумя различными микрофлюидными каналы и обязательно расположены в ряд в одной и той же плоскости. Напротив, в других вариантах воплощения, которые будут описаны ниже, определенные отверстия могут быть обеспечены одним и тем же каналом, и при этом отверстия расположены по двум направлениям в одной и той же плоскости.
Стенки 3, 30 и крышка 2 позволяют определить два микрофлюидных канала 4, 40, закрытых на уровне их соответствующих отверстий 47, 470 микропористой мембраной 5. Входы для текучей среды в каждом из этих каналов 4, 40 принадлежат соответственно отверстию 21 или 22. Выходы для текучей среды для этих микрофлюидных каналов не представлены.
Микропористая мембрана 5 разделяет две среды, а именно микрофлюидный канал и внешнюю среду этого канала, причем эта внешняя среда образована, например, в культивационной камере 8, в которой должна быть расположена клетка-мишень, которую необходимо стимулировать. С этой точки зрения следует отметить, что гель, используемый в статье Смита и др., не представляет собой мембрану, поскольку он не разделяет микрофлюидный канал и культивационную камеру, но напротив, образует культурную среду, заполняющую культивационную камеру.
Кроме того, микропористая мембрана 5 мешает текучей среде, которая должна течь по микрофлюидным каналам 4, 40, проходить с другой стороны от этой мембраны, однако, эта последняя допускает диффузию молекул, пригодных для стимулирования клеток-мишеней, пригодных для переноса текучей средой по меньшей мере в один из микрофлюидных каналов 4, 40, как это будет подробно разъяснено в описании в дальнейшем. Устройство 1 согласно изобретению не требует обязательного присутствия геля в культивационной камере 8. Микрофлюидное устройство 1 также включает основание 6, предпочтительно жесткое и прозрачное, и боковые стенки 7а, 7b, предпочтительно выполненные из фотоотверждаемой и/или термоотверждаемой смолы. Эти боковые стенки 7а, 7b, основание 6 и микропористая мембрана позволяют формировать камеру 8. Для образования камеры 8 предусмотрены четыре боковые стенки, причем эти стенки на самом деле могут быть включены в единый контур, поскольку процедура изготовления успешно позволяет создавать эти стенки как единое целое.
Дно камеры 8 образовано верхней поверхностью 61 основания 6, которое предназначено для приема клетки-мишени, например, образованной из живых клеток. В этом случае живые клетки должны быть расположены на расстоянии от микропористой мембраны 5 на основании 6 камеры 8. Их можно также культивировать в стандартных условиях, отдельно от микрофлюидного устройства 1.
Микрофлюидные каналы 4, 40 дают возможность заставить циркулировать текучую среду, содержащую молекулы, пригодные для стимулирования клеток-мишеней. Это осуществляется, как это будет более подробно разъяснено в дальнейшем описании, за счет диффузии через микропористую мембрану 5 по направлению к камере 8, затем за счет диффузии через камеру 8 (культивационную камеру) ко дну, где находятся, например, живые клетки (ЖК), которые исследуются на предмет их стимулирования.
Основание 6 успешно выполнено из оптически прозрачного материала, например стекла. Это представляет интерес, поскольку в таком случае можно разместить средство оптической визуализации 18 снаружи относительно устройства, например, для визуализации отклика на стимулирование живых клеток, расположенных на дне камеры 8. Крышка 2 может быть выполнена из материала, выбранного из: стекла или кремния, неэластомерного полимера с поперечными связями, образованными под действием облучения, металла, электропроводящего или полупроводникового сплава, керамики, кварца, сапфира, эластомера.
Микропористую мембрану 5 выбирают для предотвращения утечки текучей среды между микрофлюидными каналами 4, 40 и камерой 8. На самом деле, микропористая мембрана 5 не может быть полностью непроницаемой для прохождения текучей среды. Также можно считать, что клетки, находящиеся в камере 8, не подвержены влиянию никакого потока, если скорость прохождения текучей среды через микропористую мембрану 5 находится ниже предельного значения.
Можно, например, считать, что эта ограниченная скорость составляет порядка 1 мкм/с. В этом случае ограничения по деформации сдвига, налагаемые на клетки, являются незначительными.
Наряду с этим скорость в каждом микрофлюидном канале 4, 40 может составлять 100-10000 мкм/с и даже превышать 10000 мкм/с. Также для получения предельного значения 1 мкм/с, гидравлическое сопротивление Rh,мембрана микропористой мембраны 5 должно быть в зависимости от скорости текучей среды в канале 4, 40 в 100-10000 раз выше, чем гидравлическое сопротивление Rh,канал микрофлюидного канала 4, 40.
Например, если скорость течения текучей среды по микрофлюидному каналу 4, 40 составляет 10000 мкм/с, то должно соблюдаться неравенство:
для подтверждения того, что скорость текучей среды через мембрану 5 существенно ниже, чем предельное значение, считающееся равным 1 мкм/с.
Наряду с этим, если мы рассматриваем микрофлюидный канал 4, 40 как прямоугольный, с высотой h, шириной w и длиной L, а микропористую мембрану 5 с толщиной е, в которой имеются идентичные и цилиндрические поры с радиусом rпоры, с поверхностной плотностью пор ρ, то соотношение (R1) будет записано следующим образом:
таким образом:
Для микрофлюидного канала 4, 40 с высотой h=100 мкм, шириной w=1000 и длиной L=1000 мкм величина θ должна быть ниже 10-10 м для соответствия соотношению (R3). Кроме того, если считать поры цилиндрическими, с радиусом 1 мкм, а толщину мембраны - 10 мкм, то поверхностная плотность пор ρ должна быть ниже величины 105 пор/см2. Соотношение (R3), разумеется, может быть обобщено в виде функции рассматриваемой величины ограниченной скорости текучей среды, проходящей через микропористую мембрану 5, с одной стороны, и скорости течения этой текучей среды по микрофлюидному каналу 4, 40, - с другой.
В микропористой мембране 5 могут присутствовать поры, гидравлический диаметр которых составляет 0,05-12 мкм. В частности, если пора является цилиндрической, то гидравлический диаметр поры соответствует ее диаметру.
Однако является предпочтительным, чтобы этот гидравлический диаметр составлял 0,05-3 мкм. На самом деле, следует отметить, что использование мембраны, имеющей поры, гидравлический диаметр которых составляет менее 3 мкм, позволяет избежать утечки потока в камеру 8 для большинства условий использования, которые могут встретиться. В настоящее время изготовители мембран предлагают на рынке мембраны, гидравлический диаметр которых пор обычно составляет более 0,2 мкм. В рамках изобретения в порах, таким образом, могут быть представлены поры с гидравлическими диаметрами, составляющими предпочтительно 0,2-3 мкм. Однако теоретически нижнего предела для гидравлического диаметра пор не существует и этим объясняется, почему может быть реальным воплощение на практике пор, гидравлический диаметр которых достигает 0,05 мкм.
При использовании пор, гидравлический диаметр которых превышает 3 мкм, использование микрофлюидного устройства априори является более тонким способом (например, при выборе расходов течения в микрофлюидном канале 4, 40), чтобы убедиться в том, что текучая среда не проходит через микропористую мембрану 5. Однако следует отметить, что повышение этого гидравлического диаметра сопровождается уменьшением количества пор мембраны, связанной с каждым из отверстий 47, 470, перекрытых мембраной 5. Или же это уменьшение количества пор в мембране, приходящейся на отверстие, благоприятствует повышению гидравлического сопротивления через каждое отверстие микрофлюидного устройства.
По этой причине представляется реальным использование пор, гидравлический диаметр которых будет превышать 3 мкм, ограничивая предусматриваемый диапазон расходов текучей среды по микрофлюидным каналам.
В устройстве согласно Смиту и др. отверстие обязательно соответствует одному и единственному диффузионному отверстию, поскольку отсутствует какая-либо мембрана, точно соответствующая той, какая предложена в изобретении. Следовательно, гидравлическое сопротивление зависит от диаметра самого отверстия в устройстве согласно Смиту и др.
Воплощение микропористой мембраны 5 представляется, таким образом, реально выгодным, поскольку она позволяет обойтись без геля и без неудобств, которые этот гель вызывает.
Что касается плотности пор микропористой мембраны 5, то она может составлять 103-1010 пор/см2. Высота пор может составлять 50 нм и 100 мкм.
Наряду с этим микропористая мембрана 5 может быть выполнена из различных материалов, таких как: стекло, кварц, кремний, кремнезем или карбид кремния, а также из полимеров, имеющих ту же природу, что и полимеры, пригодные для использования для остальной части микрофлюидного устройства. Можно также использовать поликарбонат, полиэстер или полиэтилентерефталат.
Согласно первому примеру можно предусмотреть наличие микропористой мембраны 5, изготовленной из поликарбоната, диаметр пор которой составляет 0,2-1 мкм, например, типа циклопоры, изготавливаемой компанией Ватман (Whatman Cyclopore™). Согласно второму примеру можно предусмотреть наличие микропористой мембраны 5, изготовленной из полиэстера, диаметр пор которой составляет 0,4-3 мкм, например типа пор Трансвелла, изготавливаемых компанией Корнинг (Corning® Transwell®). Согласно третьему примеру можно предусмотреть наличие микропористой мембраны 5, изготовленной из полиэтилентерефталата, диаметр пор которой составляет 0,4-8 мкм, например, типа «трековых» мембран, изготавливаемых компанией Бектон Диккинсон.
Эти микропористые мембраны демонстрируют преимущество, состоящее в том, что они совместимы с процедурой изготовления микрофлюидного устройства 1, которое будет описано ниже со ссылкой на Фигуры 3(a)-3(d). Они также демонстрируют преимущество, состоящее в том, что они являются биосовместимыми и функционально пригодными для того, чтобы быть проницаемыми специально для различных молекул. Под функциональной пригодностью понимается, что микропористую мембрану 5 можно химически модифицировать таким образом, чтобы она исполняла определенную функцию (сдерживания определенных веществ, химических реакций и т.д.).
В общем виде, устройство может иметь следующие размеры. Высота h микрофлюидного канала может составлять 1-1000 мкм, предпочтительно 10-200 мкм. Его ширина (не представлена) может составлять 10-2 мм. Высота h′ камеры 8 может составлять 10-1000 мкм, предпочтительно 50-200 мкм. Наряду с этим, расстояние между входом Е и выходом S составляет несколько сантиметров.
С микрофлюидным устройством может быть связано одно средство оптической визуализации 18, как было указано ранее. Это средство оптической визуализации 18 позволяет распознавать карту концентраций стимулирующих молекул, применяемых для клеток-мишеней. Оно позволяет также осуществлять функциональное формирование изображения биологического отклика клеток на стимулирующие молекулы. Таким образом, оно является намного более удобным для экспериментального осуществления корреляций между наблюдаемым поведением клеток-мишеней и картой концентраций, которые для них применяются.
Эта наблюдение можно осуществлять при высоком пространственном разрешении, поскольку основание из оптически прозрачного материала может быть очень тонким. Например, можно осуществлять микроскопию флуоресценции при высоком разрешении и даже при сверхвысоком разрешении с помощью таких технологий, как микроскопия локализации, осуществляемой за счет фотоактивации (PALM, «Photo-Activated Localized Microscopy», микроскопия фотоактивационной локализации согласно англосаксонской терминологии), или технология истощения носителями зарядов, осуществляемая за счет вынужденного излучения (STED, «Stimulated-Emission-Depletion», микроскопия на основе подавления спонтанного испускания), при использовании, например, основания, образованного из тонкой пластинки стекла толщиной 150 мкм.
Примером процедуры изготовления микрофлюидного устройства 1 согласно изобретению является процедура, которая содержит, по меньшей мере, этапы, состоящие в:
(a) использовании штемпеля 1′, изготовленного из эластомерного материала для вдавливания фотоотверждаемой и/или термоотверждаемой жидкости, расположенной на опоре 2′, снабженной микропористой мембраной 5;
(b) фотооблучении и/или нагреве жидкости для формирования, с одной стороны, первой боковой стенки 3, прикрытой у ее основания микропористой мембраной 5, а с другой стороны, центральной стенки 30, находящейся в контакте с мембраной 5;
(c) приклеивании крышки 2, снабженной отверстиями (не представлены), к первой боковой стенке 3 и к центральной стенке 30, со стороны, противоположной опоре 2′, для формирования микрофлюидных каналов 4, 40, по каждому из которых может циркулировать текучая среда;
(d) после извлечения опоры 2′ наклеивании на высвободившиеся части первой боковой стенки 3 и центральной стенки 30, досягаемые для опоры 2′ на углублении, комплекта, содержащего, по меньшей мере, основание 6 и упомянутые по меньшей мере две вторые боковые стенки 7а, 7b из фотоотверждаемой и/или термоотверждаемой смолы для образования камеры 8.
Эта технология основана на технологии, раскрытой в документе WO 2008/009803.
Эффективное функционирование в ходе этапа (а) представлено на Фигуре 3(a).
Штемпель 1′, используемый в ходе этапа (а), может быть изготовлен из эластомерного материала, такого как полидиметилсилоксан. Он содержит профиль, используемый как матрицу, дополнительную к матрице микрофлюидного устройства 1, которую требуется создать. Штемпель 1′ содержит также выступ 1′а, снабженный вертикальной прорезью 1′с для образования центральной стенки 30 микрофлюидного устройства 1, которую требуется получить. Он также содержит полую зону 1′b, окружающую выступ 1′а, зона в котором предназначена для формирования упомянутой первой боковой стенки 3 микрофлюидного устройства 1. Опора 2′ также может быть выполнена из полидиметилсилоксана и представляет собой плоскость профиля.
Микропористую мембрану 5 предварительно устанавливают на опоре 2′, затем штемпель 1′ прижимают к опоре 2′. Штемпель 1′ прижимают к мембране 5, так же как и к опоре 2′, через прокладку выступа а. Затем заполняют объем, расположенный между штемпелем 1′ и опорой 2′, в требуемых количествах, а именно в полой зоне 1′b штемпеля 1′ и в прорези, созданной в выступе а, например, с использованием фотосшиваемой и/или фотополимеризуемой смолы в форме жидкой смолы ЖС. Это заполнение не изменяет положения микропористой мембраны 5, поскольку последняя зажата между штемпелем 1′ и опорой 2′.
Фотосшиваемая и/или фотополимеризуемая смола представляет собой раствор или дисперсию на основе мономеров и/или предполимеров. В способе согласно изобретению используют фотосшиваемые и/или фотополимеризуемые смолы, обычно используемые в качестве адгезивов, клеев или облицовочных материалов для поверхности. Является предпочтительным, чтобы были выбраны адгезивы, клеи или облицовочные материалы для поверхности, используемые, как правило, в области оптики. Такие смолы, когда их подвергают облучению и фотосшиванию и/или фотополимеризации, становятся твердыми. Является предпочтительным, чтобы твердое тело, образованное указанным способом, было прозрачным и лишенным пузырьков или любых других дефектов.
Такие смолы обычно созданы на основе мономеров/сомономеров/предполимеров типа эпоксидной смолы, эпоксисилана, акрилата, метакрилата, акриловой кислоты, метакриловой кислоты, но также можно еще упомянуть тиоленовые, полиуретановые, уретан-акрилатные смолы. Смолы могут быть заменены фотосшиваемыми водными гелями, такими как гели полиакриламида, и они выбраны, поскольку они являются жидкими при комнатной температуре. Смолы также могут быть заменены полидиметилсилоксаном.
Среди фотосшиваемых смол, используемых в настоящем изобретении, можно упомянуть продукцию, выпускаемую компанией Norland Optics под маркой NOA® Norland Optical Adhesives (оптические адгезивы компании Норланд), такие как, например, продукты NOA81 и NOA60, продукты, выпускаемые компанией Dymax под маркой «Dymax Adhesive and light curing Systems» («адгезивы компании Димакс и светоотверждающие системы»), продукты, выпускаемые компанией Bohle под маркой «UV adhesives» («ультрафиолетовые адгезивы»), продукты, выпускаемые компанией Sartomer под коммерческими номерами SR492 и SR499. Полимеризацию и/или поперечное сшивание этих смол осуществляют путем фотоактивации с помощью любых подходящих средств, таких как облучение рентгеновским, ультрафиолетовым, видимым, инфракрасным излучением.
Преимущественно выбирают смолу, которая, будучи полимеризованной и/или поперечно-сшитой, является жесткой и непластичной, поскольку эластомерные смолы имеют тенденцию к деформации, когда она заставляет циркулировать текучие среды по микрофлюидному устройству 1 под давлением. Тем не менее, для определенных применений, таких как исследование эластичности живых клеток, использование фотосшиваемых эластомерных смол не исключается.
После заполнения объема, расположенного между штемпелем 1′ и опорой 2′ жидкой смолой (ЖС), применяют приложение давления Р к штемпелю 1′, для удаления случайных излишков смолы. На Фигуре 2 выступающие части, а именно выступ 1′а штемпеля 1′, созданного из эластомера, находятся в контакте с опорой 2′. Жидкая смола принимает форму полых зон штемпеля 1′.
Структура, полученная по завершению этапа (b), представлена на Фигуре 3(b).
В ходе этапа (b) облучение смолы осуществляют по оси, перпендикулярной к основанию устройства, проходящей сквозь штемпель 1′. Облучение должно быть дозированным таким образом, чтобы по желанию можно было бы оставлять на поверхности первой боковой стенки 3 и центральной стенки 30, изготовленных из смол, активные участки для полимеризации и/или для поперечного сшивания. Затем штемпель 1′ снимают с устройства. На Фигуре 3(b) можно наблюдать первую боковую стенку 3, изготовленную из смолы, подвергнутой фотополимеризации и/или фотосшиванию, с профилем, дополняющим профиль полых зон штемпеля 1′. На той же самой Фигуре можно наблюдать также центральную стенку 30, которая позволяет разделять микрофлюидные каналы 4, 40.
Отпечаток, сделанный с помощью штемпеля 1′, изготовлен