Способ получения нитрата церия (iv)
Иллюстрации
Показать всеИзобретение относится к способу получения нитрата церия (IV) электрохимическим окислением нитрата церия (III) в анодной камере электролизера, содержащей раствор с начальной концентрацией ионов церия (III) 100-130 г/л и начальной концентрацией свободной азотной кислоты в анолите и в католите 8-12 г/л, при плотности тока на платинированном ниобиевом аноде 1-3 А/дм2. Способ характеризуется тем, что процесс электролитического окисления ионов церия (III) проводят в анодной камере трехкамерного электролизера, отделенной от двух катодных камер анионообменной и катионообменной мембранами, причем в анодной камере поддерживают постоянную концентрацию свободной азотной кислоты 8-12 г/л, а по окончании очередного цикла электролиза в раствор из катодной камеры, отделенной от анодной камеры катионообменной мембраной, добавляют нитрат церия (III), концентрированную азотную кислоту и воду и используют в качестве анолита для следующего цикла электролиза. Использование предлагаемого способа позволяет устранить потери ионов церия за счет их переноса из анолита в католит. 2 пр., 2 табл.
Реферат
Изобретение относится к электрохимии, конкретно - к электрохимическим способам получения нитрата церия (IV) из нитрата церия (III), и может быть использовано для разделения редкоземельных элементов и получения реагента для окисления органических веществ.
Известен способ получения четырехвалентного церия электрохимическим окислением нитрата церия (III) в азотно-кислом растворе. Электроокисление проводили в проточном мембранном электролизере фильтр-прессного типа, с анионообменной мембраной МА-41. В качестве анода использовали платиновую пластину, в качестве катода - титановую пластину [Седнева Т.А., Тихомирова И.А. Окисление церия в мембранном электролизере. - Апатиты. 2002 - 11 с. - Деп. в ВИНИТИ 12.08.2002, №1475-В2002]. Оптимальная плотность тока для окисления церия (III) с концентрацией металла порядка 63 г/л в электролите без перемешивания лежит в интервале 5,0-7,5 А/дм2 при интегральном выходе по току 58,7-31,4% соответственно.
Недостатком данного способа являются достаточно низкий интегральный выход по току и растворение платинового анода.
Наиболее близким по технической сущности является способ получения нитрата церия (IV) электрохимическим окислением нитрата церия (III) [Поздеев С.С., Кондратьева Е.С., Губин А.Ф. Электрохимическое получение ионов церия (IV) для применения в процессе очистки сточных вод от органических примесей// Гальванотехника и обработка поверхности 2014. - т. 22. - №4. - С. 37-39]. Согласно этому процессу в качестве анода используют ниобий, покрытый тонким слоем платины (платинированный ниобиевый анод), помещенный в анодную камеру двухкамерного электролизера с анионообменной мембраной МА-41ИЛ. При этом начальный состав электролита в катодной камере электролизера - раствор азотной кислоты с концентрацией 10 г/л. Начальный состав электролита в анодной камере - раствор нитрата церия (III) с концентрацией металла 115 г/л, содержащий 10 г/л свободной азотной кислоты.
Этот способ имеет следующий недостаток - в процессе электролиза анионы нитрата переносятся из катодной камеры в анодную. Поэтому концентрация свободной азотной кислоты в анолите непрерывно увеличивается и достигает значения свыше 30 г/л. Такое увеличение концентрации снижает устойчивость платинового покрытия и ведет к его постепенному стравливанию.
Технической задачей данного изобретения является предотвращение роста концентрации свободной азотной кислоты в анолите и устранение потерь ионов церия (III) и (IV) в результате их переноса в католит через катионообменную мембрану.
Поставленная задача решается в настоящем изобретении сочетанием следующих приемов:
(1) Предотвращение роста концентрации азотной кислоты в анолите достигается за счет проведения процесса получения нитрата церия (IV) электрохимическим окислением нитрата церия (III) при плотности тока 1-3 А/дм2 на платинированном ниобиевом аноде, находящемся в анодной камере трехкамерного электролизера с двумя катодными камерами, одна из которых отделена от анодной камеры анионообменной мембраной, а вторая - катионообменной мембраной.
(2) Для устранения потерь ионов церия по окончании очередного цикла электролиза новую порцию анолита для следующего цикла электролиза готовят путем добавления нитрата церия (III), концентрированной азотной кислоты и воды к раствору, образовавшемуся в ходе предшествующего цикла электролиза в катодной камере, отделенной от анодной камеры катионообменной мембраной.
При этом во избежание роста напряжения на электролизере и для предотвращения увеличения расхода электроэнергии на процесс получения нитрата церия (IV) периодически контролируют концентрацию свободной азотной кислоты в катодной камере с анионообменной мембраной и, при необходимости, католит корректируют добавлением азотной кислоты, поддерживая ее концентрацию в пределах 8-12 г/л.
Изобретение иллюстрируют следующие примеры.
Пример 1.
Эксперименты по электрохимическому окислению ионов церия (III) согласно известному способу проводили в двухкамерном электролизере мембранного типа при анодной плотности тока 2 А/дм2. В качестве анода использовали платинированный ниобий, в качестве катода - листовой титан марки ВТ1-0, для разделения катодного и анодного пространств используют анионообменную мембрану марки МА-41ИЛ. Площади электродов и мембраны были одинаковы и составляли 0,225 дм2. Растворы анолита (азотнокислый церий на фоне азотной кислоты) и католита (азотная кислота) циркулировали в камерах электролизера со скоростью 13,8 л/час. Объемы анолита - 0,2 л, объем каждого католита - 0,16 л. Начальная концентрация азотной кислоты в анолите и католитах составляла 10 г/л, концентрация церия (III) в анолите - 115 г/л.
Концентрацию церия определяли титрованием раствором соли Мора в присутствии индикатора - наполовину окисленного дифениламин-4-сульфокислоты натриевая соль (ДАС). Концентрацию азотной кислоты определяли кислотно-основным титрованием по методике, описанной в литературе.
Для количественной оценки протекания процесса использовали величины выхода по току (ВТ) и степень окисления (α, %).
Величину выхода по току рассчитывали по формуле:
BT=Qтеор/Qпракт·100, %,
где Qпракт - количество электричества, затраченное на окисление, А·ч;
Qтеор - теоретическое количество электричества необходимое на окисление, рассчитанное по закону Фарадея, А·ч.
Qтеор.=C(Ce4+)·V/q,
где C(Ce4+) - текущая концентрация ионов Ce4+ в растворе, г/л;
V - объем обрабатываемого раствора, л;
q - электрохимический эквивалент, который равен в данном случае 5,224 г·экв/(А·ч).
Qпракт=I·t,
где I - сила тока между электродами, A;
t - время электролиза, ч.
Величину степени окисления вещества рассчитывали по формуле:
α=C(Ce4+)/C(Ce исх) 100, %,
где C(Ce исх) - общая концентрация церия в обрабатываемом растворе, г/л.
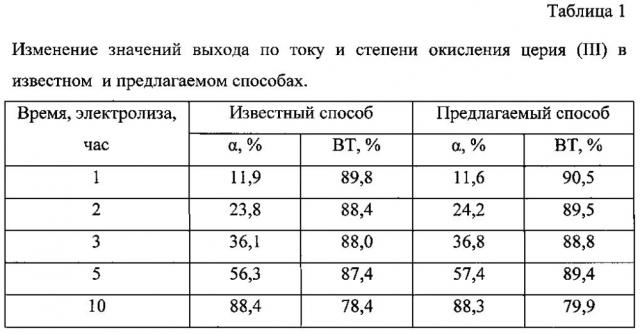
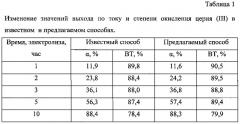
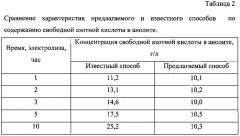
Через заданные промежутки времени (1, 2, 3, 5 и 10 часов после начала электролиза) из анодной камеры были отобраны пробы для определения концентрации церия (IV) с целью расчета степени окисления и выхода по току (таблица 1), а также для определения концентрации свободной азотной кислоты (таблица 2).
Из представленных данных видно, что в ходе электролиза происходит увеличение концентрации кислоты, к концу электролиза остаточное содержание свободной азотной кислоты в анолите составляло 30 г/л, что недопустимо для эксплуатации платинового покрытия.
Пример 2.
Эксперименты по электрохимическому окислению ионов церия (III) проводили в трехкамерном электролизере мембранного типа с одной катионообменной (МК-40Л) и одной анионообменной (МА-41ИЛ) мембранами при анодной плотности тока 2 А/дм2. В качестве электродов использовали платинированный ниобиевый анод с поверхностью 0,225 дм2 и два титановых катода марки ВТ1-0 с поверхностью по 0,225 дм2 каждый. Анолит - раствор азотнокислого церия (III) с начальной концентрацией 115 г/л и азотной кислоты 10 г/л циркулировал между анодной камерой электролизера и вспомогательной емкостью со скоростью 13,8 л/час. В катодные камеры помещали по 0,16 л раствора с начальной концентрацией свободной азотной кислоты 10 г/л.
Через заданные промежутки времени (1, 2, 3, 5 и 10 часов после начала электролиза) из анодной камеры были отобраны пробы для определения концентрации церия (IV) с целью расчета степени окисления и выхода по току (таблица 1), а также для определения концентрации свободной азотной кислоты (таблица 2).
Сравнительные результаты известного и предлагаемого способа представлены в таблице 2. Видно, что при использовании трехкамерного электролизера концентрация кислоты в анолите поддерживается постоянной.
Способ получения нитрата церия (IV) электрохимическим окислением нитрата церия (III) в анодной камере электролизера, содержащей раствор с начальной концентрацией ионов церия (III) 100-130 г/л и начальной концентрацией свободной азотной кислоты в анолите и в католите 8-12 г/л, при плотности тока на платинированном ниобиевом аноде 1-3 А/дм2, отличающийся тем, что процесс электролитического окисления ионов церия (III) проводят в анодной камере трехкамерного электролизера, отделенной от двух катодных камер анионообменной и катионообменной мембранами, причем в анодной камере поддерживают постоянную концентрацию свободной азотной кислоты 8-12 г/л, а по окончании очередного цикла электролиза в раствор из катодной камеры, отделенной от анодной камеры катионообменной мембраной, добавляют нитрат церия (III), концентрированную азотную кислоту и воду и используют в качестве анолита для следующего цикла электролиза.