Палладиевый катализатор, способ его приготовления и способ получения янтарной кислоты
Иллюстрации
Показать всеИзобретение относится к области приготовления палладиевых катализаторов, которые могут быть использованы для гидрирования органических электролитов с ненасыщенными С-С связями в молекулах, в частности, для селективного гидрирования малеиновой кислоты в янтарную кислоту в водной среде. Катализатор представляет собой наночастицы палладия с размерами 1.2-5 нм, которые нанесены в количестве 0.1-2.5 мас. % на порошковые носители различной химической природы (Al2O3, SiO2, TiO2, ZrO2, Сибунит), имеющие относительно низкую удельную поверхность 2-455 м2/г, что минимизирует влияние диффузии реагентов, обусловленной существованием адсорбированных сольватных слоев и двойного электрического слоя на поверхности носителя, на скорость каталитического процесса. Требуемое дисперсное состояние наночастиц палладия достигается тем, что гидролитическое осаждение палладия на носитель из растворов H2PdCl4 осуществляют при pH 9-9.5 непосредственно в присутствии носителя с последующим жидкофазным восстановлением катализатора, что позволяет достичь более высокой дисперсности нанесенного металла благодаря полному гидролизу комплексов хлорида палладия и сокращению времени старения образующихся гидроксокомплексов в растворе вследствие их быстрой адсорбции на носитель. Технический результат - высокие активность и селективность получаемых катализаторов в гидрировании малеиновой кислоты в янтарную кислоту в водной среде в мягких условиях. 3 н. и 2 з.п. ф-лы, 2 ил., 1 табл., 15 пр.
Реферат
Изобретение относится к области приготовления палладиевых катализаторов, предназначенных для гидрирования кратных С-С связей в молекулах органических электролитов, в частности для гидрирования малеиновой кислоты (МК) в янтарную кислоту (ЯК) в водной среде.
Эффективность гидрирования ненасыщенных органических соединений с полярными группировками в водных средах во многом предопределяется образованием и структурой двойного электрического слоя (ДЭС) на поверхности металлического катализатора [Сокольский Д.В., Сокольская A.M. Металлы-катализаторы гидрогенизации. - Алма-Ата: Наука, 1970. - 436 с.]. В этом отношении решающую роль могут играть не только адсорбция ионизированных молекул субстрата в ДЭС и характер их ориентации относительно поверхности катализатора под действием ее электрического поля [Сокольский Д.В. Гидрирование в растворах. - Алма-Ата: Изд-во АН Каз. ССР, 1962. - 488 с.], но и интенсивность их переноса сквозь ДЭС к активным центрам катализатора (V. Ponec, G.C. Bond, Catalysis by metals and alloys. Chapter 11. - Elsevier, 1995). Последнее обусловлено тем, что по сравнению с внешним раствором транспорт молекул реагентов в пределах ДЭС может оказаться затрудненным из-за "жесткости" сольватных слоев поверхности, структурированных в электрическом поле или вследствие адсорбционных взаимодействий [A. Obliger et al., Physical Review E, 89 (2014) 043013; S. Song et al., Journal of Colloid and Interface Science 287 (2005) 114-120]. Это означает, что коэффициенты диффузии реагентов в пределах ДЭС могут оказаться значительно ниже, чем во внешнем растворе. Согласно теории Гуи-Чепмена протяженность ДЭС составляет от единиц до десятков нанометров в зависимости от ионной силы раствора, однако при движении раствора относительно поверхности катализатора некоторая часть ДЭС способна обрываться вдоль так называемой плоскости скольжения, характеризующейся величиной электрокинетического потенциала или ζ-потенциала. Такое нарушение сплошности ДЭС за счет сил трения, возникающих при движении частицы катализатора в растворе, несомненно, будет приводить к усилению массообмена между внешним раствором и поверхностью катализатора.
Следуя этим взглядам, можно ожидать, что относительно легко транспорт реагентов к поверхности катализатора осуществляется на периферии зерен катализатора, где возможны не только описанное выше механическое нарушение структуры ДЭС, но и реализация кратчайшего пути доставки реагентов сквозь ДЭС к поверхности катализатора, поскольку в этом случае диффузионный поток направлен по нормали к ней. В особых условиях - когда скорость химической реакции достаточно высока, а скорость диффузии реагентов сквозь ДЭС, наоборот, низка - возможно проявление внешнедиффузионного торможения каталитического процесса. В результате тонкий, несколько десятков нанометров, слой раствора на периферии зерна катализатора окажется сильно обедненным реагентами по отношению к внешнему раствору, что отразится на кинетических параметрах процесса - порядках по реагентам и кажущейся энергии активации, хотя первый порядок по катализатору еще будет соблюдаться.
Совершенно иная картина массопереноса складывается в случае, когда реагенты вынуждены проникать в поры катализатора, размеры которых соизмеримы с толщиной ДЭС. В этом случае ДЭС будет затруднять движение молекул реагентов к центру зерен катализатора на всем протяжении таких пор, создавая условия для возникновения внутридиффузионного торможения каталитического процесса. Таким образом, можно ожидать, что в силу описанных выше причин скорость превращения органического электролита на пористом катализаторе может оказаться заниженной и зависимой от размеров пор. Все эти эффекты продемонстрированы в настоящем патенте, который предлагает способ устранения их негативных последствий в гидрировании МК.
В настоящее время в промышленном получении янтарной кислоты ЯК доминирует метод каталитического гидрирования малеиновой кислоты в водных растворах, которую обычно генерируют непосредственно в каталитическом реакторе взаимодействием малеинового ангидрида с горячей водой (сам ангидрид мало растворим в воде). Следует указать, что такой способ не является оптимальным, поскольку при отдельном приготовлении водного раствора МК и его последующей очистке ионообменными смолами [JPS 61204148] или активированным углем [JPS 61204149] существенно увеличивается ресурс катализатора.
В качестве катализаторов гидрирования малеиновой кислоты МК используют металлы VIII группы Периодической системы (Ni, Ru, Rh, Pd, Pt), однако палладий привлекает наибольший интерес в силу своей высокой активности в мягких условиях (по сравнению с никелем и платиной), стабильности в слабокислых растворах органических кислот (в сравнении с никелем) и относительной дешевизны (среди платиновых металлов). Экономически целесообразно диспергирование этих металлов на носителях, что позволяет значительно увеличить их активную поверхность. Носителями для палладия могут служить силикагель [РФ 2129540], окись алюминия [РФ 2129540], активированный уголь [РФ 2129540], Сибунит [РФ 2129540], ионообменные смолы [A. Knapik et al., J. Mol. Catal. A: Chem. 279 (2008) 47-56]. Содержание палладия варьируют от 0.1 до 10 мас. %, но предпочтительнее использовать катализаторы с содержанием металла от 0.5 до 5 мас. %. Процесс гидрирования МК осуществляют в непрерывном режиме - в проточных условиях во взвешенном слое гранул катализатора [JPH 02121946], или в периодическом режиме - в статическом реакторе с использованием суспензионного катализатора [РФ 2129540]. При этом используют растворы МК с концентрацией 10-60 мас. % (обычно - 20-40 мас. %), давление H2 поддерживают в пределах 5-50 атм., а температуру - 50-120°С. Вода в качестве растворителя и относительно низкая температура процесса обеспечивают наибольший, практически количественный, выход ЯК для катализаторов на основе благородных металлов; в этих же условиях катализаторы, содержащие металлы группы железа, напротив, малоактивны и неустойчивы в кислых растворах МК.
Наиболее близким техническим решением является способ получения янтарной кислоты жидкофазным гидрированием малеинового ангидрида, или малеиновой кислоты, или солей малеиновой кислоты в воде в присутствии палладийсодержащего катализатора на носителе, в качестве катализатора используют палладий-никелевый катализатор при соотношении палладий : никель, равном 1:0,5-5, или палладий-железный катализатор при соотношении палладий : железо, равном 1:0,1-6 [Пат. РФ 2129540, С07С 51/14, 55/10, 27.04.1999],
В приведенных в прототипе примерах катализаторы получали нанесением полихлоргидроксокомплексов (ПХГК) палладия на силикагель КСК, γ-Al2O3 и углеродные носители ОУ-Б предварительно модифицированные никелем (до 0.5 мас. %) или же содержащие естественные примеси железа (около 0.3 мас. %). Описание методики синтеза такого катализатора состава 0.05%Pd/ОУ-Б(0.3%Fe) приведено ниже (прототип).
Предварительно готовят раствор ПХГК Pd: при перемешивании и подогреве до ~70°С растворяют 0.017 г (9.583×10-5 моль) PdCl2 и 0.011 г (1.17×10-4 моль) NaCl в 5 см3 дистиллированной воды, добавляют 0.001 см3 концентрированной соляной кислоты, охлаждают полученный раствор до 50°С и гидролизуют раствором 0.25 N NaOH до массового соотношения NaOH:Pd=0.5 (1.33 мольн.), а затем оставляют его стареть на сутки при комнатной температуре. Катализатор с расчетным содержанием 0.05 мас. % палладия и 0.3 мас. % железа получают на лабораторной установке, состоящей из круглодонной колбы емкостью 0.5 дм3, снабженной мешалкой, термометром и капельной воронкой. В колбу загружают 20 г (в расчете на сухой) угля ОУ-Б, суспендируют его в 200 см3 дистиллированной воды при комнатной температуре и к этой суспензии дозируют раствор ПХГК Pd с последующей получасовой выдержкой. Затем катализатор фильтруют под вакуумом на воронке Бюхнера, отмывают дистиллированной водой до отсутствия ионов хлора в промывной воде и сушат.
Из анализа мольных соотношений реагентов, используемых в этом примере, следует, что количество добавленной щелочи по стехиометрии не достаточно для связывания всех ионов хлора, вводимых в виде PdCl2 и HCl, т.е. генерирование частиц ПХГК Pd, их старение и осаждение на носитель осуществляют в слабокислой среде.
Недостатком указанных катализаторов является их сравнительно низкая активность в гидрировании МК в ЯК. Причина этого остается неясной, поскольку авторы патента РФ 2129540 не привели какой-либо информации о физико-химическом состоянии нанесенного активного компонента катализаторов.
Результаты наших фундаментальных работ [П.А. Симонов и др. Кинетика и катализ 41 (2000) 281-297; Simonov, P.A., and Likholobov, V.A., in: Catal. and Electrocatal. at Nanoparticle Surfaces (A. Wieckowski, E.R. Savinova, C.G. Vayenas, eds.), 2003, Marcel Dekker, New York, p. 409-454] по изучению закономерностей гидролиза хлоридных комплексов палладия (II) и последующего формирования нанесенных частиц металла позволяют предположить, что ухудшение качества палладиевых катализаторов, полученных согласно приведенной выше методике, может оказаться следствием следующих негативных процессов, имеющих место в условиях синтеза этих образцов:
- длительное старение - в течение суток - раствора ПХГК Pd в отсутствие носителя обычно приводит к существенному укрупнению палладийсодержащих частиц вследствие агрегации первичных частиц ПХГК Pd в растворе;
- нанесение малых количеств (в патенте - 0.05 мас. %) палладия на активный уголь, как правило, сопровождается восстановлением большей части его растворенных соединений на периферии зерен носителя по электрохимическому механизму, в ходе которого формируются грубые кристаллиты и даже островковые пленки металла и прочно адсорбируются ионы хлора; при этом чем выше удельная поверхность углеродного носителя, тем интенсивнее протекает процесс восстановления;
- при отсутствии щелочной обработки адсорбированных углем ПХГК Pd и их жидкофазного восстановления на поверхности катализатора остаются заметные количества соадсорбированных ионов хлора, которые в дальнейшем, т.е. в ходе каталитического процесса, могут влиять на его эксплуатационные свойства.
Кроме этого, использование в этом патенте носителей с развитой пористостью, в принципе, может обусловить заметное влияние ДЭС поверхности катализаторов на кинетику каталитического процесса в порах катализатора, как указывалось выше.
Способ приготовления катализаторов и регламентируемые поверхностные свойства носителей, защищаемые настоящим патентом, минимизируют эти нежелательные эффекты.
Изобретение решает задачу эффективного катализатора для процесса гидрирования малеиновой кислоты в янтарную кислоту в водной среде в мягких условиях.
Технический результат - получение нанесенного палладиевого катализатора, высокоактивного и селективного в гидрировании МК в ЯК в водной среде в мягких условиях (50°С, 1 атм).
Задача решается составом палладиевого катализатор для получения янтарной кислоты путем гидрирования малеиновой кислоты в водной среде, который содержит нанесенный на поверхность носителя палладий в количестве 0.1-2.5 мас. %, носитель представляет собой порошок с удельной поверхностью 2-455 м2/г.
В качестве порошкового носителя катализатор может содержать нерастворимые в растворах карбоновых кислот оксиды, такие как: Al2O3, SiO2, TiO2, ZrO2 и углеродные носители типа Сибунит.
Задача решается также способом приготовления катализатора, содержащего нанесенный на носитель палладий в количестве 0.1-2.5 мас. %, который заключается в гидролитическом осаждении палладия на носитель из растворов H2PdCl4, формирование наночастиц гидроокиси палладия осуществляют при pH 9-9.5 непосредственно в присутствии носителя с последующим их жидкофазным восстановлением до металла, что обеспечивает совмещение процессов формирования в растворе и адсорбции этих наночастиц на поверхность носителя и тем самым позволяет достичь более высокой дисперсности нанесенного металла в катализаторе благодаря полному гидролизу комплексов хлорида палладия и сокращению времени старения образующихся коллоидов гидроокиси растворе вследствие их быстрой адсорбции на носитель. В качестве порошкового носителя можно использовать нерастворимые в растворах карбоновых кислот оксиды такие как: Al2O3, SiO2, TiO2, ZrO2 и углеродные носители типа Сибунит с удельной поверхностью 2-455 м2/г.
Задача решается также способом получения янтарной кислоты путем селективного гидрирования малеиновой кислоты в янтарную кислоту в водной среде в мягких условиях (30-50°С, давлении не ниже 1 атм), который осуществляют в присутствии описанного выше катализатора.
Отличительными признаками настоящего изобретения в сравнении с прототипом являются:
- генерирование палладийсодержащих частиц гидролизом H2PdCl4 в присутствии носителя, что сопровождается их адсорбцией на носитель и, в конечном счете, позволяет достичь более высокой дисперсности нанесенного металла в катализаторе;
- осуществление гидролиза H2PdCl4 в щелочной среде при pH 9-9.5 с последующим жидкофазным восстановлением нанесенного металла, что позволяет достичь полного гидролиза хлорида палладия и максимально элиминировать ионы хлора из конечного катализатора;
- использование для приготовления катализаторов носителей с относительно низкой удельной поверхностью (2-455 м2/г) с целью снижения диффузионного торможения процесса гидрирования МК в ЯК в водной среде;
- повышенная активность палладиевых катализаторов в гидрировании МК в ЯК в водной среде в мягких условиях (30-50°С, давление водорода не ниже 1 атм).
Сущность изобретения иллюстрируется следующими примерами, таблицей и иллюстрациями.
Пример 1 (прототип)
Катализатор 0.05%Pd/ОУ-А готовят аналогично прототипу (Пат. РФ №2129540, синтез детально изложен выше) с использованием в качестве носителя активированного угля ОУ-А (SБЭТ=920 м2/г, размер зерен меньше 100 мкм) - близкого аналога ОУ-Б [Угли активные. Каталог./ред. Н.А. Якунина. - Черкассы: НИИТЭХИМ, 1983]. Согласно информации от производителя, при зольности до 6-10% оба угля содержат около 0.2%Fe; объем микропор составляет 0.26-0.28 см3/г, а объем мезопор - в 0.13-0.18 см3/г (т.е. в отличие от носителей, используемых в сравнительных примерах 2-15, носители для прототипа являются преимущественно микропористыми и значительно превосходят их по величине удельной поверхности).
Пример 2
Катализатор 0.5%Pd/Сиб. 176 готовят осаждением гидроксокомплексов палладия, образующихся при смешении водных растворов Na2CO3 и H2PdCl4 (мольное соотношение 10:1), на поверхность углеродного носителя Сибунит 176 (SБЭТ=6 м2/г) при комнатной температуре. С этой целью к суспензии носителя в дистиллированной воде (20 мл воды +1 г носителя, фракция порошка 40-70 мкм) при перемешивании по каплям, в течение 5 мин, добавляют расчетное количество водного 0.1 М раствора H2PdCl4, после чего смесь оставляют перемешиваться 15 мин. Затем в полученную суспензию носителя в растворе H2PdCl4 в течение 10 мин дозируют расчетное количество 0.1 М Na2CO3 и перемешивают еще 20 мин. По завершении этого этапа приготовления катализатора значение pH суспензии составляет 9-9.5.
По окончании этой процедуры капельный анализ рассола на остаточное содержание палладия (проба с KI) дает отрицательный результат, а аргентометрическое определение в нем содержания ионов Cl- по методу Мора (после нейтрализации с помощью HNO3) показывает, что все ионы Cl- остаются в растворе, что свидетельствует о полном гидролизе нанесенных соединений палладия и отсутствии адсорбированного хлора на поверхности углеродного носителя. В завершение суспензию нагревают до 60°С, добавляют аликвоту 1М NaOOCH (мольное соотношение NaOOCH/H2PdCl4=1.5:1) и оставляют на 30 минут, после чего катализатор отфильтровывают, промывают дистиллированной водой до нейтральной реакции промывных вод и сушат при 65°С на воздухе.
Пример 3
Катализатор 0.5%Pd/Сиб. 159 готовят по методике, описанной в Примере 2, но в качестве носителя используется углеродный носитель Сибунит 159 (SБЭТ=11 м2/г).
Пример 4
Катализатор 0.5%Pd/Сиб. 55 готовят по методике, описанной в Примере 2, но в качестве носителя используется углеродный носитель Сибунит 55 (SБЭТ=455 м2/г).
Пример 5
Катализатор 0.5%Pd/α-Al2O3 готовят осаждением гидроксокомплексов палладия, образующихся при смешении водных растворов Na2CO3 и H2PdCl4 (мольное соотношение 10:1), на поверхность α-Al2O3 (SБЭТ=10 м2/г) при комнатной температуре. С этой целью к суспензии носителя в водном растворе Na2CO3 (20 мл раствора +1 г носителя, фракция порошка 40-90 мкм), интенсивно перемешиваемой магнитной мешалкой, в течение 10 мин по каплям приливают расчетное количество водного раствора H2PdCl4, после чего ее перемешивают еще 3.5-4 ч для старения нанесенной гидрокиси Pd и полного осаждения палладия на носитель (хотя основная масса металла осаждается из раствора в течение первых 20-30 мин). По завершении этого этапа приготовления катализатора значение pH суспензии составляет 9-9.5.
Затем суспензию нагревают до 75°С, добавляют аликвоту 1М NaOOCH (мольное соотношение NaOOCH/H2PdCl4=1.5:1) и оставляют на 30 минут, после чего катализатор отфильтровывают, промывают дистиллированной водой до нейтральной реакции промывных вод и сушат при 65°С на воздухе.
Пример 6
Катализатор 0.5%Pd/γ-Al2O3 (Reachim) готовят по методике, описанной в Примере 5, но в качестве носителя используется γ-Al2O3 (Реахим, МРТУ 6-09-3200-66, SБЭТ=103 м2/г).
Пример 7
Катализатор 0.5%Pd/γ-Al2O3 (Puralox) готовят по методике, описанной в Примере 5, но в качестве носителя используется γ-Al2O3 (Puralox, Sasol North America Alumina Product Group, SБЭТ=200 м2/г).
Пример 8
Катализатор 0.5%Pd/TiO2 (рутил) готовят по методике, описанной в Примере 5, но в качестве носителя используется TiO2 (рутил) (SБЭТ=2.0 м2/г).
Пример 9
Катализатор 0.5%Pd/ZrO2 готовят по методике, описанной в Примере 5, но в качестве носителя используется ZrO2 (SБЭТ=14 м2/г), полученный прокаливанием ZrO(NO3)2 на воздухе при 1200°С в течение 4 часов.
Пример 10
Катализатор 0.5%Pd/FW-70 готовят по методике, описанной в Примере 5, за исключением того, что осаждение гидроксокомплексов палладия на носитель проводят при 35°С, а в качестве носителя используют кизельгур FW-70 (Celatom, SБЭТ=1.7 м2/г).
Пример 11
Катализатор 0.5%Pd/SiO2 готовят по методике, описанной в Примере 10, за исключением того, что в качестве носителя используют силикагель SiO2 (SБЭТ=200 м2/г).
Пример 12
Катализатор 0.1%Pd/α-Al2O3 готовят по методике, описанной в Примере 5, за исключением того, что содержание палладия в катализаторе составляет 0.1 мас. %.
Пример 13
Катализатор 1.0%Pd/α-Al2O3 готовят по методике, описанной в Примере 5, за исключением того, что содержание палладия в катализаторе составляет 1.0 мас. %.
Пример 14
Катализатор 1.7%Pd/α-Al2O3 готовят по методике, описанной в Примере 5, за исключением того, что содержание палладия в катализаторе составляет 1.7 мас. %.
Пример 15
Катализатор 2.5%Pd/α-Al2O3 готовят по методике, описанной в Примере 5, за исключением того, что содержание палладия в катализаторе составляет 2.5 мас. %.
Текстурные характеристики носителей для катализаторов определяли из данных по адсорбции азота при 77K на установке ASAP 2400 (Micrometritics). Образцы предварительно тренировали при 573K до остаточного давления 10-3 мм рт.ст. Из начального участка изотермы адсорбции N2 в области Р/Р0=0.05-0.2 вычисляли величину удельной поверхности по БЭТ (SВЭТ). Объем микропор (Vми), доступных для молекул азота при 77K, определяли сравнительным методом [А.P. Karnaukhov, V.B. Fenelonov, V.Yu. Gavrilov, Pure Appl. Chem. 61, 1913 (1989)]. Объем мезопор (Vме) десорбционной (BJH cum. des.) ветви гистерезиса капиллярной конденсации азота в соответствии с BJH моделью [Е.Р. Barrett, L.G. Joyner, P.P. Halenda, J. Amer. Chem. Soc. 73, 373 (1951)]. Средний диаметр nop (Dпор) вычисляли по модели БЭТ как Dпор=4VΣ/SБЭТ.
Средне-поверхностный размер частиц металла в катализаторах, приготовленных согласно Примерам 1-15, определен методами хемосорбции СО (импульсное СО-титрование) и просвечивающей электронной микроскопии (ПЭМ).
СО-титрование катализаторов проводили при 20-25°С с использованием проточной установки, собранной на базе хроматографа. Навеску тестируемого образца помещали в U-образный кварцевый реактор, служащий одной из колонок хроматографа, и восстанавливали в токе Н2 в течение 1 ч при 120°С. Затем образец охлаждали до комнатной температуры и импульсами (фиксированными порциями) в поток Н2 вводили СО. В этих условиях молекулы СО прочно адсорбируются только на поверхности нанесенного металла, не затрагивая носитель. Концентрацию СО в проскоке на выходе из реактора регистрировали катарометром. Титрование прекращали при полном насыщении поверхности образца адсорбатом.
Дисперсность частиц нанесенного палладия (DPd), определяемую как количество поверхностных атомов палладия к общему количеству атомов металла в катализаторе, вычисляли по количеству хемосорбированного СО, исходя из допущения, что один поверхностный атом Pd связывает одну молекулу СО. При пересчете дисперсности металла на кажущийся средне-поверхностный размер (ds) его частиц использовали формулу:
Исходя из микрофотографий, полученных методом ПЭМ (прибор JEM-2010), для образцов катализаторов строили гистограммы распределения частиц по размерам, а затем вычисляли средне-поверхностный размер частиц металла как
где: di и ni - размер частиц и их количество в i-столбце гистограммы.
Результаты определения средне-поверхностных размеров частиц палладия в приготовленных образцах катализаторов приведены в таблице.
Массовую долю кристаллической фракции частиц металла в катализаторах определяли методом рентгенофазового анализа по интегральной интенсивности линии Pd 111. Оказалось, что во всех образцах эта линия настолько уширена, что сливается с фоном диффузного рассеяния рентгеновских лучей: это свидетельствует о том, что частицы палладия во всех образцах преимущественно "ренгеноаморфные", т.е. кристаллическая фракция частиц металла размером более 2 нм практически отсутствует.
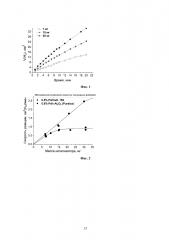
Гидрирование МК проводили в термостатируемом стеклянном реакторе объемом около 100 см3 в статических условиях при температуре 30-50°С и давлении Н2 1 атм. Кинетические измерения проводили волюмометрическим методом. С этой целью водную суспензию 5-100 мг катализатора помещали в реактор и вакуумировали, реактор продували водородом и соединяли с газовой бюреткой, наполненной водородом. Реактор нагревали до 50°С и восстанавливали катализатор в течение 30 минут при умеренном перемешивании его суспензии. Затем через пробоотборник в реактор вводили 3 см3 0.2-1 М раствора МК, скорость перемешивания увеличивали до 600-800 с-1 и регистрировали объем поглощенного водорода в зависимости от времени. Скорость поглощения Н2 (см3/мин) для каждой навески катализатора вычисляли по наклону начального прямолинейного участка на графике зависимости объема поглощенного водорода от времени (Фиг. 1. Зависимость объема поглощенного водорода, V(H2), от времени реакции гидрирования МК на катализаторе 0.5%Pd/α-Al2O3, приготовленного по Примеру 5. Условия: 50°С, 1 атм Н2). Активность катализатора вычисляли по наклону начального прямолинейного участка на графике зависимости скорости поглощения Н2 от массы навески катализатора, а предельную скорость поглощения водорода - по выходу этой кривой на плато при максимальных загрузках катализатора (Фиг. 2. Влияние массы навески катализатора на начальную скорость гидрирования МК. Катализаторы: 0.5%Pd/Сиб. 159 (Пример 3) и 0.5% Pd/γ-Al2O3 (Пример 7). Условия: 50°С, 1 атм Н2.), когда процесс переходит в диффузионно-контролируемый режим. Для определения кажущейся энергии активации реакции кинетические эксперименты проводили при различных температурах (30-50°С).
Оказалось, что скорость реакции гидрирования МА на палладиевых катализаторах не зависит от концентрации МА в диапазоне 0.2-1 М, а порядок по водороду в случае использования непористых носителей близок к 1.5. Сравнение истинной активности катализаторов (таблица) проводилось для следующих условий: температура процесса - 50°С, давление Н2 - 1 атм, начальная концентрация МА - 0.2-0.5 М, концентрация суспензии катализатора - 0.5-2 г/л. Удельную каталитическую активность (УКА), или т.н. число оборотов реакции, рассчитывали как число превращенных молекул МК на одном поверхностном атоме палладия в единицу времени.
Для наиболее активных катализаторов время полного поглощения водорода составляло 20-30 мин, а анализ продуктов реакции методом 1Н ЯМР показал, что иных органических соединений, кроме ЯК, в растворе не наблюдается, т.е. селективность гидрирования МК в ЯК близка к 100%.
Как следует из анализа данных таблицы по каталитической активности палладиевых катализаторов, приготовленных согласно Примерам 1-15, предлагаемый способ приготовления позволяет получать катализаторы, характеризующиеся повышенной в 3-18 раз активностью в гидрировании МК на единицу массы нанесенного металла по сравнению с прототипом. При этом, несмотря на высокую каталитическую активность, достигаемую благодаря высокой дисперсности частиц палладия, катализаторы на пористых носителях с развитой поверхностью типа Сибунит 55 (Пример 5) или γ-Al2O3 (Примеры 6 и 7) по сравнению со своими непористыми аналогами (Примеры 2 и 5, соответственно) показывают тенденцию к понижению как УКА, так и предельной скорости гидрирования при увеличении концентрации катализатора в реакционной массе. Это обусловлено диффузионным торможением процесса в порах носителей: так, в ряду носителей, однотипных по химической природе, значения УКА катализаторов на их основе уменьшаются с уменьшением средних размеров пор (сравни катализаторы 2-4 и 5-7 в таблице).
Катализатор-прототип, содержащий в качестве носителя микропористый уголь, вообще малоактивен в мягких условиях эксплуатации (50°С, 1 атм Н2), выбранных нами в настоящем способе гидрирования МК в ЯК. Более того, в этих условиях катализатор 0.1%Pd/α-Al2O3 (Пример 12) показывает активность, равную 37 лH2/гPd×мин, которая всего лишь примерно в два раза меньше активности известного катализатора (0.2%Pd+0.5%Ni)/γ-Al2O3 (68.9 лH2/гPd×мин) (Пат. РФ №2129540). Хотя авторы этого патента осуществляли гидрирование МК на указанном катализаторе в сравнительно жестких условиях (90°С, 15 ат.), к существенному каталитическому эффекту, как видно, это не привело.
1. Палладиевый катализатор для получения янтарной кислоты путем гидрирования малеиновой кислоты в водной среде, который содержит нанесенный на поверхность носителя палладий в количестве 0.1-2.5 мас.%, отличающийся тем, что носитель представляет собой порошок с удельной поверхностью 2-455 м2/г.
2. Катализатор по п. 2, отличающийся тем, что в качестве порошкового носителя катализатор содержит нерастворимые в растворах карбоновых кислот оксиды, такие как: Al2O3, SiO2, TiO2, ZrO2, а также углеродные носители типа Сибунит.
3. Способ приготовления катализатора по п.1, который заключается в гидролитическом осаждении палладия на порошковый носитель из растворов H2PdCl4, отличающийся тем, что формирование наночастиц гидроокиси палладия осуществляют при рН 9-9.5 непосредственно в присутствии носителя с последующим их жидкофазным восстановлением, что обеспечивает совмещение процессов формирования в растворе и адсорбции этих наночастиц на поверхность носителя.
4. Способ по п. 3, отличающийся тем, что в качестве порошкового носителя используют нерастворимые в растворах карбоновых кислот оксиды, такие как: Al2O3, SiO2, TiO2, ZrO2, а также углеродные носители типа Сибунит, обладающие удельной поверхностью 2-455 м2/г.
5. Способ получения янтарной кислоты путем селективного гидрирования малеиновой кислоты в янтарную кислоту в водной среде, отличающийся тем, что его проводят в присутствии катализатора по пп. 1 и 2 или приготовленного по пп. 3 и 4 в мягких условиях при температуре 30-50°С и давлении, равном 1 атм.