Способ регенерации отработанного щелочного гальванического электролита меднения
Иллюстрации
Показать всеИзобретение относится к области гальванотехники и может быть использовано для регенерации отработанных растворов. Способ регенерации отработанного щелочного гальванического электролита меднения, содержащего комплексы катионов меди (II) с этилендиаминтетрауксусной кислотой (ЭДТК), включает восстановление катионов меди (II) в катионы меди (I) при нагревании, удаление комплексона ЭДТК из кислого раствора, при этом в качестве восстановителя катионов меди (II) используют тиосульфат натрия, процесс восстановления осуществляют при рН=5-6, нагревании до 90 °C в течение 15 мин и мольном соотношении υ(Cu2+) : υ(тиосульфат), равном 1:1,05, а полученный сульфид меди (I) прокаливают и растворяют в серной кислоте с получением оксида меди (II). Технический результат: получение сточных вод с концентрацией катионов меди (II) ниже ПДК. 1 табл., 12 пр.
Реферат
Изобретение относится к регенерации отработанных щелочных гальванических электролитов меднения, содержащих анионы этилендиаминтетра-уксусной кислоты (ЭДТК), регенерацией меди и ЭДТК, и может быть применено в гальванической индустрии и промышленной экологии.
Процессы нанесения медных покрытий часто осуществляют в щелочной среде. С целью предотвращения образования осадка при pH>7 нерастворимого в воде гидроксида меди(II) в гальванический электролит вводят комплексоны, образующие в щелочной среде с катионами меди(II) растворимые в воде прочные комплексы. Состав и структура комплексов зависит от pH раствора, отношения концентраций меди и комплексона. Для получения прочных комплексов используют избыток комплексонов (в несколько раз) от стехиометрического.
При длительной эксплуатации и неоднократных возобновлениях новыми порциями реагентов в щелочных гальванических электролитах образуются различные побочные продукты - устойчивые гидрозоли. Это приводит к изменению электропроводимости, вязкости и других физико-химических свойств электролитов, растворы становятся вязкими, уменьшается скорость диффузии, нарушается адгезия меди к поверхности деталей. Такие отработанные растворы выводят из эксплуатационного цикла, и они подлежат обезвреживанию.
Однако из-за образования в щелочной среде прочных комплексов меди(II) с комплексонами из этих растворов катионы меди не могут быть удалены в виде малорастворимых гидроксидов.
Известен способ [1] (RU 2182183, опубл. 10.05.2002) осаждения цветных металлов с помощью пульпы, содержащей тиосульфат кальция, полученной путем растворения элементарной серы в водной суспензии гашеной извести при длительном кипячении смеси для максимального растворения серы. При этом цветные металлы осаждаются в виде сульфидов (общей формулы MeS) со смесью гипса и сульфита кальция. Остаточное содержание цветных металлов в сточной воде составляет 1 мг/л, что в 100 раз превышает значения ПДК для Cu2+.
Недостатками способа являются его энергоемкость, нетехнологичность, ресурсо- и трудоемкость, так как выделение сульфидов цветных металлов из соединений с кальцием из-за избытка серы и побочных продуктов осуществляют серосульфидной флотацией осажденной пульпы. Известно, что после флотации вода загрязняется флотореагентами, при этом образуется флотошлам.
Наиболее близким к настоящему изобретению является способ [2] регенерационной очистки щелочных растворов меднения (RU 2343225 от 10.01.2009), в котором регенераци щелочного раствора меднения, содержащего ЭДТА в качестве комплексона, осуществляют восстановлением катионов меди(II) до оксида меди(I) в щелочной среде, восстанавливающим моносахаридом при нагревании. Остаточное содержание катионов меди в растворе после восстановления моносахаридом составляет 85 мг/л. Далее выделяют малорастворимый ЭДТК из кислых растворов при pH 1,6-2. Удаление остаточных количеств катионов меди(II) осуществляют железом в кислой среде. Оксид меди(I) и ЭДТК регенерируют. После полного удаления катионов меди перед сбросом воду нейтрализуют. Образовавшаяся сточная вода имеет темно-бурое окрашивание.
Недостатком этого метода является его низкая эффективность и неудовлетворительные экологические параметры. При снижении концентрации меди(II) [(Cu2+)≤0,1 мг/л] цементацией в кислой среде металлическим железом расход железа на порядок превышает теоретически необходимый. Это приводит к перерасходу кислоты, что, в конечном счете, приводит к засаливанию сточной воды. Кроме того, реакция восстановления меди приводит к образованию окрашенных водных растворов, следовательно, такие растворы должны проходить дополнительные стадии очистки и обесцвечивания.
Кроме сказанного, в качестве восстановителя применяются дорогие пищевые продукты - моносахариды (альдозы типа глюкозы), продуктом окисления которых являются соответствующие кислоты (глюконовая в случае с глюкозой). При нейтрализации водных растворов оксидом кальция образуется растворимый в воде глюконат кальция, наличие которого в растворе повышает ее жесткость и ХПК. Для сброса в коллектор такой окрашенной и грязной воды необходимо ее обесцветить, пропуская через угольные фильтры, а для снижения концентрации солей, ХПК и жесткости осуществить более чем стократное ее разбавление чистой водой.
Таким образом, способ [2] многостадиен и характеризуется неудовлетворительными экономическими и экологическими показателями.
Задача изобретения - усовершенствование, упрощение и повышение эффективности процесса регенерации отработанных щелочных гальванических электролитов меднения, количественное выделение катионов меди из растворов с минимальным его загрязнением (засолением).
Технический результат - количественная регенерация из растворов ЭДТК и катионов меди(II), и получение сточных вод с концентрацией катионов меди(II) ниже ПДК.
Это достигается тем, что в настоящем способе регенерации отработанного щелочного гальванического электролита меднения, содержащего комплексы катионов меди(II) с этилендиаминтетрауксусной кислотой (ЭДТК), в качестве восстановителя катионов меди(II) используют тиосульфат натрия, процесс восстановления осуществляют при pH=5-6, нагревании до 90°C в течение 15 минут и мольном соотношении υ(Cu2+) : υ(тиосульфат), равном 1:1,05, а полученный сульфид меди(I) прокаливают и растворяют в серной кислоте с получением катионов меди(II).
Ниже приведен химизм последовательно осуществляемых процессов.
1. Восстановление катионов меди при нагревании с тиосульфатом натрия.
2CuSO4+2Na2S2O3+2H2O→Cu2S↓+2H2SO4+S↓+2Na2SO4 (pH=5-6)
Удаляют из раствора нерастворимые в воде серу и сульфид меди(I).
2. Раствор подкисляют до pH=2 и удаляют ЭДТК фильтрованием.
Na2H2Edta+2HCl→2NaCl+H4Edta↓
3. Регенерация водного концентрата трилона Б (динатриевая соль ЭДТК) с использованием его для приготовления свежих порций гальванических электролитов.
H4Edta+2NaOH→Na2H2Edta(концентрат)+2H2O
4. Регенерация оксида меди(II) прокаливанием сульфида меди(I).
Cu2S+2O2→2CuO+SO2
5. Уходящий оксид серы(IV) поглощают раствором гидроксида натрия, предотвращая загрязнение атмосферы:
2NaOH+SO2→Na2SO3+H2O
6. Регенерация водного концентрата сульфата меди(II).
CuO+H2SO4→CuSO4 (концентрат)+H2O
7. Нейтрализация раствора оксидом кальция.
СаО+H2SO4→CaSO4↓
Такая последовательность процедур позволяет при минимальных расходах химикатов обеспечить максимально полное извлечение из отработанных щелочных растворов химического меднения, содержащих ЭДТК, и получить сточную воду с минимальной засоленностью.
Полученная таким образом сточная вода прозрачна в видимой области спектра и имеет следующие показатели: перманганатная окисляемость 76,1 мг O2/л, сухой остаток (10,0200 г/л), жесткость 0,1 ммол/л.
Такая сточная вода может быть применена в оборотных технологических циклах или сброшена в коллектор без дополнительных процедур очистки.
Пример 1. Один литр отработанного гальванического электролита, содержащего (г/л): сульфат меди пентагидрат (15), гидроксид натрия (15), Трилон Б (30), подкисляют серной кислотой до pH=5-6, добавляют тиосульфат натрия (15,65 г), что соответствует мольному отношению 1:1,05 и нагревают раствор на водяной бане. Сульфид меди(I) удаляют из раствора, маточник подкисляют до pH=2. При этом выделяется кристаллы ЭДТК, которые удаляют фильтрованием.
Содержание меди в воде определяли фотометрированием при λmax=434-436 нм экстрагированного в CCl4 комплекса меди(II) с диэтилдитиокарбаматом натрия.
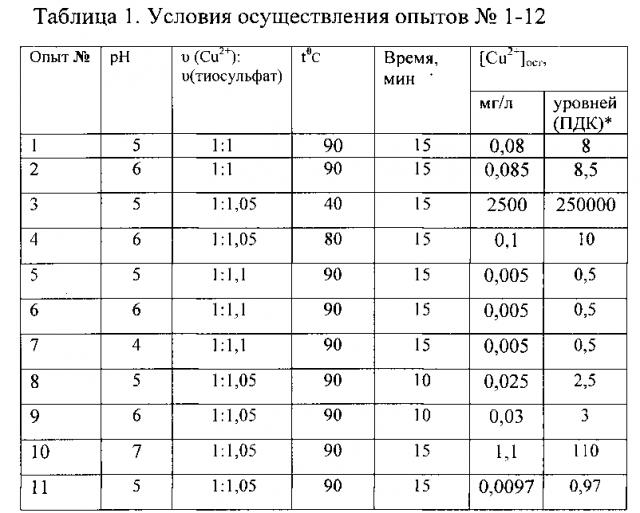
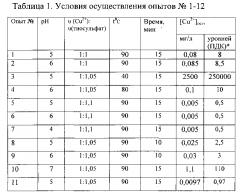
ЭДТК растворяют в растворе гидроксида натрия и регенерируют ее в концентрат трилона Б, который используют для приготовления свежих гальванических электролитов. Сульфид меди(I) прокаливают в печи, до окисления его в CuO. Полученный таким образом CuO растворяют в серной кислоте и получают водный концентрат сульфата меди(II), который используют для приготовления свежих растворов меднения. Количественные показатели исследований обобщены в таблице 1. В примерах 1-10 эксперименты осуществлены, как описано в примере 1, только при других параметрах.
Примеры 1-12 таблицы 1 показывают, что оптимальными условиями процесса восстановления катионов меди(II) тиосульфатом натрия являются: температура раствора до 90°C, время реакции 15 минут, pH=5-6 и /мольное соотношение υ(Cu2+) : υ(тиосульфат)=1:1,05
ПДК (Cu2+)=0,01 мг/л.
Литература
1. Пат. 2110487 РФ, МПК7 C22B 3/44. Способ осаждения цветных металлов из растворов. [Текст] / Калашникова М.И., Кескинова М.В., Шнеерсон Я.М., Салтыков П.М., Четвертаков В.В., Салтыкова Е.Г., Позднякова Н.Н.; заявитель и патентообладатель: Открытое акционерное общество "Институт Гипроникель"; заявл. 08.02.2000; опубл. 10.05.2002.
2. Пат. 2343225 РФ, МПК C3F 1/46, C22G 1/36. Способ регенерационной очистки щелочных растворов меднения. [Текст] / Пашаян А.А., Пашаян Ал.А. заявл. 05.05.2007; опубл. 10.01.2009.
Способ регенерации отработанного щелочного гальванического электролита меднения, содержащего комплексы катионов меди (II) с этилендиаминтетрауксусной кислотой (ЭДТК), включающий восстановление катионов меди (II) в катионы меди (I) при нагревании, удаление комплексона ЭДТК из кислого раствора, отличающийся тем, что в качестве восстановителя катионов меди (II) используют тиосульфат натрия, процесс восстановления осуществляют при рН=5-6, нагревании до 90 °C в течение 15 мин и мольном соотношении υ(Cu2+) : υ(тиосульфат), равном 1:1,05, а полученный сульфид меди (I) прокаливают и растворяют в серной кислоте с получением оксида меди (II).