Лечение заболеваний, связанных с аполипопротеином-а1, путем ингибирования природного антисмыслового транскрипта аполипопротеина-а1
Иллюстрации
Показать всеИзобретение относится к области биохимии. Предложен антисмысловой олигонуклеотид, содержащий по меньшей мере одну модифицированную межнуклеотидную связь, который гибридизуется с природным антисмысловым полинуклеотидом аполипопротеина A1 (ApoA1) и повышает экспрессию молекул ApoA1 по сравнению с нормальным контролем. Также предложены варианты композиции, содержащей указанный антисмысловой олигонуклеотид. Композиции предназначены для повышения экспрессии ApoA1, а также для предотвращения или лечения заболеваний, связанных с ApoA1. Изобретение обеспечивает ингибирование природного антисмыслового транскрипта ApoA1 у пациента и, таким образом, позволяет повысить экспрессию ApoA1. 5 н. и 22 з.п. ф-лы, 11 ил., 4 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет на основании предварительной патентной заявки США № 61/102681, поданной 3 октября 2008, предварительной патентной заявки США № 61/152236, поданной 12 февраля 2009, и предварительной патентной заявки США № 61/176267, поданной 7 мая 2009, каждая из которых включена в данное описание в качестве ссылки во всей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Воплощения данного изобретения включают в себя олигонуклеотиды, модулирующие экспрессию и/или функцию аполипопротеина и ассоциированных с ним молекул.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Гибридизация ДНК-РНК и РНК-РНК имеет большое значение для многих аспектов функционирования нуклеиновых кислот, включающих в себя репликацию, транскрипцию и трансляцию ДНК. Гибридизация также играет ключевую роль в ряде технологий, используемых либо для детекции конкретной нуклеиновой кислоты, либо для изменения ее экспрессии. Например, антисмысловые нуклеотиды нарушают экспрессию гена путем гибридизации с целевой РНК, что препятствует сплайсингу, транскрипции, трансляции и репликации РНК. Дополнительной характеристикой антисмысловой ДНК является способность гибридов ДНК-РНК расщепляться под действием рибонуклеазы H, активность которой можно обнаружить в клетках большинства типов. Антисмысловые молекулы можно доставлять в клетки, как в случае олигодезоксинуклеотидов (ODN), или их можно экспрессировать из эндогенных генов, как в случае молекул РНК. Недавно FDA утвердило антисмысловое лекарственное средство, VITRAVENETM (для лечения цитомегаловирусного ретинита), что свидетельствует о возможности терапевтического применения антисмысловых молекул.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В разделе Сущность изобретения приводится краткое описание содержания и предмета изобретения. Следует понимать, что данный раздел не предназначен для интерпретации или ограничения объема или смысла формулы изобретения.
В одном воплощении изобретение предлагает способы ингибирования активности природного антисмыслового транскрипта путем применения антисмыслового олигонуклеотида (олигонуклеотидов), направленного на некоторый участок природного антисмыслового транскрипта, где указанное применение приводит к повышающей регуляции соответствующего смыслового гена. В данном описании также предполагается, что ингибирование природного антисмыслового транскрипта может происходить под действием миРНК, рибозимов и маленьких молекул, которые входят в объем настоящего изобретения.
Одно воплощение относится к способу модуляции функции и/или экспрессии полинуклеотида аполипопротеина (ApoA1) в клетках или тканях пациента in vivo или in vitro, который включает в себя приведение в контакт указанных клеток или тканей с антисмысловым олигонуклеотидом, содержащим от 5 до 30 нуклеотидов в длину, где последовательность указанного олигонуклеотида, по меньшей мере, на 50% идентична обратному комплементу полинуклеотида, содержащего от 5 до 30 последовательных нуклеотидов из нуклеотидов 1-932 последовательности SEQ ID NO:2 (фигура 8); и последующую модуляцию функции и/или экспрессии полинуклеотида аполипопротеина (ApoA1) в клетках или тканях пациента in vivo или in vitro.
В другом предпочтительном воплощении олигонуклеотид направлен на природную антисмысловую последовательность полинуклеотидов ApoA1, например, полинуклеотидов, описанных как SEQ ID NO: 2, а также любых вариантов, аллелей, гомологов, мутантов, производных, фрагментов указанных полинуклеотидов и комплементарных им последовательностей. Примеры антисмысловых олигонуклеотидов описаны как SEQ ID NO: 81-173.
Другое воплощение относится к способу модуляции функции и/или экспрессии полинуклеотида аполипопротеина (ApoA1) в клетках или тканях пациента in vivo или in vitro, который включает в себя приведение в контакт указанных клеток или тканей с антисмысловым олигонуклеотидом, содержащим от 5 до 30 нуклеотидов в длину, где последовательность указанного олигонуклеотида, по меньшей мере, на 50% идентична обратной последовательности, комплементарной антисмысловому полинуклеотиду аполипопротеина (ApoA1); и последующую модуляцию функции и/или экспрессии полинуклеотида аполипопротеина (ApoA1) в клетках или тканях пациента in vivo или in vitro.
Другое воплощение относится к способу модуляции функции и/или экспрессии полинуклеотида аполипопротеина (ApoA1) в клетках или тканях пациента in vivo или in vitro, который включает в себя приведение в контакт указанных клеток или тканей с антисмысловым олигонуклеотидом, содержащим от 5 до 30 нуклеотидов в длину, где последовательность указанного олигонуклеотида, по меньшей мере, на 50% идентична последовательности олигонуклеотида, который является антисмысловым по отношению к антисмысловому полинуклеотиду аполипопротеина (ApoA1); и последующую модуляцию функции и/или экспрессии полинуклеотида аполипопротеина (ApoA1) в клетках или тканях пациента in vivo или in vitro.
В предпочтительном воплощении композиция содержит один или более антисмысловых олигонуклеотидов, которые связываются со смысловыми и/или антисмысловыми полинуклеотидами аполипопротеина (ApoA1).
В другом предпочтительном воплощении олигонуклеотиды содержат один или более модифицированных или замещенных нуклеотидов.
В другом предпочтительном воплощении олигонуклеотиды содержат одну или более модифицированных связей.
В следующем воплощении модифицированные нуклеотиды содержат модифицированные основания, включающие в себя фосфоротиоат, метилфосфонат, мономеры пептидных нуклеиновых кислот или молекулы замкнутых нуклеиновых кислот (LNA). Предпочтительно модифицированные нуклеотиды представляют собой молекулы замкнутых нуклеиновых кислот, включающих в себя α-L-LNA.
В другом предпочтительном воплощении олигонуклеотиды вводят пациенту подкожно, внутримышечно, внутривенно или внутрибрюшинно.
В другом предпочтительном воплощении олигонуклеотиды вводят в составе фармацевтической композиции. Режим лечения включает в себя, по меньшей мере, однократное введение пациенту антисмысловых соединений, однако данный режим можно изменить и вводить несколько доз в течение определенного периода времени. Лечение можно сочетать с одним или более другими видами терапии.
В другом предпочтительном воплощении олигонуклеотиды заключают в липосому.
Другие аспекты описаны ниже.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фигуре 1 приведено графическое изображение результатов ПЦР в реальном времени, демонстрирующих, что уровни мРНК ApoA1 в клетках HepG2 значительно увеличиваются через 48 часов после обработки некоторыми олигонуклеотидами, являющимися антисмысловыми по отношению к антисмысловой последовательности ApoA1 DA327409ext. Столбики RH3-RH597 соответствуют образцам, обработанным SEQ ID NO: 81-158.
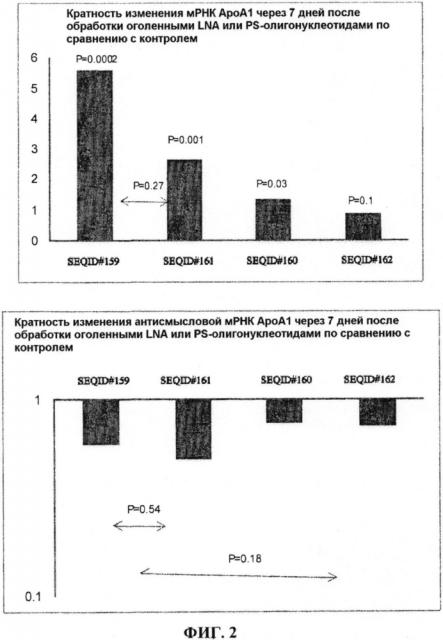
На фигуре 2 приведено графическое изображение результатов ПЦР в реальном времени, демонстрирующих кратность изменения уровня мРНК ApoA1 (верхняя панель) и природной последовательности DA327409ext, антисмысловой по отношению к РНК ApoA1 (нижняя панель), после обработки клеток HepG2 оголенными LNA или фосфотиоатными олигонуклеотидами в течение 7 дней, по сравнению с контролем. Столбики #6LNA, #11LNA, #6PS и #11PS обозначают SEQ ID NO: 159, 160, 161, 162 соответственно.
На фигуре 3 приведено графическое изображение результатов ПЦР в реальном времени, демонстрирующих степень изменения уровня природной последовательности DA327409ext, антисмысловой по отношению к РНК АроА1 (первый столбик в каждой паре столбиков, не закрашенный) и ApoA1 мРНК (второй столбик в каждой паре столбиков, закрашенный) после обработки клеток HepG2 олигонуклеотидами LNA. Столбики 6-11 соответствуют SEQ ID NO 159, 167-170 и 160.
На фигуре 4 изображено дозозависимое увеличение уровней мРНК (нижняя панель) и белка (верхняя панель) ApoA1 после обработки клеток HepG2 олигонуклеотидами. Столбики CUR-4806 и CUR-4811 обозначают SEQ ID NO 159 и 160 соответственно.
На фигуре 5 приведено графическое изображение результатов ПЦР в реальном времени, демонстрирующих повышающую регуляцию мРНК ApoA1 в первичных гепатоцитах африканской зеленой мартышки после обработки олигонуклеотидами, направленными против природной антисмысловой последовательности ApoA1 DA327409ext. Столбики CUR-4816 и CUR-4811 обозначают SEQ ID NO 173 и 160 соответственно.
На фигуре 6 приведен график, демонстрирующий, что уровни мРНК и белка ApoA1 в биопсийных образцах печени обезьян увеличиваются после обработки CUR-962, олигонуклеотидом, сконструированным против антисмысловой последовательности ApoA1 DA327409ext, по сравнению с исходным уровнем, как определено методами ПЦР в реальном времени и ELISA, соответственно (правые панели). Уровни мРНК или белка ApoA1 не изменяются в контрольной группе, получающей в течение такого же периода времени олигонуклеотид, который заведомо не влияет на уровень ApoA1 in vitro (CUR-963) (левые панели). Столбики CUR-962 и CUR-963 представляют SEQ ID NO: 170 и 171 соответственно.
На фигуре 7 показаны SEQ ID NO 1, мРНК ApoA1 и SEQ ID NO 1a, геномная последовательность ApoA1 получена из собрания генов UCSC, март 2006 (http://genome.ucsc. edu/index.html?org=Human&db=hgl8&hgsid=144980821, экзоны показаны заглавными буквами, интроны - маленькими)
На фигуре 8 показана SEQ ID NO: 2.
На фигурах 9A-D показаны SEQ ID NO: 3-158.
На фигуре 10 показаны SEQ ID NO: 159-173. * обозначает фосфотиоатную связь, + обозначает модификацию LNA.
На фигуре 11 показано параллельное выравнивание природных антисмысловых последовательностей ApoA1 человека и макак-резуса, а также положение некоторых олигонуклеотидов, используемых для таргетирования на указанные последовательности.
ПОДРОБНОЕ ОПИСАНИЕ
Некоторые аспекты данного изобретения описаны ниже с целью иллюстрации со ссылкой на возможные способы применения. Следует понимать, что многочисленные конкретные детали, взаимосвязи и способы описаны для облегчения полного понимания изобретения. Однако рядовой специалист в данной области может легко понять, что изобретение можно осуществить без использования одной или более конкретных деталей или с помощью других способов. Настоящее изобретение не ограничивается показанным порядком процессов или событий, так как некоторые процессы могут протекать в другой последовательности и/или одновременно с другими процессами или событиями. Кроме того, не все описанные процессы или события являются необходимыми для выполнения методологии настоящего изобретения.
Подразумевается, что все гены, названия генов и генные продукты, раскрытые в данном описании, относятся к гомологам, полученным из любых видов, которые можно использовать в сочетании с раскрытыми в данном описании композициями и способами. Так, указанные термины включают в себя, без ограничения, человеческие и мышиные гены и генные продукты. Следует понимать, что описание гена или генного продукта, полученных из конкретного вида, является только иллюстративным и не должно толковаться как ограничение, если контекст, в котором это описание встречается, однозначно не указывает иначе. Так, например, в случае раскрытых в данном описании генов, которые в некоторых воплощениях связаны с нуклеотидными и аминокислотными последовательностями млекопитающих, предполагается, что они охватывают гомологичные и/или ортологичные гены и генные продукты, полученные из других животных, которые включают в себя, без ограничения, других млекопитающих, рыб, амфибий, рептилий и птиц. В предпочтительных воплощениях гены или нуклеотидные последовательности являются человеческими.
Определения
Используемая в данном описании терминология предназначается только для описания конкретных воплощений, но не для ограничения данного изобретения. В данном описании предполагается, что единственное число равным образом включает в себя множественное число, если контекст однозначно не указывает иначе. Кроме того, подразумевается, что термины "включающий в себя", "включает в себя", "имеющий", "имеет", "с", или их варианты, используемые в отношении какого-либо диапазона в подробном описании и/или формуле изобретения, являются включающими, подобно термину "содержащий".
Термин "примерно" или "приблизительно" означает, что конкретное значение находится в приемлемом диапазоне ошибки, который определяется рядовым специалистом в данной области и отчасти зависит от способа измерения или определения значения, т.е. от ограничений системы измерения. Например, "приблизительно" может относиться к стандартному отклонению в пределах 1 или более 1, в соответствии с принятой в данной области практикой. Альтернативно "приблизительно" может относиться к диапазону, составляющему до 20%, предпочтительно до 10%, более предпочтительно до 5%, и еще более предпочтительно до 1% от заданного значения. Альтернативно, особенно в отношении к биологическим системам или процессам, данный термин может относиться к порядку величины, предпочтительно в пределах 5-кратного диапазона и более предпочтительно в пределах 2-кратного диапазона значения. Если не указано иначе, предполагается, что термин "приблизительно", в применении к конкретным значениям, описанным в заявке и формуле изобретения, относится к приемлемому диапазону ошибки конкретного значения.
В данном описании термин "мРНК" относится к известному в настоящее время транскрипту (известным транскриптам) целевого гена, а также к любым другим транскриптам, которые могут быть обнаружены.
Под "антисмысловым олигонуклеотидом" или "антисмысловым соединением" подразумевается молекула РНК или ДНК, которая связывается с другой РНК или ДНК (целевой РНК, ДНК). Например, олигонуклеотид РНК, который связывается с другой молекулой целевой РНК посредством РНК-РНК взаимодействий и изменяет активность РНК-мишени (Eguchi et al., 1991 Ann. Rev. Biochem. 60, 631-652). Антисмысловой олигонуклеотид может осуществлять повышающую или понижающую регуляцию экспрессии и/или функционирования конкретного полинуклеотида. Подразумевается, что данное определение включает в себя любую чужеродную молекулу РНК или ДНК, которая является полезной с терапевтической, диагностической или другой точки зрения. Такие молекулы включают в себя, например, антисмысловые молекулы РНК или ДНК, интерферирующие РНК (РНКи), микро РНК, молекулы РНК-ловушек, миРНК, каталитические РНК, терапевтические редактирующие РНК, а также агонистические и антагонистические РНК, антисмысловые олигомерные соединения, антисмысловые олигонуклеотиды, олигонуклеотиды внешних вспомогательных последовательностей (EGS), продукты альтернативного сплайсинга, праймеры, зонды и другие олигомерные соединения, которые гибридизуются, по меньшей мере, с частью целевой нуклеиновой кислоты. Как таковые, указанные соединения можно вводить в виде одноцепочечных, двухцепочечных, частично одноцепочечных или циклических олигомерных соединений.
В контексте данного изобретения термин "олигонуклеотид" относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК) или к их миметикам. Термин "олигонуклеотид" также включает в себя линейные или циклические олигомеры, содержащие природные и/или модифицированные мономеры или связи, в том числе дезоксирибонуклеозиды, рибонуклеозиды, их замещенные и альфа-аномерные формы, пептидные нуклеиновые кислоты (PNA), замкнутые нуклеиновые кислоты (LNA), фосфоротиоат, метилфосфонат и т.п. Олигонуклеотиды могут специфически связываться с целевым полинуклеотидом посредством регулярных мономер-мономерных взаимодействий, таких как спаривание оснований по принципу Уотсона-Крика, хугстиновское спаривание оснований, обратное хугстиновское спаривание оснований и т.п.
Олигонуклеотид может быть "химерным", то есть, он может состоять из разных участков. В контексте данного изобретения "химерные" соединения представляют собой олигонуклеотиды, которые содержат два или более различных химических участков, например, участок (участки) ДНК, участок (участки) РНК, участок (участки) ПНК и другие. Каждый химический участок состоит, по меньшей мере, из одного мономерного элемента, т.е. нуклеотида в случае олигонуклеотидного соединения. Указанные олигонуклеотиды, как правило, содержат, по меньшей мере, один участок, где олигонуклеотид является модифицированным с целью придания ему одного или более желательных свойств. Желательные свойства олигонуклеотида включают в себя, без ограничения, например, повышенную устойчивость к деградации под действием нуклеазы, повышенную способность поглощаться клеткой, и/или повышенное сродство связывания с целевой нуклеиновой кислотой. Таким образом, разные участки олигонуклеотида могут обладать разными свойствами. Химерные олигонуклеотиды настоящего изобретения можно получить в виде смешанных структур, содержащих два или более олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или аналогов олигонуклеотидов, описанных выше.
Олигонуклеотид может состоять из участков, соединенных "стандартным способом", то есть, мономеры могут быть соединены последовательно, как в нативной ДНК, или они могут соединяться через спейсеры. Спейсеры предназначаются для формирования ковалентного "мостика" между участками и имеют в предпочтительных случаях длину, не превышающую примерно 100 атомов углерода. Спейсеры могут нести разные функциональные группы, например, имеющие положительный или отрицательный заряд, особые связывающие свойства в отношении нуклеиновых кислот (интеркаляторы, вещества, связывающиеся с бороздкой, токсины, флуорофоры и другие), они могут являться липофильными и индуцировать образование особых вторичных структур, таких как, например, аланинсодержащие пептиды, которые индуцируют образование альфа-спиралей.
В данном описании термины "аполипопротеин" и "аполипопротеин A" охватывают все члены семейства, мутанты, аллели, фрагменты, разновидности, кодирующие и некодирующие последовательности, смысловые и антисмысловые полинуклеотидные цепи и другие.
В данном описании термин "олигонуклеотид, специфичный к" или "олигонуклеотид, направленный на" относится к олигонуклеотиду, имеющему последовательность, (i) способную образовывать стабильный комплекс с частью гена-мишени, или (ii) способную образовывать стабильный дуплекс с частью транскрипта мРНК гена-мишени. Стабильность комплексов и дуплексов можно определить с помощью теоретических расчетов и/или in vitro анализов. Примеры анализов, используемых для определения стабильности гибридизационных комплексов и дуплексов, описаны ниже в разделе Примеры.
В данном описании термин "нуклеиновая кислота-мишень" охватывает ДНК, РНК (в том числе пре-мРНК и мРНК), транскрибированную с такой ДНК, а также кДНК, полученную из такой РНК, кодирующие, некодирующие последовательности, смысловые или антисмысловые полинуклеотиды. Специфическая гибридизация олигомерного соединения с нуклеиновой кислотой-мишенью препятствует нормальному функционированию нуклеиновой кислоты. Такую модуляцию функции нуклеиновой кислоты-мишени под действием соединений, которые специфически гибридизуются с ней, обычно называют "антисмысловой". Функции ДНК, подлежащие нарушению, включают в себя, например, репликацию и транскрипцию. Функции РНК, подлежащие нарушению, включают в себя все жизненно важные функции, такие как, например, перемещение РНК в участок трансляции белка, трансляция белка с РНК, сплайсинг РНК с образованием одного или более разновидностей мРНК, и каталитическая активность, которая может реализовываться или опосредоваться РНК. Общий эффект такого препятствования функционированию нуклеиновой кислоты-мишени заключается в модуляции экспрессии кодируемого продукта или олигонуклеотидов.
РНК-интерференция "РНКи" опосредуется молекулами двухцепочечных РНК (дцРНК), которые имеют последовательность-специфичную гомологию по отношению к последовательности нуклеиновой кислоты-"мишени" (Caplen, N. J., et al, Proc. Natl. Acad. Sci. USA 98:9742-9747 (2001)). В некоторых воплощениях настоящего изобретения медиаторами являются "малые интерферирующие" дуплексы РНК (миРНК), содержащие 5-25 нуклеотидов. миРНК образуются в результате процессинга дцРНК под действием фермента РНКазы, известного как дайсер (Bernstein, E., et al, Nature 409:363-366 (2001)). Дуплексные продукты миРНК участвуют в образовании мультибелкового комплекса, содержащего миРНК, который называют RISC (комплекс РНК-индуцированного сайленсинга (RNA Induced Silencing Complex)). Без связи с какой-либо конкретной теорией полагают, что RISC затем направляется к нуклеиновой кислоте-мишени (подходящей мишенью является мРНК), где дуплекс миРНК взаимодействует в последовательность-специфичной манере с мишенью, опосредуя ее каталитическое расщепление (Bernstein, E., et al, Nature 409:363-366 (2001); Boutla, A., et al, Curr. Biol 11: 1776-1780 (2001)). Малые интерферирующие РНК, пригодные для применения в настоящем изобретении, можно синтезировать и использовать с помощью способов, хорошо известных в данной области и знакомых рядовым специалистам в данной области. Малые интерферирующие РНК, подходящие для применения в способах настоящего изобретения, содержат примерно от 1 до 50 нуклеотидов (нт). В примерах неограничивающих воплощений миРНК могут содержать примерно от 5 до 40 нт, примерно от 5 до 30 нт, примерно от 10 до 30 нт, примерно от 15 до 25 нт или примерно 20-25 нуклеотидов.
Выбор подходящих олигонуклеотидов проводят с помощью компьютерных программ, которые автоматически выравнивают нуклеотидные последовательности и указывают участки идентичности или гомологии. Такие программы используют для сравнения нуклеотидных последовательностей, полученных, например, в результате поиска в базах данных, таких как GenBank, или в результате секвенирования продуктов ПЦР. Сравнение нуклеотидных последовательностей, полученных из ряда видов, позволяет выбирать нуклеотидные последовательности, которые обладают подходящей степенью идентичности среди видов. В случае не секвенированных генов проводят саузерн-блоттинг, чтобы определить степень идентичности генов целевых видов и других видов. Путем проведения саузерн-блоттинга в условиях разной жесткости, хорошо известных в данной области, можно определить примерную величину идентичности. Указанные процедуры позволяют проводить отбор олигонуклеотидов, которые обладают высокой степенью комплементарности по отношению к целевым нуклеотидным последовательностям субъекта, подлежащим регулированию, и низкой степенью комплементарности по отношению к нуклеотидным последовательностям, полученным из других видов. Для специалиста в данной области будет очевидно, что существует очень широкая свобода действий при выборе подходящих участков генов для применения в настоящем изобретении.
Под "каталитической РНК" подразумевается молекула РНК с ферментативной активностью (Cech, 1988 J. American. Med. Assoc. 260, 3030-3035). Действие каталитических нуклеиновых кислот (рибозимы) включает в себя вначале связывание с РНК-мишенью. Такое связывание происходит за счет мишень-связывающего фрагмента каталитической нуклеиновой кислоты, который находится в непосредственной близости от каталитического фрагмента молекулы, осуществляющего расщепление РНК-мишени. Таким образом, каталитическая нуклеиновая кислота вначале распознает РНК-мишень и затем связывается с ней путем спаривания оснований, и после связывания с нужным участком указанная нуклеиновая кислота действует как фермент, расщепляя РНК-мишень.
Термин "РНК-ловушка" относится к молекуле РНК, которая имитирует природный связывающий домен для лиганда. Следовательно, РНК-ловушка конкурирует с природной связывающей мишенью за связывание со специфическим лигандом. Например, показано, что при сверхэкспрессии РНК трансактивационного ответа (TAR) ВИЧ может действовать как "ловушка", эффективно связывая белок tat ВИЧ и предотвращая посредством этого его связывание с последовательностями TAR, кодируемыми РНК ВИЧ (Sullenger et ah, 1990, Cell, 63, 601-608). Это конкретный пример. Специалистам в данной области будет ясно, что данный пример не является единственным, и что другие воплощения можно легко сгенерировать с помощью широко известных в данной области методов.
В данном описании термин "мономеры" обычно обозначает мономеры, связанные фосфодиэфирными связями или их аналогами, образующие олигонуклеотиды, размер которых варьирует от нескольких мономерных единиц, например, примерно от 3-4, до нескольких сотен мономерных единиц. Аналоги фосфодиэфирных связей включают в себя: фосфоротиоат, фосфородитиоат, метилфосфонаты, фосфороселеноат, фосфорамидат и т.п., как более подробно описано ниже.
В контексте настоящего изобретения термины "нуклеиновое основание" и "нуклеотид" или "нуклеозид" используются как взаимозаменяемые и охватывают природные нуклеиновые основания и неприродные нуклеиновые основания. Специалистам в данной области известно, что разные нуклеиновые основания, которые ранее считались "неприродными", впоследствии были обнаружены в природе. Таким образом, термин "нуклеиновое основание" включает в себя не только пуриновые и пиримидиновые гетероциклы, но и их гетероциклические аналоги и таутомеры. Иллюстративные примеры нуклеиновых оснований включают в себя аденин, гуанин, тимин, цитозин, урацил, пурин, ксантин, диаминопурин, 8-оксо-N6-метиладенин, 7-деазаксантин, 7-деазагуанин, N4,N4- этаноцитозин, N6,N6-этано-2,6-диаминопурин, 5-метилцитозин, 5-(C3-C6)-алкинилцитозин, 5-фторурацил, 5-бромурацил, псевдоизоцитозин, 2-гидрокси-5-метил-4-триазолопиридин, изоцитозин, изогуанин, инозин, а "неприродные" нуклеиновые основания описаны в Benner et al., патент США № 5432272. Подразумевается, что термин "нуклеиновое основание" охватывает каждый из приведенных примеров и все приведенные примеры, а также их аналоги и таутомеры. Особый интерес с точки зрения терапевтического и диагностического применения у людей вызывают такие нуклеиновые основания, как аденин, гуанин, тимин, цитозин и урацил, которые считаются природными нуклеиновыми основаниями. Термин "нуклеозид" включает в себя природные нуклеозиды, в том числе 2'-дезоксильные и 2'-гидроксильные формы, например, описанные в Kornberg and Baker, DNA Replication, 2nd Ed. (Freeman, San Francisco, 1992).
Термин "аналоги" в отношении к нуклеозидам включает в себя синтетические нуклеозиды, содержащие модифицированные основные фрагменты и/или модифицированные сахарные фрагменты, например, описанные в общих чертах Scheit, Nucleotide Analogs, John Wiley, New York, 1980; Freier & Altmann, Nucl. Acid. Res., 1997, 25(22), 4429-4443, Toulme, J.J., Nature Biotechnology 19:17-18 (2001); Manoharan M., Biochemica et Biophysica Acta 1489:117-139(1999); Freier S. M., Nucleic Acid Research, 25:4429-4443 (1997), Uhlman, E., Drug Discovery & Development, 3: 203-213 (2000), Herdewin P., Antisense & Nucleic Acid Drug Dev., 10:297-310 (2000)); 2'-O,3'-C-связанные [3.2.0] бициклоарабинонуклеозиды (см., например N. K Christiensen., et al, J. Am. Chem. Soc, 120: 5458-5463 (1998). Такие аналоги включают в себя синтетические нуклеозиды, сконструированные с целью улучшения связывающих свойств, например, стабильности дуплекса или триплекса, специфичности или т.п.
В данном описании термин "гибридизация" относится к спариванию по существу комплементарных цепей олигомерных соединений. Механизм спаривания включает в себя образование водородных связей между комплементарными нуклеозидными или нуклеотидными основаниями (нуклеиновые основания), которые могут представлять собой уотсон-криковские пары оснований, хугстиновские пары оснований или обратные хугстиновские пары оснований. Например, аденин и тимин являются комплементарными нуклеиновыми основаниями, которые спариваются посредством образования водородных связей. Гибридизация может происходить в разных условиях.
Антисмысловое соединение "специфически гибридизуется", если связывание соединения с нуклеиновой кислотой-мишенью препятствует нормальному функционированию нуклеиновой кислоты-мишени, приводя к модуляции ее функции и/или активности, и существует степень комплементарности, достаточная для того, чтобы избежать неспецифического связывания антисмыслового соединения с нуклеотидными последовательностями-не мишенями в условиях, в которых желательно образование специфического связывания, т.е. в физиологических условиях в случае анализов in vivo или терапевтического лечения, и в условиях проведения анализов in vitro.
В данном описании фраза "жесткие условия гибридизации" или "жесткие условия" относится к условиям, в которых соединение данного изобретения гибридизуется с последовательностью-мишенью и с минимальным числом других последовательностей. Жесткие условия являются последовательность-зависимыми и могут различаться в зависимости от обстоятельств, например, в контексте данного изобретения "жесткие условия", в которых олигомерные соединения гибридизуются с последовательностью-мишенью, зависят от природы и состава олигомерных соединений и методов анализа, используемых для исследования данных соединений. Как правило, жесткие условия гибридизации включают в себя низкие концентрации (<0,15M) солей, содержащих неорганические катионы, такие как Na++ или K++ (т. е., низкую ионную силу), температуру выше 20°C-25°C и ниже Тпл комплекса олигомерное соединение:последовательность-мишень, и присутствие денатурирующих средств, таких как формамид, диметилформамид, диметилсульфоксид или детергента додецилсульфата натрия (SDS). Например, степень гибридизации уменьшается на 1,1% с каждым 1% формамида. Примером условий высокой жесткости гибридизации является 0,1X натрий хлорид-натрий цитратный буфер (SSC)/0,1% (масс./об.) SDS при 60ºC в течение 30 минут.
Термин "комплементарность" в данном описании обозначает способность к точному спариванию двух оснований, находящихся на одной или двух олигомерных цепях. Например, если нуклеиновое основание в определенном положении антисмыслового соединения способно образовывать водородные связи с нуклеиновым основанием в определенном положении нуклеиновой кислоты-мишени, где указанная нуклеиновая кислота-мишень представляет собой ДНК, РНК или молекулу олигонуклеотида, то положение водородной связи между олигонуклеотидом и нуклеиновой кислотой-мишенью считается комплементарным положением. Олигомерное соединение и другая молекула ДНК, РНК или олигонуклеотида являются комплементарными друг другу, если достаточное число комплементарных положений в каждой молекуле занято нуклеиновыми основаниями, которые могут образовывать друг с другом водородные связи. Таким образом, термины "способный к специфической гибридизации" и "комплементарный" используются для обозначения достаточной степени точного спаривания или комплементарности достаточного числа нуклеиновых оснований, что обеспечивает стабильное и специфическое связывание олигомерного соединения и нуклеиновой кислоты-мишени.
В данной области известно, что последовательность олигомерного соединения способна к специфической гибридизации, если она на 100% комплементарна нуклеиновой кислоте-мишени. Кроме того, олигонуклеотид может гибридизоваться на протяжении одного или более сегментов, так что находящиеся между ними или соседние сегменты не участвуют в событиях гибридизации (например, в случае петлеобразной структуры, несовпадающей структуры или шпилькообразной структуры). Олигомерные соединения настоящего изобретения содержат последовательность, которая по меньшей мере примерно на 70%, или по меньшей мере примерно на 75%, или по меньшей мере примерно на 80%, или по меньшей мере примерно на 85%, или по меньшей мере примерно на 90%, или по меньшей мере примерно на 95%, или по меньшей мере примерно на 99% комплементарна последовательности целевого участка нуклеиновой кислоты-мишени, против которой они направлены. Например, антисмысловое соединение, 18 из 20 нуклеотидов которого комплементарны целевому участку и, следовательно, способны гибридизоваться с ним, обладает 90 процентной комплементарностью. В данном примере остальные некомплементарные нуклеотиды могут быть собраны в группы или рассеяны среди комплементарных нуклеотидов, они могут не быть смежными по отношению друг к другу или к комплементарным нуклеотидам. Как таковое, антисмысловое соединение, которое, имея длину 18 нуклеотидов, содержит 4 (четыре) некомплементарных нуклеотида, фланкируемых двумя участками, полностью комплементарными нуклеиновой кислоте-мишени, обладает общей комплементарностью 77,8% по отношению к нуклеиновой кислоте-мишени и, следовательно, входит в объем настоящего изобретения. Процент комплементарности антисмыслового соединения участку нуклеиновой кислоты-мишени можно определить стандартным способом с использованием известных в данной области программ BLAST (средство поиска основного локального выравнивания) и PowerBLAST (Altschul et al., J. Mol. Biol., 1990, 215, 403-410; Zhang and Madden, Genome Res., 1997, 7, 649-656). Процент гомологии, идентичности или комплементарности последовательностей можно определить, например, с помощью программы Gap (Пакет для анализа последовательностей Wisconsin, версия 8 для Unix, Genetics Computer Group, University Research Park, Madison Wis.), используя параметры по умолчанию алгоритма Смита-Ватермана (Adv. Appl. Math., 1981, 2, 482-489).
В данном описании термин "температура плавления (Тпл)" относится к температуре, при которой 50% олигонуклеотидов, комплементарных последовательности-мишени, гибридизуются с последовательностью-мишенью в состоянии равновесия в условиях определенной ионной силы, pH, и концентрации нуклеиновой кислоты. Поскольку последовательности-мишени обычно присутствуют в избытке, при Тпл 50% олигонуклеотидов встречаются в состоянии равновесия). Как правило, жесткие условия включают в себя концентрацию соли, составляющую по меньшей мере примерно от 0,01 до 1,0 M ионов Na (или других солей) при pH от 7,0 до 8,3, и температуру, составляющую по меньшей мере примерно 30°C для коротких олигонуклеотидов (например, содержащих от 10 до 50 нуклеотидов). Жесткие условия также включают в себя применение дестабилизирующих средств, таких как формамид.
В данном описании термин "модуляция" означает либо увеличение (стимуляция), либо уменьшение (ингибирование) экспрессии гена.
Термин "вариант" в контексте полинуклеотидной последовательности может относиться к полинуклеотидной последовательности, родственной гену дикого типа. Данное определение также может включать в себя, например, "аллельные", "сплайсинговые", "видовые" или "полиморфные" варианты. Сплайсинговый вариант может обладать значительной идентичностью по отношению к молекуле сравнения, однако он содержит большее или меньшее число полинуклеотидов вследствие альтернативного сплайсинга экзонов при процессинге мРНК. Соответствующий полипептид может содержать дополнительные функциональные домены, или в нем могут отсутствовать такие домены. Видовые варианты представляют собой полинуклеотидные последовательности, варьирующие от одного вида к другому. Особое значение в настоящем изобретении имеют варианты продуктов гена дикого типа. Варианты могут образовываться в результате, по меньшей мере, одной мутации в нуклеотидной последовательности и могут приводить к синтезу измененных мРНК или полипептидов, у которых может быть необязательно изменена структура или функция. Любой конкретный природный или рекомбинантный ген может не иметь аллельных форм, или он может иметь одну или более аллельных форм. Распространенные мутационные изменения, которые приводят к образованию вариантов, как правило, обусловлены природными делециями, добавлениями или заменами нуклеотидов. Каждый из указанных типов изменений может встречаться по отдельности или в сочетании с другими, один или более раз на протяжении конкретной последовательности.
Полученные полипептиды обычно обладают значительной аминокислотной идентичностью по отношению друг к другу. Полиморфные варианты представляют собой вариации полинуклеотидной последовательности конкретного гена у субъектов определенного вида. Полиморфные варианты также могут включать в себя "однонуклеотидные полиморфизмы" (SNP) или одноосновные мутации, которые приводят к изменению полинуклеотидной последовательности по одному основанию. Присутствие SNP может указывать, например, на наличие некоторой популяции с предрасположенностью к болезненному состоянию, то есть, на чувствительность вместо устойчивости.
Производные полинуклеотидов включают в себя нуклеиновые кислоты, подвергшиеся химической модификации, такой как замена водорода на алкил, ацил или аминогруппу. Производные, например, производные олигонуклеотидов, могут содержать неприродные фрагменты, такие как измененные сахарные фрагменты или междусах