Дизайн устойчивого гетеродимерного антитела с мутациями в fc домене
Иллюстрации
Показать всеИзобретение относится к биохимии. Описаны каркасы, которые содержат тяжелые цепи, являющиеся асимметричными в различных доменах (например, СН2 и СН3), для того, чтобы достичь селективности между различными Fc рецепторами, участвующими в модуляции эффекторной функции, селективности более высокой, чем селективность, достигаемая при использовании натуральной гомодимерной (симметричной) Fc молекулы, и повышенной устойчивости и чистоты полученных в результате вариантных Fc гетеродимеров. Эти новые молекулы содержат комплексы гетерогенных компонентов, созданные с целью изменить естественное поведение антител и использовать их в лекарственных средствах. 14 н. и 66 з.п. ф-лы, 38 ил., 12 табл., 8 пр.
Реферат
Данная заявка претендует на преимущества в соответствии с 35 U.S.С. §1 19(е) предварительной заявки на патент США No. 61/410746, поданной 5 ноября 2010 года; предварительной заявки на патент США No.61/425375, поданной 21 декабря 2010 года; предварительной заявки на патент США No. 61/439341, поданной 03 февраля 2011 года; предварительной заявки на патент США No. 61/475614, поданной 14 апреля 2011 года; предварительной заявки на патент США No. 61/491846, поданной 31 мая 2011 года, и предварительной заявки на патент США No. 61/497861, поданной 16 июня 2011 года, каждая из которых включена в данное изобретение посредством отсылки.
Данная заявка включает, посредством отсылки, Список последовательностей, представленный в виде текстового файла Zymeworks V84467WO.txt, созданного 4 ноября 2011 года и имеющего объем 15 килобайт.
Область техники, к которой относится изобретение
Настоящая заявка, в целом, предусматривает гетеродимерные полипептиды, их композиции и способы получения и применения таких полипептидных гетеродимеров. Более конкретно, настоящее изобретение относится к термоустойчивым мультиспецифическим, включая биспецифические, антителам, содержащим гетеродимерный Fc домен.
Сведения о предшествующем уровне техники
Биспецифические антитела представляют собой молекулы антител, которые могут одновременно связывать два отдельных различных антигена (или различные эпитопы одного и того же антигена). Одним из применений биспецифических антител является перенацеливание цитотоксических иммунных эффекторных клеток на повышенный лизис опухолевых клеток, такой как при использовании антителозависимой клеточной цитотоксичности (ADCC). В данном случае одно плечо биспецифического антитела связывает антиген на опухолевой клетке, а другое плечо связывает детерминанту, экспрессирующуюся на эффекторных клетках. При перекрестном слиянии опухолевой и эффекторной клеток биспецифическое антитело не только обеспечивает сближение эффекторных и опухолевых клеток, но также одновременно включает их активацию, что приводит к эффективному киллингу опухолевых клеток. Биспецифические антитела также применялись для обогащения химио- или радиотерапевтических агентов в опухолевых тканях с целью минимизации вредного действия на здоровые ткани. В этом случае одно плечо биспецифического антитела связывает антиген, экспрессирующийся на клетке, нацеленной на разрушение, а второе плечо доставляет химиотерапевтическое лекарство, радиоизотоп или токсин.
Основным препятствием в общей разработке биспецифических антител была трудность получения материалов в достаточном количестве и удовлетворительного качества как для преклинических, так и для клинических исследований.
Обычное получение полноразмерных биспецифических антител основано на совместной экспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина, где две цепи имеют разные специфичности (Millstein et al., 1983, Nature, 305:537-539). Свойственное участку Fc молекулы антитела стремление димеризоваться приводит к образованию сложных смесей, содержащих до 10 различных молекул IgG, состоящих из различных комбинаций тяжелых и легких цепей, из которых только одна комбинация имеет корректную биспецифическую структуру. Очистка корректной молекулы, которую обычно проводят на стадиях аффинной хроматографии, является достаточно трудоемкой, а выходы продукта низкие. Аналогичные методы раскрываются в Международной патентной заявке WO 93/08829 и в статье Traunecker et al., 1991, EMBO J., 10:3655-3659. Таким образом, получение биспецифического антитела с двумя Fab плечами, выбранного с целью связывания с двумя различными мишенями, с применением традиционного метода гибридом является трудной задачей [Segal DM et al. (2001) J Immunol Methods. 248, 1-6.]. Трифункциональное антитело, Катумаксомаб (Catumaxomab), является биспецифическим mAb, полученным при использовании квадрогибридомы крысы/мыши, а очистку этого антитела проводят хроматографией на колонке с белком А с применением рН-зависимой элюции [Lindhofer Н. et al. (1995) J Immunol 155, 219-225].
Другим традиционным методом получения биспецифического антитела является химическая конъюгация двух антител или их фрагментов, имеющих разные специфичности. Однако этот метод также является сложным, а процесс химической модификации может инактивировать антитело или вызвать агрегацию. Так как очистка от нежелательных продуктов остается сложной, низкий выход и плохое качество биспецифического антитела делает этот процесс неподходящим для крупномасштабного производства, необходимого для клинических разработок. Кроме того, эти молекулы могут не сохранить конформацию обычного антитела.
В последнее время для усовершенствования получения биспецифических антител были применены различные методы гетеродимеризации. Однако, слияние доменов простой гетеродимеризацией, подобное слиянию доменов Jun/Fos суперспираль с scFv доменами, дает смесь гомо- и гетеродимеров и требует сборки рефолдингом (de Kruif and Logtenberg, J. Biol. Chem. 271:7630-4, 1996). Слияние фрагментов scFv с целыми антителами также использовали в качестве механизма димеризации (Coloma and Morrison, Nat. Biotechnol. 15:159-63, 1997). Однако, такое слияние дает большую молекулу, обладающую плохой способностью проникать в однородные ткани. Слияние вместе двух фрагментов scFv также применяли для получения биспецифических белков (например, антител BITE® от Micromet Inc., Bethesda, MD, патент США No. 7635472). Однако, такие белки не содержат областей Fc и, следовательно, не позволяют манипулировать с их активностями, используя области Fc. Кроме того, эти белки являются низкомолекулярными (~55 кДа) и, следовательно, имеют относительно короткий период полужизни в сыворотке.
В других методах гетеродимеризации биспецифические антитела состоят из тяжелой цепи гибридного иммуноглобулина с первой специфичностью связывания в одном плече и парой тяжелая цепь-легкая цепь гибридного иммуноглобулина (предоставляющей вторую специфичность связывания) в другом плече. Было найдено, что такая асимметричная структура способствует отделению заданного биспецифического соединения от нежелательных комбинаций, так как присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает легкий способ отделения. Этот метод раскрывается в Международной заявке на патент WO 94/04690. Более подробно получение биспецифических антител описано, например, в Suresh et al., 1986, Methods in Enzymology, 121:210.
Согласно другому методу, описанному в Международной заявке на патент WO96/27011, можно сконструировать пару молекул антитела, чтобы достичь максимального процентного содержания гетеродимеров, которые регенерируются из рекомбинантной клеточной культуры. Этим методом одну или более низкомолекулярных аминокислотных боковых цепей из CH3 интерфейса (области контакта) первой молекулы антитела заменяли на более высокомолекулярные боковые цепи (например, тирозин или триптофан). Компенсирующие "полости" размера, идентичного или аналогичного размеру более высокомолекулярной(-ых) боковой(-ых) цепей(-и), создают в области контакта (на интерфейсе) второй молекулы антитела, заменяя аминокислотную(-ые) боковую(-ые) цепь(-и) большего размера на меньшие (например, аланин или треонин). Это обеспечивает механизм повышения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры [патентная заявка США US005731168A, патент США US007183076B2, Ridgway JB, Presta LG, Carter P. Protein Eng 1996 Jul; 9(7):617-21; Atwell S, Ridgway JB, Wells JA, Carter P. J Mol Biol 1997 Jul 4; 270(1):26-35.]. Недавно Gunasekaran и сотрудники [Gunasekaran K. et al. (2010) J Biol Chem. 285, 19637-46] применили стратегию комплементарного электростатического взаимодействия для осуществления селективной гетеродимеризации. Davis и сотрудники [Davis, JH. et al. (2010) Prot Eng Des Sel; 23(4):195-202] создали CH3 домены, используя домен, полученный обменом нитей (SEED), который состоит из чередующихся сегментов последовательностей CH3 человеческих IgA и IgG, и они, преимущественно, ассоциированы в виде гетеродимеров. Однако, во всех этих методах получают антитела, содержащие гетеродимерные области Fc, которые значительно менее устойчивы, чем исходная молекула или молекула дикого типа.
Таким образом, в области техники остается потребность в альтернативных мультиспецифических вариантных Fc гетеродимерах, конкретно, в вариантах CH3 доменов, которые были бы модифицированы таким образом, чтобы выбрать гетеродимеры с повышенной устойчивостью и чистотой.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Согласно одному аспекту изобретения предусматривается выделенный гетеродимер, содержащий гетеродимерную Fc область, при этом гетеродимерная Fc область содержит вариантную форму CH3 домена, включающую мутации аминокислотных остатков, содействующие образованию гетеродимера, при этом гетеродимерная Fc область дополнительно содержит вариантную форму СН2 домена, включающую асимметричные аминокислотные модификации, стимулирующие селективное связывание Fc-гамма-рецептора. Согласно одному варианту СН2 домен селективно связывает Fc-гамма IIIa-рецепторы по сравнению с СН2 доменом дикого типа. Согласно одной модификации вариантная форма CH3 домена имеет температуру плавления (Tm) около 70°С или выше.
В другом аспекте изобретения предусматривается выделенный гетеромультимер, содержащий гетеродимерную Fc область, причем гетеродимерная Fc область включает вариантную форму домена CH3, содержащую аминокислотные мутации, стимулирующие образование гетеродимера с повышенной устойчивостью, и этот вариантный CH3 домен имеет температуру плавления (Tm) около 70°С или выше. Согласно одному варианту гетеродимерная Fc область не содержит дополнительной дисульфидной связи в CH3 домене по сравнению с Fc областью дикого типа, более конкретно, гетеродимерная Fc область не содержит дополнительной дисульфидной связи в CH3 домене по сравнению с Fc областью дикого типа. Согласно альтернативному варианту изобретения гетеродимерная Fc область содержит дополнительную дисульфидную связь в вариантном CH3 домене по сравнению с Fc областью дикого типа, при условии, что температура плавления (Tm) равна около 70°С или выше в отсутствие дополнительной дисульфидной связи. Согласно еще одному варианту гетеродимерная Fc область содержит дополнительную дисульфидную связь в вариантной форме CH3 домена по сравнению с Fc областью дикого типа, и при этом вариантный CH3 домен имеет температуру плавления (Tm) около 77.5°С или выше.
Согласно одному варианту предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает вариантную форму CH3 домена, содержащую аминокислотные мутации, стимулирующие образование гетеродимера с повышенной устойчивостью, при этом вариантная форма домена CH3 имеет температуру плавления (Tm) около 70°С или выше, а чистота гетеродимерной области Fc равна более, примерно, 90%, или чистота гетеродимерной области Fc равна более, примерно, 95% или выше, или чистота гетеродимерной области Fc равна более, примерно, 98% или выше.
Согласно одному варианту изобретения предусматривается также выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает вариантную форму CH3 домена, содержащую аминокислотные мутации, стимулирующие образование гетеродимера с повышенной устойчивостью, при этом вариантная форма домена CH3 имеет температуру плавления (Tm) около 70°С или выше, или Tm около 71°С или выше, или Tm около 74°С или выше. Согласно другому варианту чистота гетеродимерной области Fc равна более, примерно, 98% или выше, а Tm равна около 73°С, или чистота гетеродимерной области Fc равна более, примерно, 90% или выше, а Tm равна около 75°С.
Согласно некоторым вариантам изобретения предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает первый полипептид CH3 домена, содержащий аминокислотные модификации L351Y и Y407A, и второй полипептид CH3 домена, содержащий аминокислотные модификации Т366А и K409F. В одном аспекте первый полипептид CH3 домена или второй полипептид CH3 домена содержит дополнительную аминокислотную модификацию в положении Т411, D399, S400, F405, N390 или K392. Аминокислотная модификация в положении Т411 выбрана из T411N, T411R, T411Q, T411K, T411D, T411E или T411W. Аминокислотная модификация в положении D399 выбрана из D399R, D399W, D399Y или D399K. Аминокислотная модификация в положении S400 выбрана из S400E, S400D, S400R, или S400K. Аминокислотная модификация в положении F405 выбрана из F405I, F405M, F405T, F405S, F405V или F405W. Аминокислотная модификация в положении N390 выбрана из N390R, N390K или N390D. Аминокислотная модификация в положении K392 выбрана из K392V, K392M, K392R, K392L, K392F или K392E.
Согласно некоторым вариантам изобретения предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает первый полипептид CH3 домена, содержащий аминокислотные модификации L351Y и Y407A, и второй полипептид CH3 домена, содержащий аминокислотные модификации Т366А и K409F.
Согласно другому варианту предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает первый полипептид CH3 домена, содержащий аминокислотную модификацию Y407A, и второй полипептид CH3 домена, содержащий аминокислотные модификации Т366А и K409F. В одном аспекте первый полипептид CH3 домена или второй полипептид CH3 домена содержит дополнительные аминокислотные модификации K392, Т411, D399 и S400. В другом аспекте первый полипептид CH3 домена содержит аминокислотную модификацию D399R, S400R и Y407A, а второй полипептид CH3 домена содержит аминокислотную модификацию Т366А, K409F, K392E и Т411Е. Согласно другому варианту изобретения вариантная форма CH3 домена имеет температуру плавления (Tm) около 74°С или выше, а чистота гетеродимера составляет около 95% или выше.
Согласно другому варианту предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает первый полипептид CH3 домена, содержащий аминокислотную модификацию в положении L351 и аминокислотную модификацию Y407A, и второй полипептид CH3 домена, содержащий аминокислотную модификацию в положении Т366 и аминокислотную модификацию K409F. В одном аспекте аминокислотная модификация в положении L351 выбрана из L351Y, L351I, L351D, L351R или L351F. В другом аспекте аминокислотная модификация в положении Y407 выбрана из Y407A, Y407V или Y407S. Еще в одном аспекте аминокислотная модификация в положении Т366 выбрана из Т366А, T366I, T366L, Т366М, T366Y, T366S, Т366С, T366V или T366W. Согласно одному варианту изобретения вариантная форма CH3 домена имеет температуру плавления (Tm) около 75°С или выше, а чистота гетеродимера составляет около 90% или выше.
Согласно другому варианту предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает первый полипептид CH3 домена, содержащий аминокислотную модификацию в положении F405 и аминокислотные модификации L351Y и Y407V, а второй полипептид CH3 домена содержит аминокислотную модификацию в положении T394W. В одном аспекте первый полипептид CH3 домена или второй полипептид CH3 домена содержит дополнительные аминокислотную модификацию в положениях K392, Т411, Т366, L368 или S400. Аминокислотная модификация в положении F405 представляет собой F405A, F405I, F405M, F405T, F405S, F405V или F405W. Аминокислотная модификация в положении K392 представляет собой K392V, K392M, K392R, K392L, K392F или K392E. Аминокислотная модификация в положении Т411 представляет собой T411N, T411R, T411Q, T411K, T411D, Т411Е или T411W. Аминокислотная модификация в положении S400 представляет собой S400E, S400D, S400R или S400K. Аминокислотная модификация в положении Т366 представляет собой Т366А, T366I, T366L, Т366М, T366Y, T366S, Т366С, T366V или T366W. Аминокислотная модификация в положении L368 представляет собой L368D, L368R, L368T, L368M, L368V, L368F, L368S и L368A.
Согласно другому варианту предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает первый полипептид CH3 домена, содержащий аминокислотные модификации L351Y, F405A и Y407V, а второй полипептид CH3 домена содержит аминокислотную модификацию в положении T394W. В одном аспекте второй полипептид CH3 домена содержит аминокислотную модификацию T366L или T366I.
Согласно еще одному варианту предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает первый полипептид CH3 домена, содержащий аминокислотные модификации F405A и Y407V, а второй полипептид CH3 домена содержит аминокислотные модификации в T366I, K392M и T394W.
Согласно некоторым вариантам предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает первый полипептид CH3 домена, содержащий аминокислотные модификации F405A и Y407V, а второй полипептид CH3 домена содержит аминокислотные модификации T366L, K392M и T394W.
Согласно другому варианту изобретения предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает первый полипептид CH3 домена, содержащий аминокислотные модификации F405A и Y407V, а второй полипептид CH3 домена содержит аминокислотные модификации T366L и T394W.
Согласно другому варианту изобретения предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает первый полипептид CH3 домена, содержащий аминокислотные модификации F405A и Y407V, а второй полипептид CH3 домена содержит аминокислотные модификации T366I и T394W.
Согласно некоторым вариантам гетеромультимера предусматривается биспецифическое антитело или мультиспецифическое антитело.
Согласно другому варианту предусматривается композиция, содержащая гетеромультимер по изобретению и фармацевтически приемлемый носитель.
Согласно другому варианту предусматривается клетка-хозяин, содержащая нуклеиновую кислоту, кодирующую гетеромультимер по изобретению.
Согласно некоторым вариантам изобретения предусматривается мультимер, который содержит, по меньшей мере одно терапевтическое антитело. В одном аспекте терапевтическое антитело выбрано из группы, состоящей из абаговомаба, адалимумаба, алемтузумаба, аурограба, бапинеузумаба, базиликсимаба, белимумаба, бевацизумаба, бриакинумаба, канакинумаба, катумаксомаба, цертолизумаба пегол, цетуксимаба, даклизумаба, деносумаба, эфализумаба, галиксимаба, гемтузумаба озогамицина, голимумаба, ибритумомаба тиуксетана, инфликсимаба, ипилимумаба, лумиликсимаба, меполизумаба, мотавизумаба, муромонаба, микограба, натализумаба, нимотузумаба, окрелизумаба, офатумумаба, омализумаба, паливизумаба, панитумумаба, пертузумаба, ранибизумаба, реслизумаба, ритуксимаба, теплизумаба, тоцилизумаба/атлизумаба, тозитумомаба, трастузумаба, ProxiniumTM, RencarexTM, устекинумаба и залутумумаба.
Согласно другому варианту гетеромультимера по изобретению предусматривается способ лечения рака у пациента, больного раком, характеризующимся антигеном рака, причем указанный способ включает введение указанному пациенту терапевтически эффективного количества гетеромультимера.
Согласно другому варианту гетеромультимера по изобретению предусматривается способ лечения иммунных расстройств (нарушений) у пациента, страдающего иммунным нарушением, характеризующимся иммунным антигеном, причем указанный способ включает введение указанному пациенту терапевтически эффективного количества гетеромультимера.
Согласно еще одному варианту предусматривается выделенный гетеромультимер, содержащий гетеродимерную область Fc, причем гетеродимерная область Fc включает вариантную форму CH3 домена, содержащую аминокислотные мутации, стимулирующие образование гетеродимера с повышенной устойчивостью, а вариантная форма CH3 доменов выбрана из вариантов, перечисленных в Таблице 1, Таблице 6 или Таблице 7.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фигуре 1 графически представлена 3-D структура антитела дикого типа, показывающая области CH3 (вверху), СН2 (в середине) и рецепторную области. Пунктирный прямоугольник слева в увеличенном виде представлен справа и показывает две области, Область 1 и Область 2, целевой области CH3;
На Фигуре 2 дано графическое 3-D изображение остатка дикого типа в положении 368;
На Фигуре 3 дано графическое 3-D изображение Области 1, показывающее изменившееся (мутировавшее) положение 368;
На Фигуре 4 дано графическое 3-D изображение дополнительных мутаций в Области 2;
На Фигуре 5 представлена таблица расчетов компьютерного моделирования (in silico) оценки столкновений, разницы площади области контакта (интерфейса), разницы упаковки, разницы электростатической энергии и общей "оценки аффинности" для первых трех вариантов AZ1, AZ2 и AZ3;
На Фигуре 6 дано графическое 3-D изображение вариантов AZ2 и AZ3, которые "основаны на" варианте AZ1;
На Фигуре 7 дано графическое 3-D изображение вариантов AZ2 и AZ3.
На Фигуре 8 представлена таблица, аналогичная таблице на Фигуре 5, но для AZ1, AZ2 и AZ3 гетеродимеров и гомодимеров. Оценка аффинности для гомодимеров не является релевантной, поэтому отсутствует оценка этого аспекта для гомодимеров;
На Фигуре 9 дано графическое 3-D изображение дикого типа (слева) и мутантного AZ4 (справа);
На Фигуре 10 представлена таблица, аналогичная таблице на Фигуре 5, показывающая компьютерные (in silico) расчеты для моделирования AZ4 гетеродимера и гомодимеров;
На Фигуре 11 дано графическое изображение CH3 вариантов AZ5 (слева) и AZ6 (справа);
На Фигуре 12 представлена таблица, аналогичная таблице на Фигуре 5, показывающая in silico данные для AZ4, AZ5 и AZ6;
На Фигуре 13 дано графическое 3-D изображение антитела слева с изображением обоснования особенностей связывания в рецепторной области с применением гетеродимерного подхода;
На Фигуре 14 дано схематическое изображение молекулы IgG;
На Фигуре 15 показано множественное выравнивание последовательностей Fcγ рецепторов. ID последовательностей в Genbank/Uniprot: FcγRIIA (sp P12318), FcγRIIB (sp P31994), FcγRIIC (gi 126116592), FcγRIIIA (sp P08637), FcγRIIIB (sp 075015);
На Фигуре 16 схематически представлена структура кристалла комплекса Fc-FcγRIIIb Complex [PDB ID: 1T83, Radaev & Sun]. В полученном комплексе 1:1 Fc и рецептора Fcγ наблюдается асимметричный контакт между двумя цепями Fc и FcγR;
На Фигуре 17 схематически представлены альтернативные мультифункциональные молекулы на основе асимметричной Fc каркасной структуры:
Асимметричный Fc каркас и Асимметричный Fc- плечо мономерного IgG;
На Фигуре 18 схематически представлены альтернативные мультифункциональные молекулы на основе асимметричной Fc каркасной структуры:
Асимметричный Fc- плечи моноспецифического IgG и Асимметричный Fc- плечи биспецифического IgG (общая легкая цепь);
На Фигуре 19 схематически представлены альтернативные мультифункциональные молекулы на основе асимметричной Fc каркасной структуры:
Асимметричный Fc- плечи биспецифического IgG и функциональная молекула, такая как токсин;
На Фигуре 20 схематически представлены альтернативные мультифункциональные молекулы на основе асимметричной Fc каркасной структуры:
Асимметричный Fc- одно плечо scFv и Асимметричный Fc- биспецифические scFv плечи.
На Фигуре 21 схематически представлены альтернативные мультифункциональные молекулы на основе асимметричной Fc каркасной структуры: Асимметричный Fc-триспецифические scFv плечи и Асимметричный Fc-тетраспецифические scFv плечи.
На Фигуре 22 представлен асимметричный дизайн мутаций на одной стороне Fc, который с целью повышения FcγR селективности вводит благоприятную сторону для FcγR взаимодействий и неблагоприятную сторону для взаимодействий, подобных взаимодействиям дикого типа. Мутации на неблагоприятной стороне Fc можно вводить с целью блокады взаимодействий с FcR и полярности смещения Fc с тем, чтобы взаимодействие происходило только с благоприятной стороны.
На Фигуре 23 показана аминокислотная последовательность для дикого типа человеческого IgG1.
На Фигуре 24 показан итеративный процесс дизайна Fc гетеродимера, объединяющий стратегию позитивного и негативного дизайна, подробнее описанную ниже.
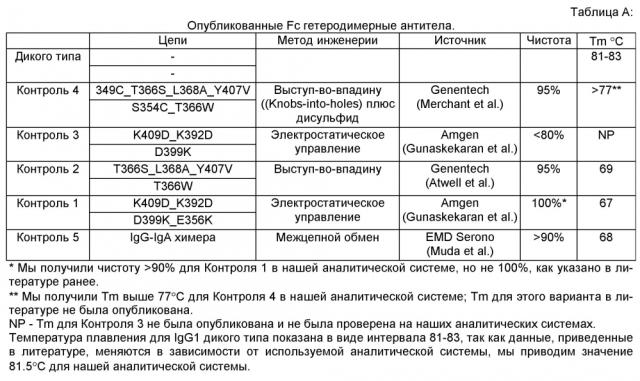
На Фигуре 25 показан in vitro анализ, применяемый для определения чистоты гетеродимера. Анализ проводили с использованием структуры полноразмерного моноспецифического антитела с двумя Fc тяжелыми цепями различной молекулярной массы. Тяжелая цепь А имеет С-концевую метку HisTag (His), а тяжелая цепь В имеет C-концевую отщепляемую метку mRFP Tag (RFP). Две тяжелых цепи A (His) и В (RFP) экспрессируются в различных относительных пропорциях вместе с фиксированным количеством легкой цепи, что приводит в результате к 3 возможным видам димеров с различной молекулярной массой: а) Гомодимер Цепь A (His)/ Цепь A (His) (~150 кДа); б) Гетеродимер Цепь A (His)/ Цепь В (RFP) (~175 кДа); в) Гомодимер Цепь В (RFP)/ Цепь В (RFP) (~200 кДа). После экспрессии, описанной в Примере 2, соотношение гетеродимер: два гомодимера определяли методом SDS-PAGE гель-электрофореза (электрофазу в полиакриламидном геле в присутствии додецилсульфата натрия) в невосстанавливающих условиях, который позволяет разделить 3 вида димера в зависимости молекулярной массы. Гели SDS-PAGE окрашивали Кумасси бриллиантовым голубым.
Фигура 25А. Проверяли следующие варианты: WT цепь A (His) только; WT цепь В (RFP) только; WT цепь A (His) плюс цепь В (RFP); Контроль 1 цепь A (His) плюс цепь В (RFP) с подтвержденной чистотой гетеродимера >95%. Состав полос димеров проверяли Вестерн-блоттингом с использованием антител, специфических к IgG-Fc (anti-Fc), mRFP Tag (anti-mRFP) и к HisTag (anti-His), показанных выше. Анализ методом SDS-PAGE гель-электрофореза показывает одну полосу для гомодимера His/His, двойную полосу для гетеродимера His/RFP и несколько полос для гомодимера RFP. Несколько полос является свойством, признаком mRFP Tag и, как было подтверждено, не влияет на физические свойства гетеродимера Fc.
Фигура 25B. Анализ методом SDS-PAGE гель-электрофореза подтверждали с использованием в качестве контроля опубликованных гетеродимерных Fc вариантов Контроль 1-4, См., Таблицу А. Варианты экспрессировали с различными соотношениями цепи A (His) и цепи В (RFP): Конкретно, соотношение 1:3 эквивалентно соотношению LC,HC_His,HC_mRFP 25%,10%,65%; соотношение 1:1 эквивалентно 25%,20%,55% и соотношение 3:1 эквивалентно 25%, 40%,35%, соответственно (как было определено, кажущееся соотношение 1:1 экспрессии цепи A (His) к цепи В (RFP) близко к 20%/55% (His/RFP) для WT Fc).
На Фигуре 25С. показан анализ методом SDS-PAGE гель-электрофореза в невосстанавливающих условиях по определению чистоты вариантов гетеродимера с каркасной структурой 1. Fc варианты экспрессировали с различными соотношениями цепи A (His) к цепи В (RFP) и анализировали методом SDS-PAGE гель-электрофореза в невосстанавливающих условиях, как описано на Фигуре 2. Конкретно, соотношение 1:3 эквивалентно соотношению LC,HC_His,HC_mRFP 25%,10%,65%; соотношение 1:1 эквивалентно 25%,20%,55% и соотношение 3:1 эквивалентно 25%, 40%,35%, соответственно как было определено, кажущееся соотношение 1:1 экспрессии цепи А (His) к цепи В (RFP) близко к 20%/55% (His/RFP) для WT Fc).
На Фигуре 26 показаны варианты гетеродимеров Fc, экспрессирующихся с конкретным соотношением цепи A (His) к цепи В (RFP) (См. Таблицу 2), очищенные аффинной хроматографией на колонке с Белком и проанализированные методом SDS-PAGE гель-электрофореза в невосстанавливающих условиях, как описано на Фигуре 25.
На Фигуре 26А показано, как различные варианты были сгруппированы в зависимости от категории чистоты на основании визуального изучения результатов SDS-PAGE гель-электрофореза. Для сравнения на гель наносили эквивалентное количество продукта, очищенного на колонке с Белком А. Это определение степени чистоты методом SDS-PAGE гель-электрофореза в невосстанавливающих условиях было подтверждено методом LC/MS для выбранных вариантов (см. Фигуру 28).
На Фигуре 26B показаны типичные результаты SDS-PAGE гель-электрофореза для выбранных гетеродимерных вариантов с каркасной структурой 1 и 2, очищенных на колонке с Белком A (AZ94, AZ86, AZ70, AZ33 и AZ34).
На Фигуре 27 проиллюстрирован анализ методом DSC (дифференциальной сканирующей калориметрии, ДСК) по определению температуры плавления домена СН3-CH3, при этом применяли два независимых метода.
Фигура 27А. Термограммы были построены по 4 независимым переходам "non-two-state" и оптимизированы, чтобы получить значения для СН2 и Fab переходов, близкие литературным данным для герцептина ~72°С (СН2) и ~82°С (Fab).
Фигура 27B. Нормализованные и скорректированные относительно базовой линии термограммы для гетеродимерных вариантов вычитали из WT, получая пик положительной и отрицательной разницы только для CH3 перехода.
На Фигуре 28 иллюстрируется ЖХ/МС анализ типичного варианта AZ70, описанного в примере 2. Указаны предполагаемые (вычисленные средние) массы гликозилированных гетеродимера и гомодимеров. Область, соответствующая массе гетеродимера, содержит основные пики, соответствующие потере глицина (-57 Да) и добавлению 1 или 2 гексоз (+162 Да и +324 Да, соответственно). Чистоту гетеродимера определяли как >90%, если отсутствовали заметные пики, соответствующие любому из гомодимеров.
На Фигуре 29 показана область контакта CH3 Фиг.29А WT Fc; Фиг.29B AZ6; Фиг.29С AZ33; Фиг.29D AZ19. Полный in silico анализ, описанный в разделе "Осуществление изобретения", и сравнение вариантов с WT показало, что одной из причин более низкой устойчивости исходного гетеродимера AZ33, чем WT, является отсутствие взаимодействия ядра/упаковки Y407 и Т366. В исходном AZ33 наблюдается неоптимальная упаковка в этом гидрофобном ядре, показанная на Фиг.29B, это означает, что оптимизация этой области, в частности, в положении Т366, должна повысить устойчивость AZ33. Это иллюстрируется на Фиг.29С и Фиг.29D введением T366I и T366L. Экспериментальные данные коррелируют с этим структурным анализом и показывают, что T366L дает наибольшее увеличение Tm. См., Пример 5.
На Фигуре 30 (А, В-увеличение части фигуры А) иллюстрируется полезность и важность анализа конформационной динамики, поясняемая вариантом AZ8 с исходным каркасом 1. Структура после in silico мутагенеза (конформация скелета близка к конформации WT) совмещается с характерной структурой 50 не моделирования методами молекулярной динамики. На Фигуре четко показана большая разница между конформациями в области петли D399-S400 варианта AZ8 по сравнению с WT, что, в свою очередь, делает доступным гидрофобное ядро для растворителя и служит причиной пониженной устойчивости AZ8 гетеродимера.
На Фигуре 31 показано, как сведения, полученные с помощью полного in silico анализа и моделирования MD, применялись для описания стратегии позитивного дизайна. Как показано на Фигуре 30, одной из причин пониженной устойчивости AZ8 по сравнению с WT является более слабое взаимодействие петли 399-400 с 409, вызванное, главным образом, утратой взаимодействия с F405 упаковки (см. сравнение Фиг.31А (WT) с Фиг.31B (AZ8)). Одним из подходов позитивного дизайна явилась оптимизация гидрофобной упаковки области с целью стабилизации конформации петли 399-400. Эту оптимизацию осуществляли с помощью мутации K392M, показанной на Фиг.31С. На Фиг.31С показан гетеродимер AZ33, который имеет Tm 74° по сравнению с Tm 68° начального варианта негативного дизайна AZ8.
На Фигуре 32 представлена динамика Fc молекулы, полученная Методом главных компонент, позволяющим рассчитать основные движения из траектории молекулярной динамики. На Фиг.32А показан чертеж скелета Fc структуры в качестве эталона. На Фиг.32B и С показано наложение динамики, наблюдаемой в соответствии с 2 самыми главными способами движения в Fc структуре. Наблюдается заметное движение раскрытие/закрытие СН2 доменов цепей А и В относительно друг друга, тогда как CH3 домены являются сравнительно неизменными. Мутации в области контакта (интерфейсе) CH3 оказывают воздействие на относительную гибкость и динамику этого движения открыть/закрыть в СН2 доменах.
На Фигуре 33 показана упаковка гидрофобного ядра двух вариантов с каркасной структурой -2 по сравнению с WT. Фиг.33А WT Fc; Фиг.33B AZ63; и Фиг.33С AZ70. Полный анализ in-silico исходного варианта с каркасной структурой -2 показал, что утрата взаимодействий ядра WT Y407-T366 является одной из причин более низкой устойчивости исходных вариантов с каркасом-2 по сравнению с WT. Утрата Y407- Т366 частично компенсируется мутациями K409F, но, как показано на Фиг.33B, в особенности мутация Т366А, оставляет в гидрофобном ядре впадину, которая дестабилизирует вариант по сравнению с WT. Оказалось, что нацеливание на это гидрофобное ядро дополнительных мутаций T366VJL351Y, как показано на примере Fc варианта AZ70 на Фиг.33С, является успешным; экспериментально определенная Tm AZ70 равна 75.5°С. См. Таблицу 4 и Пример 6.
На Фигуре 34 показаны взаимодействия петли 399-400 двух вариантов каркасной структуры-2 по сравнению с WT: Фиг.34А WT Fc; Фиг.34В AZ63; и Фиг 34С AZ94. Полный анализ in-silico исходного варианта с каркасной структурой -2 показал, что утрата WT солевого мостика K409-D399 (Фиг.34А) вследствие мутации K409F и, следовательно, ненасыщенного остатка D399 (Фиг.34B) является причиной более ′открытой′ конформации петли 399-400. Помимо всего прочего, это увеличивает доступ растворителя к гидрофобному ядру и дополнительно повышает дестабилизацию варианта по сравнению с WT. Одним из методов, применяемых для стабилизации петли 399-400 и компенсации утраты взаимодействия K409-D399, являлось создание дополнительных солевых мостиков D399R-T411E и S400R-K392E, как показано на Фиг.34С для варианта AZ94. Экспериментально доказано, что степень чистоты >95% и Tm равна 74°С. См. Таблицу 4 и Пример 6. Далее, хотя AZ94 имеет значительно более высокую степень чистоты и более устойчив по сравнению с начальным вариантом с каркасом-2 (чистота <90%, Tm 71°С), мутации в гидрофобном ядре AZ94 являются менее предпочтительными, чем ′наилучшие′ мутации в гидрофобном ядре, идентифицированные в варианте AZ70 (Фигура 33). Так как мутации в гидрофобном ядре в AZ70 (T366V_L351Y) отдалены от мутаций солевых мостиков AZ94 в петле 399-400, предполагается, что комбинация аминокислотных мутаций AZ70 и дополнительных мутаций AZ94 даст более высокую температуру плавления, чем температура плавления AZ70 или AZ94. Эту комбинацию проверяли, как описано в Примерах 1-4.
На Фигуре 35 показаны константы ассоциации (Ka(М-1)) для процессов связывания гомодимерного IgG1 Fc, гетеродимерного вариантов het1 (Контроль 1): A:Y349C_T366S_L368A_Y407V/B:S354C_T366W и het2 (Контроль 4): A:K409D_K392D/B:D399K_D356K с шестью Fc гамма рецепторами. Для гетеродимерных Fc вариантов наблюдается тенденция к слегка измененному связыванию с Fc гамма рецепторами по сравнению с дикого типа IgG1 Fc. См. Пример 7.
На Фигуре 36А показана относительная прочность связывания (связывающая способность) дикого типа IgG1 Fc и его различных гомодимерных и асимметричных мутантных форм с рецепторами IIbF, IIBY и IIaR, прочность связывания для дикого типа применяли в качестве эталона. (Homo Fc + S267D) относится к связывающей способности гомодимерного Fc с мутацией S267D в обеих цепях. (Het Fc + asym S267D) относится к прочности связывания гомодимерного Fc с мутацией S267D, введенной в одну из двух цепей в Fc. Приводится средняя величина прочности связывания способности, полученная при введении мутации в любую из двух цепей Fc. Введение этой мутации в одну цепь уменьшает прочность связывания, приблизительно, вдвое по сравнению с прочностью связывания для той же самой мутации в гомодимерном продукте. (Het Fc + asym S267D + asym E269K) относится к прочности связывания гомодимерного Fc как с мутацией S267D, так и с мутацией and E269K, введенными асимметрично в одну из двух цепей Fc. Мутация E269K блокирует взаимодействие FcgR с одной из сторон Fc и способна снижать прочность связывания, приблизительно, вдвое по сравнению с прочностью связывания, наблюдаемой для самого асимметричного S267D варианта (Het Fc + S267D). В данном случае Het Fc состоит из CH3 мутаций, указанных для варианта het2 (Контроль 4) на Фигуре 35.
На Фигуре 36B приводится константа ассоциации (Ka(M-1)) различных Fc и их вариантов с несколькими FcgRIIa, FcgRIIb и FcgRIIIa аллотипами. Ka дикого типа IgG1 Fc с различными Fcg рецепторами представлена в виде столбцов со штриховкой горизонтальными линиями. Столбцы со штриховкой вертикальными линиями (homodimer base2) изображают Ka гомодимерного Fc с мутациями S239D/D265S/I332E/S298A. Столбцы со штриховкой наклонными линиями изображают Ka гетеродимерного Fc с асимметричными мутациями A:S239D/D265S/I332E/E269K и B:S239D/D265S/S298A в СН2 домене. Введение ассиметричных мутаций позволяет достичь повышенной селективности при выборе между IIIa и IIa/IIb рецепторами. В данном случае гетеродимерный Fc состоит из CH3 мутаций, указанных для варианта het2 (Контроль 4) на Фигуре 35.
На Фигуре 36С показана константа ассоциации (Ka(М-1)) для дикого типа IgG1 и трех других вариантов, включающих гомодимерные или асимметричные мутации в СН2 домене области Fc. Значения Ka дикого типа Fc представлены столбцом, заштрихованным в виде