Сополимер-1, способы его получения и аналитические методы
Иллюстрации
Показать всеИзобретение относится к способу получения маркеров молекулярной массы для глатирамера ацетата со случайной аминокислотной последовательностью, аналогичной последовательности глатирамера ацетата, содержащему стадии: a) воздействие на полипептидную смесь, которая является смесью полипептидов, содержащих аланин, глутаминовую кислоту, тирозин и лизин в том же молярном соотношении, что у глатирамера ацетата, гель-проникающей хроматографией (ГПХ)/эксклюзионной хроматографией (ЭХ) для получения полипептидных фракций с молекулярными массами в диапазоне от 2 кДа до 30 кДа; b) выбор полипептидных фракций, которые будут использованы в качестве маркеров молекулярной массы, из указанных полипептидных фракций, полученных на стадии а), таким образом, что одна из фракций представляет вершину пика молекулярной массы, а другие фракции распределены по обе стороны от вершины пика молекулярной массы; и c) определение полидисперсности указанных выбранных полипептидных фракций, где полидисперсность указанных выбранных полипептидных фракций должна составлять меньше, чем или быть равной 1,20. 18 з.п. ф-лы, 9 ил., 21 табл., 21 пр.
Реферат
Родственная заявка
Данная заявка испрашивает приоритет по предварительной заявки на патент Индии №409/MUM/2011, поданной 14 февраля 2011 года.
Область изобретения
Настоящее изобретение относится к аналитическим методам, таким как определение молекулярной массы полипептида, в частности, глатирамера ацетата. Настоящее изобретение также относится к улучшенному способу получения полипептидов или их фармацевтически приемлемых солей, в частности, глатирамера ацетата, также известного как сополимер-1. Настоящее изобретение также относится к определению характеристик глатирамера ацетата пептидным картированием.
Предпосылки создания изобретения
Одно из наиболее распространенных неврологических заболеваний взрослых людей представляет собой рассеянный склероз. Это состояние является хроническим, воспалительным заболеванием ЦНС, которое характеризуется демиелинизацией в головном мозге и спинном мозге. Глатирамера ацетат (ГА), известный также как сополимер-1, как было показано, является эффективным при лечении рассеянного склероза (PC). Ежедневные подкожные инъекции глатирамера ацетатом (20 мг/инъекцию) уменьшают патологические изменения, частоту рецидивов и прогрессирование нетрудоспособности (Johnson K.P. et al, Neurol., 1995, 45 (7): 1268-76). Глатирамера ацетат уменьшает долю новых поражений PC, прогрессирующих в «черные дыры» (Filippi М. et al, Neurol., 2001, 57: 731-733).
Глатирамера ацетат (Сополимер-1) обозначен торговой маркой КОПАКСОН®. Он предназначен для снижения частоты рецидивов у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом (РРМС). Глатирамера ацетат состоит из ацетатных солей синтетических полипептидов, содержащих четыре встречающиеся в природе аминокислоты: L-глутаминовую кислоту, L-аланин, L-тирозин и L-лизин со средней мольной долей 0,141, 0,427, 0,095 и 0,338, соответственно. Он синтезируется путем химической полимеризации четырех аминокислот с получением продукта с желаемым диапазоном молекулярных масс. Средняя молекулярная масса глатирамера ацетата составляет 4,700-11,000 дальтон [маркировка США для лиофилизированного порошка] или 5000-9000 дальтон [маркировка США для предварительно заполненного шприца/общая характеристика продукта]. Копаксон содержит смесь полипептидов, имеющих различные молекулярные массы и последовательности.
Структурная формула Копаксона представляет собой
(Glu, Ala, Lys, Tyr)х. xCH3COOH
(C5H9NO4. C3H7NO2.C6H14N2O2.C9H11NO3)x. xC2H4O2
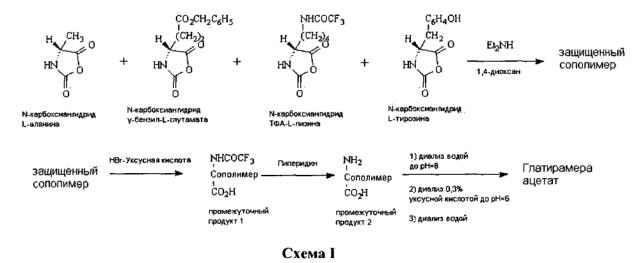
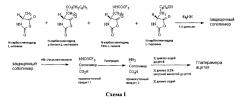
Способ получения глатирамера ацетата описан в Euro. J. Immun. 1, 242-248 (1971) [Tietelbaum et al] и US3849550 [Tietelbaum et al]. В US 3849550 раскрыт способ, в котором N-карбоксиангидриды тирозина, аланина, γ-бензил-глутамата и ε-N-трифторацетил-лизина полимеризуют при комнатной температуре в безводном диоксане с диэтиламином в качестве инициатора. Удаление защитной γ-карбоксильной группы глутаминовой кислоты осуществляется с помощью бромистого водорода в ледяной уксусной кислоте, за которым следует удаление трифторацетильных групп от остатков лизина при помощи 1М пиперидина.
Способ получения сополимера-1 также описан в US 5800808, IN 190759, US 5981589, US 6054430, US 6342476, US 6362161 и WO 00/05250. Эти документы подробно останавливаются на способе получения сополимера-1, включающем полимеризацию четырех N-карбоксиангидридов аминокислот, чтобы получить защищенный сополимер и снятие защиты с защищенного сополимера с использованием бромистого водорода в уксусной кислоте и пиперидине для получения сополимера с удаленной защитной группой, который затем подвергают диализу для очистки и солевого обмена.
В US 20060172942 раскрывается способ получения глатирамера ацетата, который включает полимеризацию N-карбоксиангидридов тирозина, аланина, γ-бензилглутамата и трифторацетил-лизина, чтобы получить защищенные полипептиды. Бензильная защитная группа из защищенных полипептидов удаляется путем каталитического гидрогенолиза с последующим удалением трифторацетильной защитной группы за счет взаимодействия полипептида с органическим основанием. Свободные трифторацетильные группы и низкомолекулярные примеси удаляют из полипептидной смеси путем ультрафильтрации с последующим контактированием полипептидной смеси с водным раствором уксусной кислоты с получением соли уксусной кислоты полипептида.
В US 7049399 описывается способ получения полипептида, содержащего полимеризацию смеси N-карбоксиангидридов L-аланина, L-тирозина, защищенного L-глутамата и защищенного L-лизина, чтобы получить защищенный сополимер или его соль; снятие защиты с защищенного сополимера (или его соли), чтобы получить полипептид или его фармацевтически приемлемую соль в одну стадию, разделение и очистку полипептида (или его фармацевтически приемлемой соли), с получением очищенного полипептида. Снятие защиты с защищенного сополимера осуществляют либо путем передачи каталитического гидрирования или каталитическим гидрированием под давлением водорода в пределах от 40-100 фунтов на квадратный дюйм (psi) и при температуре в диапазоне от 50°-80°C.
Недостатком по отношению к способу, описанному в этих документах, является то, что гидрогенолиз требует высоких давления и температуры, что в свою очередь, требует дополнительных мер предосторожности при работе в крупных масштабах, тем самым увеличивая стоимость производства. Так как Копаксон является стабильным при низкой температуре от 2°C до 8°C, высокая температура во время последней стадии может привести к разложению продукта, снижая тем самым качество и выход целевого продукта.
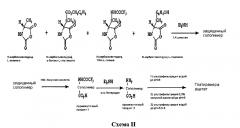
В WO 2006050122 описан двухстадийный способ получения глатирамера ацетата. Способ включает полимеризацию смеси N-карбоксиангидрида L-тирозина, N-карбоксиангидрида L-аланина, N-карбоксиангидрида защищенного L-глутамата и N-карбоксиангидрида N-защищенного L-лизина, в полярном апротонном растворителе в присутствии инициатора с образованием защищенного глатирамера, добавление кислоты и/или органического или неорганического основания к образованному защищенному глатирамеру, чтобы формировать глатирамер, и обработку полученного глатирамера с уксусной кислотой с образованием глатирамера ацетата. Снятие защиты с защищенного глатирамера осуществляется двумя различными способами. Первый способ для удаления защитных групп заключается в обработке кислотой и второй способ для снятия защиты осуществляют путем обработки гидроксидом щелочноземельного металла. Недостатком указанного способа является то, что использование гидроксида щелочноземельного металла для удаления защитных групп у пептидов приводит к медленным реакциям и образованию высоких уровней диастереомера в результате рацемизации/эпимеризации стереогенных центров (Ahmed F. Abdel-Magid et al, Tetrahedron Letters 39, 3391 (1998)).
В WO 2006029393 раскрыт способ получения смеси трифторацетил- полипептидов, у которых могут быть разные аминокислотные последовательности, где каждый полипептид состоит, по существу, из аланина, глутаминовой кислоты, тирозина и лизина, где смесь имеет желаемую среднюю молекулярную массу, содержащий удаление защитной группы у смеси полипептидов, каждый из которых состоит по существу из аланина, γ-бензилглутамата, тирозина и трифторацетил-лизина с помощью раствора бромистоводородной кислоты в уксусной кислоте, причем раствор содержит менее, чем 0,5% свободного брома и менее, чем 1000 частей на миллион (мд) примесей ионов металлов. В данном документе также раскрыто, что раствор бромистоводородной кислоты в уксусной кислоте, имеющей менее чем 0,5% свободного брома, может быть получен путем предварительной обработки раствора брома акцептором, предпочтительно фенолом, чтобы уменьшить уровень свободного брома. Также в этом документе раскрыто использование от 10% до 36% бромистоводородной кислоты в уксусной кислоте.
В US 20080021200 раскрыт способ получения полипептида, содержащего L-тирозин, L-аланин, L-глутамат и L-лизин или их фармацевтически приемлемую соль, где указанный способ включает: (а) полимеризацию смеси N-карбоксиангидрида L-тирозина, N-карбоксиангидрида L-аланина, N-карбоксиангидрида защищенного L-глутамата и N-карбоксиангидрида защищенного L-лизина, в полярном апротонном растворителе в присутствии инициатора, с образованием защищенного полипептида, (b) смешивание кислоты с защищенным полипептидом, полученным на стадии (а) и растворителем, с образованием продукта, и (с) смешивание вещества, выбранного из группы, состоящей из диизопропиламина, изопропиламина, аммиака и их смесей, с продуктом, полученным на стадии (b) и водой, или смеси растворителя и воды, чтобы сформировать полипептид с удаленной защитной группой или его фармацевтически приемлемую соль. Кроме того, раскрывается, что диизопропиламин и изопропиламин были единственными аминами, которые успешно удалили Nε-трифторацетильную группу из фрагмента лизина. Также в данном документе раскрыто, что, когда диизопропиламин или изопропиламин используются для удаления трифторацетильных групп, получают прозрачный раствор через 1 ч или примерно через 1,5 часа, соответственно.
В WO 2009016643 описывается способ получения глатирамера ацетата (Сополимер-1), где трифторацетил-сополимер-1, полученный после реакции дебензилирования, промывают органическим растворителем, чтобы удалить реакционный бензилбромид, вырабатываемый в качестве побочного продукта реакции. Высвобожденный бензилбромид является высоко реакционноспособным электрофилом и реагирует с нуклеофилами, подобно первичным и вторичным аминам, чтобы генерировать нежелательные N-алкилированные продукты. Также он высоко слезоточивый и обработка его в больших количествах в промышленных масштабах является вредной и небезопасной. В WO′643 также раскрывается реакция дебензилирования защищенного сополимера-1 в течение более короткого периода времени при высокой температуре и способ для удаления бензилбромида из реакционной смеси. Удаление бензильной защитной группы глутаминовой кислоты зависит от 33% бромистого водорода в уксусной кислоте при температуре 35-45°C в течение 1-5 часов, тем самым уменьшая время реакции, и для того, чтобы удалить бензилбромид, отфильтрованный продукт промывают органическим растворителем. Этот способ использует дополнительный органический растворитель, который является нежелательным в промышленном масштабе. Таким образом, способы получения глатирамера ацетата, как описано выше, являются промышленно неосуществимыми.
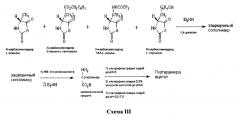
Авторы настоящего изобретения разработали простой и экономически эффективный, рентабельный и унифицированный способ получения сополимера-1 (глатирамера ацетата). Применение 33% HBr приводит к расщеплению пептидных связей в полимере приводя к получению низкомолекулярных соединений. Настоящее изобретение обеспечивает более рентабельный способ получения глатирамера ацетата с использованием примерно 7% до 20% HBr, предпочтительно, около 15% HBr, в уксусной кислоте для удаления бензильной защитной группы при комнатной температуре, предпочтительно приблизительно при 23°C до 30°C, более предпочтительно при около 25°C, наиболее предпочтительно при 25°C±0,2°C. Настоящее изобретение также относится к способу получения глатирамера ацетата, где влажное твердое вещество, полученное после первой стадии удаления защитных групп, не подвергают сушке и используют как таковое в последующей реакции, что экономит много времени и, следовательно, считается промышленно осуществимым способом. Настоящее изобретение также относится к способу удаления трифторацетильной защитной группы с использованием амина, предпочтительно вторичного амина, такого как диалкиламин, выбранного из диэтиламина, диметиламина или диизопропиламина, предпочтительно, диэтиламина.
Предшествующий уровень техники обеспечивает способы определения молекулярной массы полипептидов, в частности глатирамера ацетата. В WO 200018794 (WO′794) раскрывается использование множества маркеров молекулярной массы, чтобы установить связь между временем удерживания на хроматографической колонке и молекулярной массой для определения средней молекулярной массы партии глатирамера ацетата. Каждый из этих маркеров молекулярной массы, раскрытый в WO′794, представляет собой полипептид, и имеет предварительно определенную аминокислотную последовательность и определенную молекулярную массу. Настоящее изобретение относится к применению фракций полипептида (маркеров молекулярной массы), полученных, воздействуя на Копаксон/глатирамера ацетат/глатирамоиды эксклюзионной хроматографией (ЭХ), или гельпроникающей хроматографией (ГПХ), для определения молекулярной массы партий глатирамера ацетата. Полипептидные фракции (маркеры молекулярной массы), полученные способом по настоящему изобретению обладают определенной молекулярной массой. Однако аминокислотная последовательность указанной полипептидной фракции является случайной.
Другой аналитический метод, используемый для определения характеристик полипептида/белка представляет собой пептидное картирование. Пептидное картирование является сравнительной процедурой, в которой полученная информация, по сравнению с образцом для сравнения или стандартным веществом, обрабатываемым аналогичным образом, подтверждает первичную структуру полипептида/белка. Это помогает обнаружить, произошли ли изменения в структуре, и свидетельствует о постоянстве процесса и генетической стабильности. В WO 2010129851 предлагается способ, где гидролиз ферментами используют, чтобы расщепить стандартную сложную смесь полипептидов, такую как глатирамера ацетат, на несколько фрагментов пептида. Пептидные фрагменты анализируют с помощью масс-спектрометрии. Результаты масс-спектрометрии каждого образца используют как «отпечаток» для сравнения с другими образцами. Каждый фрагмент пептида, обнаруженный первым масс-анализатором, выбирают и подвергают второму масс-спектрометрическому анализу для расщепления ионов предшественника пептида на еще более мелкие фрагменты. Масс-спектры, полученные из тандемного масс спектрометрического анализа, анализируются с помощью программного обеспечения, такого как BioTools, чтобы получить последовательность каждого пептидного фрагмента.
В Expert Opin. Pharmacother. (2009) 10 (4) раскрывается, что полипептидное картирование с помощью разделения капиллярным электрофорезом полипептидных фрагментов, полученных после расщепления трипсином и картирование на основе протеолитического гидролиза с помощью карбоксипептидазы P, с последующим разделением фрагментов обращенно-фазовой ВЭЖХ является методом определения различий между последовательностями ГА структуры и других структур глатирамоидов. Карбоксипептидаза P является дорогим и труднодоступным реагентом. Авторы настоящего изобретения испробовали различные комбинации протеолитических ферментов. Было обнаружено авторами настоящего изобретения, что смесь полипептидов, обработанная трипсином с последующей обработкой карбоксипептидазой B дает результаты, аналогичные результаты с карбоксипептидазой P.
Задача изобретения
Задачей настоящего изобретения является создание маркеров молекулярной массы и их использование при определении молекулярной массы партий глатирамера ацетата посредством ГПХ.
Другой целью настоящего изобретения является создание простого, экономически эффективного, рентабельного и унифицированного способа получения полипептидов, в частности, глатирамера ацетата.
Другой целью настоящего изобретения является создание способа получения трифторацетил-сополимера путем обработки защищенного сополимера примерно от 7% до 20% HBr для получения сополимера-1.
Еще одной целью настоящего изобретения является создание способа получения сополимера-1 (глатирамера ацетата) обработкой защищенного сополимера или трифторацетил-сополимера диалкиламином, выбранным из диэтиламина, диметиламина, или диизопропиламина, предпочтительно диэтиламина, чтобы получить сополимер с частично удаленной защитной группой или сополимер с полностью удаленной защитной группой.
Другой целью настоящего изобретения является создание способа получения глатирамера ацетата, где влажное твердое вещество, полученное после первой стадии удаления защитных групп, не подвергают сушке и используют как таковое в последующей реакции, что экономит много времени и, следовательно, считается промышленно применимым способом.
Другая цель настоящего изобретения относится к способу определения характеристик полипептидной смеси, в частности глатирамера ацетата, с использованием трипсина и карбоксипептидазы В.
Сущность изобретения
Настоящее изобретение относится к способу получения полипептидных фракций со случайной последовательностью аминокислот, аналогичной последовательности глатирамера ацетата, которые служат в качестве маркеров молекулярной массы для глатирамера ацетата, содержащему стадии,
а) воздействие на полипептидную смесь, которая подобна глатирамера ацетату по аминокислотному составу и молярному соотношению аминокислот, гель-проникающей хроматографией (ГПХ)/эксклюзионной хроматографией (ЭХ), чтобы получить полипептидные фракции, имеющие молекулярные массы в диапазоне от 2кДа до 30 кДа;
b) выбор полипептидных фракций, которые будут использоваться в качестве маркеров молекулярной массы из указанных полипептидных фракций, полученных на стадии а), таким образом, что одна из фракций представляет собой вершину пика молекулярной массы, а другие фракции распределены по обе стороны от вершины пика молекулярной массы, и
c) определение коэффициента асимметрии пика этих выбранных полипептидных фракций.
Предпочтительно, коэффициент асимметрии пика выбранных полипептидных фракций находится в диапазоне от 0,8 до 1.
Предпочтительно, полидисперсность указанных выбранных полипептидных фракций составляет меньше, чем или равна 1,20.
Предпочтительно, смесь полипептидов представляет собой глатирамера ацетат.
Еще один аспект настоящего изобретения относится к применению полипептидных фракций, полученных способом по настоящему изобретению, в качестве маркеров молекулярной массы для определения молекулярной массы партии глатирамера ацетата посредством способа, содержащего следующие стадии
a) калибровка ЭХ-ВЭЖХ колонки с использованием указанных выбранных полипептидных фракций;
b) установление взаимосвязи между временем удерживания и логарифмом (log) молекулярной массы указанных выбранных фракций с помощью калибровочной кривой;
c) проведение ЭХ-ВЭЖХ партии Глатирамера ацетата, молекулярная масса которого должна быть определена, чтобы получить время удерживания;
d) использование соотношения между временем удерживания и логарифмом молекулярной массы для определения молекулярной массы партии глатирамера ацетата.
Предпочтительно, ЭХ-ВЭЖХ колонку выбирают из Superose-12 или Superdex-75, подвижную фазу выбирают от 0,1 до 0,3 М ацетата аммония или формиата аммония, и скорость потока регулируют в диапазоне от 0,4 до 0,6 мл/мин.
Другой аспект настоящего изобретения обеспечивает способ проверки стабильности и воспроизводимости способа получения маркеров молекулярной массы, при этом способ содержит стадии,
а) получение множественного набора маркеров молекулярной массы, с использованием способа по настоящему изобретению, из различных партий глатирамера ацетата/Копаксона, каждый набор, содержащий маркеры молекулярной массы, имеет молекулярную массу в диапазоне от 2000 до 13000 дальтон;
b) сопоставление маркеров молекулярной массы из каждого набора, полученного на стадии а), с использованием статистического способа рандомизации, чтобы дополнительно выделить больший набор маркеров молекулярной массы, и
c) использование этих более крупных наборов, полученных на стадии b) в качестве маркеров молекулярной массы для определения молекулярной массы партии Копаксон/глатирамера ацетат посредством ГПХ.
Предпочтительно, маркеры молекулярной массы, используемые на стадии с) обеспечивают предсказуемые результаты, основанные на 95% доверительного интервала.
Предпочтительно, глатирамера ацетат, используемый для приготовления маркеров молекулярной массы получают с помощью способа, включающего следующие стадии
a) обработку защищенного сополимера с примерно 7% до 20% HBr в уксусной кислоте, при температуре около 25°C в течение около 21-23 часов, чтобы получить трифторацетил-сополимер;
b) обработку указанного трифторацетил-сополимера с диэтиламином, чтобы получить сополимер с полностью удаленной защитной группой;
c) превращение сополимера с полностью удаленной защитной группой в глатирамера ацетат.
Другой аспект настоящего изобретения обеспечивает способ получения глатирамера ацетата, содержащего стадии
a) обработку защищенного сополимера с примерно 7% до 20% HBr в уксусной кислоте при температуре около 25°C в течение примерно 21-23 часов, чтобы получить трифторацетил-сополимер;
b) обработку указанного трифторацетил-сополимера с основанием, выбранным из диэтиламина, диметиламина или диизопропиламина, чтобы получить сополимер с полностью удаленной защитной группой;
c) превращение сополимера с полностью удаленной защитной группой в глатирамера ацетат.
Предпочтительно, обработку на стадии а) осуществляют при температуре 25°C±0,2°C, HBr в уксусной кислоте, необязательно предварительно обрабатывают акцептором, выбранным из фенола, резорцина, тирозина, бисульфита натрия, тиосульфат натрия, нафталина, 1-нафтола или 2-нафтола; и основание выбирают из диэтиламина.
Другой аспект настоящего изобретения обеспечивает превращение сополимера с полностью удаленной защитной группой до глатирамера ацетата, содержащий стадии
а) концентрирование водного раствора сополимера с полностью удаленной защитной группой до минимального объема с использованием тангенциальной поточной фильтрации пропуская через кассету мембраны из полиэфирсульфона, имеющей номинальное отсечение по молекулярной массе 1 кДа;
b) промывка концентрированного раствора со стадии а), водой до достижения pH от 8 до 9, с последующей промывкой 0,3% раствором уксусной кислоты для солевого обмена, чтобы получить глатирамера ацетат; и
c) промывка глатирамера ацетата, полученного на стадии b), водой до достижения pH от 5,5 до 7, чтобы получить чистый глатирамера ацетат.
Предпочтительно, глатирамера ацетат, полученный способом по настоящему изобретению, имеет содержание бромированного тирозина не более, чем 0,15% и содержание диэтиламида не более, чем 5000 частей на миллион (мд). Предпочтительно, глатирамера ацетата, полученный способом по настоящему изобретению, имеет среднюю молекулярную массу в диапазоне 5000-9000 дальтон.
Предпочтительно, глатирамера ацетат, полученный способом по настоящему изобретению, используется в приготовлении фармацевтической композиции или в виде лиофилизированного твердого вещества или в виде водного раствора, содержащих глатирамера ацетат в диапазоне концентраций приблизительно 25-45 мг/мл.
Другой аспект настоящего изобретения относится к способу для определения характеристик глатирамера ацетата пептидным картированием с использованием трипсина и карбоксипептидазы B, содержащем стадии
a) ферментативной обработки глатирамера ацетата с использованием трипсина для получения пептидных короткоцепочечных фрагментов;
b) обработку полученных пептидных фрагментов карбоксипептидазой В, что приводит к дальнейшей фрагментации пептидной цепи;
c) отделение и анализ пептидных фрагментов, полученных на стадии b) с использованием ВЭЖХ-УФ, чтобы получить хроматограмму, и
d) сравнение, полученной таким образом, хроматограммы с хроматограммой образца для сравнения, чтобы определить структурное сходство.
Предпочтительно, образцом для сравнения, используемым для пептидного картирования, является Копаксон® (продаваемый состав).
Краткое описание фигур
Фиг.1: График, показывающий фракционирование Копаксона® партия №Р53289.
Фиг.2: Наложение профиля пика выбранных фракций (маркеров молекулярной массы).
Фиг.3: Калибровочная кривая фракционированных маркеров молекулярной массы.
Фиг.4: Определение молекулярной массы Копаксона® партия №53119 ГПХ с использованием фракционированных маркеров молекулярной массы.
Фиг.5: График, показывающий фракционирование глатирамера ацетата, полученного способом по настоящему изобретению.
Фиг.6: Калибровочная кривая фракционированного глатирамера ацетата, полученного способом по настоящему изобретению.
Фиг.7: Определение молекулярной массы глатирамера ацетата с использованием маркеров, приведенных в таблице 4.
Фиг.8: Наложение хроматограммы сравнения расщепления структуры Копаксона® и глатирамера ацетат, полученного способом по настоящему изобретению, при обработке ферментом трипсином.
Фиг.9: Наложение хроматограммы сравнения расщепления структуры Копаксона® и глатирамера ацетата, полученного способом по настоящему изобретению, при обработке трипсином с последующей обработкой ферментом карбоксипептидазой В.
Подробное описание изобретения
Настоящее изобретение относится к маркерам молекулярной массы для определения молекулярной массы полипептидов, в частности глатирамера ацетата (Сополимер-1).
Маркеры молекулярной массы, используемые в настоящем изобретении, являются полипептидными фракциями, состоящими из полипептидов со случайной последовательностью аминокислот подобной последовательности глатирамера ацетата. Предпочтительно, указанные маркеры молекулярной массы содержат аланин, глутаминовую кислоту, тирозин и лизин в том же мольном соотношении, которое присутствует в глатирамера ацетате.
Один из вариантов осуществления настоящего изобретения относится к полипептидным фракциям со случайной аминокислотной последовательностью подобной последовательности глатирамера ацетата, которые служат в качестве маркеров молекулярной массы для глатирамера ацетата, полученного по способу, содержащему следующие стадии
a) воздействие на полипептидную смесь, которая аналогична глатирамера ацетату по аминокислотному составу и молярному соотношению аминокислот, гель-проникающей хроматографией (ГПХ)/эксклюзионной хроматографией (ЭХ), чтобы получить полипептидные фракции, имеющие молекулярные массы в диапазоне от 2 кДа до 30 кДа;
b) выбор полипептидных фракций, которые будут использоваться в качестве маркеров молекулярной массы, из указанных полипептидных фракций, полученных на стадии а) таким образом, что одна из фракций представляет собой вершину пика молекулярной массы, а другие выбранные фракции распределены по обе стороны от вершины пика молекулярной массы, и
с) определение коэффициента асимметрии пика этих выбранных полипептидных фракций.
Предпочтительно, коэффициент асимметрии пика этих выбранных полипептидных фракций находится в диапазоне от 0,8 до 1. Пик симметрии, как измерено при помощи коэффициента асимметрии пика, имеет большое значение в хроматографическом анализе. Когда коэффициент асимметрии пика увеличивается, интеграция становится менее надежной.
Коэффициент асимметрии пика может быть рассчитан в соответствии с методом фармакопейного комитета США (USP).
Предпочтительно, полидисперсность этих отдельных полипептидных фракций составляет меньше, чем или равна 1,20.
В другом варианте осуществления, настоящее изобретение относится к способу получения полипептидных фракций со случайной аминокислотной последовательностью аналогичной последовательности глатирамера ацетата, которые служат в качестве маркеров молекулярной массы для глатирамера ацетата, содержащего стадии
a) воздействие на полипептидную смесь, которая аналогична глатирамера ацетату по аминокислотному составу и молярному соотношению аминокислот, гель-проникающей хроматографией (ГПХ)/эксклюзионной хроматографией (ЭХ), чтобы получить полипептидные фракции, имеющие молекулярные массы в диапазоне от 2 кДа до 30 кДа;
b) выбор полипептидных фракций, которые будут использоваться в качестве маркеров молекулярной массы, из указанных полипептидных фракций, полученных на стадии а) таким образом, что одна из фракций представляет собой вершину пика молекулярной массы, а другие выбранные фракции распределены по обе стороны от вершины пика молекулярной массы, и
c) определение коэффициента асимметрии пика этих выбранных полипептидных фракций.
Предпочтительно, коэффициент асимметрии пика этих выбранных полипептидных фракций находится в диапазоне от 0,8 до 1. Полидисперсность указанных выбранных полипептидных фракций, предпочтительно составляет меньше, чем или равна 1,20.
Предпочтительно, полипептидная смесь представляет собой Копаксон® или глатирамера ацетат, полученный способом по настоящему изобретению или любым другим известным способом.
Колонка, используемая в хроматографической методике выбирается из Superose-12 или Superdex-75, предпочтительно Superose-12. Подвижная фаза выбрана из ацетата аммония или формиата аммония. Ацетат аммония или формиат аммония используют в диапазоне концентрации от 0,1 до 0,3 М, предпочтительно 0,2 М. pH подвижной фазы составляет приблизительно от 4 до 6, предпочтительно от 5. Скорость потока и количество Копаксон®/глатирамера ацетата раствора, которое загружают в колонку зависит от радиуса и длины колонки. Детекторы, используемые для хроматографического метода, выбирают из УФ-детектора, рефрактометрического детектора, с рассеиванием лазерного излучения с кратными углами, детектора рассеивания лазерного излучения с кратными углами (РЛИКУ), детектора флуоресценции или их комбинации.
В предпочтительном варианте осуществления настоящего изобретения, Копаксон®/глатирамера ацетата приблизительно от 0,5 до 4 мг, предпочтительно 2 мг, подвергают ГПХ (ЭХ) на колонке Superose-12 или Superdex-75 с использованием 0,2 М формиата аммония или ацетата аммония, pH 5,0, в качестве подвижной фазы. 22 отдельные фракции собирают в интервальном промежутке в течение 1 минуты, как на фиг.1. Все фракции лиофилизируют отдельно. Из 22 фракций, пять фракций выбирают таким образом, чтобы выбрать две от каждой стороны вершины пика и фракцию вершины пика. Определяют коэффициент асимметрии пика этих полипептидных фракций. Коэффициент асимметрии пика предпочтительно находится в диапазоне от 0,8 до 1. Эти выбранные фракции суспендируют в 0,2 М ацетате аммония или формиате аммония при pH 5,0, и конечная концентрация каждой из этих фракций составляет 1-10 мг/мл, предпочтительно 6 мг/мл. Молекулярную массу этих выбранных фракций определяют с помощью ЭХ-РЛИКУ. Определяют Mp (вершину пика молекулярной массы), Mw (среднемассовую молекулярную массу), Mn (среднечисленную молекулярную массу) и полидисперсность каждой выбранной фракции. Почти одинаковые значения Mp, Mw и Mn предполагают, что эти фракции являются почти монодисперсными. Полидисперсность этих фракций составляет менее 1,05. Указанные охарактеризованные фракции используют в качестве маркеров молекулярной массы для определения Mp, Mw и Mn партий глатирамера ацетата. Каждая из этих полипептидных фракций состоит из полипептида со случайной аминокислотной последовательностью. Калибровочная кривая отображается с использованием логарифма (log) молекулярной массы и времени удерживания этих фракций, как показано на фиг.3. Коэффициент корреляции (R2) для калибровочной кривой составляет 0,996.
Условия ЭХ-ВЭЖХ, используемые для фракционирования Копаксон® являются такими, как приведены в таблице 1 ниже.
| Таблица 1. | |
| Условия хроматографии для ЭХ-ВЭЖХ | |
| ВЭЖХ | Вода для ВЭЖХ |
| Детекторы | УФ, ИР и РЛИКУ |
| Программное обеспечение | Empower 2 и Astra |
| Колонка | Superose 12 (10/300 GL) и Superdex-75 |
| Подвижная фаза | 0,2 М ацетата аммония pH 5,0 или 0,2М формиата аммония pH 5,0 |
| Скорость потока | 0,5 мл/мин. |
| УФ детектирование | 275 нм |
| Условия ИР | Чувствительность: 32, Темп.: 30°C |
| РЛИКУ | Wyatt MiniDawn Treos |
Mp (Вершина пика молекулярной массы), Mw (среднемассовая молекулярная масса) и Mn (среднечисленная молекулярная масса) для выбранной фракции приведены в таблице 2, ниже
| Таблица 2. | ||||
| Охарактеризованные фракции, использованные в качестве маркеров молекулярной массы | ||||
| Фракция | Mp (кДа) | Mw (кДа) | М (кДа) | Полидисперность ПД=Mw/Mn |
| Фракция #5 | 23,77 | 23,88 | 23,76 | 1,01 |
| Фракция #7 | 17,07 | 17,16 | 17,07 | 1,01 |
| Фракция #11 | 8,33 | 8,82 | 8,62 | 1,02 |
| Фракция #13 | 5,59 | 5,98 | 5,83 | 1,03 |
| Фракция #17 | 3,28 | 3,48 | 3,43 | 1,01 |
Индекс полидисперсности (ИПД) является мерой распределения молекулярной массы в данном образце полимера. Он рассчитывается путем деления среднемассовой молекулярной массы на среднечисленную молекулярную массу. Почти одинаковые значения Mp, Mw и Mn предполагают, что эти фракции являются почти монодисперсными.
В другом предпочтительном варианте осуществления настоящего изобретения, около 40 мг глатирамера ацетата подвергают ГПХ на Superose-12 (10/300) GL системы с использованием 0,2 М ацетата аммония, pH 5,0, в качестве подвижной фазы. Глатирамер начинает элюироваться через 20 минут. Около 30 фракций собирают с интервалом 0,5 мин. Выбирают от 12 до 15 фракций. Эти фракции анализируют на коэффициент асимметрии пика, молекулярную массу и поли дисперсность. Фракции выбраны таким образом, что одна из этих фракций представляет вершину пика молекулярной массы, а другие фракции распределены по обе стороны от вершины пика молекулярной массы. Фракции с полидисперсностью меньше, чем 1,2 отбирают и лиофилизируют. Фракции с полидисперсностью более чем 1,2 подвергают дальнейшей очистке с целью получения фракций, имеющих полидисперсность меньше, чем 1,2. Предпочтительно, выбирают фракции с молекулярной массой 3 кДа, 5 кДа, 7 кДа, 10 кДа и 12 кДа, чтобы использовать в качестве маркеров молекулярной массы.
Условия ГПХ, используемые для фракционирования Глатирамера ацетата, полученного способом по настоящему изобретению, представлены в таблице 3 ниже
| Таблица 3. | |
| Условия хроматографии для гельпроникающей хроматографии | |
| Система | Actapurifier |
| Колонка | Superose 12 (10/300 GL) |
| Подвижная фаза | 0,2 М ацетата аммония, pH 5,0 |
| Объем впрыска | 1 мл |
| Скорость потока | 0,5 мл/мин. |
| Общее время анализа | 60 мин |
| Детектор | УФ |
| УФ детектирование | 280 нм |
Молекулярную массу указанных выбранных фракций определяют, используя ЭХ-РЛИКУ. Mp и полидисперность указанных выбранных фракций приведены в таблице 4, ниже
| Таблица 4: | ||
| Охарактеризованные фракции, использованные в качестве маркеров молекулярной массы | ||
| Фракция | Mp (кДа) | Полидисперность ПД=Mw/Mn |
| Фракция #16 | 12,56 | 1,05 |
| Фракция #18 | 10,05 | 1,08 |
| Фракция #22 | 7,38 | 1,17 |
| Фракция #24 | 5,06 | 1,11 |
| Фракция #26 | 3,2 | 1,05 |
Любое количество фракций может быть выбрано для использования в качестве маркеров. Критерием для отбора является то, что одна из фракций должна представлять вершину пика молекулярной массы, а другие фракции, которые выбраны, должны быть распределены по обе стороны от вершины пика молекулярной массы.
Предпочтительно, коэффициент асимметрии пика этих отобранных фракций находится в диапазоне от 0,8 до 1.
Эти выбранные полипептидные фракции, которые будут использоваться в качестве маркеров молекулярной массы, далее характеризованы посредством ЯМР и соотношения аминокислот. Способ получения маркеров молекулярной массы согласно настоящему изобретению является стабильным и воспроизводимым. Маркеры молекулярной массы, полученные способом по настоящему изобретению, имитируют глатирамера ацетата по показателям гидродинамического объема.
В другом варианте осуществления, настоящее изобретение относится к применению выбранных полипептидных фракций, которые служат в качестве маркеров молекулярной массы для определения молекулярной массы пар