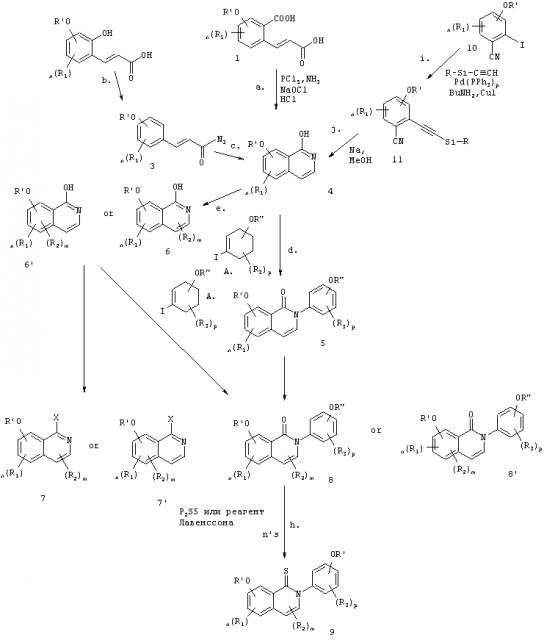
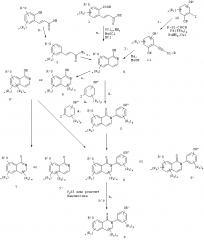
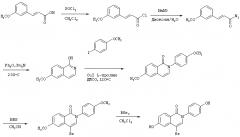
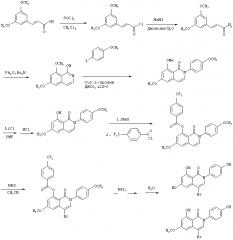
Связывающие агенты ядерных рецепторов
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к гастро- и эндокринологии, и может быть использована для предотвращения, лечения, отсрочки возникновения, снижения заболеваемости или снижения тяжести состояния, связанного с употреблением пищи с высоким содержанием жира, жировой инфильтрации печени, постменопаузным ожирением, для повышения расхода энергии у пациента, увеличения тощей массы тела. Для этого пациенту, нуждающемуся в таком лечении, вводят терапевтически эффективное количество соединения лиганда эстрогенового рецептора, где указанное соединение представляет собой 4-бром-6,8-дигидрокси-2-(4-гидроксифенил)изохинолин-1-(2Н)-он (12u) или 4-циано-6,8-дигидрокси-2-(4-гидроксифенил)изохинолин-1-(2Н)-он (14m). Группа изобретений обеспечивает повышение эффективности лечения вышеуказанных состояний при его безопасности. 5 н. и 8 з.п. ф-лы, 10 табл., 33 ил., 41 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
[001] Настоящее изобретение относится к способам предупреждения и/или лечения метаболических расстройств, постклимактерического ожирения и состояний, связанных с употреблением пищи с высоким содержанием жира, включая ожирение, рост массы тела, образование жировой массы, снижение содержания минеральных веществ в костях, прирост веса белой жировой ткани, повышенные уровни холестерина, повышенные уровни лептина, инсулинорезистентность, диабет II типа, повышенные уровни глюкозы в крови, воспалительные заболевания, сердечно-сосудистые заболевания, состояние жировой инфильтрации печени (накопление жира в печени), пониженные уровни разобщающего белка-1 (UCP-1) и повышенный липогенез.
УРОВЕНЬ ТЕХНИКИ
[002] Суперсемейство ядерных гормональных рецепторов лиганд-активирующих транскрипционных факторов представлено в различных тканях, и отвечает за множество действий в этих тканях.
[003] Суперсемейство ядерных рецепторов (NR), в настоящее время, включает около 48 различных белков, из которых 27 являются лиганд-регулирующими, большинство из которых, предположительно, действует как лиганд-активирующие факторы транскрипции, оказывая влияние на весьма разнообразные биологические реакции за счет регуляции генной экспрессии. Члены этого семейства включают рецепторы небольших эндогенных липофильных молекул, таких как стероидные гормоны, ретиноиды, витамин D и гормон щитовидной железы.
[004] Суперсемейство ядерных рецепторов (NR) включает подсемейство стероидных ядерных рецепторов, включая рецептор минералокортикоидов (MR) (или рецептор альдостерона), рецепторы эстрогенов (ER), ER альфа (ER-α) и ER бета (ERβ), рецептор андрогена (AR), рецепторы прогестерона (PR), глюкокордикоидные рецепторы (GR) и другие. Также близкородственными по структуре являются рецепторы, связанные с эстрогеном (ERR), ERR-α, ERR-β и ERR-γ. Стероидные ядерные рецепторы выполняют важные функции в организме, некоторые из которых связаны с транскрипционным гомеостазом водно-солевого баланса, ростом, улучшением состояния и заживлением ран, фертильностью, реакцией на стрессы, иммунологической функцией и когнитивной функцией. Эти эффекты могут быть опосредованы цитозольными, митохондриальными или ядерными событиями. Соответственно, соединения, которые модулируют (то есть являются антагонистами, агонистами, частичными антагонистами, частичными агонистами) активность стероидных ядерных рецепторов, являются важными фармацевтическими средствами, которые обладают особенной полезностью в ряде способов, а также для лечения и предупреждения широкого ряда заболеваний и расстройств, модулируемых активностью стероидных ядерных рецепторов.
[005] Биологические действия эстрогенов и антиэстрогенов проявляются через два различных внутриклеточных рецептора, эстрогеновый рецептор альфа (ER-α) и эстрогеновый рецептор бета (ER-β). Например, ER-β присутствует, помимо других тканей, в мозге, костях, иммунной системе, желудочно-кишечном тракте, легких, яичниках, эндометрии, простате, сосудистой сети, мочеполовой системе, слюнных железах и так далее. Роль ER-β в этих тканях может быть подтверждена наблюдаемыми фенотипами у ER-β нокаутных мышей. Патологии в этих тканях можно лечить введением ER-β селективных лигандов.
[006] За последнее десятилетие широкое распространение метаболических заболеваний, таких как ожирение, инсулинорезистентность и диабет II типа, существенно увеличилось. Например, в 2008 году количество людей, страдающих ожирением или избыточным весом, во всем мире оценивалось в 400 миллионов, а в Соединенных штатах избыточным весом или ожирением страдали около двух третей жителей, что делает ожирение серьезной проблемой здравоохранения и экономической нагрузкой на общество. Ожирение не является самостоятельным заболеванием, поскольку оно приводит к возникновению различных осложнений, включая сахарный диабет 2 типа (T2DM), гипертонию, атеросклероз и другие сердечно-сосудистые заболевания, остеопороз и клиническую депрессию [Lavie et al., 2009 J Am Coll Cardiol 53:1925-32; Fabricatore et al., 2006 Annu Rev Clin Psychol 2:357-77]. В настоящее время не существует эффективных фармацевтических средств для лечения этого пандемического заболевания. Хирургические способы, хотя и могут снизить вес на 50-90%, являются ограниченными из-за хирургического риска и связанных побочных эффектов. Наилучшие лекарства, присутствующие на рынке в настоящее время, снижают вес, самое большее, на 5-10% в год. Для лечения показания избыточного веса существует только два лекарства, одобренных FDA (Управлением по контролю за продуктами и лекарствами, США): 1. Амфетамины и сибутрамин, которые действуют на гипоталамус для контроля стимуляции аппетита в ЦНС.2. Орлистат, который является ингибитором липазы, блокирующим абсорбцию жира в желудочно-кишечном тракте и снижающим потребление энергии [Cooke et al., 2006 Nat Rev Drug Discov 5:919-31]. Общеизвестные побочные эффекты, связанные с этими лекарствами, включают тахикардию, гипертонию, недержание кала и/или сердечную вальвулопатию, что обусловливает чрезвычайную важность разработки лекарств против ожирения. Следовательно, в данной области существует необходимость в более эффективных и безопасных лекарствах для лечения состояний, таких как ожирение, и других родственных состояний и метаболических расстройств.
[007] Ожирение является гетерогенным заболеванием, которое возникает, если потребление энергии превышает расходование энергии. Несмотря на то, что этиология ожирения остается неопределенной, описано несколько механизмов, таких как изменение сигналов пищевого поведения в гипоталамусе, уровня лептина, адипокинов, секретируемых белой жировой тканью (WAT), нейропептидов и нейротрансмиттеров, контролирующих поведение, возрастные гормональные изменения, воспалительные сигналы в жировой ткани, стресс и другие факторы запускают возникновение ожирения [Yu et al., 2009 Forum Nutr 61:95-103; Rother et al., 2009 Dtsch Med Wochenschr 134:1057-9; Reisin et al., 2009 Med Clin North Am 93:733-51].
[008] Увеличение заболеваемости постклимактерическим ожирением, висцеральным ожирением во время андропаузы и половых различий при метаболических заболеваниях указывают на значимость суперсемейства ядерных гормональных рецепторов (NR) в регуляции веса тела [Allende-Vigo MZ 2008 Р R Health Sci J 27:190-5; Geer et al., 2009 Gend Med 6 Suppl 1:60-75]. Многие из NR играют основные роли в регуляции возникновения метаболических заболеваний. Активация желчной кислотой ядерных рецепторов, таких как фарнезоидный Х-рецептор (FXR), конститутивный андростан-рецептор (CAR) и прегнан-Х-рецептор (PXR), ускоряет снижение веса и также увеличивает восприимчивость к инсулину [Thomas et al., 2008 Nat Rev Drug Discov 7:678-93; Cariou В et al., 2007 Trends Pharmacol Sci 28:236-43]. Точно так же, рецепторы, связанные с эстрогеном (ERRα, ERRβ и ERRγ) играют существенные роли в повышении расходования энергии, снижении адипогенеза и прироста массы тела [Ariazi ЕА et al., 2006 Curr Top Med Chem 6:203-15]. Другие члены NR, принадлежащие к рецепторам, активируемым пролифератором пероксисом (PPAR), и эстрогеновые рецепторы (ER), также играют роль в поддержании с глюкозы в крови и жира в организме, что делает NR перспективной мишенью для предупреждения/лечения ожирения и метаболических заболеваний [Kintscher U et al., 2009 Curr Opin Investig Drugs 10:381-7; Beekum О et al., 2009 Obesity (Silver Spring) 17:213-9; Billin AN 2008 Expert Opin Investig Drugs 17:1465-71; Barros RP et al., 2006 Trends Mol Med 12:425-31].
[009] В некоторых случаях ER-β действует как антагонист ER-α за счет гетеродимеризации с ER-α. Например, агонисты ER-β могут блокировать пролиферативное влияние ER-α в тканях, таких как простата и молочная железа, где ER-α, как известно, промотирует неоплазию. Помимо его анти-ER-α-опосредованного ингибирования роста, ER-β самостоятельно ингибирует пролиферацию и промотирует дифференцировку рака простаты и других видов рака. Предположительно, ER-β также является антагонистом пролиферативного действия AR в тканях предстательной железы. Гипертрофия и гиперплазия/дисплазия предстательной железы могут быть результатом комбинации андрогенной стимуляции пролиферации и/или нарушения активации ER-β локально синтезированными эстрогенами. Такая гипертрофия или гиперплазия/дисплазия часто приводит к различным заболеваниям предстательной железы, таким как аденома простаты (BPH), воспалительная атрофия предстательной железы (предшественник неоплазии), интраэпителиальная неоплазия предстательной железы (PIN) и рак простаты (CaP). Введение экзогенных агонистов ER-β, предположительно, может обеспечивать простатическую антипролиферацию, и, за счет этого, обеспечивать преимущество при предупреждении или лечении этих заболеваний простаты. Кроме того, можно ожидать снижения побочных эффектов для селективных агентов ER-β, по сравнению с неселективными изоформами лигандов для лечения многих из этих заболеваний.
[0010] Следовательно, соединения, действующие как лиганды эстрогеновых рецепторов, являются полезными при лечении различных состояний и расстройств. Селективные модуляторы эстрогеновых рецепторов (лиганды экстрогеновых рецепторов, такие как агонисты ERβ) описаны, например, в публикации патента США №2009/0030036.
[0011] Гормоны являются важными регуляторами адипозной функции, и эпидемиологические исследования позволяют предположить, что эстрогены регулируют метаболизм и распределение жира. Наличие в жировой ткани ER-α и ER-β, двух рецепторов, опосредующих действие эстрадиола, подразумевает непосредственную роль этих лигандов в адипозной функции. Кроме того, наблюдаемые половые и возрастные отличия, при обнаружении бурой жировой ткани (BAT) у людей, указывают на возможность того, что уровень циркуляции эстрадиола может быть важным действующим фактором в развитии BAT [Cypess AM et al., 2009 / V Engl J Med 360:1509-17]. Исследования с отдельными RE нокаутными мышами (КО) показали важность этих изоформ в поддержании липидного и глюкозного гомеостаза [Harris НА 2007 Mol Endocrinol 21:1-13]. Мыши ER-αKO демонстрируют инсулинорезистентность, тогда как мыши ER-PKO, употреблявшие пищу с высоким содержанием жира, показали более высокое значение ожирения, чем мыши дикого типа [Foryst-Ludwig A et al., 2008 PLoS Genet 4:е1000108]. Хотя в некоторых из этих исследований рассматривается мысль, что эстрогенный контроль веса тела опосредуется через ER-β, до сих пор непонятно, какая изоформа опосредует преимущественное действие эстрадиола на содержание жира, глюкозы и холестерина в организме [Pallottini V et al., 2008 Infect Disord Drug Targets 8:52-60; Liang YQ et al., 2002 Int J Obes Relat Metab Disord 26:1103-9].
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0012] В одном из вариантов настоящего изобретения представлен a) способ лечения, отсрочки возникновения, снижения заболеваемости или снижения степени состояния, связанного с употреблением пищи с высоким содержанием жира; b) способ предупреждения состояния, связанного с употреблением пищи с высоким содержанием жира; c) способ лечения, отсрочки возникновения, снижения заболеваемости или снижения степени состояния, связанного с постклимактерическим ожирением; d) способ предупреждения состояния, связанного с постклимактерическим ожирением; e) способ увеличения расходования энергии у пациента; f) способ увеличения тощей массы тела; g) способ лечения, предупреждения, отсрочки возникновения, снижения заболеваемости или снижения степени метаболического расстройства; h) способ увеличения мышечной массы; i) способ лечения, отсрочки возникновения, снижения заболеваемости или снижения степени состояния жировой инфильтрации печени; j) способ предупреждения состояния жировой инфильтрации печени; и к) способ лечения, предупреждения, отсрочки возникновения или снижения заболеваемости состоянием неалкогольного стеатогепатита (NASH); включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения лиганда эстрогенового бета-рецептора.
[0013] В одном из вариантов настоящего изобретения представлен a) способ лечения, отсрочки возникновения, снижения заболеваемости или снижения степени состояния, связанного с употреблением пищи с высоким содержанием жира; b) способ предупреждения состояния, связанного с употреблением пищи с высоким содержанием жира; c) способ лечения, отсрочки возникновения, снижения заболеваемости или снижения степени состояния, связанного с постклимактерическим ожирением; d) способ предупреждения состояния, связанного с постклимактерическим ожирением; e) способ увеличения расходования энергии у пациента; f) способ увеличения тощей массы тела; g) способ лечения, предупреждения, отсрочки возникновения, снижения заболеваемости или снижения степени метаболического расстройства; h) способ увеличения мышечной массы; i) способ лечения, отсрочки возникновения, снижения заболеваемости или снижения степени состояния жировой инфильтрации печени; j) способ предупреждения состояния жировой инфильтрации печени; и k) способ лечения, предупреждения, отсрочки возникновения или снижения заболеваемости состоянием неалкогольного стеатогепатита (NASH); включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения настоящего изобретения.
[0014] В одном из вариантов настоящего изобретения представлен способ лечения, отсрочки возникновения, снижения заболеваемости или снижения степени состояния, связанного с употреблением пищи с высоким содержанием жира, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения лиганда эстрогенового рецептора, представленного структурой Формулы XI:
R1, R2, R3, каждый независимо, является водородом, альдегидом, COOH, -C(=NH)-OH, CHNOH, CH=CHCO2H, CH=CHCO2R, -CH=CH2, гидроксиалкилом, галогеном, гидроксилом, алкокси, циано, нитро, CF3, NH2, 4-Ph-OMe, 4-Ph-OH, SH, COR, COOR, OCOR, алкенилом, аллилом, 2-метилаллилом, алкинилом, пропаргилом, OSO2CF3, OSO2CH3, NHR, NHCOR, N(R)2, сульфонамидом, SO2R, алкилом, циклоалкилом, галоалкилом, арилом, фенилом, бензилом, защищенным гидроксилом, OCH2CH2NR4R5, Z-anwin-Q, Z-алкил-NR4R5, Z-алкил-гетероциклом или OCH2CH2-гетероциклом, где этот гетероцикл является 3-7-членным насыщенным или ненасыщенным, замещенным или незамещенным гетероциклическим кольцом;
R является алкилом, циклоалкилом, водородом, галоалкилом, дигалоалкилом, тригалоалкилом, CH2F, CHF2, CF3, CF2CF3, арилом, фенилом, бензилом, -Ph-CF3, -Ph-CH2F, -Ph-CHF2, -Ph-CF2CF3, галогеном, алкенилом, CN, NO2 или OH;
R' является водородом, алкилом или COR;
R" является водородом, алкилом или COR;
R4 и R5 независимо являются водородом, фенилом, бензилом, алкиловой группой из 1-6 атомов углерода, 3-7-членным циклоалкилом, гетероциклоалкилом, ариловой или гетероариловой группой;
Z является O, NH, CH2 или ;
Q является SO3H, CO2H, CO2R, NO2, тетразолом, SO2NH2 или SO2NHR;
h равен 0, 1, 2 или 3;
i равен 0, 1, 2, 3 или 4;
n равен 1, 2, 3 или 4;
m равен 1 или 2;
p равен 0, 1, 2, 3, 4 или 5; и
Алкил является линейным алкилом из 1-7 атомов углерода, разветвленным алкилом из 1-7 атомов углерода или циклоалкилом из 3-8 атомов углерода;
или его изомер, фармацевтически приемлемая соль, фармацевтический продукт, полиморф, кристалл, N-оксид, сложный эфир, гидрат или любая их комбинация.
[0015] В одном из вариантов настоящего изобретения представлен способ предупреждения состояния, связанного с употреблением пищи с высоким содержанием жира, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения лиганда эстрогенового рецептора, представленного структурой Формулы XI, как описано выше в настоящем документе, или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, кристалла, N-оксида, сложного эфира или любой их комбинации.
[0016] В одном из вариантов настоящего изобретения представлен способ лечения, отсрочки возникновения, снижения заболеваемости или снижения степени состояния, связанного постклимактерическим ожирением, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения лиганда эстрогенового рецептора, представленного структурой Формулы XI, как описано выше в настоящем документе, или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, кристалла, N-оксида, сложного эфира или любой их комбинации.
[0017] В одном из вариантов настоящего изобретения представлен способ предупреждения состояния, связанного постклимактерическим ожирением, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения лиганда эстрогенового рецептора, представленного структурой Формулы XI, как описано выше в настоящем документе, или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, кристалла, N-оксида, сложного эфира или любой их комбинации.
[0018] В одном из вариантов настоящего изобретения представлен способ повышения расходования энергии у пациента, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения Формулы XI, как описано выше в настоящем документе, или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, кристалла, N-оксида, сложного эфира или любой их комбинации.
[0019] В одном из вариантов настоящего изобретения представлен способ повышения тощей массы тела, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения Формулы XI, как описано выше в настоящем документе, или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, кристалла, N-оксида, сложного эфира или любой их комбинации.
[0020] В одном из вариантов настоящего изобретения представлен способ лечения, предупреждения, отсрочки возникновения, снижения заболеваемости или снижения степени метаболического расстройства, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения лиганда эстрогенового рецептора, представленного структурой Формулы XI, как описано выше в настоящем документе, или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, кристалла, N-оксида, сложного эфира или любой их комбинации.
[0021] В одном из вариантов настоящего изобретения представлен способ повышения мышечной массы, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения Формулы XI, как описано выше в настоящем документе, или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, кристалла, N-оксида, сложного эфира или любой их комбинации.
[0022] В одно из вариантов настоящего изобретения представлен способ лечения, отсрочки возникновения, снижения заболеваемости или снижения степени состояния жировой инфильтрации печени, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения Формулы XI, как описано выше в настоящем документе, или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, кристалла, N-оксида, сложного эфира или любой их комбинации.
[0023] В одном из вариантов настоящего изобретения представлен способ предупреждения состояния жировой инфильтрации печени, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения Формулы XI, как описано выше в настоящем документе, или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, кристалла, N-оксида, сложного эфира или любой их комбинации.
[0024] В одном из вариантов настоящего изобретения представлен способ лечения, предупреждения, отсрочки возникновения, снижения заболеваемости неалкогольным стеатогепатитом, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения Формулы XI, как описано выше в настоящем документе, или его изомера, фармацевтически приемлемой соли, фармацевтического продукта, полиморфа, кристалла, N-оксида, сложного эфира или любой их комбинации.
[0025] В одном из вариантов настоящего изобретения представлено селективное соединение лиганда эстрогенового рецептора, где указанным соединением является 4-циано-6,8-дигидрокси-2-(4-гидроксифенил)изохинолин-1(2H)-он или его изомер, фармацевтически приемлемая соль, фармацевтический продукт, полиморф, кристалл, N-оксид, сложный эфир, гидрат или любая их комбинация.
[0026] В одном из вариантов настоящего изобретения представлено селективное соединение лиганда эстрогенового рецептора, где указанным соединением является 4-циано-6,8-дигидрокси-2-(4-гидроксифенил)изохинолин-1(2H)-он или его изомер, фармацевтически приемлемая соль, фармацевтический продукт, полиморф, кристалл, N-оксид, сложный эфир, гидрат или любая их комбинация.
[0027] В одном из вариантов настоящего изобретения представлено селективное соединение лиганда эстрогенового рецептора, где указанным соединением является 4-бром-6,8-дигидрокси-2-(4-гидроксифенил)изохинолин-1(2H)-он или его изомер, фармацевтически приемлемая соль, фармацевтический продукт, полиморф, кристалл, N-оксид, сложный эфир, гидрат или любая их комбинация.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0024] На Фигуре 1 изображены константы связывания 12b (A), 12f (B), 12h (C), 12р (D), 12s (E), 12u (F), 12у (G), 12z (H) и эстрадиола (последний график) с ER-α (штриховая заливка) и ER-β (полная заливка).
[0025] На Фигуре 2 изображена активация ER-α и ER-β соединением 121 в дозировке 0,1, 1, 10, 100 и 100 нМ.
[0026] На Фигуре 3 изображены характеристики ER-β селективных SERM in vitro и in vivo. (A) Структура 14m и 12u. (B) Характеристики связывания и трансактивации ER-β SERM, 14m и 12u: Анализ связывания лиганда (колонки 2-6) и анализ трансактивации (колонки 7-8). (C) 14m и 12u слабо вызывают пролиферацию клеток Ishikawa. 14m и 12u не увеличивают вес матки. Данные выражены как среднее значение±стандартная ошибка. RBA - относительное значение сродства к связыванию; ER-α - эстрогеновый рецептор α; ER-β - эстрогеновый рецептор β; s.c. - подкожное введение.
[0027] На Фигуре 4 изображено действие 14m на ожирение, вызванное питанием. (A) Вес тела, измеренный два раза в неделю. (B) Потребление пищи. На графике A нижняя кривая показывает процентное изменение веса тела при приеме пищи с высоким содержанием жира и приеме носителя и 14m, соответственно. На вклейке графика A показаны репрезентативные мыши, получающие пищу с высоким содержанием жиров и нормальную пищу. Значения выражены как среднее значение±стандартная ошибка. H.F. - питание высоким содержанием жиров; N.D. - нормальное питание; B.Wt - вес тела; * - достоверность при p<0,05 у животных, получающих нормальное питание и обработанных носителем; # - достоверность при p<0,05 у животных, получающих питание высоким содержанием жиров и обработанных носителем.
[0028] На Фигуре 5 изображено действие 14m и 12u на ожирение, вызванное питанием с высоким содержанием жиров. (A) Вес тела, измеренный два раза в неделю, представленный как изменение веса тела, начиная с 0 дня. (B) 14m и 12u снижают массу жира (верхний график) и увеличивают мышечную массу (нижний график). Данные выражены как процентное содержание жира и тощей массы от веса тела. N.D. -нормальное питание; H.F. - питание высоким содержанием жиров; * - достоверность при p<0,05 у животных, получающих нормальное питание и обработанных носителем; # - достоверность при p<0,05 у животных, получающих питание с высоким содержанием жиров и обработанных носителем.
[0029] На Фигуре 6 изображено действие 14m на снижение массы жира и маркеры метаболического заболевания. (A) показывает влияние 14m на содержание жира в организме (левый график) и содержание минеральных веществ в костях (ВМС, правый график). Содержание жира в организме выражено в процентах жира от веса тела. (B), (C), (E) и (F) показывают действие 14m на маркеры метаболического заболевания: белая жировая ткань (WAT; график В); холестерин (график С); лептин (график E); и воспалительный маркер MIP-iβ (график F). (D) показывает влияние 14m на содержание глюкозы в сыворотке после испытание на переносимость глюкозы.
[0030] На Фигуре 7 представлен вес белой жировой ткани (WAT), вес бурой жировой ткани (BAT) и вес икроножной мышцы (GASTROC) в конце исследования для мышей после завершения исследования. Сохранение питания с высоким содержанием жиров существенно увеличивает вес WAT и снижает вес икроножной мышцы по сравнению с нормальным питанием. 14m и 12u препятствуют увеличению веса WAT и увеличивают вес икроножной мышцы в группе с питанием при высоком содержанием жиров по сравнению с группой, обработанной носителем (* достоверное значение для нормального рациона+носитель, # значимое значение для питания с высоким содержанием жиров+носитель).
[0031] На Фигуре 8 изображены репрезентативные отделы печени, полученные из мышей с нормальным питанием, мышей, получавших питание с высоким содержанием жиров и обработанных носителем, и мышей, получавших питание с высоким содержанием жиров и обработанных 14m.Введение 14m уменьшает накопление капелек жира в печени. (Пример 23.7). N.D. - нормальное питание; H.F. - питание с высоким содержанием жиров.
[0032] На Фигуре 9 изображен вес семенников мышей (график A), уровень тестостерона в сыворотке (T) (график B) и содержание фолликулостимулирующего гормона (FSH) в сыворотке (график C) после завершения исследования (Пример 23.8). Эти уровни были определены сразу после умерщвления. 14m и 12u не оказали влияния на содержание тестостерона в сыворотке. 14m не оказал влияния на содержание тестостерона и фолликулостимулирующего гормона (FSH) в сыворотке. Содержание общего тестостерона и FSH в сыворотке определили сразу перед умерщвлением, через 12 недель обработки. 14m не оказал подавляющего действия на эти эндокринные гормоны, позволяя предположить, что его действие не было опосредовано через ERa.
[0033] На Фигуре 10 изображено действие 12u на лечение ожирения, вызванного питанием с высоким содержанием жиров. (A) Вес тела, измеренный два раза в неделю. (B) масса жира. N.D. - нормальное питание. (C) Вес WAT, ВАТ, печени. H.F. - питание с высоким содержанием жиров; * - достоверность при p<0,05 у животных, получающих нормальный рацион и обработанных носителем; # - достоверность при p<0,05 у животных, получающих рацион с высоким содержанием жиров и обработанных носителем.
[0034] На Фигуре 11 изображено действие 12u на изменение состава тела мышей с удаленными яичниками. (A) Вес тела, измеренный два раза в неделю (B) Потребление пищи (C) Масса жира (левый график) и тощая масса (правый график). (D) Вес белой жировой ткани (WAT) и вес матки. OVX - овариэктомия; * - достоверность при p<0,05 у животных, получающих нормальное питание и обработанных носителем; # -достоверность при p<0,05 у животных, получающих питание с высоким содержанием жиров и обработанных носителем.
[0035] На Фигуре 12 изображено влияние лиганда ER-β на функцию PPAR-γ через лиганд-связывающий участок (LBD). (A). Клетки НЕК-293 трансфицировали при помощи 0,25 мкг PPRE-LUC, 5 нг CMV-Renilla LUC и указанных рецепторов (PPAR-γ и ER-β для левого графика и PPAR-α и ER-β для правого графика). Клетки обработали через 24 часа после трансфекции указанными лигандами и собрали через 48 часов после трансфекции, измерили активность люциферазы светляков и нормализовали к люциферазе Renilla. (B). Н475 в ER-β LBD является важным для его функции. Н475 в ER-β LBD мутировали до аланина (A) с использованием набора сайт-направленного мутагенеза. Анализ трансактивации выполнили так, как описано на графике A, в клетках НЕК-293 с титрованием лигандов ER-β в H475A дикого типа или ER-β.(C). H475A ER-β не ингибирует трансактивацию PPAR-γ. Клетки НЕК-293 трансфицировали при помощи 0,25 мкг PPRE-LUC, 5 нг CMV-Renilla LUC и 50 нг указанных рецепторов (PPAR-γ или PPAR-γ и ER-β дикого типа или PPAR-γ и ER-β H475A). Клетки обработали через 24 часа после трансфекции указанными лигандами и собрали через 48 часов после трансфекции, измерили активность люциферазы светляков и нормализовали к люциферазе Renilla. (D). Лиганд ER-β зависимо ингибирует PGC-1 коактивированный PPAR-y, но не трансактивацию PPAR-a. Клетки HepG2 трансфицировали при помощи 0,25 мкг PPRE-LUC, 5 нг CMV-Renilla LUC, 0,5 мкг PGC-1 или векторного скелета и 100 нг указанных рецепторов (PPAR-γ или PPAR-γ и ER-β дикого типа или PPAR-γ и ER-β H475A для верхних графиков и PPAR-α или PPAR-α и ER-β для нижнего графика). Клетки обработали указанными лигандами через 24 часа после трансфекции и собрали через 48 часов после трансфекции, измерили активность люциферазы светляков и нормализовали к люциферазе Renilla. (E). SHP-1 является ER-P специфичным геном-мишенью. Клетки НЕК-293 трансфицировали при помощи 0,25 мкг SHP-LUC, 5 нг CMV-Renilla LUC и 50 нг указанных рецепторов (FXR и ER-α для левого графика и FXR и ER-β для правого графика). Клетки обработали через 24 часа после трансфекции указанными лигандами и собрали через 48 часов после трансфекции, измерили активность люциферазы светляков и нормализовали к люциферазе Renilla. PRAP - пролифератор пероксисом и активированный рецептор; ER - эстрогеновый рецептор; H - гистидин; A - аланин; RLU - относительные люциферазные единицы; Tro - троглитазон; PGC-1 - коактиватор PPAR-γ; SHP - низкомолекулярный гетеродимерный участник; FXR - фарнезоидный Х-рецептор.
[0036] На Фигуре 13 изображено влияние 12y (Фигура 13A) и 12u (Фигура 13B) на адгезию макрофага к эндотелиальным клеткам.
[0037] На Фигуре 14 изображено влияние 12b на размер отека, вызванного каррагенином (то есть каррагенин-индуцированный свежий отек лапы в качестве модели острого воспаления).
[0038] На Фигуре 15 изображен протокол лечения для измерения быстрого (негеномного) расслабления аортального кольца за счет NRBA настоящего изобретения.
[0039] На Фигуре 16 изображены кривые зависимости от концентраций, построенные так же, как и на Фигуре 15, для 14m, 12u и 12y.
[0040] На Фигуре 17 изображен протокол ответного лечения для измерения дозозависимого действия снижения фенилэфринового сужения аортального кольца за счет фенилэфрина (PE).
[0041] На Фигуре 18 изображены кривые зависимости от концентраций, построенные так же, как и на Фигуре 17, для 12y, 12z и 141. [0042] На Фигуре 19 изображен протокол измерения влияния долгосрочного инкубирования аортальных колец с NRBA настоящего изобретения, и иллюстративный график для 141.
[0043] На Фигуре 20 изображено (A) Ингибирование пролиферации RASMC за счет лиганда ER-β 141. Клеточную пролиферацию оценили с использованием калориметрического анализа WST-1. Поглощение при 450 нм измерили и выразили в процентах от поглощения в контрольных клетках, содержащих только клетки в 0 день (G0). (B) Флуоресцентное обнаружение внутриклеточного ROS. Субконфлюэнтный монослой клеток ARPE-19 предварительно обработали соответствующими лекарствами с ICI или без ICI, а затем подвергли воздействию окислительного стресса с tBH. Значения для клеток, обработанных только красителем, вычли из данных исходной флуоресценции. Флуоресценцию записали относительно клеток, содержащих краситель, в присутствии только окислителя. Обработку каждым лекарством выполнили в трех экземплярах и нанесли на график +/-стандартная ошибка среднего.
[0044] На Фигуре 21 изображено влияние 12b и 12u на пролиферацию клеток LNCaP (рака простаты).
[0045] На Фигуре 22 изображено влияние 12b и 12u на пролиферацию клеток С-26 (рака ободочной кишки).
[0046] На Фигуре 23 изображено влияние 12b и 12u на рост опухоли ксенотрансплантата LNCaP-стромальных клеток через 10, 14 и 21 день.
[0047] На Фигуре 24 изображено влияние 12u и 12m на маркеры неалкогольного стеатогепатита (NASH); 12u и 12m снижают выделение трансаминаз сыворотки, вызванное питанием с высоким содержанием жиров.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0048] В одном из вариантов NRBA относится к соединению, которое влияет на активность эстрогенового рецептора. В одном из вариантов NRBA проявляет активность в качестве агониста или, в другом варианте, антагониста, или, в другом варианте, частичного агониста, или, в другом варианте, частичного антагониста эстрогенового рецептора.
[0049] В некоторых вариантах NRBA являются соединениями лигандов эстрогеновых рецепторов. В одном из вариантов соединение лиганда эстрогенового рецептора является селективным модулятором эстрогенового рецептора (SERM). В одном из вариантов соединение лиганда эстрогенового рецептора является селективным модулятором эстрогенового рецептора β (β-SERM или ERP SERM, или ER-β селективный SERM). В одном из вариантов соединение лиганда эстрогенового рецептора является агонистом эстрогенового рецептора. В одном из вариантов соединение лиганда эстрогенового рецептора является агонистом эстрогенового рецептора β (ER-β). В одном из вариантов соединение лиганда эстрогенового рецептора является антагонистом эстрогенового рецептора β (ER-β).
[0050] В одном из вариантов соединение лиганда эстрогенового рецептора является селективным по отношению к ER-β. В одном из вариантов соединение лиганда эстрогенового рецептора не дает перекрестную реакцию с ER-α. В одном из вариантов соединение лиганда эстрогенового рецептора не дает перекрестную реакцию с ER-α в концентрации до 10 мкМ. В одном из вариантов соединение лиганда эстрогенового рецептора не дает перекрестную реакцию с ER-α в концентрации до 1 мкМ. В одном из вариантов соединение лиганда эстрогенового рецептора связывается с ER-β по меньшей мере с 5-кратной селективностью по сравнению с ER-α. В одном из вариантов соединение лиганда эстрогенового рецептора связывается с ER-β по меньшей мере с 10-кратной селективностью по сравнению с ER-α. В одном из вариантов соединение лиганда эстрогенового рецептора связывается с ER-β по меньшей мере с 50-кратной селективностью по сравнению с ER-α. В одном из вариантов соединение лиганда эстрогенового рецептора связывается с ER-β по меньшей мере с 100-кратной селективностью по сравнению с ER-α. В одном из вариантов соединение лиганда эстрогенового рецептора является агонистом β-SERM.
[0051] В одном из вариантов соединение лиганда эстрогенового рецептора действует как агонист по отношению к ER-β. В одном из вариантов соединение лиганда эстрогенового рецептора действует как антагонист по отношению к ER-β. В одном из вариантов соединение лиганда эстрогенового рецептора действует как агонист по отношению к ER-α. В одном из вариантов соединение лиганда эстрогенового рецептора действует как антагонист по отношению к ER-α. В одном из вариантов соединение лиганда эстрогенового рецептора действует как агонист по отношению к обоим ER-β и ER-α. В одном из вариантов соединение лиганда эстрогенового рецептора действует как агонист по отношению к обоим ER-β и ER-α с селективностью по меньшей мере в 5 раз по отношению к ER-β. В одном из вариантов соединение лиганда эстрогенового рецептора действует как агонист по отношению к обоим ER-β и ER-α с селективностью по меньшей мере в 10 раз по отношению к ER-β. В одном из вариантов соединение лиганда эстрогенового рецептора действует как агонист по отношению к обоим ER-β и ER-α с селективностью в 20-30 раз по отношению к ER-β с EC50 менее 10 нМ.
[0052] В одном из вариантов NRBA оказывает свое действие на эстрогеновый рецептор (например, ER-α, ER-β или ERR) тканезависимым образом. В некоторых вариантах NRBA настоящего изобретения могут действовать в некоторых тканях как агонисты эстрогеновых рецепторов (например, в костях, мозге и/или сердце) и как антагонисты в других типах тканей, например, в молочной железе и/или слизистой оболочке матки.
[0053] В одном из вариантов NRBA настоящего изобретения имеет IC50 или EC50 в отношении ERα и/или ERβ до около 10 мкМ, что определено с использованием анализов трансактивации ERa и/или ERβ, известных в данной области, или, в других вариантах, описанных в настоящем документе. В некоторых вариантах NRBA демонстрирует значения EC50 или IC50 (в качестве агонистов или антагонистов, соответственно) около 5 мкМ или менее, чем около 5 мкМ. Было выявлено, что репрезентативные соединения настоящего изобретения обладают активностью агонистов или антагонистов в отношении эстрогеновых рецепторов. Соединения настоящего изобретения обладают, в некоторых вариантах, IC50 или EC50 антагониста или агониста в отношении ERα и/или ERβ около 5 мкМ или менее, чем около 5 мкМ, или, в некоторых вариантах, до около 500 нМ, или, в других вариантах, до около 50 нМ, или, в других вариантах, до около 10 нМ, или, в других вариантах, до около 1 нМ, по результатам измерения в анализах трансактивации ERα и/или ERβ.
[0054] Термин «IC50» относится, в некоторых вариантах, к концентрации NRBA, которая снижает активность мишени (напр