Ковалентный моноконъюгат капроновой кислоты с тимозином бета 4, устойчивый к деградации в токе крови, и способ его получения
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии, в частности к области модификации белков, и описывает способ региоселективного химического N-концевого гексаилирования тимозина бета 4, а также моноконъюгат, полученный вышеописанным способом. Способ характеризуется тем, что растворяют ангидрид гексановой кислоты в многокомпонентном водно-органическом буфере с pH 3, обеспечивающим региоселективное гексаилирование и содержащем дезацетилтимозин бета 4, инкубируют его в течение 3 ч при 25°C, очищают методом ОФ ВЭЖХ и лиофилизуют. Моноконъюгат капроновой кислоты с тимозином бета 4 обладает улучшенными фармакокинетическими свойствами. Изобретение позволяет получить моногексаилированный тимозин бета 4 с высоким выходом и может быть использовано в медицине и фармацевтической промышленности.2 н.п. ф-лы, 4 ил., 3 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области модификации белков, в частности касается аналогов тимозина бета 4 с пролонгированным временем циркуляции в крови. Оно может быть использовано для получения аналогов человеческого тимозина бета 4.
Уровень техники
Тимозин бета 4 - это пептид, вырабатываемый клетками тимусовой железы, который участвует в регуляции полимеризации актина, а также участвует в пролиферации, миграции и дифференциации клеток. Эти свойства тимозина бета 4 определяют его ценность в качестве медицинского препарата, особенно при лечении ишемической болезни сердца.
Тимозин бета 4 человека представляет собой 43-членный пептид, ацетилированный по N-концевой α-аминогруппе.
Немодифицированный тимозин бета 4 получают биотехнологическим методом с помощью технологии рекомбинантной ДНК и далее модифицируют путем избирательного химического ацетилирования N-концевой альфа-аминогруппы. Такой способ описан в работах (К.А. Бейрахова, В.Н. Степаненко, А.И. Мирошников, Р.С. Есипов / Биотехнологический способ получения ацетилированного тимозина бета 4 // Биоорганическая химия, 2011, том 37, №2, с. 1-10), (Д.А. Макаров, Т.И. Муравьева, В.Н. Степаненко, В.И. Швец, Р.С. Есипов, 2014. Оптимизация и масштабирование лабораторного метода получения рекомбинантного тимозина бета 4 человека до пилотного производства. Биотехнология 4, 35-44).
Природный тимозин бета 4 коротко живущий пептид, и период его полувыведения из крови напрямую зависит от вводимой дозы в организм [Mora CA, Baumann CA, Paino JE, Goldstein AL, Badamchian M / Biodistribution of synthetic thymosin beta 4 in the serum, urine, and major organs of mice // Int. J. Immunopharmacol. 1997 Jan; 19(1):1-8], что создает трудности при его администрировании. Стандартный подход, применяемый для повышения стабильности терапевтического белка, заключается в присоединении к нему химическими или энзиматическими методами различных защитных групп, обеспечивающих защиту от протеалитических ферментов [Jevsevar S, Kunstelj М, Porekar VG. PEGylation of the therapeutic proteins. Biotechnol J. 2010 Jan; 5(1):113-28; Schlapschy M, Binder U, , Theobald I, Wachinger K, Kisling S, Haller D, Skerra A. PASylation: a biological alternative to PEGylation for extending the plasma half-life of pharmaceutically active proteins. ProteinEngDesSel. 2013 Aug; 26(8):489-501; Susanne M Mumby. Reversible palmitoylation of signaling proteins / Current Opinionin Cell Biology Volume 9, Issue 2, April 1997, Pages 148-154]. Но принципиальная сложность такого подхода по отношению к тимозину бета 4 заключается в том, что химическая модификация тимозина бета 4 предпочтительна только по N-концевой альфа-аминогруппе. Присоединение функциональной группы к любому другому аминокислотному остатку внутри пептида изменит его нативную структуру, что в свою очередь приведет к потере его биологической активности. Известно, что биологическая активность тимозина бета 4 определяется активными сайтами в коротких пептидных последовательностях, так например, его основной актинсвязывающий сайт расположен в аминокислотных остатках 17-22, основной сайт, проявляющий антиапоптозную активность и осуществляющий защиту от токсичности, располагается в аминокислотных остатках 1-15, а сайт, представляет собой первые четыре аминокислотных остатка Ac-SPDK, первый из которых ацетилирован по N-концевой альфа-аминогруппе, обладает широким спектром биологической активности. Связано это с тем, что природная пострансляционная модификация пептида - присоединение ацетильной группы происходит именно по N-концевой альфа-аминогруппе тимозина бета 4. Поскольку концентрация тимозина бета 4 в крови уже через 2 часа падает до базального уровня после его администрирования [Mora CA, Baumann CA, Paino JE, Goldstein AL, Badamchian M. Biodistribution of synthetic thymosin beta 4 in the serum, urine, and major organs of mice. Int J Immunopharmacol. 1997 Jan; 19(1):1-8], существует потребность в аналогах тимозина бета 4 с пролонгированным временем циркуляции в крови.
Раскрытие изобретения
Настоящее изобретение относится к созданию стабильного в токе крови аналога тимозина бета 4 посредством региоселективного химического гексаилирования тимозина бета 4. Конкретнее, настоящее изобретение раскрывает способ получения модифицированного тимозина бета 4 с пролонгированной стабильностью в токе крови с высоким выходом за счет региоспецифического ацилирования тимозина бета 4 ангидридом гексановой кислоты по свободной N-концевой альфа-аминогруппе тимозина бета 4.
Изобретение иллюстрируется следующими чертежами.
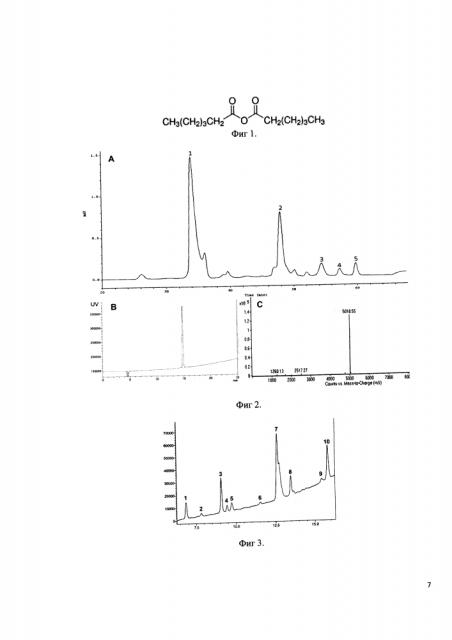
Фиг 1. Формула ангидрида гексановой кислоты.
Фиг 2:
A - Профиль полупрепаративной хроматографической очистки продуктов реакции гексаилирования дезацетилтимозина бета 4. Колонка Диасорб 130 С16Т, 8 мкм, 15X250 мм. Разделение проводили в градиенте 80% ацетонитрила с 0,1% ТФУ 15-30%. 1 - дезацетилтимозин бета 4, 2 - моногексаноилтимозин бета 4, 3-5 - побочные продукты реакции.
B - профиль аналитической ОФ ВЭЖХ фракции 2.
C - Масс-спектр аналитической ОФ ВЭЖХ фракции 2.
Фиг 3. Хроматографический профиль продуктов протеолитического расщепления конъюгата капроновой кислоты с тимозином бета 4.
Фиг 4. Однобуквенная последовательность дезацетилтимозина бета 4. Результаты протеолитического расщепления конъюгата капроновой кислоты с тимозином бета 4.
Подробное описание изобретения
Химическая модификация молекулы белка жирными кислотами придает молекуле белка липофильные свойства, что приводит к изменениям в белок/белковых взаимодействиях, связывании с мембраной и таргетных взаимодействиях. Сайтспецифическое ацилирование ангидридом гексановой кислоты возможно только при pH ниже 4. Характерным аспектом изобретения является региоспецифический способ гексаилирования, включающий моноселективное ацилирование тимозина бета 4 ангидридом гексановой (капроновой) кислоты (фиг. 1) по свободной N-концевой альфа-аминогруппе пептида в буферном растворе для гексаилирования. Техническим результатом региоселективной химической модификации является образование моногексаноилтимозина β4, выход которого составляет не ниже 30%.
Под буферным раствором для гексаилирования подразумевается многокомпонентный водно-органический буферный раствор, содержащий 30% ацетонитрила и 15% любого другого органического растворителя, например бутанола или изопропанола, список не ограничивается перечисленным, который обеспечивает постоянное значение pH 3,0. Такой буфер с концентрацией от 5 мМ до 100 мМ может содержать соли уксусной, фосфорной, лимонной кислот, список не ограничивается перечисленным.
Техническим результатом изобретения является получение моногексаилированного тимозина бета 4, обладающего в 4 раз большим временем полувыведения из плазмы крови по сравнению с тимозином бета 4.
Осуществление изобретения
Пример 1
Получение моногексаноилтимозина бета 4.
К растворенному в буфере (50 мМ ацетат натрия, 30% ацетонитрила, 15% бутанола, pH 3) дезацетилтимозину бета 4 добавляют 22,5 мкл ангидрида гексановой кислоты, тщательно перемешивают и инкубируют в течение 3 ч при 25°C. Идентификацию образующегося моногексаноилтимозина бета 4 проводят методом хромато-масс-спектрометрии Реакционную смесь разбавляют в 10 раз дистиллированной водой и наносят на колонну Диасорб 130 С16Т, 8 мкм, 15X250 мм. Разделение проводят в градиенте 80% ацетонитрила с 0,1% ТФУ (15-30% за 60 мин). Фракции содержащие моногексаноилтимозин бета 4 более 98% объединяют и лиофилизуют. На фигуре 4 под буковой A изображен профиль полупрепаративной хроматографической очистки монокесаноилтимозина бета 4, где 2 - пик, соответствует моногексаноилтимозину бета 4; 3, 4 и 5 - пики - побочные продукты реакции. Под буквой B изображен профиль аналитической ОФ ВЭЖХ фракции, содержащей моногексаноилтимозин бета 4, под буквой C изображен масс-спектр моногексаноилтимозина бета 4.
Пример 2
Подтверждение структуры моногексаилированного тимозина бета 4.
Лиофилизованный аналог тимозина бета 4 и химически синтезированный тимозин бета 4 в количестве 200 мкг (считают по пептиду) растворяют в 50 мкл буфера (50 мМ Трис/HCl, pH 8,0), затем добавляют 5 мкл 0,067 мг/мл раствора Asp-N протеиназы (0,335 мкг) и инкубируют в течение 3 ч при 37°C. Протеолитическую смесь анализируют методом хромато-масс-спектрометрии. Хроматографические профили продуктов протеолитического расщепления соответствуют профилям на фиг 3. Молекулярные массы фрагментов пептидов соответствуют значениям на фиг 4.
Пример 3
Тестирование стабильности аналога тимозина бета 4 и химически синтезированного тимозина бета 4 на сыворотке крови.
Стабильность определяют как время, за которое в сыворотке крови остается 50% пептида от исходного количества (T1/2). Сыворотку крови выделяют из крови кролика по стандартным протоколам. Расфасовывают по 50 мкл и замораживают на -70°C. Расфасованную сыворотку крови используют однократно. Тестируемые образцы растворяют в стерильном физиологическом растворе и вводят в концентрации 10 мг/мл в 50 мкл сыворотки крови и инкубируют в течение 1-24 ч при 37°C. Смесь анализируют методом хромато-масс-спектрометрии. Стабильность измеряют по изменению площади поглощения исследуемого образца со временем. Результаты обрабатывают статистически, достоверность отличий результатов определяют параметрическим методом. Для тимозина бета 4 T1/2 соответствует 2 ч., для моногексаилированного тимозина бета 4 T1/2 соответствует 8 ч.
1. Способ получения моноконъюгата капроновой кислоты с тимозином бета 4, включающий растворение ангидрида гексановой кислоты в многокомпонентном водно-органическом буфере с pH 3, обеспечивающим региоселективное гексаилирование и содержащем дезацетилтимозин бета 4, инкубирование в течение 3 ч при 25°C, очистку методом ОФ ВЭЖХ и лиофилизацию.
2. Ковалентный моноконъюгат капроновой кислоты с тимозином бета 4, устойчивый к деградации в токе крови, полученный способом по п.1.