Фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к жидкой фармацевтической композиции, содержащей от 0,05 мг/мл до 0,5 мг/мл карбетоцина или его фармацевтически активной соли. Значение рН композиции составляет от 5,1 до 5,9. Композиция может дополнительно содержать буферный агент, антиоксидант и агент для поддержания изотоничности. Также описана жидкая фармацевтическая композиция, содержащая от 0,01 до 4 мг/мл фармацевтически активного соединения FE 202767 или его фармацевтически приемлемой соли. Значение рН композиции составляет от 5,1 до 5,9. Также описаны наборы, содержащие указанные жидкие фармацевтические композиции. Фармацевтические композиции по изобретению обладают улучшенной стабильностью. 5 н. и 17 з.п. ф-лы, 7 ил., 7 табл., 9 пр.
Реферат
Настоящее изобретение относится к фармацевтическим композициям, например фармацевтическим композициям для лечения послеродового кровотечения (РРН) или других медицинских применений. В частности, оно относится к фармацевтическим композициям, обладающим улучшенной стабильностью, например, при комнатной температуре или температуре окружающей среды.
Послеродовое кровотечение (РРН) является одной из главных причин смертности и тяжелой заболеваемости, связанных с беременностью, в развивающихся странах, а также в цивилизованном мире. Оно представляет собой потенциально угрожающее жизни состояние с примерно 140000 летальных исходов ежегодно, один случай каждые четыре минуты, причем подавляющее число случаев приходится на женщин, которым недоступна адекватная акушерская помощь. Хотя эта проблема важна в численном отношении, не все регионы цивилизованного мира одинаково подвержены, и в Европе частота летальных исходов, ассоциированных с маточными кровотечениями, широко варьирует от одной страны к другой. Выживаемость по популяциям в 11 регионах в пределах европейских стран показала, что частота тяжелых кровотечений варьирует от 0,1% до 0,9% беременностей (группа MOMS-B, 1999). Имеются хорошие основания надеяться, что различия в клинической практике могут иметь огромную важность для различий в смертности/заболеваемости. Конфиденциальное расследование по вопросам материнской смертности в Великобритании, охватывающее 1994-1996 годы, показало, что после того как во всех подразделениях по вопросам материнства были предприняты мероприятия для установления руководства по ведению больных с кровотечениями в третьем триместре и после родов, не было ни одного летального исхода от кровотечения при неосложненных родах естественным путем (Department of Health et al, 1998). Это достижение подтверждает предположение, что клиническое ведение больных имеет ключевую роль в предупреждении тяжелых маточных кровотечений.
РРН является сложным для ведения, так как оценка кровопотери в отделениях родовспоможения не достоверна. Зачастую меры принимают в ответ на развитие таких материнских симптомов, как гипотония или недомогание, а не основываясь на оцененной кровопотере. Такие запаздывающие меры ответственны за множество случаев тяжелого кровотечения, и может потребоваться неотложное хирургическое вмешательство, так как трата времени на использование других способов лечения может стать опасной для пациента. Эти соображения говорят в пользу применения курса стандартного профилактического введения средства, стимулирующего сокращения матки, всем роженицам. Довод в пользу проведения такого курса подкрепляется тем фактом, что атония матки вносит наиболее существенный вклад в развитие РРН. Атония матки представляет собой потерю мышечного тонуса матки. Обычно сокращение мышц матки сжимает сосуды и снижает количество протекающей жидкости. Это увеличивает вероятность коагуляции и предотвращает кровотечения. Таким образом, отсутствие мышечного сокращения матки может вызвать острую кровопотерю. Клинически 75-80% послеродовых кровотечений происходят вследствие атонии матки.
Обзоры продемонстрировали убедительные доказательства в пользу стандартного профилактического введения средства, стимулирующего сокращение матки, либо в отдельности, либо как часть Активной тактики ведения третьего периода родов (Active Management of the Third Stage of Labour, AMTSL)); AMTSL обычно определяют как трехкомпонентное вмешательство: профилактическое введение средства, стимулирующего сокращение матки, ранний зажим пуповины и контролируемая тракция за пуповину. Кроме того, показано, что AMTSL в равной степени эффективна у женщин "низкой степени риска" и "высокой степени риска". В настоящее время применение средства, стимулирующего сокращение матки, в качестве профилактики во всех родовспомогательных отделениях для предупреждения тяжелого кровотечения является стандартной клинической практикой в большинстве стран Европы, и эта практика возрастает во всем мире.
Доступные в настоящее время средства, стимулирующие сокращение матки, представляют собой окситоцин, эргометрин, Syntometrine® (комбинация окситоцина и эргометрина) и мизопростол. Однако, они не лишены недостатков. Мизопростол вводят перорально или вагинально, и это менее эффективно по сравнению с инъецируемыми средствами, стимулирующими сокращение матки; как правило, его не рекомендуют использовать, если доступны инъецируемые средства, стимулирующие сокращение матки. Syntometrine® лицензирован лишь в некоторых странах в Европе. Он, возможно, более эффективен, чем окситоцин в отдельности, но он дает больше побочных эффектов, в частности тошноту и рвоту. Кроме того, он не подходит для применения у женщин с гипертонией, преэклампсией и заболеванием сердца, тем самым снижая его пригодность для стандартного профилактического использования. Окситоцин сам по себе имеет недостаток, выражающийся в коротком периоде полувыведения. Хотя это можно обойти путем введения в виде непрерывной внутривенной инфузии для обеспечения непрерывной стимулирующей сокращения матки активности; это вызывает больше неудобств по сравнению с однократной инъекцией. При введении в виде однократной болюсной дозы, будь то внутривенная или внутримышечная инъекция, требуется тщательное наблюдение за тонусом матки, и может потребоваться дополнительное средство, стимулирующее сокращение матки, из-за короткого периода полувыведения.
Карбетоцин [(1-дезамино-1-монокарба-2-(O-метил)-тирозин)окситоцин] представляет собой синтетический аналог окситоцина длительного действия с активностью агониста. Карбетоцин (PABAL®, DURATOCIN®) в настоящее время одобрен для предупреждения атонии матки после рождения ребенка с помощью кесарева сечения под эпидуральной или спинальной анестезией. При его существующем на рынке использовании, внутривенное введение карбетоцина обеспечивает период полувыведения приблизительно 40 минут, который в 4-10 раз дольше периода полувыведения, зарегистрированного для окситоцина (4-10 минут). Однако, используя внутримышечную инъекцию, карбетоцин достигает пиковых концентраций в плазме менее чем за тридцать минут и имеет биодоступность 80% (W Rath, European Journal of Obstetrics and Gynaecology and Reproductive Biology 147 (2009) 15-20). Таким образом, карбетоцин потенциально является наиболее идеальным лекарственным средством для стандартной профилактики послеродового кровотечения, предлагаемым во всех родовспомогательных отделениях, так как он подходит как для внутримышечной инъекции, так и для внутривенного введения, обеспечивая удобство и простоту осуществления; он обладает быстрым началом действия; является длительно действующим, особенно по сравнению с окситоцином; редко ассоциирован с побочными действиями лекарства; и обладает превосходной переносимостью. В опубликованных клинических испытаниях карбетоцин показал эффективность, подобную окситоцину и Syntometrine®, или даже имеет тенденцию к лучшей эффективности, продемонстрированной по нескольким критериям: кровопотеря (измеренная или оцененная), случаи кровопотери более 500 мл, дополнительное применение средства, стимулирующего сокращение матки, или общее вмешательство для стимулирования сокращения матки. Таким образом, карбетоцин предоставляет улучшение имеющихся в настоящее время доступных возможностей для предупреждения атонии матки и чрезмерного кровотечения после родов естественным путем. По сравнению с окситоцином его преимущество состоит главным образом в том, что он заменит необходимость непрерывной инфузии или дополнительного стимулирующего сокращение матки вмешательства. Практически карбетоцин может заменить 2-4 часа послеродовой стандартной инфузионной терапии и/или улучшить эффект по сравнению с болюсной инъекцией окситоцина. Кроме того, любое уменьшение дополнительных вмешательств предоставляет благоприятное фармакоэкономическое преимущество в пользу применения карбетоцина. По сравнению с Syntometrine® его преимущество состоит главным образом в лучшей переносимости и безопасности и отсутствии важных противопоказаний. В любом случае, карбетоцин лучше подходит для стандартного профилактического использования и, вероятно, облегчает его осуществление.
Имеющийся в настоящее время препарат карбетоцина (PABAL®, раствор для инъекций 100 микрограмм/мл, Ferring Pharmaceuticals Limited) не стабилен при комнатной температуре (RT) и требует хранения в холодильнике при температуре 2-8°C. Таким образом, существует необходимость в препарате карбетоцина, который стабилен при комнатной температуре (например, при 25°C и 60%-ной относительной влажности) в течение вплоть до двух лет, обеспечивая, например, применение в амбулаторных условиях. Это дает преимущество в климатической зоне I/II. Более важно, существует необходимость в препарате, который может храниться не в холодильнике в климатической зоне III/IV (высокая температура, например, тропические регионы), а именно, удовлетворяет требованиям стабильности при температурах и влажности для этих зон, например, подтвержденная документально длительная стабильность при температуре 30°C и относительной влажности вплоть до 75%. Терминология климатических зон используется Комиссией по контролю за качеством пищевых продуктов и лекарств США (FDA) и Европейской организацией экспертизы лекарственных препаратов (ЕМЕА) и известна специалистам в данной области техники. Так, климатическая зона I представляет климат умеренных широт; климатическая зона II представляет субтропический и средиземноморский климат; климатическая зона III представляет горячий сухой климат; и климатическая зона IV представляет горячий влажный климат.
Согласно настоящему изобретению предложена жидкая композиция (например, жидкая фармацевтическая композиция), содержащая карбетоцин или его фармацевтически активную соль, где значение pH композиции составляет от 5,0 до 6,0. Значение pH композиции может составлять от 5,1 до 6,0, например от 5,2 до 6, например от 5,26 до 6. Значение pH композиции может составлять от 5,15 до 5,75, например от 5,2 до 5,65. Значение pH композиции может составлять от 5,26 до 5,8, например от 5,26 до 5,75, например от 5,26 до 5,7, например от 5,26 до 5,65, например от 5,4 до 5,65. Предпочтительно, жидкая композиция (например, жидкая фармацевтическая композиция) содержит карбетоцин.
Предпочтительно, композиция представляет собой водную композицию (например, водную фармацевтическую композицию), содержащую карбетоцин или его фармацевтически активную соль, где значение pH композиции составляет от 5,0 до 6,0. Значение pH композиции может составлять от 5,1 до 6,0, например от 5,2 до 6, например от 5,26 до 6. Значение pH композиции может составлять от 5,15 до 5,75, например от 5,2 до 5,65. Значение pH композиции может составлять от 5,26 до 5,8, например от 5,26 до 5,75, например от 5,26 до 5,7, например от 5,26 до 5,65, например от 5,4 до 5,65. Следует понимать, что композиция по изобретению предпочтительно представляет собой водный раствор. Хотя вода (например, вода для инъекций или WFI) является предпочтительным растворителем, могут быть использованы другие растворители (смеси воды с другими фармацевтически приемлемыми растворителями, фармацевтически приемлемыми спиртами и так далее).
Авторы изобретения обнаружили (Примеры 1-3), что композиция, например фармацевтическая композиция, содержащая карбетоцин или его фармацевтически активную соль и имеющая значение pH в пределах определенного конкретного диапазона pH, может храниться при комнатной температуре (например, при 25°C и 60%-ной относительной влажности) в течение продолжительного периода (например, вплоть до 2 лет). Композиция также может иметь длительную температурную стабильность при 30°C и 40°C и относительной влажности вплоть до 75% и, таким образом, быть подходящей для применения в регионах зон III/IV, не требуя хранения в холодильнике.
Композиция может включать (содержать) буферный агент, например фармацевтически приемлемый буферный агент. В данном описании термин "буферный агент" представляет собой агент, который способен доводить кислый или щелочной раствор до определенного pH состояния и затем предотвращать отклонение от этого состояния; другими словами, буферный агент представляет собой агент, который добавляют к уже кислому или щелочному раствору для модификации pH и затем сохранения pH на этом модифицированном уровне. В общем, буферный агент представляет слабую кислоту или слабое основание, которое содержится в буферном растворе и ответственно за буферное действие, наблюдаемое в этих растворах. Буферный агент может представлять собой, например, уксусную кислоту, адипиновую кислоту, лимонную кислоту, малеиновую кислоту, янтарную кислоту или фосфат (например, фосфат натрия, например дигидрат двухосновного фосфата натрия). Предпочтительно, буферный агент представляет собой янтарную кислоту. Композиция может включать единственный буферный агент (то есть не включает два или более буферных агента). Композиция может включать два или более буферных агента (например, лимонную кислоту и фосфат (например, натрия)).
В другом аспекте композиция может включать (содержать) буферный раствор. В данном описании термин "буфер" или "буферный раствор" означает раствор, включающий смесь слабой кислоты и сопряженного с ней основания или слабого основания и сопряженной с ним кислоты, который обладает тем свойством, что значение pH этого раствора изменяется очень мало при добавлении небольшого количества сильной кислоты или основания, так что pH этого буфера (раствора) сохраняется. Буфер (раствор) может представлять собой, например, цитратный буфер (раствор), содержащий лимонную кислоту и цитрат (например, цитрат натрия); янтарный буфер (раствор), содержащий янтарную кислоту и сукцинат (например, сукцинат натрия), ацетатный буфер (раствор), содержащий уксусную кислоту и ацетат (например, ацетат натрия); цитратно-фосфатный буфер (раствор), содержащий лимонную кислоту и фосфат; или фосфатный буфер (раствор), содержащий, например, фосфат (мононатрия) и сопряженное с ним основание (гидрофосфат натрия). Предпочтительный буфер представляет собой янтарный буфер. Композиция может включать единственный буфер (т.е. не включает два или более буфера). Композиция может включать два или более буфера.
Авторы изобретения обнаружили, что включение буферного агента янтарной кислоты (или применение сукцинатного буфера) может обеспечить эффективную стабильность при комнатной температуре (например, при 25°C и 60%-ной относительной влажности), в то же время возможно обеспечивая дополнительные преимущества - например, применение буферного агента янтарной кислоты или сукцинатного буфера может вносить вклад в уменьшение побочных реакций в месте инъекции и связанной с этим болью по сравнению с другими забуференными препаратами.
Концентрация карбетоцина в жидкой композиции (например, водной композиции) может составлять от 0,01 до 55 мг/мл, например от 0,01 до 50 мг/мл, например от 0,01 до 10 мг/мл, например от 0,01 до 1,5 мг/мл, предпочтительно от 0,05 до 0,5 мг/мл, например 0,1 мг/мл. Концентрация карбетоцина в жидкой композиции (например, водной композиции) может составлять, например, 1 мг/мл, 10 мг/мл, 50 мг/мл и так далее.
Композиции по изобретению могут дополнительно содержать антиоксидант. Антиоксидант может представлять собой любой антиоксидант, широко применяемый в данной области техники, например любой антиоксидант, одобренный для применения в качестве фармацевтического эксципиента. Например, антиоксидант может представлять собой метионин, этилендиаминтетрауксусную кислоту (EDTA), бутилированный гидрокситолуол, метабисульфит натрия и так далее. Предпочтительно, антиоксидант присутствует в количестве от 0,01% до 10% (масс./об.), например от 0,05% до 5% (масс./об.), наиболее предпочтительно от 0,08% до 1% (масс./об.). Предпочтительно, антиоксидант представляет собой метионин, EDTA или комбинацию метионина и EDTA. Например, антиоксидант может представлять собой метионин и присутствовать в количестве 0,1% масс./об. (или 1 мг/мл-см. Пример 2).
Композиция может дополнительно содержать агент для поддержания изотоничности. Агенты для поддержания изотоничности, например маннит или NaCl, хорошо известны в данной области техники. Предпочтительно, агент для поддержания изотоничности присутствует в количестве, достаточном для обеспечения изотонической композиции (раствора), например, в количестве от 0,01% до 10% (масс./об.). Предпочтительно, агент для поддержания изотоничности представляет собой маннит. Когда агент для поддержания изотоничности представляет собой маннит, он может присутствовать в количестве от 0,5% до 7,5% (масс./об.), более предпочтительно от 4,0% до 5,5% (масс./об.), например 5,0% (масс./об.). Когда агент для поддержания изотоничности представляет собой маннит, он может присутствовать в количестве от 0,05% до 7,5% (масс./об.). Когда агент для поддержания изотоничности представляет собой NaCl, он может присутствовать в количестве от 0,05% до 1,2% (масс./об.), более предпочтительно от 0,08% до 1% (масс./об.), например 0,9% (масс./об.). Агент для поддержания изотоничности может присутствовать в количестве от 0,1 до 100 мг/мл, например от 0,5 до 7 мг/мл, например от 1 до 5 мг/мл. Например, когда агент для поддержания изотоничности представляет собой маннит, он может присутствовать в количестве от 5 до 75 мг/мл, например от 40 до 55 мг/мл (см., например, Таблицу 3а). Когда агент для поддержания изотоничности представляет собой NaCl, он может присутствовать в количестве от 0,5 до 12 мг/мл, например от 8 до 10 мг/мл (см., например, Таблицу 3б), например 7,5 мг/мл (см. Пример 6).
Композиция может быть предназначена для введения любым путем, например пероральным, ректальным, трансбуккальным, интраназальным, вагинальным, трансдермальным (например, с помощью пластырной технологии); парентеральной, внутривенной, внутримышечной или подкожной инъекцией; интрацистернальным, интравагинальным, внутрибрюшинным, местным путем (порошки, мази или капли) или в виде трансбуккального или назального спрея. Предпочтительно, композиция представляет собой инъецируемую композицию или инъецируемый препарат. Инъецируемые препараты могут быть предложены в любом подходящем контейнере, например ампуле, флаконе, предварительно наполненном шприце, устройстве для инъекций (например, устройство для инъекций однократного использования, такое как продается Becton Dickinson под маркой Uniject), картридже для инъекций, ампуле, (много-)дозовой ручке-шприце и тому подобное. Предпочтительно, композиция предназначена для внутримышечного введения (например, внутримышечной инъекции) или внутривенного введения (например, IV инъекции).
Композиция может включать усиливающий агент, представляющий собой эксципиент, который усиливает эффективную дозу (например, усиливает эффективную дозу после интраназального введения). Усиливающий агент может представлять собой любой усиливающий агент, широко применяемый в данной области техники, например, любой усиливающий агент, одобренный для применения в качестве фармацевтического эксципиента. Усиливающий агент может представлять собой, например, метил-β-циклодекстрин, Полисорбат 80, карбоксиметилцеллюлозу или гидроксипропилметилцеллюлозу.
Композиции по изобретению могут быть предназначены для применения для (или в изготовлении лекарственных средств для) лечения или предупреждения атонии матки. Композиции могут быть предназначены для применения в лечении или предупреждении атонии матки после рождения ребенка естественным путем. Композиции могут быть предназначены для применения в лечении или предупреждении атонии матки после рождения ребенка с помощью кесарева сечения, например рождения ребенка с помощью кесарева сечения под эпидуральной или спинальной анестезией. Композиции могут быть предназначены для применения в лечении или предупреждении атонии матки, например, у пациента, имеющего риск развития РРН. Композиции могут быть предназначены для применения для (или в изготовлении лекарственных средств для) лечения или предупреждения кровотечения (например, чрезмерного кровотечения) после рождения (ребенка) естественным путем. Композиции по изобретению могут быть предназначены для применения в качестве препарата, стимулирующего сокращение матки. Композиции по изобретению могут быть предназначены для (например, стандартного) введения после рождения ребенка естественным путем.
Согласно настоящему изобретению в дополнительном аспекте предложен способ лечения или предупреждения атонии матки (например, после рождения ребенка естественным путем или рождения ребенка с помощью кесарева сечения либо у пациента, имеющего риск развития РРН) или способ лечения или предупреждения чрезмерного кровотечения после родов естественным путем, включающий стадию введения пациенту, нуждающемуся в этом, композиции, как изложено выше.
Предпочтительно, когда композиции по изобретению не включают соединение четвертичного амина, такое как хлорид бензалкония. Предпочтительно, когда композиции по изобретению не включают парагидроксибензоатный консервант или комбинацию парагидроксибензоатного консерванта с сорастворителем. Предпочтительно, когда композиции по изобретению имеют содержание ионов дивалентного металла менее 2 мМ, например 0,195 мМ или менее, например 0,1 нМ или менее. Предпочтительно, когда композиции по изобретению не включают солюбилизатор. Предпочтительно, когда композиции по изобретению не включают метил-β-циклодекстрин.
В другом аспекте изобретения предложены стабилизированные композиции карбетоцина или других фармацевтически активных соединений (например, других фармацевтически активных пептидов или фармацевтически активных малых молекул). Так, согласно дополнительному аспекту изобретения предложена жидкая (например, водная) композиция, содержащая: фармацевтически активное соединение или его соль и антиоксидант, где значение pH композиции составляет от 5,0 до 6,0. Значение pH композиции может составлять от 5,1 до 6,0, например от 5,2 до 6, например от 5,26 до 6. Значение pH композиции может составлять от 5,15 до 5,75, например от 5,2 до 5,65. Значение pH композиции может составлять от 5,0 до 5,9, например от 5,1 до 5,9, например от 5,2 до 5,8. Значение pH композиции может составлять от 5,26 до 5,8, например от 5,26 до 5,75, например от 5,26 до 5,7, например от 5,26 до 5,65, например от 5,4 до 5,65. Фармацевтически активное соединение может представлять собой карбетоцин. Композиция может быть предназначена для интраназального введения. Фармацевтически активное соединение может представлять собой соединение формулы (I) или его сольват или фармацевтически приемлемые соли:
где: n выбран из 0, 1 и 2; p выбран из 0, 1, 2, 3, 4, 5 и 6; R1 выбран из арила, возможно замещенного по меньшей мере одним заместителем, представляющим собой OH, F, Cl, Br, алкил или O-алкил; R2 выбран из R4, H, алкила, циклоалкила, арила и 5- и 6-членных гетероароматических кольцевых систем; R3 выбран из H и ковалентной связи с R2, когда R2 представляет собой R4, с образованием кольцевой структуры; R4 представляет собой C1-6алкиленовую группировку, замещенную по меньшей мере одним заместителем, представляющим собой O-алкил, S-алкил или OH; каждый W и X независимо выбран из CH2 и S, но оба не могут представлять CH2; алкил выбран из C1-6алкила с прямой цепью и С4-8алкила с разветвленной цепью и возможно имеет по меньшей мере один гидроксильный заместитель; арил выбран из фенила и моно- или поли-замещенного фенила; при условии, что когда R2 представляет собой H, p равен 1, R3 представляет собой H, n равен 1, и W и X оба представляют собой S, тогда R1 не представляет собой 4-гидроксифенил. Как описано выше и в данном описании арил означает ароматическую группу, выбранную из фенила и моно- или полизамещенного фенила; группировки заместителей, если они присутствуют, могут быть выбраны из атомов фтора (F), хлора (Cl) и брома (Br) и алкила, гидрокси (-OH), алкокси (-O-алкил) и алкилтио (-S-алкил). Предпочтительно, фармацевтически активное соединение представляет собой соединение формулы (I), указанное выше, при условии, что когда R2 представляет собой H, p равен 0, R3 представляет собой H, n равен 1, и W и X оба представляют собой S, тогда R1 не представляет собой 4-гидроксифенил. Эти соединения, их медицинские применения и способы их получения раскрыты в WO 2009/122285 (международная заявка No. PCT/IB 2009/005351) от Ferring B.V.
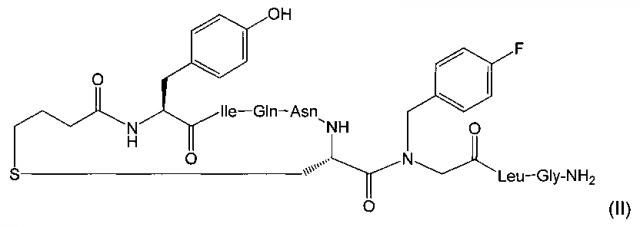
Предпочтительно, фармацевтически активное соединение представляет собой карба-1-[4-FBzlGly7]dOT, где 4-FBzlGly представляет собой N-(4-фторбензил)глицин. Карба-1-[4-FBzlGly7]dOT представляет собой аналог окситоцина, также известный как FE 202767. FE 202767 имеет структуру формулы (II):
FE 202767 является селективным агонистом рецептора окситоцина, проходящим оценку для клинического применения. FE 202767 формулы (II), некоторые его медицинские применения и способы его получения раскрыты в WO 2009/122285. FE 202767 представляет собой соединение Примера 49 WO 2009/122285 (международная заявка No. PCT/IB2009/005351) от Ferring B.V.
Пептидные агонисты окситоцина, такие как раскрыты в WO 2009/122285, как ожидается, предназначены для доставки интраназальным путем (то есть интраназальное введение). Интраназальные препараты данного типа обычно содержатся в распыляющих устройствах (и вводятся с их использованием), где лекарственное средство остается в растворе (например, при концентрации активного соединения 0,05-2 мг/мл) в инертной атмосфере в течение продолжительного периода времени (вплоть до 2 лет). Таким образом, существует необходимость в стабильных при комнатной температуре препаратах агонистов/аналогов окситоцина, таких как карба-1-[4-FBzlGly7]dOT (FE 202767), например, чтобы избежать необходимость хранения при низких температурах.
Композиция может содержать буферный агент, например, уксусную кислоту, адипиновую кислоту, лимонную кислоту, малеиновую кислоту, янтарную кислоту или фосфат (например, натрия). Композиция может включать единственный буферный агент. Композиция может включать более одного буферного агента (например, может содержать лимонную кислоту и фосфат (например, натрия)). Композиция может содержать буфер (раствор), например, цитратный буфер (раствор), содержащий лимонную кислоту и цитрат (например, цитрат натрия); сукцинатный буфер (раствор), содержащий янтарную кислоту и сукцинат (например, сукцинат натрия), ацетатный буфер (раствор), содержащий уксусную кислоту и ацетат (например, ацетат натрия); цитратно-фосфатный буфер (раствор), содержащий лимонную кислоту и фосфат; или фосфатный буфер (раствор). Однако, предпочтительно, что если фармацевтически активное соединение представляет собой 1-дезамино-8-D-аргинин-вазопрессин (десмопрессин), буферный агент не представляет собой яблочную кислоту (и/или композиция не включает яблочную кислоту в качестве буфера).
Концентрация фармацевтически приемлемого соединения в жидкой (водной) композиции может составлять, например, от 0,01 до 5 мг/мл.
Концентрация карбетоцина в жидкой (водной) композиции может составлять от 0,01 до 55 мг/мл, например от 0,01 до 50 мг/мл, например от 0,01 до 10 мг/мл, например от 0,01 до 1,5 мг/мл, предпочтительно от 0,05 до 0,5 мг/мл, например 0,1 мг/мл. Концентрация карбетоцина в жидкой композиции (например, водной композиции) может составлять, например, 1 мг/мл, 10 мг/мл, 50 мг/мл и так далее.
Концентрация соединения формулы (II) в жидкой (водной) композиции может составлять от 0,01 до 4 мг/мл, например от 0,05 до 2 мг/мл, более предпочтительно от 0,1 до 1,4 мг/мл, наиболее предпочтительно от 0,2 до 0,7 мг/мл.
Композиции по этому аспекту изобретения содержат антиоксидант. Антиоксидант может представлять собой любой антиоксидант, широко применяемый в данной области техники, например любой антиоксидант, одобренный для применения в качестве фармацевтического эксципиента. Например, антиоксидант может представлять собой метионин, EDTA, бутилированный гидрокситолуол, метабисульфит натрия и так далее. Предпочтительно, антиоксидант присутствует в количестве от 0,01% до 10% (масс./об.), например от 0,05% до 5% (масс./об.), наиболее предпочтительно от 0,08% до 1% (масс./об.). Предпочтительно, антиоксидант представляет собой метионин, EDTA или комбинацию метионина и EDTA. В качестве примера, антиоксидант представляет собой метионин и присутствует в количестве 0,5% масс./об. В качестве примера, антиоксидант представляет собой EDTA и присутствует в количестве 0,1% масс./об.
Композиция может дополнительно содержать агент для поддержания изотоничности. Агенты для поддержания изотоничности, например, маннит или NaCl, хорошо известны в данной области техники. Предпочтительно, агент для поддержания изотоничности присутствует в количестве, достаточном для обеспечения изотонической композиции (раствора), например, в количестве от 0,01% до 10% (масс./об.). Предпочтительно, агент для поддержания изотоничности представляет собой маннит. Когда агент для поддержания изотоничности представляет собой маннит, он может присутствовать в количестве от 0,5% до 7,5% (масс./об.), более предпочтительно от 4,0% до 5,5% (масс./об.), например 5,0% (масс./об.). Когда агент для поддержания изотоничности представляет собой маннит, он может присутствовать в количестве от 0,05% до 7,5% (масс./об.). Когда агент для поддержания изотоничности представляет собой NaCl, он может присутствовать в количестве от 0,05% до 1,2% (масс./об.), более предпочтительно от 0,08% до 1% (масс./об.), например 0,9% (масс./об.). Агент для поддержания изотоничности может присутствовать в количестве от 0,1 до 100 мг/мл, например от 0,5 до 7 мг/мл, например от 1 до 5 мг/мл. Например, когда агент для поддержания изотоничности представляет собой маннит, он может присутствовать в количестве от 5 до 75 мг/мл, например от 40 до 55 мг/мл. Когда агент для поддержания изотоничности представляет собой NaCl, он может присутствовать в количестве от 0,5 до 12 мг/мл, например от 8 до 10 мг/мл.
Композиция может быть предназначена для введения любым путем, например пероральным, ректальным, трансбуккальным, интраназальным, вагинальным, трансдермальным (например, с помощью пластырной технологии); парентеральной, внутривенной, внутримышечной или подкожной инъекцией; интрацистернальным, интравагинальным, внутрибрюшинным, местным путем (порошки, мази или капли) или в виде трансбуккального или назального спрея. Предпочтительно, композиция предназначена для интраназального введения, например, представляет собой назальный спрей. Как указано выше, композиции, подходящие для интраназального введения, как ожидают, остаются стабильными в растворе при комнатной температуре в течение продолжительного периода времени.
Композиция может включать усиливающий агент, представляющий собой эксципиент, который усиливает эффективную дозу (например, усиливает эффективную дозу после интраназального введения). Усиливающий агент может представлять собой любой усиливающий агент, широко применяемый в данной области техники, например, любой усиливающий агент, одобренный для применения в качестве фармацевтического эксципиента. Усиливающий агент может представлять собой, например, метил-β-циклодекстрин, Полисорбат 80, карбоксиметилцеллюлозу или гидроксипропилметилцеллюлозу.
Предпочтительно, когда композиции по изобретению не включают соединение четвертичного амина, такое как хлорид бензалкония. Предпочтительно, когда композиции по изобретению не включают парагидроксибензоатный консервант или комбинацию парагидроксибензоатного консерванта с сорастворителем. Предпочтительно, когда композиции по изобретению имеют содержание ионов дивалентного металла менее 2 мМ, например 0,195 мМ или менее, например 0,1 нМ или менее. Предпочтительно, когда композиции по изобретению не включают солюбилизатор. Предпочтительно, когда композиции по изобретению не включают метил-β-циклодекстрин.
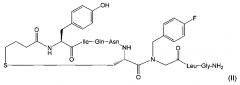
Согласно данному изобретению в дополнительном аспекте предложена жидкая (например, водная) композиция, содержащая: фармацевтически активное соединение формулы (II):
или его (фармацевтически приемлемую) соль, где значение pH композиции составляет от 5,0 до 6,0. Значение pH композиции может составлять от 5,0 до 5,9, например от 5,1 до 5,9, например от 5,2 до 5,8. Значение pH композиции может составлять от 5,1 до 6,0, например от 5,2 до 6, например от 5,26 до 6. Значение pH композиции может составлять от 5,15 до 5,75, например от 5,2 до 5,65. Значение pH композиции может составлять от 5,26 до 5,8, например от 5,26 до 5,75, например от 5,26 до 5,7, например от 5,26 до 5,65, например от 5,4 до 5,65. Предпочтительно, жидкая (например, водная) композиция содержит фармацевтически активное соединение формулы (II):
Композиция может быть предназначена для введения любым путем, например пероральным, ректальным, трансбуккальным, интраназальным, вагинальным, трансдермальным (например, с помощью пластырной технологии); парентеральной, внутривенной, внутримышечной или подкожной инъекцией; интрацистернальным, интравагинальным, внутрибрюшинным, местным путем (порошки, мази или капли) или в виде трансбуккального или назального спрея. Предпочтительно, композиция предназначена для интраназального введения, например, представляет собой назальный спрей. Как указано выше, композиции, подходящие для интраназального введения, как ожидают, остаются стабильными в растворе при комнатной температуре в течение продолжительного периода времени. Примечательно, авторы изобретения обнаружили, что композиции соединения формулы (II), указанной выше, могут обеспечивать такую стабильность при значениях pH, которые особенно подходят для интраназального введения, без необходимости включения антиоксиданта (см. Пример 7).
Композиция может содержать буферный агент, например, уксусную кислоту, адипиновую кислоту, лимонную кислоту, малеиновую кислоту, янтарную кислоту или фосфат (например, натрия). Композиция может включать единственный буферный агент. Композиция может включать более одного буферного агента (например, может содержать лимонную кислоту и фосфат (например, натрия)). Композиция может содержать буфер (раствор), например, цитратный буфер (раствор), содержащий лимонную кислоту и цитрат (например, цитрат натрия); сукцинатный буфер (раствор), содержащий янтарную кислоту и сукцинат (например, сукцинат натрия), ацетатный буфер (раствор), содержащий уксусную кислоту и ацетат (например, ацетат натрия); цитратно-фосфатный буфер (раствор), содержащий лимонную кислоту и фосфат; или фосфатный буфер (раствор).
Предпочтительно, фармацевтическая композиция содержит цитратно-фосфатный буфер, и pH составляет от 5,1 до 6,0, например от 5,2 до 6, например от 5,26 до 6.
Предпочтительно, фармацевтическая композиция содержит сукцинатный буфер или цитратный буфер, и pH составляет от 5,0 до 5,9, например от 5,0 до 5,8, например от 5 до 5,7.
Концентрация соединения формулы (II) в жидкой (водной) композиции может составлять от 0,01 до 4 мг/мл, например от 0,05 до 2 мг/мл, более предпочтительно от 0,1 до 1,4 мг/мл, наиболее предпочтительно от 0,2 до 0,7 мг/мл.
Композиции по данному аспекту изобретения дополнительно содержат антиоксидант. Антиоксидант может представлять собой любой антиоксидант, широко применяемый в данной области техники, например любой антиоксидант, одобренный для применения в качестве фармацевтического эксципиента. Например, антиоксидант может представлять собой метионин, EDTA, бутилированный гидрокситолуол, метабисульфит натрия и так далее. Предпочтительно, антиоксидант присутствует в количестве от 0,01% до 10% (масс./об.), например от 0,05% до 5% (масс./об.), наиболее предпочтительно от 0,08% до 1% (масс./об.). Предпочтительно, антиоксидант представляет собой метионин, EDTA или комбинацию метионина и EDTA. В качестве примера, антиоксидант представляет собой метионин и присутствует в количестве 0,5% масс./об. В качестве примера, антиоксидант представляет собой EDTA и присутствует в количестве 0,1% масс./об.
Композиция может дополнительно содержать агент для поддержания изотоничности. Агенты для поддержания изотоничности, например, маннит или NaCl, хорошо известны в данной области техники. Предпочтительно, агент для поддержания изотоничности присутствует в количестве, достаточном для обеспечения изотонической композиции (раствора), например, в количестве от 0,01% до 10% (масс./об.). Предп