Химический синтез и противоопухолевый и противометастатический эффекты конъюгата двойного действия
Иллюстрации
Показать всеИзобретение относится к конъюгату двойного действия формулы I, в котором доцетаксел связан с производным мурамилдипептида, что обеспечивает достижение противоопухолевого и противометастатического эффекта. Способ получения конъюгата осуществляют путем комбинации твердофазного и жидкофазного синтеза. Также предложены фармацевтическая композиция и применение конъюгата для получения противоопухолевых лекарственных средств. 4 н. и 17 з.п. ф-лы, 29 ил., 13 табл., 51 пр.
Реферат
Область техники
Настоящее изобретение относится к группе конъюгатов доцетаксела и производных мурамилдепептида, и синтезу, применению указанных соединений в лечении рака. Изобретение принадлежит к области медицинской технологии.
Уровень техники
Американским Национальным Институтом Рака (NCI) было обнаружено, что Паклитаксел (также называемый таксол), выделенный из тиса коротколистного (Taxus brevifolia) [1], демонстрирует противоопухолевую активность. Первоначальные исследования механизма действия показали, что паклитаксел является митотическим ингибитором, который приостанавливает рост раковых клеток на стадии G2 и М за счет активации полимеризации и деполимеризации микротрубочек раковой клетки, таким образом предотвращая формирование веретена деления в раковой клетке [2]. Дальнейшие исследования механизма действия показали, что паклитаксел также может использоваться в качестве аналога бактериального липополисахарида (LPS), который проявляет свое противоопухолевое действие, оказывая влияние или изменяя функцию макрофагов в иммунной системе, например, стимулируя экспрессию фактора некроза опухоли α (TNF-α) и интерлейкина-1(IL-1) в макрофагах [3, 4]. Кроме того, он демонстрирует противоопухолевый эффект, активируя МАР-2 киназу, стимулируя фосфорилирование тирозина раковых клеток [5, 6].
Мурамилдипептид (N-ацетилмурамил-L-аланил-D-изоглутамин, МДП) представляет собой наименьшее структурное звено, проявляющее иммуноадъювантную активность пептидогликанов клеточной стенки микробактерий [7, 8]. МДП, вводимый одновременно или перед введением антигена, усилит иммунный ответ или изменит тип иммунного ответа. Кроме того, мурамилдипептид демонстрирует и другие типы активности, такие как неспецифическая резистентность к инфекции, вызванной палочкой Фридлендера, кишечной палочкой, синегнойной палочкой, листерией мононуклеоза, грибом Tritirachium album и др., неспецифическая резистентность к фибросаркоме, гепатоме и др., и иммунорегуляция [9-13]. Исследования также показали, что МДП, связанный с липополисахаридом (LPS), может существенно стимулировать экспрессию цитокинов макрофагов [14-16].
Основываясь на этом, мы предположили, что паклитаксел, связанный с мурамилдипептидом, также может демонстрировать синергичность. Мы впервые выдвигаем новую идею о том, что связывание химиотерапевтического препарата паклитаксел и иммуностимулятора мурамилдипептида приводит к образованию ряда конъюгатов, и проводятся биологические исследования для проверки предположения о расширении целей химиотерапии за счет ассоциации иммунотерапии с противоопухолевой и в тоже время противо-метастатической [17].
Мы раскрыли две группы конъюгатов в нашем предыдущем патенте [18], которые были получены за счет связывания мурамилдипептида с паклитакселом 2′-гидрокси (2′-O-МТС, Схема 1), или с 3′-амино-производным 3′-N-бензоилпаклитакселом (3′-N-MTC, Схема 1). В ходе исследований in vitro мы обнаружили, что конъюгат 2′-O-МТС не только продемонстрировал противоопухолевую активность паклитаксела, но также ассоциировался с макрофагами, что приводило к выработке αTNF- и IL-1 в существенной степени, что означает, что он потенциально предотвращает метастазирование рака. Однако активность 3′-N-MTC конъюгата была не столь значительна, как активность 2′-O-МТС. Исходя из этого мы предварительно определили, что оптимальное положение конъюгатов для связывания будут 2′-гидроксильная группа. К сожалению, конъюгат 2′-O-MTC не показал желаемых результатов в экспериментах in vivo, которые могли зависеть от физико-химических свойств или фармацевтических свойств молекулы. В продолжении этой дизайнерской концепции, используемой при разработке новых лекарственных средств, мы оптимизировали аналог 2′-О-МТС посредством упрощения структур молекул мурамилдипептида, и получили новую группу аналогов 2′-O-МТС, которые продемонстрировали значительную противоопухолевую и противометастатическую активность в экспериментах in vivo, что означает, что они потенциально могут разрабатываться в качестве противоопухолевых лекарств, новая группа аналога 2-О-МТС, упомянутая выше, представляет собой группу, описанную нами в настоящем патенте
Паклитаксел, химиотерапевтическая часть в мурамил паклитаксел-дипептид конъюгате, является таксановым противоопухолевым препаратом, в то время как доцетаксел, полусинтетическое производное, является еще одним важным таксановым противоопухолевым препаратом, который демонстрирует ингибирующую активность на последней стадии рака молочной железы, немелкоклеточного рака легкого, рака яичников, рака поджелудочной железы, рака печени, опухолей головы и шеи. Недавние исследования показали, что доцетаксел индуцирует апоптоз раковых клеток за счет активации образования микротрубочками устойчивых полимеров и ингибирования деполимеризации [19], кроме того, он ингибирует митоз и пролиферацию раковых клеток [20]. Исследования также показали, что доцетаксел может остановить опухолевую клетку на G2/M стадии за счет активации экспрессии Bax белка и подавления экспрессии Bcl-2 белка[21]. Исходя из этого настоящее изобретение предполагает замену паклитаксела, препарата химиотерапии в исходном конъюгате, на доцетаксел с образованием конъюгатов доцетаксел-мурамилдипептидов, исследование показало, что такие конъюгаты также демонстрируют противоопухолевую активность.
Мурамилдипептид, стимулирующая иммунологическую реактивность часть конъюгатов паклитаксел-мурамилдипептид, демонстрирует широкий спектр биологической активности и вызывает большой интерес с момента своего открытия. Однако мурамилдипептид проявляет несколько побочных эффектов, таких как иммуногенные индуцированные аллергические реакции, лихорадка, воспаление и сонливость, которые ограничивают его клиническое применение. Для того чтобы найти мурамилдипептид с более высокой активностью и меньшим числом побочных эффектов, ученые синтезировали сотни мурамилдипептидных соединений или аналогов и исследовали их биологическую активность. L-треонин-мурамилдипептид получают путем замены L-аланина в молекуле мурамилдипептида на L-треонин, который демонстрирует более высокую иммуноадъювантную активность, нежели чем у мурамилдипептида, но пирогенность в 100 раз ниже. При использовании в качестве адъювантной вакцины, L-треонин-мурамилдипептид не стимулирует макрофаги и противовоспалительный эффект, но стимулирует иммунный ответ введенного антигена, поэтому он является идеальной адъювантной вакциной за счет своего действия, и побочный эффект может быть эффективно отделен [22].
Мурабутид получают путем введения мурамилдипептида в длинную липотропную цепь. Мурабутид может увеличить неспецифическую антибактериальную и антивирусную инфекцию иммунной системы организма и стимулировать активность колониестимулирующего фактора. Кроме того, он хорошо переносится человеком [23-26]. По сравнению с другими экзогенными иммуномодуляторами мурабутид не является пирогенным и способствует высвобождению цитокинами как синергетически, так и избирательно Th1 цитокина, и мурабутид не вызывает воспалительной реакции [27, 28]. Кроме того, мурабутид в сочетании с IFN-α или IL-2 может значительно повысить противоопухолевую активность цитокинов, таким образом повышая антивирусный и противовоспалительный эффект IFN-α [29, 30]. Мурабутид может регулировать функцию макрофагов [31]. Он также может быть использован в лечении хронического гепатита С (HCV), поскольку в сочетании с IFN-α он продемонстрировал синергетический эффект в ходе экспериментов in vitro [32].
Мурамилтрипептид фосфатидилэтаноламин (МТР-РЕ) получают путем введения липофильной длинной цепи в мурамилдипептиды посредством фосфатной связи. МТР-РЕ может активировать моноциты и макрофаги, тем самым приводя к гибели опухолевых клеток. МТР-РЕ, инкапсулированный в липосомы (L-MTP-PE), вводимый внутривенно, в основном используют для активации макрофагов в легких, печени и селезенке [33]. Его активность выше от десяти до сотен раз, и пирогенность значительно снижена. Через два часа после внутривенного введения пациентам с метастатической меланомой, фактор некроза опухоли в плазме крови увеличивается в шестнадцать раз, а уровень содержания неоптерина и интерлейкина был существенно повышен [34].
MDP-Lys (L18) получают путем введения липофильной длинной цепи в мурамилдипептиды через лизин. MDP-Lys (L18) может увеличить производство цитокинов, таких как CSFs, IL-1, IL-6,, -Lys (L18) может увеличить проит.д., которые играют важную роль в регулировании кроветворной системы [35-36]. Кроме того, MDP-Lys (L18) обладает сильным антиинфекционным, противоопухолевым эффектом [37].
MDP-C получают путем введения ароматической конъюгированной системы в мурамилдипептиды посредством лизина. MDP-C способен стимулировать сильную цитотоксическую активность макрофагов против Р388 клеток лейкемии, он может также вводить стимулировать выработку мастоцитомы Р815 цитотоксическими Т-лимфоцитами (CTL). Сообщают, что MDP-C стимулирует дендритные клетки (BMDC) костного мозга мышей вырабатывать цитокины IL-2 и IL-12 (интерлейкин), и он также может быть использован как эффективный иммуностимулятор, поскольку он проявляет активность в отношении стимуляции выработки цитотоксическими Т-лимфоцитами интерферона-γ. Низкие дозы MDP-C могут значительно и синергично способствовать пролиферации лимфоцитов селезенки мыши, вызванной Конканавалином А (ConA). Кроме того, MDP-C может увеличить экспрессию молекул поверхностью дендритных клеток костного мозга, таких как CD11c, МНС I и молекулы-1 клеточной адгезии. Кроме того, MDP-C в экспериментах in vitro может быть значительно повышать за счет производства антител и специфичного поверхностного антигена вируса гепатита В (HBsAg) Т-клеток, реакция иммунной системы на HBsAg у трансгенных мышей с вирусом гепатита В была существенно усилена [38, 39].
Адамантантиламиддипептид (AdDP) получается путем соединения карбоксильного конца дипептидного фрагмента в молекуле t мурамилдипептида с амантадином. AdDP является безопасным и демонстрирует противовирусную антибактериальную активность. По сравнению с другими аналогами MDP, его биодоступность выше [40]. AdDP может улучшить гуморальный иммунитет у BALB / с мышей и кроликов в сочетании с белком иммуногена перорально или перитонеально [41].
Также были получены циклические аналоги мурамилдипептида, не содержащие сахарных остатков, путем выделения из природных веществ, такие как FK-156 и FK-565. Они продемонстрировали антибактериальную, противовирусную и противоопухолевую активность[42].
Ссылки
[1] Mansukhlal С. Wani, Harold Lawrence Taylor, Monroe E. Wall, Philip Coggon, Andrew T. McPhail; Plant antitumor agents. VI. Isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia; J. Am. Chem. Soc.; 1971, 93(9), 2325-2327.
[2] Peter B. Schiff and Susan B. Horwitz; Taxol stabilizes microtubules in mouse fibroblast cells; Proc. Natl. Acad. Sci. USA 1980, 77(3), 1561-1565.
[3] A.H. Ding, F. Porteu, E. Sanchez, and C.F. Nathan; Shared actions of endotoxin and taxol on TNF receptors and TNF release; Science; 1990, 20, 370-372.
[4] Christian Bogdan and Aihao Ding; Taxol, a microtubule-stabilizing antineoplastic agent, induces expression of tumor necrosis factor a and interleukin-1 in macrophages; Journal of Leukocyte Biology; 1992, 52, 119-121.
[5] B. Brugg and A Matus; Phosphorylation determines the binding of microtubule-a- ssociated protein 2 (MAP2) to microtubules in living cells; J. Cell Biol.; 1991, 114(4), 735-743.
[6] Carboni, J., Singh, С., Tepper, M.; Cancer Institute Workshop on Taxol and Taxus, Alenandria, V.A.; NCI, 1992.
[7] Ellouz F., Adam A., Ciorbaru R., et al; Minimal structural rэкв.uirements for adjuvant activity of bacterial peptidoglycan derivatives; Biochem. Biophys. Res. Commun.; 1974, 59, 1317-1325.
[8] Adam, A., Ciorbaru, R., Ellouz, F., Petit, J.F. and Lederer, E.; Adjuvant activity of monomeric bacterial cell wall peptidoglycans; Biochem. Biophys. Res. Commun.; 1974, 56(3), 561-567.
[9] F. Audibert, L. , P. Lefrancier, J. Choay; Distinctive adjuvanticity of synthetic analogs of mycobacterial water-soluble components; Cellular Immunology; 1976, 21, 243-249.
[10] M.A. Parant, F.M. Audibert, L.A Chedid, M.R. Level, P.L. Lefrancier, J.P. Choay, and E. Lederer; Immunostimulant activities of a lipophilic muramyl dipeptide derivative and of desmuramyl peptidolipid analogs; Infect. Immun.; 1980, 27, 826-831.
[11] Adam A., Petit J.F., Chedid L.; Influence of a synthetic adjuvant (MDP) on qualitative and quantitative changes of serum globulins; Immunology; 1978, 35(6), 963-970.
[12] Dietrich F.M., Hochkeppel H.K., Lukas В.; Enhancement of host resistance against virus infections by MTP-PE, a synthetic lipophilic muramyl peptide - increased survival in mice and guinea pigs after single drug administration prior to infection, and the effect of MTP-PE on interferon levels in sera and lungs; Int. J. Immunopharmacol; 1986, 8, 931-932.
[13] Adam A., Lederer E.; Muramyl peptides: immunomodulators, sleep factors, and vitamins; Med. Res. Rev., 1984, 4(2), 111-152.
[14] Anton V. Gorbachev, Nancy A. Dilulio, and Robert L.; Fairchild IL-12 augments CD81 T cell development for contact hypersensitivity responses and circumvents Anti-CD154 antibody-mediated inhibition; The Journal of Immunology, 2001, 167, 156-162.
[15] Alexandre A. Vetcher, Marek Napierala, Ravi R. Iyer, Paul D. Chastain, Jack D. Griffith, and Robert D.; Wells sticky DNA a long GAA·GAA·TTC triplex that is formed intramolecularly, in the sэкв.uence of intron 1 of the frataxin gene; J. Biol. Chem.; 2002, 277, 39217-39227.
[16] C.L. Contel, N. Temime, D.J. Charron, and M.A. Parant; Modulation of lipopolysaccharide-induced cytokine gene expression in mouse bone marrow-derived macrophages by muramyl dipeptide; The Journal of Immunology; 1993, 150, 4541-4549.
[17] Xuqin Li, Junli Yu, Song Xu, Nan Wang, Hongzhen Yang, Zheng Yan, Guifang Cheng, Gang Liu; Chemical conjugation of muramyl dipeptide and paclitaxel to explore the combination of immunotherapy and chemotherapy for cancer; Glycoconj J.; 2008, 25(5), 415-425.
[18] Патент № 200510081265 X.
[19] Toshiyuki Harada, Shigeaki Ogura, Koichi Yamazaki, Ichiro Kinoshita, Tomoo Itoh, Hiroshi Isobe, Katsushige Yamashiro, Hirotoshi Dosaka-Akita, Masaharu Nishimura; Predictive value of expression of P53, Bcl-2 and lung resistance-related protein for response to chemotherapy in non-small cell lung cancers; Cancer Science; 2005, 94(4), 394-399.
[20] David L. Morse, Heather Gray, Claire M. Payne, and Robert J. Gillies; Docetaxel induces cell death through mitotic catastrophe in human breast cancer cells; Mol Cancer Ther; 2005, 4, 1495-1504.
[21] Yu Q, Gao J.X., He X.S., et al; Docetaxcel induces apoptosis and regulates expressions of bax an d bcl-2 protein in human breast carcinoma MCF-7 Cells; Cancer Res. Pre. Treatment, 2006, 33(6), 388-390.
[22] Deborah A. Eppstein, Noelene E. Byars, Anthony C. Allison; New adjuvants for vaccines containing purified protein antigens; Advanced Drug Delivery Reviews 1990, 4, 233-253.
[23] L.A. Chedid, M.A. Parant, F.M. Audibert, G.J. Riveau, F.J. Parant, E. Lederer, J.P. Choay, and P.L. Lefrancier; Biological activity of a new synthetic muramyl peptide adjuvant devoid of pyrogenicity; Infection and Immunity; 1982, 35, 417-424.
[24] Chomel J.J., Simon-Lavoine N., Thouvenot D., Valette M., Choay J., Chedid L., Aymard M.; Prophylactic and therapeutic effects of murabutide in OF1 mice infected with influenza A and В viruses; International Journal of Immunopharmacology; 1985, 7(3), 346-347.
[25] George M. Bahr, Edith Darcissac, Dorian Bevec, Peter Dukor, Louis Chedid; Immunopharmacological activities and clinical development of muramyl peptides with particular emphasis on murabutide; International Journal of Immunopharmacology; 199517(2), 117-131.
[26] A. Galelli, P. Lefrancier, and L. Chedid; Colony-stimulating activity induced by synthetic muramyl peptides: variation with chemical structure and association with anti-infectious activity; Infection and Immunity; 1984, 46, 495-500.
[27] George M. Bahr, Edith Darcissac, Philippe R. Pouillart, Louis A. Chedid; Synergistic effects between recombinant interleukin-2 and the synthetic immunomodulator murabutide: selective enhancement of cytokine release and potentiation of antitumor activity; Journal of Interferon and Cytokine Research; 1996, 16(2), 169-178.
[28] Edith C.A. Darcissac, George M. Bahr, Philippe R. Pouillart, Gilles J. Riveau, Monique A. Parant; Selective potentiation of cytokine expression in human whole blood by murabutide, a muramyl dipeptide analogue; Cytokine, 1996, 8, 658-666.
[29] George M. Bahr, Philippe R. Pouillart, Louis A Chedid; Enhancement in vivo of the antiinflammatory and antitumor activities of type I interferon by association with the synthetic immunomodulator murabutide; Journal of Interferon and Cytokine Research; 1996, 16(4), 297-306.
[30] Philippe R. Pouillart, Francoise M. Audibert, Louis A Chedid, Pierre L. Lefrancier, George M. Bahr; Enhancement by muramyl peptides of the protective response of interferon-α/β against encephalomyocarditis virus infection; International Journal of Immunopharmacology; 1996, 18(3), 183-192.
[31] Gilles J. Riveau, Beatrice G. Brunel-Riveau, Francoise M. Audibert, Louis A. Chedid; Influence of a muramyl dipeptide on human blood leukocyte functions and their membrane antigens; Cellular Immunology; 1991, 134, 147-156.
[32] E. С. A. Darcissac, V. Vidal, M. Guillaume, J.J. Thebault, G.M. Bahr; Clinical tolerance and profile of cytokine induction in healthy volunteers following the simultaneous administration of IFN-α and the synthetic immunomodulator murabutide; Journal of Interferon and Cytokine Research; 2001, 21(9), 655-661.
[33] (a). Nardin A., Lefebvre M.L., Labroquere K., Faure O., Abastado J.P.; Liposomal muramyl tripeptide phosphatidylethanolamine: tTargeting and activating macrophages for adjuvant treatment of osteosarcoma; Current Cancer Drug Targets; 2006, 6, 123-133.
(b). Meyers Paul A., Schwartz Cindy L., et al; A randomized, prospective trial of the addition of ifosfamide and/or muramyl tripeptide to cisplatin, doxorubicin, and high-dose methotrexate; J. Clin. Oncol.; 2005, 23(9), 2004-2011.
[34] Liebes L., Walsh С.M., Chachoua A., et al; Modulation of monocyte functions by muramyl triptide phosphatidylethanolamine in a phase II study in patients with metastatic melanoma; J. Natl. Cancer. Inst.; 1992, 84, 694-699.
[35] Y. Osada, T. Otani, M. Sato, T. Une, K. Matsumoto, and H. Ogawa; Polymorphonuclear leukocyte activation by a synthetic muramyl dipeptide analog; Infection and Immunity; 1982, 38, 848-854.
[36] Kenji Namba, Eiko Yamamura, Hironobu Nitanai, Tsuyoshi Otani, Ichiro Azuma; Romurtide, a synthetic muramyl dipeptide derivative, promotes megakaryocytopoiesis through stimulation of cytokine production in nonhuman primates with myelosuppression; Vaccine, 1997, 15(4), 405-413.
[37] Ichiro Azuma, Tsukasa Seya; Development of immunoadjuvants for immunotherapy of cancer; International Immunopharmacology; 2001, 1(7), 1229-1392.
[38] Hong-Zhen Yang, Song Xu, Xue-Yan Liao, Suo-De Zhang, Zheng-Lun Liang, Bai-He Liu, Jin-Ye Bai, Chao Jiang, Jian Ding, Gui-Fang Cheng, and Gang Liu; A novel immunostimulator, N2-[α-O-Benzyl-N-(acetylmuramyl)-I-alanyl-d-isoglutaminyl] -N6-trans-(m-nitrocinnamoyl)-I-lysine, and its adjuvancy on the hepatitis В surface antigen; J. Med. Chem.; 2005, 48(16), 5112-5122.
[39] Патент CN 1609118 A[40] P. Walder, E. Buchar, Z Machkova, T. Vrba, M. Flegel, , K. Mas′ek; Pharmacokinetic profile of the immunomodulating compound adamantylamide dipeptide(AdDP), a muramyl dipeptide derivative in mice; Immuno-pharmacology and Immunotoxicology, 1991, 13(1 and 2), 101-119.
[41] Pablo D. Becker, Ricardo S. Corral, Carlos , Saul Grinstein; Adamantylamide dipeptide as effective immunoadjuvant in rabbits and mice; Vaccine; 2001, 19(32), 4579-4903.
[42] A.M. Kolodziejczyk, A.S. Kolodziejczyk, S. Stoev; New convenient synthesis of immunostimulating peptides containingmeso-diaminopimelic acid Syntheses of FK-565 and FK-156; International Journal of Peptide and Protein Research; 1992, 39(4), 382-387.
Подробное описание изобретения
Техническая проблема, решаемая с помощью настоящего изобретения, заключается в обеспечении ряда конъюгатов, обладающих противоопухолевой и противометастатической синергетической активностью.
Вторая техническая проблема, которая будет решена с помощью настоящего изобретения, это обеспечение способа получения таких конъюгатов.
Третьей технической проблемой, которая будет решена с помощью настоящего изобретения, является обеспечение фармацевтической композиции, содержащей такой конъюгат.
Еще одна техническая проблема, решаемая с помощью настоящего изобретения, заключается в применении такого конъюгата для получения противоопухолевых и противометастатических синергичных лекарственных средств.
Для решения технических проблем, упомянутых выше, в настоящем изобретении применены следующие решения:
Соединение формулы I и его фармацевтически приемлемые соли,
где А представляет собой трет-бутокси, В представляет собой гидрокси;
где n=2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12.
В предпочтительном варианте реализации n=2, 3, 4, 5, 6, 7, 8, 9 или 10.
В другом предпочтительном варианте реализации n=2, 3, 4, 5, 6, 7 или 8.
В еще одном предпочтительном варианте реализации n=2, 3, 4 или 5.
При этом X выбран из C1-6 алкилена, -С=С- и C1-6 алкила, содержащего гетероатом, где указанный гетероатом представляет собой кислород; или X представляет собой одинарную связь, посредством которой М непосредственно связан с ацилом.
В предпочтительном варианте реализации X выбран из С1-4 алкилена, -С=С- и C1-4 алкила, содержащего гетероатом, где гетероатом независимо выбран из кислорода и серы; или X представляет собой одинарную связь, посредством которой М непосредственно связан с ацилом.
В другом предпочтительном варианте реализации, X выбран из C1-3 алкилена, -С=С- и С1-3 алкила, содержащего гетероатом, где гетероатом представляет собой является кислородом; или X представляет собой одинарную связь, посредством которой М непосредственно связан с ацилом.
В еще одном предпочтительном варианте реализации X выбран из -С=С-, -СН2-СН2-, -О-СН2- и одинарной связи.
М может представлять собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, например, М может представляет собой арил или гетероарил, термин «арил»,как показано в настоящем тексте, относится к арилу, содержащему от пяти до четырнадцати членов.
В одном варианте реализации М выбран из фенила, нафтила и гетероарила, выбранного из пятичленного гетероциклического кольца, содержащего атом серы, или десятичленного конденсированного гетероциклического ароматического кольца, содержащего атом азота.
Термин «гетероарил» может, например, представлять собой гетероциклическое ароматическое кольцо, содержащее один или более, а именно один, два, три и четыре гетероатома в кольце, где гетероатом независимо выбран из азота, кислорода и серы.
В другом примере «гетероарил» может представлять собой гетероциклическое ароматическое кольцо, содержащее от пяти до четырнадцати членов и один или более, а именно один, два, три и четыре гетероатома в кольце, где гетероатом независимо выбран из азота, кислорода и серы.
В еще одном примере «гетероарил» может быть выбран из пятичленного гетероциклического ароматического кольца, шестичленного гетероциклического ароматического кольца, восьмичленного конденсированного гетероциклического ароматического кольца, девятичленного конденсированного гетероциклического ароматического кольца, десятичленного конденсированного гетероциклического ароматического кольца, все ароматические кольца, упомянутые выше, содержат один или более, а именно один, два, три и четыре гетероатома в кольце, где гетероатом независимо выбран из азота, кислорода и серы.
«Пятичленное гетероциклическое ароматическое кольцо» представляет собой .
Термин «десятичленное конденсированное гетероциклическое ароматическое кольцо», содержащее один и более, например, один, два, три или четыре гетероатома в ядре, где гетероатом независимо выбран из азота, кислорода и серы, десятичленное конденсированное гетероциклическое ароматическое кольцо, описанное в настоящем тексте, выбрано из
и
R относится к одному или нескольким заместителям, и R может быть необязательно связан с М.
В одном из вариантов реализации R выбранирается из водорода, замещенного или незамещенного прямого неразветвленного или разветвленного C1-6 алкила, гидрокси, замещенного или незамещенного неразветвленного прямого или разветвленного C1-6 алкокси, сульфгидрила, замещенного или незамещенного неразветвленного прямого или разветвленного C1-6 алкилтио, C1-6 алкокси-C1-6 алкила, амино, замещенного или незамещенного прямого неразветвленного или разветвленного C1-6 алкиламино, включающегоий моно-алкиламино или ди-алкиламино, альдегидной группы, замещенного или незамещенного неразветвленного или разветвленного C1-6 алкилацила, карбоксила, замещенного или незамещенного неразветвленного или разветвленного C1-6 алкилацилокси, карбамоила, замещенного или незамещенного неразветвленного или разветвленного C1-6 алкиламида, С2-6 алкена, галогена, нитро и циано;
Замещенная группа C1-C6 прямой цепи или разветвленной цепи, описанной в настоящем тексте, выбрана из гидроксила, сульфгидрила, амино, альдегидной группы, карбоксила, карбамоила, галогена, нитро и циано;
В одном из вариантов реализации R выбран из водорода, замещенного или незамещенного неразветвленного или разветвленного C1-4 алкила, гидрокси, замещенного или незамещенного неразветвленного или разветвленного С1-4 алкокси, С1-4 алкокси-C1-4 алкила, сульфгидрила, замещенного или незамещенного неразветвленного или разветвленного С1-4 алкилтио, амино, замещенного или незамещенного неразветвленного или разветвленного С1-4 алкиламино, включающего моно-алкиламино или ди-алкиламино, альдегидной группы, замещенного или незамещенного неразветвленного или разветвленного С1-4 алкилацила, карбоксила, замещенного или незамещенного неразветвленного или разветвленного С1-4 алкилацилокси, карбамоила, замещенного или незамещенного неразветвленого или разветвленного C1-4 алкиламида, С2-4 алкена, галогена, нитро и циано;
Замещенная группа неразветвленного или разветвленного С1-С4 алкила, описанного в настоящем тексте, выбрана из гидроксила, сульфгидрила, амино, альдегидной группы, карбоксила, карбамоила, фтора, хлора, брома, нитро и циано;
В одном из вариантов реализации R выбран из водорода, неразветвленного или разветвленного С1-4 алкила, гидрокси, неразветвленного или разветвленного С1-4 алкокси, сульфгидрила, неразветвленного или разветвленного С1-4 алкилтио, амино, неразветвленного или разветвленного С1-4 алкиламино, галогена, нитро и циано;
В одном из вариантов реализации R выбран из водорода, гидроксила, сульфгидрила, амино, фтора, хлора, брома, нитро, циано, метила, этила, н-пропила, изо-пропила, метокси, этокси, н-пропокси и изо-пропокси;
В одном варианте конъюгат формулы I, как показано в настоящем тескте, выбран из конъюгата формулы IF, как представлено ниже:
где R21 представляет собой один или более заместителей, и при этом R21 выбран из галогена.
В одном варианте неразветвленный или разветвленный С1-6 алкил, описанный в настоящем тексте, к неразветвленному или разветвленному С1-4 алкилу, или неразветвленному или разветвленному С2-5 алкилу. В другом варианте неразветвленный или разветвленный С1-6 алкил выбран из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила, трет-бутила, пентила, нео-пентила, изо-пентила и гексила. Неразветвленный или разветвленный С1-4 алкил, описанный в настоящем тексте, предпочтительно выбран из метила, этила, н-пропила, изо-пропила, н-бутила и трет-бутила. Неразветвленный или разветвленный С2-5 алкил, описанный в настоящем тексте, предпочтительно выбран из этила, н-пропила, изо-пропила, н-бутила, трет-бутила, пентила и изо-пентила.
Замещающая группа замещенного или незамещенного неразветвленного или разветвленного C1-6 алкила, описанного в настоящем тексте, может быть выбрана из гидроксила, сульфгидрила, амино, альдегидной группы, карбоксила, карбамоила, галогена, нитро и циано.
Замещающая группа замещенного или незамещенного С1-4 алкила и неразветвленного или разветвленного С1-4 алкила, описанного в настоящем тексте, может быть выбрана из гидроксила, сульфгидрила, амино, альдегидной группы, карбоксила, карбамоила, фтора, хлора, брома, нитро и циано.
Термин «С2-6 алкен», как показано в настоящем тексте, относится к алкену, имеющему два, три, четыре, пять или шесть атомов углерода. Это может быть прямая цепь или разветвленная цепь. Например, С2-6 алкен может быть выбран из винила, 1-пропенила, 2-пропенила, 1-бутенила, 2-бутенила, 1-пентенила и 1-гексенила. С2-6 алкен предпочтительно выбран из С2-4 алкена.
Термин «алкокси», как показано в настоящем тексте, относится к -О-алкилу.
Термин «галоген», как показано в настоящем тексте, относится к фтору, хлору, брому или йоду. В одном из вариантов галоген предпочтительно выбран из фтора и хлора.
Группа «R-M-X-CO-» наиболее предпочтительно выбрана из п-хлорциннамоила, п-гидроксициннамоила, п-метилциннамоила, 2,4-дифторциннамоила, 3-фтор-4-хлорциннамоила, 3-хлор-4-фторциннамоила, 4-фторциннамоила, 3-фторциннамоила, 3,4-дифторциннамоила, 2-хинолинацила, 2-тиенилакрилоила, 2-нитро-4-хлорбензоила и 2-нафтилоксиацетила.
Фармацевтически приемлемая соль конъюгатов, описанных выше, представляет собой часть настоящего изобретения, основные атомы в молекулах конъюгатов в настоящем изобретении могут образовывать соли с кислотой, без особых ограничений, с любой фармацевтически приемлемой кислотой, такой как неорганические кислоты, включающие соляную кислоту, бромоводородную кислоту, серную кислоту, фосфорную кислоту, азотную кислоту и органические кислоты, включающие щавелевую кислоту, фумаровую кислоту, малеиновую кислоту, янтарную кислоту, лимонную кислоту, винную кислоту, метансульфоновую кислоту и п-толуолсульфоновую кислоту и др.
Конъюгаты аналога мурамилдипептида и доцетаксела и их соли могут быть синтезированы с помощью общих и типичных способов, как следующие:
1. Доцетаксел-2′-O-сложный моноэфир алкандикарбоновой кислоты синтезируют посредством жидкофазного синтеза;
2. Аналог мурамилдепептида (MDA) синтезируют посредством твердофазного или жидкофазного синтеза;
3. Конъюгаты аналога мурамилдепептида и доцетаксела синтезируют посредством жидкофазного синтеза.
При этом способ получения доцетаксел-2′-O-сложного моноэфира алкандикарбоновой кислоты методом жидкофазного синтеза включает следующие стадии:
(1) Доцетаксел, алкандикарбоновой кислоты диандригид и 4-N,N-диметилпиридин растворяют в N,N-диметилформамиде (DMF) и перемешивают в течение 2 часов при к.т;
(2) Раствор DMF разбавляют дихлорметаном (DCM), затем слой DCM промывают последовательно водным раствором HCl (2N) и H2O;
(3) Наконец, дихлорметановый слой отделяют и концентрируют под вакуумом, остаток растворяют в небольшом количестве метанола, после чего к остатку добавляют воду в избытке, выпадает белый осадок, доцетаксел-2′-O- сложный моноэфир алкандикарбоновой кислоты получают в виде белого твердого вещества после фильтрации и лиофилизации. При этом способ получения аналога мурамилдипептида методом твердофазного синтеза и жидкофазного синтеза включает следующие стадии:
1) Твердофазный синтез:
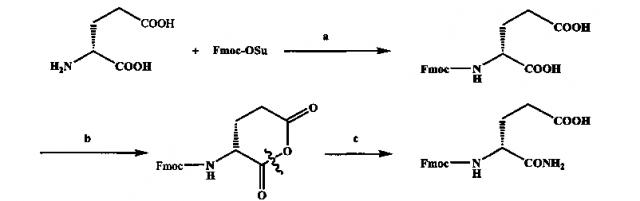
(1) Синтез промежуточной аминокислоты Fmoc-D-iso-Gln-OH;
Схема показана ниже:
Реагенты и условия: (а) к.т, 3 д; (b) дициклогексил карбодиимид (DCC), 0°C, 5 ч, к.т, 20 ч; (с) NH3; -10°C, 1.5 ч
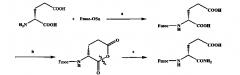
(2) Затем, используя любую из аминосмол, такую как смола Rink AM (емкость смолы 0,88 ммоль/г), в качестве носителя твердой фазы, Fmoc-L-Lys(Boc)-COOH, Fmoc-D-iso-Gln-COOH, Fmoc-L-Ala-COOH и карбоновую кислоту вводят в смолу посредством твердофазного синтеза; После завершения реакции конденсации аналог мурамилдепептида получают в результате таких стадий, как тщательная промывка и отщепление от смолы, и технический продукт очищают и т.д. Используемое здесь ацилирование является обычной реакцией конденсации с образованием амида, реакция конденсации завершают путем добавления избыточного количества реагентов (таких как аминокислота или карбоновая кислота) и сверхактивного конденсирующего средства (такого как 2-(7-аза-1Н-бензотриазол-1-yl)-1,1,3,3-тетраметилуроний гексафгорфосфат (HATU), 2-(1Н-бензотриазол-1-yl)-1,1,3,3-тетраметилуроний гексафгорфосфат (HBTU), бензотриазол-1-ил-окситрис-(диметиламино)-фосфоний гексафторфосфат (ВОР), бензотриазол-1-ил-окситрипирролидиносросфоний гексафггорфосфат (PyBOP). Особенностью данного способа является то, что введение карбоновой кислоты не зависит от структуры (такой как ароматические и неароматические, неразветвленная и разветвленная цепь), стерических затруднений, физико-химических свойств, электронного эффекта, кольцевой системы и линейной системы и т.д. Поэтому три вышеупомянутых аминокислоты могут быть заменены любой природной или искусственной аминокислотой, такой как Fmoc-D-Lys(Boc)-COOH, Fmoc-L-isc-Gln-COOH, Fmoc-L-Gln-COOH, Fmoc-D-Gln-COOH или Fmoc-D-Ala-COOH.
Схема показана ниже:
Реагенты и условия: (а) 20% пиперидин/DMF; к.т., 1 ч; (b) Fmoc-Lys(Boc)-OH, HOBt, N,N′-диизопропилкарбодиимид (DIC); к.т., 8 ч; (С) Fmoc-D-iso-Gln-OH, HOBt, DIC; к.т, 12 ч; (d) Fmoc-Ala-OH, HOBt, DIC; к.т, 8 ч; (e) органическая кислота©, HOBt, DIC; к.т, 8 ч; (f) 90% трифторуксусная кислота (TFA)/H2O, к.т, 2 ч
2) Жидкофазный синтез:
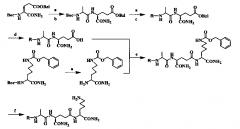
(1) Синтез промежуточной аминокислоты Boc-D-Glu(Obzl)-NH2;
Схема показана ниже:
Реагенты и условия: (a) C6H5CH2OH, BF3·Et2O; к.т., 15 ч; (b) (Boc)2O, NaHCO3; к.т., 20 ч; (с) HOSu, DCC, NH3; -10°C, 1,5 ч
(2) Синтез промежуточной аминокислоты Boc-Lys(Z)-NH2;
Схема показана ниже:
Реагенты и условия: (a) HOSu, DIC, NH2; -10°C, 1,5 ч
(3) Затем, дипептидный фрагмент Boc-Ala-D-Glu(OBzl)-NH2 и трипептидный фрагмент R-Ala-D-Glu(OBzl)-NH2 синтезируют посредством метода активной этерификации, и защитную группу Bzl в трипептиде удаляют путем использования бромистоводной кислоты в растворе уксусной кислоты или в других подходящих кислотных/основных условиях, тетрапептид R-Ala-D-iso-Gln-Lys(Z)-NH2 синтезируют посредством метода активной этерификации;
(4) Наконец, защитную группу Z удаляют с помощью смеси этилэфирата трехфтористого бора, TFA и этантиола (V/V/V=9:9:2) с получением неочищенного продукта, и после очистки получают аналог мурамилдипептида.
Схема показана ниже:
Реагенты и условия: (а) 50% TFA/DCM; к.т. 1 ч; (b) Boc-Ala-OH, HOSu, DIC; 0°C, 5 ч, к.т., 20 ч; (с) органическая кислота ©, HOSu, DIC; 0°C, 5 ч, к.т., 20 ч; (d) HBr/НОАс; к.т., 3 ч; (е) HOSu, DIC; 0°C, 5 ч, к.т., 20h; (f) BF3·Et2O, TFA, EtSH(9:9:2); к.т. 2 ч
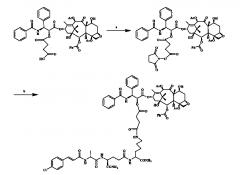
При этом способ получения конъюгатов аналога мурамилдипептида и доцетаксела включает следующие стадии:
1) Сначала доцетаксел-2′-O-сложный моноэфир алкандикарбоновой кислоты, HOSu и DIC с определенным молярным соотношением (2:1-1:2) растворяют в диметилсульфоксиде (DMSO) или DMF, или N-метилпирролидоне и т.д., реакция в растворе протекает в течение 1-10 часов при температуре от -20°C до 50°C;
2) Затем эквимолярные количества аналога мурамилдипептида добавляют к раствору DMSO или DMF или N-метилпирролидона и т.д., pH реакционной смеси доводят до 6-8 слабощелочным реагентом, таким как N-метилморфолин и т.д., реакцию продолжают 1-10 часов, конъюгат получают после завершения реакции;
3) Наконец, любой растворитель, выбранный из воды, метанола, этанола, диэтилового эфира, петролейного эфира, этилбутилового эфира, добавляют в реакционный раствор, и выпавшее в осадок вещество отфильтровывают, неочищенный продукт очищают с получением целевого продукта;
4) Способ очистки включает препаративную ВЭЖХ и перекристаллизацию.
Схема показана ниже:
Реагенты и условия: (а) ангидрид, DMAP, к.т., 4 ч; (b) HOSu, 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (EDC·HCl), DMSO, к.т., 20 ч; MDA производные, к.т., 12 ч
При этом алкандикарбоновая кислота выбрана из С4-С14 алкандикарбоновой кислоты, диангидрид алкандикарбоновой кислоты выбран из диангидрида С4-С14 алкандикарбоновой кислоты.
Способ получения конъюгата, раскрытого в настоящем изобретении, характеризуется мягкими условиями реакции, малым временем реакции, стабильным выходом, так что он пригоден для построения библиотеки соединений посредством, например, метода комбинаторной химии, который также входит в объем притязаний согласно настоящему изобретению.
Специалисты в данной области техники могут изменить вышеуказанные стадии таким образом, чтобы повысить выход, они могут разработать схемы, исходя из базовых знаний в данной области, такие как выбор реагента, растворителя и температуры. Также они могут, используя ряд традиционных защитных групп, избежать побочной реакции и тем самым повысить выход продукта. Такие общие реакции могут быть упомянуты в книгах по химии синтеза пептидов, таких как 1) Gang LIU and Kit S. LAM, "One-bead one-compound combinatorial library method", Combinatorial Chemistry, A Practical Approach, Edited by Hicham Fenniri, OXFORD University Press, 2000, Chapter 2, pp 33-50; 2) Gang Liu, Xiaoyi Xiao,, et al. Looking for combinatorial chemistry in drug research. Science Press, 2003, 6; 3) N. Leo Benoiton, Chemistry of Peptide Synthesis, published in 2005 by CRC press; 4) Miklos Bodanszky, Principles of Peptide Synthesis by Publisher of Springer Verlag (Edition: 2ND/REV). Такие модификации и изменения находятся в рамках настоящего изобретения.
В настоящем изобретении показано применение конъюгатов, раскрытых в настоящем изобретении, для изготовления лекарственных средств для предотвращения и/или лечения рака. При этом указанный тип рак выбран из меланомы, рака желудка, рака легкого, рака молочной железы, рака почки, рака печени, эпидермальной карциномы полости рта, рака шейки матки, коллоидной аденофибромы, рака поджелудочной железы, рака предстательной железы и рака толстой кишки.
Поэтому настоящее изобретение также относится к композициям, содержащим терапевтическое количества конъюгата, описанного в настоящем изобретении, и один или более фармацевтически приемлемых носителей и/или наполнителей композиции. Фармацевтические носители включают по меньшей мере один в солевой раствор, буферный солевой раствор, декстрозу, воду, глицерин, этанол, далее описанные более подробно. При необходимости композиция может также содержать меньшее количество увлажняющих или эмульгирующих агентов или pH буферных агентов. Композиция может представлять собой жидкий раствор, суспензию, эмульсию, таблетки, пилюли, капсулы, препараты с замедленным высвобождением или порошки. Композиция может быть в виде суппозиторий, в которых используют традиционные связующие вещества и носители, такие как глицерид трехосновной карбоновой кислоты. В препарате для перорального приема можно использовать стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза и карбонат магния и др. фармацевтической степени чистоты. В соответствии с требованиями относительно изготовлений различных препаратов, стадия, предваряющая получение, может включать смешивание, гранулирование и прессование или растворение активных ингредиентов. Кроме того, композиция может быть приго