Водные композиции, содержащие арбекацин
Иллюстрации
Показать всеИзобретение относится к водным жидким фармацевтическим композициям для ингаляции, содержащим арбекацин и хлорид-ионы. Композиции хорошо переносятся при использовании в способе лечения или профилактики заболевания верхних или нижних дыхательных путей, в котором композиция аэрозолизирована и вдыхается пациентом. Кроме того, изобретение относится к применению водной жидкой композиции для игаляции для лечения или профилактики заболеваний верхних или нижних дыхательных путей, а также к арбекацина гидрохлориду. 4 н. и 9 з.п. ф-лы, 11 прим., 2 ил., 15 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Изобретение относится к водным жидким фармацевтическим композициям, содержащим арбекацин и хлорид-ионы, которые можно применять в способе лечения или профилактики заболевания верхних или нижних дыхательных путей. Изобретение также относится к арбекацина гидрохлориду.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Аминогликозиды являются бактерицидными антибиотиками, полученными из бактерий порядка Actinomycetales, более конкретно из рода Streptomyces или Micromonospora. Они представляют собой поликатионные соединения, содержащие аминоциклитол с циклическими аминосахарами, присоединенными при помощи гликозидных связей. Как правило, используют сульфатные соли. Аминогликозиды имеют схожие токсикологические характеристики, при этом ототоксичность является основным ограничением для их использования. Другими общими побочными эффектами являются нефротоксичность, нервно-мышечная блокирующая активность и аллергия, включая перекрестную реактивность. Они имеют схожий спектр противомикробного действия и, по-видимому, действуют, препятствуя синтезу бактериального белка, возможно, путем необратимого связывания с 30S и, в некоторой степени, с 50S субъединицами бактериальной рибосомы. Они наиболее активны в отношении грамотрицательных палочек. Сообщалось, что грамотрицательные бактерии, включая виды Brucella, Clymmatobacterium, Campylobacter, Citrobacter, Escherichia, Enterobacter, Klebsiella, Proteus, Providencia, Pseudomonas, Serratia, Vibrio и Yersinia, чувствительны к аминогликозидам. Кроме того, грамположительные штаммы, такие как Staphylococcus aureus, очень чувствительны к аминогликозидам, таким как гентамицина сульфат. Помимо этого некоторые актиномицеты и микоплазмы предположительно чувствительны к аминогликозидам. Бактериальная устойчивость, как правило, связана с опосредованной плазмидами продукцией инактивирующих ферментов. Основываясь на спектре их активности, их используют для лечения таких инфекций, как инфекции желчевыводящих путей, бруцеллез, болезнь кошачьих царапин, кистозный фиброз, эндокардит, эндометрит, гастроэнтерит, паховая гранулема, листериоз, менингит, наружный отит, средний отит, воспалительное заболевание тазовых органов, перитонит, чума, пневмония, сепсис, кожные инфекции и инфекции мочевыводящих путей, а также для профилактики хирургической инфекции и лечения пациентов с иммунной недостаточностью и находящихся в реанимации пациентов. Аминогликозиды обладают постантибиотическим эффектом, выражающимся в том, что антибактериальная активность сохраняется после того, как концентрации падают ниже минимальной ингибирующей концентрации (Martindale - The complete drug reference, 1999, тридцать второе издание, под редакцией K. Parfitt, Pharmaceutical Press).
Арбекацин представляет собой аминогликозид, полученный из дибекацина. Его используют в виде арбекацина сульфата при лечении серьезных инфекций, вызванных устойчивой к метициллину Staphylococcus aureus (Martindale - The complete drug reference, 1999, тридцать второе издание, под редакцией K. Parfitt, Pharmaceutical Press). Арбекацин был впервые описан в JP 56051499 A и JP 58134099 A и продается в виде раствора арбекацина сульфата для парентерального применения.
Из желудочно-кишечного тракта всасывается небольшое количество аминогликозидов, и аминогликозиды предпочтительно вводить внутривенно. Однако существует большая вероятность тяжелых системных побочных эффектов (таких как ототоксичность и нефротоксичность) из-за тонкой грани между терапевтическими и токсическими дозами. Кроме того, для лечения инфекции дыхательных путей необходимо вводить относительно высокие парентеральные дозы, поскольку аминогликозиды плохо диффундируют через липидные мембраны и в бронхиальный секрет. Это может снижать их эффективность, поскольку часто лишь субингибирующие концентрации аминогликозидов присутствуют в очаге инфекции. Было предложено несколько подходов с целью избежать токсичности и повысить эффективность аминогликозидов (Ratjen et al., «Aminoglycoside therapy against Pseudomonas aeruginosa in cystic fibrosis: A review», Journal of Cystic fibrosis 8 (2009) 361-369). Например, в US 6221388 описаны препараты инкапсулированных в липосомы аминогликозидов и в US 5508269 описано прямое введение тобрамицина в инфицированные дыхательные пути.
Аэрозолизацию, например, гентамицина, тобрамицина и амикацина изучали и применяли для увеличения их концентрации в дыхательных путях, при этом избегая токсичности. Примерами препаратов аминогликозидов для ингаляции являются тоби (TOBI®) (US 5508269), брамитоб (Bramitob®) (US 6987094) и арикейс (Arikace®) (US 7718189). Однако некоторые из этих препаратов требуют очень длительного времени распыления, что отрицательно сказывается на соблюдении пациентами режима и схемы лечения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предложение высококонцентрированных и хорошо переносимых препаратов арбекацина для ингаляции, которые можно распылять в течение короткого периода времени (то есть периода времени, приемлемого для пациентов).
При разработке высококонцентрированного препарата арбекацина для ингаляции авторы изобретения обнаружили, что обычно используемых подходов для получения хорошо переносимых препаратов для ингаляции, например, с почти физиологической тоничностью, оптимизированным pH и определенной концентрацией проникающих анионов было недостаточно. Препараты арбекацина, полученные в соответствии с данными подходами, сразу же вызывали реакции в виде кашля у здоровых добровольцев. Таким образом, был необходим другой подход для создания высококонцентрированных препаратов арбекацина для ингаляции.
Авторы изобретения неожиданно обнаружили, что раздражение было связано с сульфатной солевой формой арбекацина, хотя эту сульфатную форму используют в других хорошо переносимых препаратах аминогликозидов для ингаляция (например, тоби, арикейс). Было обнаружено, что для решения проблемы в растворе арбекацина необходимо полностью или частично заменять сульфат-ионы хлорид-ионами в определенной концентрации.
Таким образом, изобретение относится к водной жидкой фармацевтической композиции, содержащей арбекацин и хлорид-ионы, в которой концентрация арбекацина, рассчитанная на свободное основание, составляет по меньшей мере 100 мг/мл и отношение молярного количества хлорид-ионов к молярному количеству арбекацина составляет по меньшей мере 0,9:1.
Композицию можно использовать в способе лечения или профилактики заболевания верхних или нижних дыхательных путей, при этом способ лечения или профилактики заболевания включает этап аэрозолизации композиции и вдыхание пациентом полученного таким образом аэрозоля.
Кроме того, изобретение относится к новой солевой форме арбекацина, а именно арбекацина гидрохлориду.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 приведена кривая дифференциальной сканирующей калориметрии арбекацина гидрохлорида, полученного в соответствии с примером 2.
На фигуре 2 приведена кривая термогравиметрического анализа арбекацина гидрохлорида, полученного в соответствии с примером 2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Фармацевтические композиции по изобретению представляют собой водные жидкости, хорошо подходящие для введения в дыхательные пути в аэрозолизированной форме.
Термин «композиция» относится к смеси соединений. Синонимами для композиции являются препарат и состав. Более конкретно, композиции по изобретению представляют собой водные жидкости, то есть жидкие системы, в которых жидкий носитель или растворитель состоит преимущественно или полностью из воды. В особых случаях жидкий носитель может содержать небольшие фракции одной или более жидкостей, которые, по меньшей мере частично, смешиваются с водой.
Композиции по изобретению предпочтительно являются стерильными композициями. Термин «стерильность» следует понимать в обычном фармацевтическом смысле. К жидким композициям применимы различные способы стерилизации, такие как, например, автоклавирование и стерильная фильтрация. Стерильная фильтрация является особенно предпочтительной, поскольку ее можно использовать в производственных линиях, тогда как автоклавирование является периодическим процессом.
Активное соединение композиции по изобретению представляет собой аминогликозидный антибиотик арбекацин. Композицию можно использовать в способе профилактики заболеваний верхних или нижних дыхательных путей, особенно инфекций верхних или нижних дыхательных путей. Такая инфекция может быть исходной причиной заболевания или может быть инфекцией в случаях, когда первопричинное заболевание верхних или нижних дыхательных путей уже имеет место. Примерами таких исходных и первопричинных заболеваний являются острый и хронический синусит, ринит и риносинусит, полипы носовой полости, носовые фурункулы, носовое кровотечение, патологические состояния носовой и синоназальной областей, связанные с заболеваниями нижних дыхательных путей, например патологические состояния носовой и синоназальной областей, связанные с ушными заболеваниями, такими как воспаления уха, аллергия, ротоглоточные инфекции, ларинготрахеобронхит, бронхит, бронхиолит, например диффузный бронхиолит и облитерирующий бронхиолит, бронхоэктаз, альвеолит, пневмония, например внебольничная пневмония, госпитальная пневмония, вентилятор-ассоциированная пневмония, пневмония, связанная с оказанием медицинской помощи, аспирационная пневмония, липидная пневмония, эозинофильная пневмония, химическая пневмония, атипичная пневмония и тяжелое острое заболевание дыхательной системы, легочные инфекции с обострением или без обострений, например, бактериальные, вирусные, грибковые и протозойные инфекции дыхательных путей, эмфизема, саркоидоз, туберкулез, нетуберкулезные микобактериальные легочные заболевания, паренхиматозные и/или фиброзные заболевания или нарушения, включая кистозный фиброз и идиопатический легочный фиброз, легочная артериальная гипертензия, интерстициальные заболевания легких, коклюш, а также отторжение трансплантата после трансплантации легких, стволовых клеток или костного мозга.
Аминогликозидные антибиотики, как правило, используют в виде сульфатной соли. Для всех аминогликозидов, описанных в 32-м издании книги Martindale (The complete drug reference, 1999, под редакцией K. Parfitt, Pharmaceutical Press), указано, что их используют в виде сульфата (то есть амикацин, апрамицин, арбекацин, астромицин, капреомицин, дибекацин, дигидрострептомицин, фрамицетин, гентамицин, изепамицин, канамицин, микрономицин, неомицин, нетилмицин, паромомицин, рибостамицин, сиссомицин, стрептомицин и тобрамицин). Исключениями являются канамицин, в случае которого также используют кислые сульфатные соли и бисульфат, неомицин, в случае которого в основном используют сульфат, но также используют и неомицина ундеканоат или гидрохлорид, и стрептомицин, в случае которого в основном используют сульфат, но также используют и стрептомицина гидрохлорид.
Арбекацин доступен только в качестве его сульфатной соли.
Как правило, принято, что дозы или концентрации арбекацина указывают применительно к свободному основанию.
Концентрация арбекацина в жидкой композиции по изобретению и в дисперсной фазе аэрозоля, полученного из нее, составляет по меньшей мере 100 мг/мл, то есть относительно высока. Высокая концентрация имеет ряд преимуществ в препаратах для ингаляции, например, легче достигать терапевтической концентрации в целевом участке, меньший объем нужно вдыхать для достижения терапевтической концентрации в целевом участке и, таким образом, сокращается время распыления, увеличивается период действия и, следовательно, уменьшается частота применения.
Концентрация арбекацина в жидкой композиции по изобретению и в дисперсной фазе аэрозоля, полученного из нее, предпочтительно составляет по меньшей мере 120 мг/мл, по меньшей мере 150 мг/мл, по меньшей мере 200 мг/мл или по меньшей мере 250 мг/мл.
Для того, чтобы быть хорошо переносимой, фармацевтическая композиция для применения в верхних и/или нижних дыхательных путях должна, насколько это возможно, обладать физиологической тоничностью или осмоляльностью. Известно, что отклонения от этой физиологической тоничности (примерно 290 мОсмол/кг, что соответствует осмоляльности физиологических жидкостей), то есть гипотонические и гипертонические растворы могут вызывать кашлевой рефлекс при ингаляции (Lowry et al., «Effect of pH and osmolarity on aerosol-induced cough in normal volunteers», Clinical Science 74 (1988) 373-376). Кроме того, отклонения от физиологической тоничности могут вызвать раздражение поверхности, на которую наносят эти растворы, поскольку вода либо извлекается, либо поступает в клетки данной поверхности (при нанесении гипертонических растворов или гипотонических растворов соответственно). Однако гипертонические растворы являются менее раздражающими, чем гипотонические растворы, и могут даже иметь дополнительные преимущества при некоторых состояниях дыхательных путей. Основное преимущество гипертонических растворов связано с усиленным выведением слизи при заболеваниях, сопровождающихся нежелательной выработкой слизи. Weber с соавторами («Effect of nebuliser type and antibiotic concentration on device performance», Pediatric Pulmonology 23 (1997) 249-260) полагают, что оптимальная осмоляльность ингаляционных растворов антибиотика лежит в диапазоне от 150 до 550 мОсмол/кг.
Дополнительные предложения из литературных источников для уменьшения кашля и сужения бронхов при аэрозольной ингаляции включают оптимальное значение pH, которое больше 2,6 и меньше 10,0 (Lowry et al., «Effect of pH and osmolarity on aerosol-induced cough in normal volunteers», Clinical Science 74 (1988) 373-376), и присутствие проникающих анионов в концентрации от 31 до 300 мМ (Weber et al. «Effect of nebuliser type and antibiotic concentration on device performance», Pediatric Pulmonology 23 (1997) 249-260; Eschenbacher et al., «Alteration in osmolarity of inhaled aerosols cause bronchoconstriction and cough, but absence of a permeant anion causes cough alone», Am. Rev. Respir. Dis. 129 (1984) 211-215).
Авторы настоящего изобретения обнаружили, что ингаляция высококонцентрированных растворов арбекацина сульфата с pH около 7,0, почти физиологической тоничностью от примерно 300 до примерно 380 мОсмол/кг и с добавлением NaCl для обеспечения проникающих анионов (от примерно 34 до примерно 46 мМ) вызывала серьезный и незамедлительный кашель, несмотря на оптимизацию в соответствии с современными представлениями для предотвращения кашлевых реакций. Аналогичные кашлевые реакции и сужение бронхов были обнаружены при ингаляции растворов тобрамицина сульфата с консервантами, такими как фенол и натрия метабисульфит. Однако протестированные препараты арбекацина сульфата не содержали консервантов или эксципиентов, которые, как известно, вызывают кашлевые реакции или сужение бронхов.
В дополнение к отсутствию в препаратах консервантов и других опасных эксципиентов было предложено улучшать переносимость, например, препаратов тобрамицина, путем снижения концентрации натрия хлорида (например, на четверть концентрированный солевой раствор вместо концентрированного солевого раствора) или даже отказа от использования натрия хлорида в препарате, как описано в US 5508269, US 6987094 и WO 2005/037256. Однако, хотя по составу и концентрации натрия хлорида препараты, протестированные авторами настоящего изобретения, были близки к имеющимся в продаже препаратам аминогликозида для ингаляции, которые, как правило, хорошо переносятся (Тоби®), протестированные высококонцентрированные растворы арбекацина по-прежнему вызывали немедленную кашлевую реакцию.
В целом, решения, предложенные в известном уровне техники для создания хорошо переносимой композиции арбекацина для ингаляции, были признаны неудовлетворительными.
Однако авторы изобретения обнаружили, что раздражение, вызываемое этими высококонцентрированными препаратами, было связано с сульфатной солевой формой арбекацина. Это было неожиданно, особенно потому, что известные аминогликозидные препараты для ингаляции содержат сульфатную соль аминогликозида (например, Тоби®, Арикейс®). Тем не менее при использовании основания арбекацина вместо коммерчески доступного арбекацина сульфата и соляной кислоты для доведения pH был получен высококонцентрированный раствор арбекацина, который можно вдыхать без кашлевых реакций. Этот препарат арбекацина гидрохлорида обладал гораздо более высокой осмоляльностью, чем его сульфатно-солевой аналог, и большей, чем рекомендовано в известном уровне техники, концентрацией проникающих анионов, однако, несмотря на это, препарат хорошо переносился при ингаляции. Он не вызывал кашлевую реакцию и сужение бронхов, что было продемонстрировано в модели на морских свинках и с привлечением людей-добровольцев.
Более конкретно, авторы изобретения обнаружили, что в препарате была необходима минимальная концентрация хлорид-ионов. Были получены различные препараты из основания арбекацина с использованием для доведения pH или соляной кислоты, или серной кислоты, или и той и другой. Препарат, в котором отношение молярного количества хлорид-ионов к молярному количеству арбекацина составляет 0,16:1, вызывал немедленный кашель, тогда как препараты, в которых данное отношение увеличено до по меньшей мере 0,9:1, переносились лучше.
Таким образом, отношение молярного количества хлорид-ионов к молярному количеству арбекацина в композиции по изобретению составляет по меньшей мере 0,9:1. Предпочтительно это отношение составляет по меньшей мере 3:1 и более предпочтительно по меньшей мере 5:1.
Даже препараты с очень высоким отношением молярного количества хлорид-ионов к молярному количеству арбекацина и, следовательно, также очень высокой осмоляльностью, лучше переносились при ингаляции, чем препараты, в которых это отношение составляло менее чем 0,9:1.
В другом аспекте было установлено, что полезно снижать количество сульфатных ионов в высококонцентрированных растворах арбекацина для ингаляции.
Таким образом, молярное количество сульфат-ионов в водной жидкой фармацевтической композиции по изобретению предпочтительно составляет не более чем 200 моль-% от молярного количества арбекацина. Более предпочтительно, молярное количество сульфат-ионов в водной жидкой фармацевтической композиции по изобретению предпочтительно составляет не более чем 50 моль-% от молярного количества арбекацина. Даже более предпочтительно, композиция практически не содержит сульфат-ионы, то есть она содержит сульфат-ионы только как неизбежные примеси.
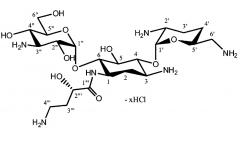
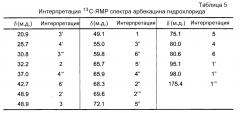
Кроме того, авторы изобретения впервые получили твердый арбекацина гидрохлорид методом лиофилизации. Согласно оценке методами дифференциальной сканирующей калориметрии и термогравиметрического анализа было получено аморфное твердое вещество. Лекарственное соединение было охарактеризовано по показателю оптического вращения [α]20 D, составляющему +79,8°. Кроме того, структурная формула и число позиций были проанализированы с помощью ядерного магнитного резонанса. Кроме того, использовали ионную хроматографию для определения содержания хлорида в твердом арбекацина гидрохлориде. Установлено, что лекарственное соединение содержало 19,66% хлорида, что соответствует числу хлоридных групп примерно от 3,5 до 4,0.
Таким образом, изобретение также относится к (твердому) арбекацина гидрохлориду. Это новое соединение можно использовать для получения водной жидкой фармацевтической композиции по изобретению.
Арбекацина гидрохлорид можно получать способом, включающим следующие этапы: (1) свободное основание арбекацина растворяют в дистиллированной воде (предпочтительно в концентрации примерно 0,5 моль/л); (2) pH раствора доводят до примерно 7 добавлением водного раствора соляной кислоты (предпочтительно с концентрацией примерно 6 моль/л); (3) полученный раствор, необязательно, можно разбавлять дистиллированной водой (предпочтительно примерно 0,5 литра на моль арбекацина); (4) затем раствор подвергают лиофилизации, получая арбекацина гидрохлорид.
Поскольку продемонстрировано, что гиперосмотические композиции арбекацина гидрохлорида хорошо переносятся при ингаляции, осмоляльность жидкой композиции по изобретению можно увеличивать сверх общепринятого максимального допустимого уровня. Осмоляльность композиции предпочтительно составляет по меньшей мере 350 мОсмол/кг, и более предпочтительно осмоляльность находится в диапазоне от 550 мОсмол/кг до 1500 мОсмол/кг. Более того, осмоляльность может находиться в диапазоне от 800 мОсмол/кг до 1500 мОсмол/кг и от 1000 мОсмол/кг до 1500 мОсмол/кг.
Фармацевтическая композиция может содержать эксципиенты, такие как регулирующие тоничность эксципиенты, эксципиенты для доведения или поддержания pH, антиоксиданты, сурфактанты, эксципиенты для замедленного высвобождения или продолжительного местного удержания, маскирующие вкус средства, подсластители и ароматизаторы. Эти эксципиенты используют для получения оптимального pH, вязкости, поверхностного натяжения и вкуса, что поддерживает стабильность препарата, аэрозолизацию, переносимость и/или эффективность препарата при ингаляции.
При необходимости в композицию по изобретению можно дополнительно включать регулирующие тоничность эксципиенты. При использовании в данном документе под регулирующим тоничность компонентом или эксципиентом понимают один или более из фармацевтических эксципиентов, которые являются осмотически активными и которые используют в общепринятой практике с целью корректировки осмоляльности или тоничности жидких фармацевтических препаратов. Обычно используемыми примерами таких эксципиентов являются натрия хлорид и маннит. Другие соли, которые можно использовать для регулирования тоничности, представляют собой натрия глюконат, натрия пируват и калия хлорид. Для этой цели можно использовать также углеводы. Примерами являются сахара, такие как глюкоза, лактоза, сахароза и трегалоза, и, кроме того, сахарные спирты, такие как ксилит, сорбит и изомальтол.
Предпочтительно жидкая композиция по изобретению содержит натрия хлорид. Предпочтительно концентрация натрия хлорида составляет от 1 до 5 г/л, более предпочтительно от 2 до 3 г/л, более предпочтительно примерно 2,5 г/л.
Авторы изобретения установили, что значение pH водной жидкой фармацевтической композиции предпочтительно должно лежать в области от слегка кислого до нейтрального, то есть композиция предпочтительно имеет значение pH в диапазоне от примерно 3 до примерно 7. Особенно предпочтительным является значение pH в диапазоне от примерно 5 до примерно 7. Установлено, что кислый pH помогает предотвращать изменение цвета, которое часто наблюдается при хранении растворов аминогликозидов.
Композиция может содержать один или более эксципиентов для доведения и/или поддержания величины pH раствора. Для доведения и, необязательно, поддержания pH можно использовать физиологически приемлемые кислоты, основания, соли, а также их сочетания. Эксципиентами, которые часто используют для снижения величины pH или для применения в качестве кислотного компонента в буферной системе, являются сильные минеральные кислоты, в частности серная кислота и соляная кислота. В настоящем изобретении для доведения рН особенно предпочтительно использовать соляную кислоту, которая затем образует соль арбекацина гидрохлорид in situ. Однако можно использовать также неорганические и органические кислоты средней силы, а также кислые соли, такие как, например, фосфорная кислота, лимонная кислота, виннокаменная кислота, янтарная кислота, фумаровая кислота, метионин, кислые гидрофосфаты с натрием или калием, молочная кислота и глюкуроновая кислота. Эксципиентами, подходящими для повышения pH или в качестве основного компонента в буферной системе, являются, в частности, минеральные основания, такие как натрия гидроксид или гидроксиды и оксиды других щелочных и щелочноземельных металлов, такие как, например, магния гидроксид и кальция гидроксид, аммония гидроксид, и основные соли аммония, такие как аммония ацетат, а также основные аминокислоты, такие как лизин, карбонаты, такие как натрия или магния карбонат, натрия гидрокарбонат, и цитраты, такие как натрия цитрат.
Композиция может также содержать буферную систему, состоящую из двух компонентов. Одна из наиболее предпочтительных буферных систем содержит лимонную кислоту и натрия цитрат. Однако можно использовать и другие буферные системы.
Антиоксиданты представляют собой натуральные или синтетические вещества, которые предотвращают или препятствуют окислению активных средств и/или окислительному повреждению в подвергнутых стрессу тканях и клетках. Антиоксиданты могут быть адъювантами, которые сами являются окисляемыми (то есть первичные антиоксиданты), или адъювантами, которые действуют как восстанавливающие средства (то есть, восстанавливающие антиоксиданты), такие как, например, токоферола ацетат, ликопин, восстановленный глутатион, каталаза и пероксид дисмутаза. Другими адъювантами, используемыми для предотвращения окислительных реакций, являются синергические антиоксиданты, которые участвуют в окислительных процессах не напрямую, а опосредованно через образование комплексов с ионами металлов, которые, как известно, катализируют окислительные реакции. Часто используемыми синергическими антиоксидантами являются этилендиаминтетрауксусная кислота (ЭДТА) и ее производные. Другими полезными антиоксидантами (с первичным, восстанавливающим и/или синергическим антиоксидантным механизмом действия) являются аскорбиновая кислота и ее соли, сложные эфиры аскорбиновой кислоты, фумаровая кислота и ее соли, яблочная кислота и ее соли, лимонная кислота и ее соли, бутилгидроксианизол, бутилгидрокситолуол, пропилгаллат и мальтол. В качестве альтернативы обычно используемым антиоксидантам в препаратах для ингаляции также можно использовать такие вещества, как ацетилцистеин, R-цистеин, витамин E TPGS, пировиноградную кислоту и ее магниевые и натриевые соли, а также глюконовую кислоту и ее магниевые и натриевые соли. Соли глюконовой кислоты обладают тем дополнительным преимуществом, что они известны своим антиоксидантным действием на подвергнутые стрессу ткани и клетки, что может быть выгодным при лечении воспалений, поскольку кислородные радикалы вызывают и постоянно поддерживают воспалительные процессы. Кроме того, считается, что пируватные соли обладают такими антиоксидантными эффектами in vivo.
Предпочтительно жидкая композиция по изобретению содержит натриевую соль этилендиаминтетрауксусной кислоты (Na-ЭДТА). Предпочтительно, концентрация Na-ЭДТА составляет от 0,01% до 0,5% по массе, более предпочтительно примерно 0,02% по массе.
Дополнительной мерой для предотвращения окисления и частичного предотвращения нежелательного изменения цвета является замена кислорода над раствором на инертный газ, такой как азот или аргон.
Кроме того, для оптимального распыления важным является поверхностное натяжение жидкой композиции. Поверхностное натяжение должно находиться в диапазоне от примерно 25 до 80 мН/м и более предпочтительно от 30 до 75 мН/м. Композиции с поверхностным натяжением в нижней части этого диапазона будут предположительно демонстрировать хорошую растекаемость на слизистых оболочках дыхательных путей. Кроме того, регулирование поверхностного натяжения может понадобиться для более полного извлечения композиции из ее исходной упаковки, что может быть, в частности, важным, поскольку высококонцентрированные препараты аминогликозида могут быть липкими из-за их сахарной природы.
Можно включать поверхностно-активные материалы (или сурфактанты) для регулирования поверхностного натяжения по описанным выше причинам и, кроме того, для стабилизации, маскировки вкуса и/или замедленного высвобождения. Еще одним преимуществом поверхностно-активных эксципиентов является то, что они способны облегчать проникновение арбекацина в бактериальные клетки, результатом чего является более выраженная антибактериальная активность. Кроме того, в литературе высказываются предположения, что сурфактанты могут способствовать разрушению или диспергированию биопленок, образованных бактериями и грибками, тем самым повышая антибактериальную эффективность арбекацина в отношении мукоидных форм бактерий.
Сурфактанты представляют собой материалы с по меньшей мере одной относительно гидрофильной и по меньшей мере одной относительно липофильной молекулярной областью, которые собираются на поверхностях раздела гидрофильной и липофильной фаз и снижают поверхностное натяжение. Поверхностно-активные материалы могут быть ионными или неионными. Особенно предпочтительными сурфактантами являются те, которые обладают хорошей физиологической совместимостью и которые считаются безопасными для пероральной или назальной ингаляции. Предпочтительными сурфактантами являются, например, тилоксапол, полисорбаты, такие как полисорбат 80, лецитин, витамин E TPGS и макрогола гидроксистеараты, такие как макрогол-15-гидроксистеарат. Сурфактантный компонент может также включать смесь из двух или более сурфактантов, например полисорбат 80 в сочетании с витамином E TPGS.
Общее содержание сурфактантного компонента в растворах для применения в дыхательных путях должно быть ограничено максимумом примерно 5% (масса/объем) во избежание раздражения слизистой оболочки. Особенно предпочтительными являются концентрации от примерно 0,01 до примерно 2,0% (масса/объем) и от примерно 0,02 до примерно 1% (масса/объем).
Предпочтительно жидкая композиция по изобретению содержит от 0,01 до 0,5% (масса/объем), более предпочтительно от 0,03 до 0,1% (масса/объем) полисорбата 80, лецитина или витамина E TPGS.
В некоторых вариантах осуществления изобретения полезными эксципиентами могут также являться маскирующие вкус средства. Плохой вкус препаратов для ингаляции является чрезвычайно неприятным и раздражающим. Ощущение плохого вкуса при ингаляции возникает в результате непосредственного осаждения капель аэрозоля в ротовой и глоточной области при пероральной ингаляции, в результате попадания лекарственного средства из носа в рот при назальной ингаляции и в результате попадания лекарственного средства из дыхательных путей в рот, связанного с мукоцилиарным клиренсом в дыхательной системе. При использовании в данном документе маскирующее вкус средство представляет собой любые фармацевтически приемлемые соединения или смесь соединений, способные улучшить вкус водной системы, независимо от механизма, с помощью которого происходит это улучшение. Например, маскирующее вкус средство может перекрывать плохой вкус, то есть уменьшать интенсивность, с которой он воспринимается, или оно может исправлять вкус путем добавления другого, как правило, более приятного, вкуса в композицию, тем самым улучшая общее органолептическое впечатление. Другими механизмами маскировки вкуса являются образование комплексов, инкапсуляция, погружение или любое другое взаимодействие между лекарственным средством и другими соединениями в композиции.
Маскирующее вкус средство можно выбирать из группы фармацевтически приемлемых подсластителей, таких как, например, сахарин, аспартам, цикламат, сукралоза, ацесульфам, неотам, тауматин и неогесперидин, включая их соли и сольваты, такие как, например, натриевая соль сахарина и калиевая соль ацесульфама. Кроме того, можно использовать сахара, такие как сахароза, трегалоза, фруктоза и лактоза, или сахарные спирты, такие как ксилит, маннит и изомальт. Другие полезные маскирующие вкус средства включают фармацевтически приемлемые сурфактанты, соли щелочных или щелочноземельных металлов, органические кислоты, такие как лимонная кислота и молочная кислота, и аминокислоты, такие как аргинин. Кроме того, для улучшения вкуса и переносимости композиции по изобретению можно использовать ароматические отдушки, такие как ингредиенты эфирных масел (например, ментол, тимол и цинеол).
В некоторых вариантах осуществления можно добавлять эксципиенты, которые увеличивают адгезию композиции по изобретению к поверхности слизистых оболочек дыхательных путей. Это может, например, способствовать увеличению времени пребывания композиции в месте нанесения и повышению эффективности лекарственного средства. Такие эксципиенты могут представлять собой мукоадгезивные эксципиенты, повышающие вязкость эксципиенты и/или гелеобразующие средства. Примерами являются полимеры, такие как поливинилпирролидон, декстраны, модифицированные крахмалы, хитозан, карбомеры и производные целлюлозы, такие как гидроксипропилметилцеллюлоза, а также вязкие жидкости, такие как пропиленгликоль и глицерин.
Другие эксципиенты можно добавлять из-за их благоприятного воздействия на дыхательные пути. Например, можно добавлять соль магния, такую как магния глюконат. Известно, что магний повышает ферментативную активность дорназы альфа, фермента, который снижает вязкость слизи. Это особенно полезно при бактериальной инфекции и воспалении, так как после этого слизь в дыхательных путях становится более вязкой и гнойной. Кроме того, низкая проникающая способность аниона глюконата может способствовать мукоцилиарному клиренсу. Помимо этого магния глюконат может обладать цитопротективным и биологическим антиоксидантным эффектом.
Предпочтительно композиция по изобретению сформулирована в виде молекулярного раствора арбекацина. Однако активное вещество (арбекацин) также может быть коллоидально диспергировано в водной жидкости. Коллоидные системы-носители, такие как мицеллы, смешанные мицеллы, коллоидные комплексы и липосомы, могут быть полезны для целевой доставки активного вещества.
Согласно еще одному аспекту изобретения фармацевтические композиции по изобретению используют в способе лечения или профилактики заболеваний верхних или нижних дыхательных путей. В частности, заболеваний, которые вызваны или связаны с бактериальными инфекциями в случаях, когда бактерии чувствительны к арбекацину.
Способ лечения или профилактики заболевания включает этап аэрозолизации композиции и вдыхания пациентом полученного таким образом аэрозоля. В данном документе аэрозоль определяют как систему, включающую непрерывную газовую фазу и диспергированную в ней прерывистую или дисперсную фазу жидкости и/или твердых частиц. Аэрозоли, включающие дисперсную жидкую фазу и непрерывную газовую фазу, иногда называют «жидкими аэрозолями» или, возможно, более корректно, «аэрозолизированными жидкостями».
В данном варианте осуществления дисперсная фаза состоит в основном из жидких капель. Капли дисперсной фазы содержат арбекацин в жидкой среде. Жидкая среда представляет собой преимущественно водную фазу с дополнительными вышеописанными эксципиентами или без них. Предпочтительно жидкая фаза содержит арбекацин в молекулярном растворе или коллоидной дисперсии. Специалисту в данной области будет понятно, что особенности и предпочтения в отношении жидкой композиции, описанные выше в данном документе, могут быть также применены к дисперсной фазе аэрозоля, полученного из нее, и наоборот.
Непрерывную газовую фазу аэрозоля можно выбирать из любых газов или газовых смесей, которые являются фармацевтически приемлемыми. Например, газ может быть просто воздухом или сжатым воздухом, что наиболее распространено в ингаляционной терапии с использованием небулайзеров в качестве генераторов аэрозоля. Альтернативно, можно использовать другие газы и газовые смеси, например воздух, обогащенный кислородом, двуокись углерода или смеси азота и кислорода.
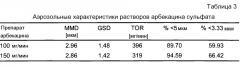
Дисперсная фаза аэрозоля, полученного из композиций по изобретению, имеет массовый средний аэродинамический диаметр (MMAD) предпочтительно от примерно 1 до примерно 6 мкм и более предпочтительно от примерно 2 до примерно 4,5 мкм или от примерно 1,5 до примерно 4 мкм. MMAD измеряют методами с использованием каскадного импактора для жидких аэрозолей и он соответствует диаметру, меньше которого имеет 50% массы аэрозолизированного лекарственного средства, иными словами 50% массы лекарственного средства содержится в каплях, имеющих диаметр меньше чем MMAD.
Другим параметром, описывающим дисперсную фазу аэрозоля, является распределение по размеру частиц аэрозолизированных частиц жидкости или капель. Геометрическое стандартное отклонение (GSD) является часто используемым показателем широты распредел