Способ обнаружения скоплений биологических частиц
Иллюстрации
Показать всеИзобретение относится к области микробиологии. Способ обнаружения кластера микроорганизмов на поверхности предусматривает этапы, на которых: а) определяют топографическое представление упомянутой поверхности; b) обнаруживают на топографическом представлении, по меньшей мере, один контур, ограничивающий область, которая может соответствовать скоплению биологических частиц. Использование данного способа позволяет обнаружить колонии микроорганизмов небольших размеров в начале их роста. 10 з.п. ф-лы, 7 ил.
Реферат
Область техники
Изобретение касается способа обнаружения скоплений биологических частиц, таких как микроорганизмы (бактерии, дрожжи, грибки…) или растительные или животные клетки, на поверхности, например на поверхности среды культуры или функционального субстрата. Эти частицы имеют микроскопические размеры, как правило, порядка от 0,5 мкм до 3 мм и, в частности, от 0,5 мкм до 10 мкм.
Изобретение применимо, в частности, для обнаружения колоний микроорганизмов.
Предшествующий уровень техники
Во многих случаях применения стремятся обнаружить как можно раньше рост микроорганизмов, таких как бактерии или дрожжи, на среде культуры, чаще всего на поверхности питательного геля. Как правило, поверхность агаровой среды культуры существенно отличается от идеальной плоскости, так как часто имеет локальные дефекты глубиной в несколько микрометров (мкм) на расстояниях в несколько миллиметров (мм). Одновременно с пробой в них может попадать пыль или фрагменты, которые могут приводить к локальным деформациям поверхности с большой пространственной частотой.
В начале роста обнаружение бактерий и дрожжей значительно затруднено, так как поглощение ими света является очень слабым в видимой области, в ближней ультрафиолетовой и в ближней инфракрасной области, и их показатель преломления очень близок к показателю преломления их окружающей среды. Таким образом, невооруженным глазом можно обнаружить только колонии диаметром более 100 мкм; время роста колоний, необходимое для достижения этих размеров, обычно составляет от 6 до 24 часов (ч).
Возможным способом обнаружения является углубленное микроскопное исследование, предпочтительно на черном фоне, но его очень трудно применять.
Часто применяют другие методы.
Например, можно сделать микроорганизмы флуоресцирующими при помощи различных не флуоресцентных добавок, которые метаболизм микроорганизмов преобразует в флуоресцентное вещество, выбираемое таким образом, чтобы долго оставаться внутри микроорганизмов. Этот метод требует достаточного длительного времени (>5ч), прежде чем бактерии станут флуоресцентными, и создания флуорогенного метаболита.
Точно также хромогенные среды позволяют селективно визуально наблюдать микроорганизмы, но при этом встает та же проблема: окрашивание требует довольно длительного времени (несколько часов), чтобы его можно было наблюдать невооруженным глазом.
Кроме того, все эти методы могут привести к серьезным нарушениям метаболизма микроорганизмов, тогда как дальнейшие тесты (например, измерение чувствительности к антибиотикам) требуют развития микроорганизмов в максимально благоприятных условиях.
Краткое изложение существа изобретения
Изобретение призвано устранить эти недостатки и предложить минимально интрузивный способ обнаружения, обеспечивающий раннее обнаружение скоплений небольших размеров, таких как колонии микроорганизмов в начале их роста.
В связи с этим объектом изобретения является способ обнаружения скопления биологических частиц на поверхности, содержащий следующие этапы, на которых:
а) определяют топографическую картину упомянутой поверхности;
b) обнаруживают на этой топографической картине, по меньшей мере, контур, ограничивающий область, которая может соответствовать скоплению биологических частиц.
Эти этапы осуществляют при помощи соответственно запрограммированного компьютера или другого электронного средства обработки данных, связанного (в частности, для осуществления этапа а) с соответствующим измерительным устройством.
Согласно предпочтительным вариантам выполнения изобретения:
- Упомянутые биологические частицы можно выбирать среди микроорганизмов, таких как бактерии, дрожжи или грибки, и растительных или животных клеток.
- Упомянутые биологические частицы могут иметь диаметр или главный размер, составляющий от 10 мкм до 3 мм или предпочтительно меньший или равный нескольким сотням 100 мкм и, например, меньший или равный 100 мкм.
- Упомянутую поверхность выбирают из: границы раздела между средой культуры и окружающей средой, такой как воздух, поверхности функционального субстрата или поверхности микропористой мембраны.
- Упомянутый этап а), на котором определяют топографическую картину упомянутой поверхности, можно осуществлять при помощи оптического способа, который применяют без контакта и без подготовки пробы, чтобы обеспечить минимальную интрузивность. В частности, речь может идти о способе хроматической конфокальной микротопографии, или о стриоскопии, или о теневом методе.
- Упомянутый этап b), на котором обнаруживают, по меньшей мере, контур, можно осуществлять посредством измерения локального наклона упомянутой топографической картины поверхности с определением пороговых значений.
- Способ может содержать также операцию предварительной обработки топографической картины, содержащую обнаружение и выделение опорной поверхности.
- Способ может содержать повторение этапов а) и b) в последовательные интервалы времени и выбор только тех областей, идентифицированных на этапах b), форма и размер которых изменяется во времени.
Согласно предпочтительному варианту изобретения, способ может содержать дополнительный этап с), на котором количественно определяют показатель, связанный с размером обнаруженного скопления, например его объем. Это представляет, в частности, интерес, когда размер исследуемых биологических частиц известен. Действительно, в этом случае этот этап с) позволяет оценить количество биологических частиц, присутствующих в скоплении. Действительно, зная средний размер исследуемых биологических частиц, взятых индивидуально, и определив размер скопления, можно легко количественно охарактеризовать биологические частицы. Такой вариант изобретения представляет особый интерес, когда биологическими частицами являются микроорганизмы и если предусмотрена последующая работа на упомянутых микроорганизмах, требующая взятия пробы колонии. Этот вариант позволяет убедиться, что количество присутствующих микроорганизмов является достаточным, например, до взятия пробы.
Согласно другому предпочтительному варианту изобретения способ может содержать дополнительный этап идентификации in-situ или ex-situ находящихся в скоплении микроорганизмов.
Краткое описание чертежей
Другие отличительные признаки, детали и преимущества изобретения будут более очевидны из нижеследующего описания, представленного в качества примера, со ссылками на прилагаемые чертежи, на которых:
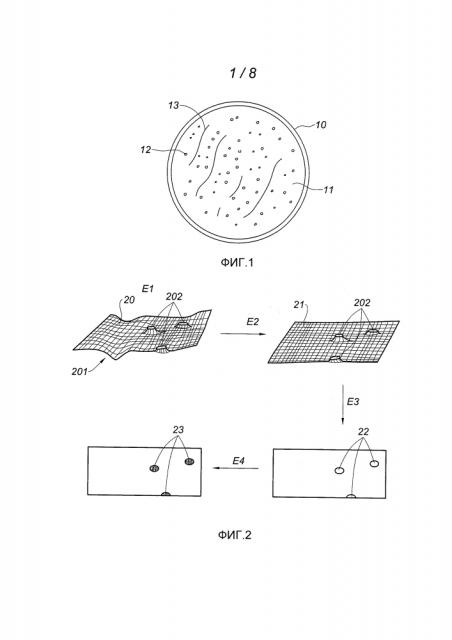
Фиг. 1 изображает поверхность среды культуры, на которой присутствуют колонии бактерий.
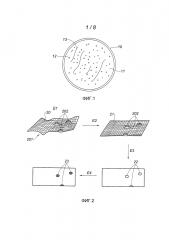
Фиг. 2 схематично изображает различные этапы способа согласно варианту выполнения изобретения.
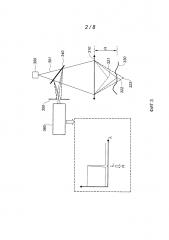
Фиг. 3 изображает принцип хроматической конфокальной микротопографии, используемой в первой версии способа в соответствии с изобретением.
Фиг. 4А, 4В и 5А, 5В, 5С, 5D и 5Е изображают экспериментальные результаты, полученные с применением технологии хроматической конфокальной микротопографии на среде культуры, засеянной бактериями.
Фиг. 6А-6D изображают второй вариант воплощения способа в соответствии с изобретением, основанный на методе стриоскопии.
Фиг. 7А-7С изображает третий вариант воплощения способа в соответствии с изобретением, основанный на теневом методе.
Описание предпочтительных вариантов воплощения
На фиг. 1 показана чашка Петри 10 в верхней проекции; эта чашка содержит питательную среду (агар-агар), на поверхности 11 которой развиваются колонии 12 бактерий. Задачей заявленного способа является обнаружение этих колоний на ранней стадии их роста, когда их диаметр является слишком малым, чтобы их можно было наблюдать невооруженным глазом (диаметр в несколько десятков микрометров, например, 30 мкм или меньше). Поверхность 11 среды культуры (то есть граница раздела агар-агар/воздух) имеет неровности 13, связанные с состоянием поверхности агар-агара. В примере, представленном на фиг. 1, агар-агар напрямую контактирует с воздухом; следовательно, он имеет тенденцию к высыханию, что приводит к изменениям его поверхности, в частности к колебанию его среднего уровня. Предпочтительно способ обнаружения скоплений биологических частиц на поверхности агар-агара учитывает эти неровности поверхности, а также происходящие на ней изменения.
Способ в соответствии с изобретением использует тот известный факт, что размножение бактерий на поверхности питательной среды приводит к образованию бугорка. Высота этого бугорка на начальных стадиях роста колонии измеряется сотнями нанометров или микрометрами. Идея изобретения основана на обнаружении бугорков, соответствующих скоплениям биологических частиц, при помощи известных технологий поверхностной топографии в сочетании с соответствующей обработкой изображения.
Как показано на фиг. 2, на первом этапе Е1 способа в соответствии с изобретением определяют топографическую картину 20 поверхности 11, на которой развиваются обнаруживаемые скопления 12. В примере, представленном на этой фигуре, речь идет о трехмерной топографической картине, принимающей, в частности, форму «трехмерной поверхности». Трехмерная топографическая картина связывает с каждой точной поверхности координаты (x, y) в плоскости Oxy и координату (z) по оси Oz, предпочтительно перпендикулярной к плоскости Oxy. Эта картина может принимать вид трехмерной поверхности в системе координат Ox, Oy, Oz или вид матрицы, в которой элементы ai,j соответствуют высоте вдоль z точек координат (i, j) в плоскости Oxy.
Второй этап Е2 представляет собой операцию предварительной обработки топографической картины 20, содержащую обнаружение и выделение базовой поверхности. Действительно, как было указано выше, поверхность 11 может быть неопределенной и даже меняться во времени. Для обеспечения хорошего обнаружения скоплений частиц, необходимо определить базовую поверхность, выделенную при помощи соответствующей обработки данных, например пространственной полосовой фильтрации, при этом частота отсечки обычно составляет примерно 0,001 мкм-1 и, например, находится в пределах от 1/2000 мкм-1 до 1/500 мкм-1. При этом исчезают полосы, связанные с подготовкой среды культуры, изменения толщины, даже самые разнородные, и неровности плоскости.
Согласно более простой версии на уровне области поверхности вычисляют средний наклон для определения плоской и наклонной базовой поверхности.
Позицией 21 обозначена фильтрованная трехмерная поверхность (или в целом: топографическая картина), в которой неровности 201 малой пространственной частоты (связанные, например, с неровностями среды 13 культуры) были устранены при помощи вышеупомянутой операции обработки. На поверхности 21 остаются только неровности или выступы 202 достаточно малого размера и/или имеющие достаточно высокие пространственные частоты. Под высокими пространственными частотами следует понимать частоты, превышающие 1/500 мкм-1. Можно убрать составляющие сверхвысоких частот, то есть составляющие, соответствующие пространственным частотам более нескольких мкм-1, которые соответствуют неровности геля, образующего среду культуры.
На третьем этапе Е3 на трехмерной поверхности 21 выделяют контуры 22. Как известно, контуры можно обнаружить при помощи известных специалистам фильтров обнаружения контура посредством измерения локального наклона поверхности, после которого определяют пороговые значения, или посредством полосовой пространственной фильтрации, например при помощи фильтра с полосой пропускания от нескольких 1/500 мкм-1 до нескольких 1/10 мкм-1. По меньшей мере, некоторые из контуров 22 ограничивают замкнутые области 23, которые идентифицируют на четвертом этапе Е4 как потенциально соответствующие скоплениям биологических частиц. Этап Е4 может содержать операцию выбора предназначенных для рассмотрения замкнутых областей. Например, можно применить критерий выбора, согласно которому выбирают только области достаточно малых размеров (с диагональю или диаметром порядка нескольких десятков микрометров), которые могут представлять собой скопления биологических частиц. В варианте или в комбинации можно повторять этапы Е1-Е4 в последовательные периоды времени и выбирать только те области 22, форма или размер которых меняется во времени. Действительно, скопления биологических частиц являются «живыми» структурами, которые развиваются, тогда как не биологические структуры не меняются или меняются лишь в незначительной степени между двумя последовательными измерениями. Это позволяет также измерять кинетику роста скоплений.
Первый этап Е1 способа, состоящий в определении топографической картины поверхности, на которой развиваются отслеживаемые скопления, можно осуществлять путем применения нескольких разных известных методов микротопографии. Чтобы не нарушать рост обнаруживаемых скоплений, предпочтительно применяют бесконтактные технологии, в частности оптические методы без подготовки пробы (то есть не основанные на использовании красителей, флуорофоров или их предшественников).
Как правило, метод оптической микротопографии включает в себя следующие этапы:
- при помощи источника света освещают поверхность, топографическую картину которой необходимо получить;
- при помощи датчика света обнаруживают сигнал, соответствующий свету, отраженному этой поверхностью или прошедшему через эту поверхность; и
- на основании обнаруженного сигнала определяют трехмерную топографическую картину поверхности.
Освещение поверхности может быть направленным от окружающей среды к поверхности. Если освещение не коллимировано, его можно сфокусировать на исследуемой зоне. Источник света может быть когерентным в пространстве и/или во времени или может быть некогерентным. Он может быть монохроматическим или полихроматическим. Обнаружение можно осуществлять при помощи одномерного (планка) или двухмерного (матрица) датчика изображения типа CMOS, CCD, фотоэлектронного умножителя, фотодиода и т.д. Этот датчик может иметь спектрометрическую функцию, позволяющую анализировать спектр обнаруженного света. Он может быть также связан с диафрагмой или точечной диафрагмой, образуя конфокальное устройство обнаружения.
Далее следует подробное описание двух методов, представляющих собой предпочтительные варианты выполнения изобретения. Вместе с тем, в рамках заявленного способа можно применять и другие оптические методы, например: автоматическая наводка на поверхность путем автоматической коллимации или посредством обработки изображения; интерферометрические и/или голографические методы; анализ фронта волны при отражении и т.д. Первым оптическим методом микротопографии, который был успешно применен для раннего обнаружения скоплений биологических частиц на поверхности, является хроматическая конфокальная микротопография. Хроматическая конфокальная микротопография была разработана компанией STIL S.S. и подробно описана в документе FR 2738343.
Метод хроматической конфокальной микротопографии или хроматического конфокального фотографирования проиллюстрирован на фиг. 3.
Точечный источник 300 белого (или, во всяком случае, полихроматического) света, например, образованный протяженным источником, объединенным с точечным отверстием, излучает световой пучок 301, фокусируемый объективом 310. Этот объектив 310 имеет протяженный осевой хроматизм: следовательно, различные спектральные составляющие пучка 301 фокусируются в соответствующих фокальных точках 321, 322, 323… вдоль оптической оси объектива. Пучок, сфокусированный таким образом при нормальном угле падения, направлен на поверхность 330 пробы. Свет, отраженный поверхностью 330, вторично проходит через объектив 310, распространяясь при этом в сторону источника 300; часть отраженного света отделяется разделителем пучка 340 и направляется в точечное отверстие 350, подвижное в осевом направлении и расположенное перед спектрофотометром 360. Учитывая осевой хроматизм объектива 310, эти лучи имеют строго определенную длину (λi) волны (λ), которая зависит от расстояния Н между объективом 310 и отражающей поверхностью 330. На основании измерения длины волны λi, произведенного спектрофотометром 360, можно определить Н.
Топографическую картину поверхности 330 можно получить посредством сканирования.
Экспериментальная демонстрация применения этого метода для осуществления заявленного способа была проведена с использованием засеянной агаровой среды культуры и оптической системы, имеющей следующие характеристики:
- частота дискретизации 1 кГц;
- динамика расстояния примерно 300 мкм;
- в качестве датчика в спектрометре использована планка CCD на 1000 пикселей, при этом каждый пиксель кодирует высоту 300нм. Методы обработки сигнала, например, способы суперпикселизации, позволяют получать вертикальное разрешение менее 300 нм. Такие известные способы позволяют улучшить разрешение, комбинируя содержимое смежных пикселей.
Например, можно использовать прибор Altisurf 500 компании Altimet.
Экспериментальные результаты представлены на фиг. 4А и 4В, а также на фиг. 5А-5Е. На этих фигурах трехмерная поверхность была заменена абсолютно эквивалентным изображением с использованием шкалы серого цвета (темно-серый цвет для малых высот, светло-серый или белый - для более значительных высот).
На фиг. 4А показана топографическая картина поверхности агаровой среды культуры, засеянной бактериями Staphilococcus epidermidis. Можно отметить искажение поверхности в несколько десятков микрометров в виде полос. На фиг. 4В показана та же картина после предварительной обработки выделения базовой поверхности. Искажение поверхности пропало, и можно без труда различить колонии бактерий высотой примерно 2 мкм и с диаметром от 10 мкм до нескольких сот мкм. Затем происходит автоматическая идентификация этих колоний посредством вычисления локального наклона и определения пороговых значений. Размер поверхности агар-агара, рассматриваемой в этом примере, равен 1,2×5 мм.
На фиг. 5А показана топографическая картина другой агаровой среды культуры, засеянной бактериями Escherichia Coli до выделения фона. На фиг. 5В показана фоновая поверхность, позволяющая выявить неровности поверхности в виде полос, и на фиг. 5С показана поверхность после выделения фона, на которой четко видны колонии бактерий.
На фиг. 5D и 5Е показано изменение во времени (в 0 часов; 1,3 ч; 2,2 ч; 3 ч; 3,9 ч) (одномерных) профилей двух из этих колоний. Можно сделать вывод, что колонии можно обнаружить примерно по истечении 2 часов и можно отслеживать динамику их роста.
В этом методе картина топографии поверхности среды является трехмерной картиной. Обнаруженные контуры соответствуют замкнутым линиям, ограничивающим объем. В зависимости от выбранного способа обнаружения контура эти замкнутые линии объединяют пиксели, соответствующие либо одному наклону, либо одной высоте.
Каждый ограниченный контуром объем можно количественно характеризовать при помощи показателя, который может включать в себя интеграл весового коэффициента (то есть высоты) пикселей, содержащихся в этом объеме. Во время вычисления этого интеграла весовой коэффициент пикселей можно ограничить пороговыми значениями. Иначе говоря, учитывают только значение весового коэффициента, выходящее за определенный порог. Этот порог можно установить по весовому коэффициенту одного или нескольких пикселей, образующих контур, или по весовому коэффициенту одного или нескольких пикселей, распределенных на поверхности, ограниченной контуром.
Если тип микроорганизма, образующего объем, известен, этот показатель позволяет произвести оценку биомассы.
Согласно другому варианту выполнения скопления биологических частиц обнаруживают при помощи метода стриоскопии.
Стриоскопия является известным оптическим методом, основанным на принципах Фурье-оптики. На фиг. 6А показана стриоскопическая установка, позволяющая осуществлять второй вариант изобретения.
Точечный источник 600 излучает по существу монохроматический расходящийся пучок 601 света, который затем фокусируется объективом 620. Прозрачная чашка Петри 610, содержащая среду культуры, засеянную на поверхности 611, из которой развиваются колонии 612 исследуемых микроорганизмов, расположена сразу за объективом 620 таким образом, чтобы через нее проходил сфокусированный пучок. В фокальной плоскости объектива 620 расположена маска 630. Эта маска 630 затеняет все световые лучи, проходящие от источника 611 через объектив и чашку Петри, но при этом их не отклоняет. Если бы поверхность 611 была идеально плоской и однородной (и при геометрической аппроксимации оптики), маска перехватывала бы весь свет пучка 601. В действительности, неровности поверхности 611, в том числе связанные с присутствием колоний 612, отклоняют некоторые световые лучи, которые, таким образом, проходят сбоку от маски. С точки зрения Фурье-оптики известно, что в фокальной плоскости объектива происходит распределение света, соответствующее спектру пространственных частот поверхности 611; таким образом, маска осуществляет полосовую пространственную фильтрацию.
На выходе маски находится система фотографирования изображений (фотоаппарат 640), наведенная на поверхность среды культуры. Изобретение, получаемое при помощи этой системы, содержит информацию о локальном наклоне поверхности 611 и, следовательно, позволяет воспроизвести трехмерную поверхность упомянутой поверхности (которая к тому же уже частично отфильтрована от нижних частот и не требует предварительной обработки).
Учитывая, что маска имеет конечный размер, то обнаруживают только те световые лучи, которые отклонены под углом, превышающим или равным пороговому значению. Это пороговое значение сведено к минимуму, когда маска имеет размер дифракционного пятна линзы. Если предположить, что источник 600 действительно является точечным (что всегда является лишь приближением), то можно обнаруживать только локальные наклоны, превышающие λ/(n-1)d, где λ является длиной волны применяемого света, d является диаметром линзы и n является показателем преломления среды. Действительно, локальный наклон, имеющий угол α, отклоняет лучи под углом (n-1)α, и наблюдать можно только отклонения, превышающие дифракцию. На практике среды культуры имеют поверхностные дефекты в несколько миллирадиан, что требует маски, намного большей этого теоретического предела, если желательно обойтись без предварительной обработки. Диаметр маски должен составлять приблизительно (n-1)I*pmax, где pmax является максимальным локальным наклоном дефектов поверхности и I является расстоянием между линзой и маской. Колония микроорганизмов толщиной 1 мкм и диаметром 30 мкм приводит к среднему локальному наклону поверхности волны, равному (1,35-1)/15=23 миллирадиан, что намного больше поверхностных дефектов геля и, следовательно, его можно легко отслеживать визуально. Локальный наклон на уровне края колонии является еще более значительным, как правило, в несколько сот миллирадиан (или десятых долей радиана).
Преимуществом стриоскопии перед методами геометрической картографии, такими как хроматическое конфокальное фотографирование, состоит в том, что необязательно иметь боковое разрешение, превосходящее размер микроколоний: поскольку используют черный фон, то без всякого труда обнаруживают и локализуют объекты, намного меньшие предела разрешения (но при этом, разумеется, не различают два объекта, находящиеся ближе друг к другу, чем упомянутый предел разрешения).
Другое преимущество состоит в том, что при помощи всего лишь одной съемки наблюдаемое поле может охватить более обширную область, чем при описанной выше конфокальной микротопографии. Так, получение одного изображения при помощи способа стриоскопии позволяет наблюдать обширную часть чашки Петри и даже всю эту чашку.
Согласно этому методу картина топографии поверхности среды является двухмерной картиной, то есть изображением, на котором изменение интенсивности между двумя смежными пикселями выражает колебание высоты поверхности освещаемого объекта и/или локальное изменение показателя преломления. Обнаруживаемые контуры соответствуют замкнутым линиям, ограничивающим поверхности. Эти линии связывают пиксели, соответствующие одинаковому изменению уровня серого.
Когда изменение высоты между двумя смежными пикселями происходит по причине присутствия колонии бактерий, ее край образует вместе с поверхностью среды культуры угол, как правило, превышающий несколько десятых радиана. Такой наклон больше наклона, образуемого изменениями уровней среды культуры, угол которого обычно меньше 10 миллирадиан.
На фиг. 6В показана другая установка, позволяющая применять заявленный способ при помощи стриоскопии. В отличие от варианта, показанного на фиг. 6А, осветительный пучок 301' подвергается коллимации, когда он проходит через прозрачную чашку Петри 610, затем фокусируется первой линзой 620' на ее выходе (фокальная длина линзы: 200 мм; диаметр: 50 мм - эти значения представлены исключительно в качестве примера). Вторая линза 621 (фокальная длина: 10 мм; цифровая апертура ON: f/3 - эти значения тоже представлены исключительно в качестве примера) формирует изображение чашки Петри. Маска 630', расположенная в фокальной плоскости линзы 620', перехватывает световые лучи, которые не были отклонены изменениями локального наклона на уровне наблюдаемой поверхности 611 или локальными изменениями показателя преломления на уровне этой поверхности (также как и лучи, которые были отклонены вниз, хотя это и не существенно). Когда колония бактерий развивается на поверхности 611 среды культуры, она отклоняет световое излучение, являющееся падающим относительно этой поверхности, таким образом, что оно не сходится в направлении маски 630', а обнаруживается датчиком 640 (например, камерой на 1400×1000 пикселей на 3 мкм каждый). Таким образом, поскольку колонии 612 бактерий локально создают флуктуацию наклона на уровне поверхности 611, их можно обнаружить при помощи датчика 640 в виде световых точек на черном фоне.
Использование параллельного осветительного пучка вместо расходящегося/сходящегося пучка установки, показанной на фиг. 6А, делает интенсивность сигнала не зависящей от положения наблюдаемого участка поверхности. Иначе говоря, на всем наблюдаемом поле одинаковый наклон уровня наблюдаемой поверхности создает сигнал одинаковой интенсивности на датчике независимо от положения локального наклона на поверхности 611 среды 610 культуры.
Фиг. 6С соответствует наблюдению колоний бактерий типа Escherichia Coli при помощи установки, показанной на фиг. 6В, через 8 часов после их посева на поверхности агар-агара TSA (Trypcase Soja Gelose). Белые точки соответствуют колониям бактерий. Сплошная линия, образующая прямой световой угол в нижней правой части изображения, соответствует стеклянной пластинке, образующей визуальную точку отсчета.
На фиг. 6D показана фотография этой же среды культуры через 24 часа после посева. Можно оценить отличную когерентность между сфотографированными колониями на фиг. 6D и колониями на фиг. 6С, обнаруженными посредством проникающей стриоскопии.
Стриоскопию можно также применять в зависимости от геометрии при отражении, при этом источник света располагают напротив среды культуры так же, как и датчик. Этот метод представляет интерес для наблюдения непрозрачных сред.
Согласно другому варианту выполнения колонии бактерий наблюдают при помощи установки, в которой применяют теневой метод. Такая установка показана на фиг. 7А. Параллельный световой пучок проходит через чашку Петри 710, содержащую среду культуры, затем фокусируется в направлении датчика 740 первой линзой (фокальная длина линзы: 200 мм; диаметр: 50 мм - эти значения представлены исключительно в качестве примера). Когда колония бактерий 712 развивается на поверхности 711 среды культуры, она отклоняет световое излучение по причине изменения высоты и, следовательно, локального наклона, образующегося на поверхности 711. В отличие от метода стриоскопии, излучение, отклоняемое при изменении высоты и/или изменении показателя преломления на наблюдаемой поверхности, не улавливается датчиком (камера 1400×1000 пикселей на 3 мкм каждый, объектив с фокальной длиной f=10 мм, цифровая апертура ON=f/3 - эти значения представлены исключительно в качестве примера). Это устройство позволяет обнаруживать локальный наклон на анализируемой плоской поверхности, который выражается появлением темной зоны на изображении, снятом датчиком 740. Таким образом, согласно этому методу колонии 712 бактерий появляются в виде темных пятен на светлом фоне, который соответствует поверхности 711 среды культуры.
Как было указано выше относительно стриоскопии, во время применения теневого метода картина топографии поверхности среды является двухмерной картиной, то есть изображением, на котором изменение интенсивности между двумя смежными пикселями отображает изменения высоты освещаемой поверхности. Оно может также отображать локальное изменение показателя преломления на уровне этой поверхности.
На фиг. 7В показано наблюдение бактерий типа Escherichia Coli при помощи установки, показанной на фиг. 7А, 8 часов спустя после их посева на поверхности агар-агара TSA. Темные точки соответствуют колониям бактерий. Следует отметить когерентность локализации эти колоний с результатами, показанными на фиг. 6D (фотография), и наблюдения при помощи проникающей стриоскопии, показанного на фиг. 6С.
Так же, как и метод стриоскопии, наблюдение колоний бактерий при помощи теневого метода можно применять в соответствии с геометрией при отражении, при этом источник света 700 располагают напротив чашки Петри 710, содержащей наблюдаемую среду культуры, так же, как и датчик 740. На фиг. 7С показана такая установка, при этом излучение от источника света отклоняется полуотражающей пластинкой 750, затем становится параллельным под действием линзы 720. Такая установка является более предпочтительной, когда среда культуры является непрозрачной.
Как в случае стриоскопии, так и при поверхностной картографии можно применять все методы обработки изображения и выделения соответствующих изображений, позволяющих выявлять изменения, связанные с ростом.
После локализации скопления можно произвести идентификацию бактерий при помощи известного измерения, например, при помощи анализа in-situ (дифракция, рамановская спектрометрия) или при помощи других средств анализа, таких как масс-спектрометрия. В последнем случае анализ производят ex-situ, что требует взятия пробы колонии бактерий.
Локализация методом топографии позволяет, например, выбирать скопления, объем которых превышает определенный порог, после чего выбранные скопления подвергают качественному анализу.
Изобретение не ограничивается обнаружением колоний микроорганизмов на поверхности среды культуры. Поверхность, на которой могут находиться отслеживаемые биологические скопления и, в целом, биологические частицы, может также быть твердым телом, например функциональным субстратом из стекла или кремния, или микропористым фильтром, который используют для сбора бактерий, содержащихся в фильтруемой жидкости, и который, например, но не ограничительно помещают на среду культуры. Операции предварительной обработки, осуществляемые на втором этапе Е2 способа, предпочтительно адаптируют к данному типу поверхности.
Окружающая среда, находящаяся над поверхностью, может быть вакуумом или текучей средой, такой как газ или жидкость, при этом газ и, в частности, воздух является более предпочтительным. Окружающая среда может быть замкнутой, что позволяет избежать рисков загрязнения и возможного испарения агар-агара.
1. Способ обнаружения кластера микроорганизмов на поверхности, содержащий этапы, на которых:a) определяют топографическое представление упомянутой поверхности;предварительно обрабатывают указанное топографическое представление, причем процесс предварительной обработки содержит обнаружение опорной поверхности и ее вычитание,b) обнаруживают на топографическом представлении, по меньшей мере, один контур, ограничивающий область, которая потенциально соответствует кластеру микроорганизмов,при этом упомянутые этапы осуществляют при помощи электронного средства обработки данных и оптическим способом.
2. Способ по п. 1, в котором упомянутые микроорганизмы выбраны из микроорганизмов, таких как бактерии, дрожжи или грибки.
3. Способ по п. 1 или 2, в котором упомянутые микроорганизмы имеют диаметр или главный размер, меньший или равный 100 мкм.
4. Способ по любому из пп. 1 или 2, в котором упомянутая поверхность выбрана из: границы раздела между культурной средой и окружающей средой, такой как: воздух, поверхность функционализированного субстрата или поверхность микропористой мембраны.
5. Способ по любому из пп. 1 или 2, в котором упомянутый этап а), на котором определяют топографическое представление упомянутой поверхности, осуществляют при помощи оптического способа, который реализуют без контакта и без подготовки образца.
6. Способ по п. 5, в котором упомянутый этап а), на котором определяют топографическое представление упомянутой поверхности, осуществляют при помощи хроматической конфокальной микротопографии.
7. Способ по п. 5, в котором упомянутый этап а), на котором определяют топографическое представление упомянутой поверхности, осуществляют при помощи шлирен-фотографии или посредством теневого метода получения изображения.
8. Способ по любому из пп. 1, 2, 6, 7, в котором этап b), на котором обнаруживают, по меньшей мере, один контур, осуществляют посредством измерения локальной крутизны топографического представления поверхности с пороговым ограничением.
9. Способ по любому из пп. 1, 2, 6, 7, содержащий повторение этапов а) и b) в последовательные интервалы времени и выбор только областей, идентифицированных на этапах b), форма и размер которых изменяется во времени.
10. Способ по любому из пп. 1, 2, 6, 7, содержащий дополнительный этап с), на котором оценивают количество микроорганизмов, присутствующих в кластере.
11. Способ по любому из пп. 2, 6, 7, содержащий дополнительный этап идентификации микроорганизмов in-situ или ex-situ, находящихся в кластерах.