Система экспрессии и способ получения немодифицированных рекомбинантных белков в escherichia coli с её использованием
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии. Предложена ДНК-конструкция, кодирующая слитый белок-предшественник, в котором вспомогательная аминокислотная последовательность связана с N-концом последовательности зрелого целевого полипептида переходной областью, предназначенной для распознавания и расщепления гибридного предшественника специфической протеазой с образованием немодифицированной зрелой формы интересующего белка. Указанная область представляет собой усеченный с N-конца на 23 аминокислотных остатка белок SUMO S. cerevisiae (Smt3), который содержит сайт расщепления SUMO-гидролазой (Ulp1). На основе ДНК-конструкции, кодирующей вариант предшественника, который включает в качестве вспомогательной последовательности глутатион-S-трансферазу (GST) и отрицательно заряженный пептид, а в качестве целевого белка интерферон (IFN) α2b человека, получен рекомбинантный штамм Е. coli. Предложен также способ получения немодифицированного IFN α2b с использованием указанного штамма Е. coli. Группа изобретений позволяет получить целевой белок с высокими показателями чистоты и активности. 7 н.п. ф-лы, 9 ил., 2 табл., 5 пр.
Реферат
Изобретение относится к биотехнологии, в частности к получению рекомбинантных полипептидов через промежуточную форму гибридного белка. Предлагается ДНК-конструкция, кодирующая слитый белок-предшественник, в котором вспомогательная аминокислотная последовательность связана с N-концом последовательности зрелого целевого полипептида переходной областью, предназначенной для распознавания и расщепления гибридного предшественника специфической протеазой с образованием немодифицированной зрелой формы интересующего белка. Согласно изобретению указанная область представляет собой усеченный с N-конца на 23 аминокислотных остатка белок SUMOSac. cerevisiae (Smt3), который содержит сайт расщепления SUMO-гидролазой (Ulp1). Получены, охарактеризованы и испытаны конкретные формы рекомбинантных ДНК и кодируемых ими гибридных белков, включающих различные партнеры слияния. На основе ДНК-конструкции, кодирующей вариант предшественника, который включает в качестве вспомогательной последовательности глутатион-S-трансферазу (GST) и отрицательно заряженный пептид, а в качестве целевого белка интерферон (IFN) α2b человека, получен рекомбинантный штамм E. coli и описан способ получения немодифицированного IFN α2b с его использованием.
Введение
Грамотрицательная бактерия Escherichiacoli является одним из наиболее широко используемых микроорганизмов-хозяев для промышленного производства рекомбинантных белков. Однако хорошо известно, что экспрессия гетерологичных белков в клетках Е. coli связана с целым рядом проблем, которые должны быть решены в процессе их получения. В частности, если после синтеза аутентичных (собственных) протеинов обусловленный механизмом трансляции дополнительный N-концевой остаток метионина в большинстве случаев эффективно удаляется бактериальными ферментами, то при экспрессии чужеродных белков в лучшем случае происходит его частичное отщепление. Дополнительный метионин на N-конце рекомбинантного белка может не оказывать отрицательного влияния на его свойства, однако известно, что его присутствие в ряде случаев приводит к снижению стабильности и повышению иммуногенности белков (Ben-Bassat A., Bauer K., 1987, Nature 326, 315) и даже к потере их биологической активности (Rabbani et al., 1988, J Biol Chem, 263:1307-1313). Это, в частности, послужило основанием для признания IFN α2 геномодифицированным продуктом и ограничения производства и использования содержащих его препаратов на территории европейских стран (Eur. Pharm., 5th ed.: 2004).
В настоящее время наиболее распространенным методом синтеза в E. coli гетерологичных протеинов с «правильным» N-концом является получение целевого белка через гибридный предшественник, от которого конечный продукт в последующем отщепляется путем обработки специфической протеазой. Важно, что применение этой методологии, кроме основной задачи удаления дополнительного метионинового остатка, позволяет решить целый ряд других проблем, возникающих при экспрессии гетерологичных белков в Е. coli, в том числе предотвратить или уменьшить их протеолитическую деградацию в бактериальных клетках, а также возможность «ошибок» при формировании нативной структуры белковых молекул; при необходимости - преодолеть низкую растворимость гибридного белка и существенно упростить методологию очистки целевого продукта.
С учетом вышеизложенного, представляется очевидным, что задача разработки новых генетических конструкций и экспрессионных систем для получения в E. coli интересующих гетерологичных белков через гибридные предшественники сохраняет свою актуальность.
Уровень техники
Партнеры слияния, наиболее часто используемые в гибридных предшественниках целевых белков - это гистидиновый таг (6-10 His), мальтоза-связывающий белок (MBP) (Kapust R et al., 1999, Protein Sci., 8, 1668-1674), глутатион-S-трансфераза (GST) (Rabhi-Essafi I. et al., 2007, Protein Eng. Des. Sel. 20, 201-209; Smith D., 1988, Gene 67, 31-40; Artika M. et al., Am. J. Biochem. Biotechnol., 2013, 9 (4), 423-429) высоко заряженный пептид (EP 0089626), белок SUMO (Butt T. et al., Protein Expr. Purif. 43, 1-9; Zhu F. et al., World J. Microbiol. Biotechnol., 2013, 29, 319-325; Peciak K. et al., 2005, Protein Exp. Purif., 43, 1-9; Panavas T. et al., 2009, Methods Mol Biol., 497, 303-317) и др. При этом общим положительным результатом объединения любого из перечисленных вспомогательных полипептидов с целевым белком является определенное повышение степени защиты последнего от протеолитической деградации, тогда как в остальном каждый из партнеров привносит в гибридный белок индивидуальные особенности.
Так, известно, что His-таг обеспечивает возможность отделения гибридного белка с помощью металло (Ni, Cu, Zn, Co) - хелатной аффинной хроматографии; MBP повышает растворимость и способствует правильному рефолдингу белка; (+) или (-) - заряженный пептид позволяет направленно изменить заряд белковой молекулы (pI); GST - повысить выход предшественника и его растворимость, а также использовать для «захвата» гибридного белка аффинное сродство GST к глутатион-содержащим сорбентам.
Что касается использования в качестве партнера слияния с интересующим полипептидом убиквитин-подобных белков, в частности белка SUMO, то основная особенность этого типа партнеров состоит в том, что в отличие от всех перечисленных выше, получаемый гибридный предшественник не нуждается во введении отдельного протеазного сайта для отщепления целевого продукта, поскольку такой сайт представлен в самой молекуле SUMO. К числу основных достоинств SUMO-содержащих гибридных предшественников относят высокую специфичность гидролиза, а также принципиальную возможность повышения растворимости «гибрида». Корректное расщепление гибридного предшественника, включающего SUMO, подтверждено многочисленными примерами, в том числе и с целевыми белками, представляющими наиболее сложные субстраты для ферментативного гидролиза, а именно содержащими S-S-связи вамино-терминальной области. В частности, показано, что при выщеплении из предшественника SUMO-IFN α2 конечного продукта дисульфидная связь сохраняется, даже находясь в первом положении последовательности интерферона (патент РФ №2441072). Что же касается способности SUMO влиять на растворимость гибридного белка, то, как показывает практика, это свойство существенно зависит от структуры основного партнера и условий биосинтеза слитого белка (Peciak K., 2014; Zhang H., PLoSOne, February 3, 2015). Таким образом, можно заключить, что безусловным преимуществом использования SUMO в составе гибридных предшественников следует считать формирование области распознавания и расщепления протеазой, отличающуюся высокой специфичностью гидролиза.
Очевидным недостатком простой комбинации SUMO с интересующим белком является то, что в отличие от большинства других «тагов», данный белок не рассчитан на использование в процессах выделения и очистки продуктов биосинтеза. С этой точки зрения перспективным представляется создание генетических конструкций, в которых в качестве вспомогательных полипептидов «гибрида» используется комбинация SUMO, выполняющего в предшественнике роль переходной области расщепления, с другими «тагами», свойства которых (в зависимости от решаемой задачи) позволяют упростить очистку и/или сместить равновесие между нерастворимой и растворимой формами и/или повысить общий выход белка-предшественника (Butt T., 2005; US 7,220,576 22.05.2007; Zhang H. et al., 2015).
Принимая во внимание то, что гидролиз специфической SUMO-протеазой нуждается не только в наличии расщепляемого сайта, но и в сохранении нативной конформации белковой молекулы (Butt Т., 2005), комбинирование этого партнера с другими «тагами» обычно приводит к получению «гибридов» достаточно большого размера. Однако эта проблема может быть частично решена за счет использования хорошо известной тактики удаления из общей структуры предшественника частей, не являющихся функционально значимыми. В частности, с этой целью некоторыми исследователями используются формы SUMO, «укороченные» с N-конца на 9-12 аминокислот, т.к. согласно существующей на сегодня точке зрения для сохранения необходимой конформации молекулы этого белка и протекания реакции гидролиза необходимой является аминокислотная последовательность от 13 до 98 аминокислотного остатка (Mossessova E., Lima C., 2000, Mol Cell, 5, 865-876).
С учетом вышеизложенного наиболее близким аналогом настоящего изобретения можно считать разработку, представленную в патенте РФ №2453604 и раскрывающую гибридный белок 10His-SUMO-IFN α2b, где SUMO из Sac. cerevisiae (Smt3) комбинируется с тагом, обычно вводимым в такого рода конструкции для выделения гибридного белка с помощью металло-хелатной хроматографии; экспрессионный вектор; рекомбинантный штамм E. coli и способ продукции безметионинового целевого продукта.
В отношении прототипа могут быть отмечены следующие недостатки.
а) Недостаточно удачный выбор «тага», имеющего назначением применение для аффинной очистки гибридного предшественника, в ходе которой используют ионы Ni (Cu, Zn, Co), образующие с матрицей координационную связь. Это определяет возможность загрязнения промежуточных продуктов ионами названных металлов и, соответственно, проверки материала на их наличие, а при обнаружении - их полного удаления. Возможно, именно это обстоятельство объясняет, что присутствующий в векторной конструкции His-таг часто остается неиспользованным в ходе очистки, если последняя осуществляется в производственных масштабах.
б) Хроматографическая очистка продуктов предусматривает 4 этапа, одним которых является обращенно-фазовая хроматография, требующая специального оборудования, обслуживания и материалов. Кроме того, известно, что используемые в данном процесс органические растворители, в частности ТФУ, оказывают достаточно жесткое воздействие на белковую молекулу, результатом которого могут быть и необратимые изменения ее конформации. И, наконец, применение обращено-фазовой хроматографии при получении рекомбинантных белков медицинского назначения, представляется весьма нежелательным, поскольку создает дополнительные сложности в плане безопасности (качества) получаемых препаратов, и, по крайней мере, требует их тщательной проверки на предмет «следов» токсичных примесей, прежде всего, - ацетонитрила, который используется в очень высоких концентрациях (70-80%%).
в) Не полностью использованные возможности по удалению из структуры гибрида частей, не несущих функциональной нагрузки.
Задачей настоящего изобретения была разработка экспрессионной системы (генетической конструкции и, соответственно, кодируемого ею предшественника, экспрессионного вектора и трансформированной им клетки E. coli), обеспечивающей получение немодифицированного целевого белка, в частности интерферона альфа 2b, простым в технологическом отношении и экономичным способом, гарантирующим отсутствие загрязнений фармацевтических продуктов следами вредных примесей.
Раскрытие изобретения
Решение поставленной задачи предусматривало: а) исследование возможности усовершенствования (максимально возможного уменьшения размеров без нарушения процесса протеолитического расщепления) переходной области гибридного предшественника путем получения и испытания в реакции гидролиза «гибридов» с различными «усечениями» N-конца Smt3; б) конструирование и экспрессию рекомбинантных ДНК с последовательностью, кодирующей отобранный на стадии (а) минимальный по размеру фрагмент Smt3, слитый с различными видами вспомогательных последовательностей при одном и том же целевом белке, и выбор оптимальных (по интересующим показателям) гибридных конструкций; в) конструирование и экспрессию рекомбинантных ДНК с последовательностью, кодирующей отобранный на стадии (а) фрагмент Smt3, слитый с различными видами целевых белков при одном и том же вспомогательном партнере слияния, и выбор оптимальных (по интересующим показателям) гибридных конструкций; г) испытание отобранных на стадиях (б)-(в) конструкций в полном цикле получения кодируемого ими целевого белка с проведением его выделения, очистки и анализа.
а) Ранее для SUMO Sac. cerevisiae (Smt3) была показана возможность укорачивания белка с N-конца, не влияющая на эффективность гидролиза специфической протеазой, на 12 аминокислот (прототип). Однако из анализа трехмерной структуры комплекса данного белка с Ulp1, а также картины выравнивания последовательностей различных убиквитин-подобных белков (Mossessova Е., 2000 и др.) нами было сделано предположение о возможности дальнейшего усечения молекулы, не влекущего за собой нарушения ее конформации. Для проверки этой гипотезы были получены оптимизированные для экспрессии в E.coli нуклеотидные последовательности, кодирующие SUMOΔ19, SUMOΔ23 и SUMOΔ40, которые после слияния с оптимизированной для экспрессии в E.coli последовательностью, кодирующей IFN α2b человека, и введения в подходящую плазмиду были использованы для трансформации клеток E. coli (пример 1) и биосинтеза гибридного предшественника. В результате анализа расщепления экспрессированных гибридных белков SUMO-протеазой Ulp1 (фиг. 1) было впервые показано, что максимально возможным «усечением» последовательности Smt3, не оказывающим негативного влияния на процесс гидролиза, является удаление с N-конца 23 аминокислотных остатков.
б) На втором этапе к отобранной конструкции, кодирующей SUMOΔ23-IFN α2b, присоединяли с 5′-конца нулкотидные последовательности, кодирующие различные вспомогательные белки: тиоредоксин (TrxA), GST, GST + отрицательно заряженный пептид. Выбор именно этой группы «тагов» определялся поставленной задачей: упростить очистку продуктов и полностью исключить возможность их загрязнения токсичными соединениями. После экспрессии данных вариантов конструкции в E.coli выяснилось, что включение в состав «гибрида» различных партнеров слияния не влияет на эффективность выщепления конечного продукта (пример 2, табл. 1), а также то, что введение GST (в обоих случаях) существенно стимулирует рост колоний, обеспечивает повышение стабильной экспрессии и, соответственно, повышает выход гибридного белка.
в) Далее был проведен эксперимент по сравнению расщепления гибридных белков типа GST-(-)пептид -SUMOΔ23-IFN α2b; GST-(-)пептид -SUMOΔ23-caIFN и GST-(-)пептид -SUMOΔ23-proCPB, где caIFN-интерферон собаки, а proCPB - прокарбоксипептидаза Б. Полученные результаты показали, что SUMOΔ23 эффективно распознается протеазой Ulp1 во всех трех случаях, т.е. может выполнять функцию сайта расщепления в составе гибридного предшественника различных интересующих белков (пример 3). Кроме того, результаты анализа позволили заключить, что созданный нами гибридный белок-партнер GST-(-)пептид - SUMOΔ23 (сокращенно GLSΔ23) создает особо благоприятные условия для очистки продуктов, т.к. позволяет быстро растворять «тельца включения», проводить их очистку на обычном анионообменнике (фиг. 2) и легко отделять партнер от целевого белка (фиг. 3).
Для осуществления полного цикла получения и очистки немодифицированного рекомбинантного белка была выбрана конструкция, кодирующая предшественник GST-(-)пептид -SUMOΔ23-IFN α2b (GLSΔ23-IFNα2b).
г) Получение интерферона альфа 2b человека включало создание экспрессионного вектора, функционально активного в E. coli, трансформацию бактериальных клеток, отбор положительных клонов и получение рекомбинантного штамма - продуцента гибридного предшественника, культивирование продуцента в условиях, обеспечивающих образование гибридного белка в нерастворимой форме, его растворение, рефолдинг, выделение и очистку.
В частном случае воплощения рекомбинантная ДНК, кодирующая предшественник GST-(-)пептид -SUMOΔ23-IFN α2b, была встроена в вектор pGEMEX, что не должно служить ограничением изобретения, поскольку очевидно, что в данном случае вектором-носителем могла бы быть и другая плазмида из числа используемых в практике для получения рекомбинантных белков в E. coli, например, принадлежащая к серии pET.
В качестве штамма-реципиента в конкретном случае выполнения использовали штамм Е. coli BL21(DE3), что также не исключает возможности применения и других известных лабораторных штаммов бактерии, предпочтительно со сниженной протеазной активностью. Полученный рекомбинантный штамм E. coli BL21(DE3)/pGLSΔ23-IFNA2B характеризовался следующими признаками:
- при микроскопии клетки прямые, палочковидной формы, грамотрицательные, неспороносные;
- при росте на питательном агаре колонии гладкие, круглые, блестящие, серые, края колоний ровные, диаметр 1-2 мм;
- культура хорошо растет на обычно используемых питательных средах, при росте в жидких средах YT, LB культура имеет вид однородной суспензии;
- устойчив к антибиотику ампициллину в концентрации 100 мкг/мл.
Условия культивирования полученного штамма-продуцента (см. пример 5) подбирались таким образом, чтобы основная часть белка была представлена нерастворимой формой, поскольку в условиях масштабного производства она имеет преимущества как в плане возможности получения более высоких выходов целевого продукта, так и с точки зрения удобства обращения с ней и ее хранения. Вместе с тем, при необходимости соотношение между нерастворимой и растворимой формами гибридного предшественника могло быть легко смещено в пользу последней путем изменения температурных режимов и условий аэрации, чему, как известно, в большой степени способствует присутствие в структуре «гибрида» глутатион-S-трансферазы (Harper S. and Speicher D., 2011, Methods Mol Biol., 681, 259-280).
Растворение и рефолдинг гибридного белка проводили общепринятыми способами (пример 5), а для его отделения мог использоваться один из двух вариантов, первый из которых основан на связывании GSTc глутатион-содержащим сорбентом, а второй - на взаимодействии отрицательно заряженного пептида с положительно заряженным сорбентом. Последующая очистка целевого продукта (после расщепления «гибрида» Ulp1) в обоих случаях предусматривала проведение хроматографической очистки на Q- и CM-сефарозе и процедуры гель-фильтрации.
В результате (вне зависимости от варианта «захвата» гибридного белка) был получен IFN α2b человека с показателями чистоты и специфической активности, близкими к прототипу. При этом предложенная ДНК-конструкция и ее применение по назначению позволили получить целевой продукт более простым в технологическом отношении и более дешевым способом, чем в прототипе, и исходно (без дополнительных проверок) гарантировать отсутствие загрязнения его следами токсичных соединений, обеспечивая тем самым достижение планируемых технических результатов.
Краткое описание фигур
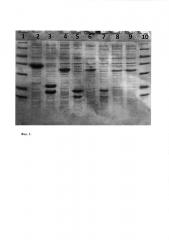
Фиг. 1. Эффективность гидролиза гибридных белков с вариантами укороченного белка SUMO.
Электрофоретическое разделение продуктов гидролиза Ulp1 в 14% ПААГ.
Дорожки 1 и 10 - маркеры молекулярных весов (14,4; 18,4; 25; 35; 45; 66,2; 116 кД). Дорожки 2-3; 4-5; 6-7; 8-9 - лизат без добавления Ulp1 и лизат, инкубированный с Ulp1 1 час во льду при гидролизе предшественников SUMO-IFNα2b, SUMOΔ19-IFNα2b, SUMOΔ23-IFNα2b, SUMOΔ40-IFNα2b, соответственно.
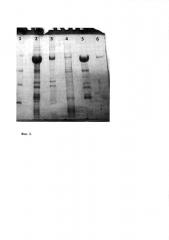
Фиг. 2. Предварительная очистка неренатурированного гибридного белка GLSΔ23-caIFN в 6 М мочевине на анионообменной смоле.
Электрофоретическое разделение в 10% ПААГ.
Дорожка 1 - маркеры молекулярных весов (14,4; 18,4; 25; 35; 45; 66,2; 116 кД).
Дорожка 2 - растворенные тельца включения GLSΔ23-caIFN в 8 М мочевине.
Дорожка 3 - то же, что и дорожка 2, но нанесено в 5 раз меньше материала.
Дорожка 4 - промывка колонки 0,2 М NaCl. Дорожка 5 - элюция 0,5 М NaCl. Дорожка 6 - смыв гибридного белка в агрегатном состоянии (1 М NaCl).
Фиг. 3. Отделение карбоксипептидазы Б человека из гибридного белка GLSΔ23-СРВ. Электрофоретическое разделение в 12% ПААГ.
Дорожка 1 - маркеры молекулярных весов (14,4; 18,4; 25; 35; 45; 66,2; 116 кД).
Дорожка 2 - нерастворимый белок после растворения телец включения.
Дорожка 3 - растворимый белок после растворения телец включения.
Дорожка 4 - ренатурированный гибридный белок.
Дорожка 5 - гидролиз Ulp1 ренатурированного гибридного белка GLSΔ23-CPB.
Фиг. 4. Очистка гибридного белка на Q-сефарозе Fast Flow.
Фиг. 5. Хроматографическое разделение на Q-сефарозе Fast Flow после ферментативного расщепления гибридного белка.
Фиг. 6. Электрофоретическое разделение в 14% ПААГ.
Дорожка 1 - маркеры молекулярных весов (14,4; 18,4; 25; 35; 45; 66,2; 116 кД).
Дорожка 2 - растворимый белок после растворения телец включения.
Дорожка 3 - нерастворимый белок после растворения телец включения.
Дорожка 4 - ренатурированный гибридный белок.
Дорожка 5 - фракция гибридного белка GLSΔ23-IFNα2b с Q-сефарозы Fast Flow.
Дорожка 6 - гидролиз Ulp1. ренатурированного гибридного белка GLSΔ23-IFNα2b.
Дорожка 7 - фракция IFNα2b с Q-сефарозы Fast Flow.
Дорожка 8 - фракция GLSΔ23 с Q-сефарозы Fast Flow.
Фиг. 7. Очистка IFNα2b на CM-сефарозе Fast Flow.
Фиг. 8. Количественное определение специфических примесей в образце IFNα2b методом ВЭЖХ.
Фиг. 9. Сравнение пептидной карты образца IFN α2b с пептидной картой стандартного образца интерферона альфа-2b.
Осуществление изобретения.
Пример 1. Исследование влияния укорачивания последовательности SUMO (Smt3) на экспрессию и расщепление гибридного предшественника.
а) Дизайн варианта синтетического гена Smt3 (SUMO из Saccharomycescerevisiae, NP_010798.1), соединенного с геном зрелого интерферона-alpha 2b человека (IFNα2b, NP_000596.2), разрабатывали на основе известной аминокислотной последовательности при помощи программы DNABuilder (http://www.innovationsinmedicine.org/software/DNABuilder), руководствуясь информацией о составе кодонов, сильно экспрессирующихся генов (stronglyexpressedgenes) Eshcherichiacoli.
При помощи программы Clone Manager (Sci-Ed Software, США) полученную нуклеотидную последовательность гена проверяли на наличие рестрикционных сайтов, используемых в дальнейшей работе. Найденные рестрикционные сайты удаляли с помощью замены соответствующего нуклеотидного триплета с использованием таблицы частоты встречаемости кодонов E. coli.
Составленную таким образом нуклеотидную последовательность гена SUMO-IFNα2b, оптимизированную для экспрессии в клетках E. coli, разбивали на олигонуклеотиды длиной 50 н.п. с помощью программы DNA Builder для последующей сборки полного гена методом рекомбинантной ПЦР. При дизайне 5`фланкирующего праймера к его 5`-концевой последовательности добавляли сайт рестриктазы NdeI, а при дизайне 3`-фланкирующего праймера - сайт рестриктазы HindIII. Эти сайты были необходимы для последующего создания экспрессионной конструкции.
ПЦР-амплификацию проводили в два этапа. В реакцию вносили эквимолярную смесь (5 мкМ каждого) олигонуклеотидных праймеров (всех, кроме крайних), составляющих ген, взаимно перекрывающихся между собой на 15-20 нуклеотидов, 0.2 мкМ раствора dNTP, 1/10 часть реакционного 10х буфера и 1 ед. термостабильной ДНК-полимеразы PfuI. Температуру отжига праймеров рассчитывали по стандартной формуле:
Tm(°C)=2·[NA+NT]+4·[NC+NG]-10,
где NX - количество соответствующих оснований. Реакцию проводили по следующей схеме: денатурация ДНК при 95°C, 5 минут; затем 10 циклов: денатурация ДНК при 95°C, 1 минута; отжиг праймеров при 55°C, 1 минута; синтез ДНК при 74°C, 2,5 минуты. Вторую амплификацию проводили, используя в качестве матрицы раствор первой реакции и крайние праймеры, обеспечивающие синтез гена с необходимыми сайтами рестриктаз, по следующей схеме: денатурация ДНК при 95°C, 5 минут; затем 30 циклов: денатурация ДНК при 95°C, 1 минута; отжиг праймеров при 55°C, 1 минута; синтез ДНК при 74°C, 2,5 минуты.
Смесь для ПЦР (50 мкл):
5 мкл 10-кратного буфера для PfuI-полимеразы («Евроген»);
5 мкл реакционной смеси 1
0,5 мкл 100 мкМ праймера Direct-S (SEQ ID NO: 1);
0,5 мкл 100 мкМ праймера Reverse-I (SEQ ID NO: 2);
1 мкл 10 мМ dNTP каждого вида («Fermentas»);
38 мкл деионизованной воды;
0,5 мкл PfuI ДНК-полимеразы («Fermentas»).
После амплификации 5 мкл ПЦР смеси анализировали электрофорезом в 1%-ном агарозном геле и выявляли гомогенный фрагмент размером 830 п.н. Фрагмент выделяли из геля с помощью набора Min Elute Gel Extraction Kit (Qiagen, Германия) в соответствии с инструкцией производителя.
б) В качестве вектора-носителя использовали плазмиду pGEMEX-1 (Promega, США). С целью накопления плазмиды проводили трансформацию компетентных клеток штамма
Escherichiacoli XL1-Blue recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [ proAB lacIqZΔM15 Tn10 (Tetr)] (Stratagene, США), затем из полученных ампициллин-устойчивых трансформантов выделяли препараты плазмидной ДНК с использованием набора QIA prep Spin Miniprep Kit (QIAGEN, Германия) в соответствии с инструкцией изготовителя.
Так как в плазмиде pGEMEX-1 есть два сайта NdeI, использовали трехкомпонентное лигирование. Для этого 200 нг исходной плазмиды pGEMEX-1 гидролизовали 10 единицами рестриктаз NdeI и AatII (New England Biolabs, США), получая фрагмент ДНК примерно 2000 п.н. Кроме этого, 200 нгр GEMEX-1 гидролизовали 10 единицами рестриктаз AatII и HindIII (New England Biolabs, США), получая фрагмент ДНК примерно 1000 п.н. 200 нг полученного продукта ПЦР (полной последовательности искусственного гена SUMO-IFNα2b) гидролизовали 10 единицами рестриктаз NdeI и HindIII (New England Biolabs, США). Выделенные из агарозного геля фрагменты объединяли и лигировали с помощью T4 ДНК лигазы. Полученной лигазной смесью трансформировали компетентные клетки штамма Escherichiacoli XL1-Blue, а затем из полученных ампициллин-устойчивых трансформантов выделяли препараты плазмидной ДНК с использованием набора QIA prep Spin Miniprep Kit (QIAGEN, Германия) в соответствии с инструкцией изготовителя. Полученные образцы ДНК анализировали совместным гидролизом рестриктазами NdeI/HindIII, и отбирали «положительные» клоны, содержащие NdeI/HindIII фрагменты размером 803, 755 и 2347 п.н. На наличие мутаций плазмиды анализировали методом секвенирования ДНК. В итоге был получен экспрессионный вектор, обозначенный нами pGEMEX-1/SUMO-IFNA2B.
в) Укорачивание последовательности SUMO проводили методом ПЦР. В качестве матрицы использовали плазмиду pGEMEX-1/SUMO-IFNA2B. Реакцию проводили по следующей схеме: денатурация ДНК при 95°C, 5 минут; затем 30 циклов: денатурация ДНК при 95°C, 1 минута; отжиг праймеров при 52°C, 1 минута; синтез ДНК при 74°C, 2 минуты. В качестве праймеров использовали синтетические олигонуклеотиды: 3`-концевой праймер - HSeq (SEQ ID NO: 3) и 5′-концевые праймеры S20 (SEQ ID NO: 4), S24 (SEQ ID NO: 5), S41 (SEQ ID NO: 6) для получения, соответственно, SUMOΔ19-IFNα2b, SUMOΔ23-IFNα2b, SUMOΔ40-IFNα2b.
После амплификации 5 мкл ПЦР смеси анализировали электрофорезом в 1%-ном агарозном геле и выявляли гомогенные фрагменты размером 824, 836, 887 и 938 п.н., (SUMOΔ19-IFNα2b, SUMOΔ23-IFNα2b и SUMOΔ40-IFNα2b, соответственно).
Фрагменты выделяли из геля с помощью набора Min Elute Gel Extraction Kit (Qiagen, Германия) в соответствии с инструкцией производителя, гидролизовали рестриктазами NdeI и HindIII, илигировали с фрагментами плазмиды pGEMEX-1, как описано в п.б). Отобранные плазмиды обозначили как pGEMEX-1/SUMOΔ19-IFNA2B, pGEMEX-1/SUMOΔ23-IFNA2B и pGEMEX-1/SUMOΔ40-IFNA2B, соответственно.
г) Так как в векторе pGEMEX-1 гены гибридных белков в полученных рекомбинантных плазмидах находятся под транскрипционным контролем T7 полимеразы, для трансформации использовали штамм E. coli BL21 (DE3) [F-, ompT, hsdSB (rB-, mB-), dcm, gal, λ (DE3)], который синтезирует РНК-полимеразу фага T7, а также обладает сниженной протеазной активностью.
Для селекции трансформированные бактерии высевали на агаризованную культуральную среду YT, содержащую ампициллин в концентрации 100 мкг/мл. Выросшими колониями бактерий инокулировали 50 мл культуральной среды TB5052 (Studier F.W. Protein Expr Purif. 2005; 41:207-234) и культивировали 48 часов при 15°C, затем бактерии собирали центрифугированием, декантировали надосадочную жидкость и осадок замораживали при -20°C.
Для анализа эффективности гидролиза гибридных белков гидролазой Ulp1 клетки размораживали и разрушали ультразвуком с периодическим охлаждением во льду в лизис-буфере, содержащем 50 мМ Трис, 150 мМ NaCl, 2 мМ EDTA, 0.1 мМ PMSF, pH 9.0. Клеточный дебрис удаляли центрифугированием при 13000 об/мин 10 мин. К надосадочной жидкости добавляли Ulp1, полученную, как описано в (Reverter D., Lima C.D. Methods Mol Biol. 2009; 497:225-239), до конечной концентрации 2 мкг/мл и инкубировали 1 час во льду. Эффективность гидролиза анализировали методом электрофореза в ДСН-ПААГ.
В результате проведенного анализа было установлено, что гибриды, содержащие усеченные формы SUMOΔ19 и SUMOΔ23, гидролизуются Ulp1 с той же эффективностью, что и гибрид с полноразмерным SUMO, тогда как предшественник с SUMOΔ40 вообще не подвергается ферментативному расщеплению (фиг. 1). Для дальнейшей работы была отобрана конструкция SUMOΔ23-IFNα2bc показанным нами максимально возможным укорачиванием SUMO Sac. cerevisiae.
SEQ ID NO: 1
SEQ ID NO: 2
SEQ ID NO: 3
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
Пример 2. Исследование влияния различных вспомогательных полипептидов на экспрессию и расщепление гибридного предшественника.
К отобранной в предыдущем примере конструкции, кодирующей SUMOΔ23-IFN α2b, присоединяли с 5′-конца нуклеотидные последовательности, кодирующие различные белки: тиоредоксин (TrxA), GST, GST + отрицательно заряженный пептид. Выбор именно этой группы «тагов» определялся поставленной задачей: упростить очистку продуктов и полностью исключить возможность загрязнения токсичными соединениями.
а) TrxA
Ген тиоредоксина E. coli tvxA (AAC40210.1) клонировали методом ПЦР, используя в качестве матрицы коммерческую плазмиду рЕТ32а. При дизайне 5` фланкирующего праймера Trx-Dir (SEQ ID NO: 7) к его 5`-концевой последовательности добавляли сайт рестриктазы NdeI, а при дизайне 3`-фланкирующего праймера Trx-Rev (SEQ ID NO: 8) - сайт рестриктазы EcoRI. Эти сайты были необходимы для последующего клонирования в плазмиду pGEMEX-1 (для плазмид серии рЕТ вместо NdeI используется сайт NcoI). Клонирование продукта ПЦР проводили аналогично описанному в Примере 1 по сайтам рестрикции NdeI и EcoRI. Полученную плазмиду pGEMEX-1/TrxA анализировали методом секвенирования ДНК в пределах вставки.
Для сборки итогового экспрессионного плазмидного вектора вводили сайт EcoRI перед последовательностью гена гибрида SUMOΔ23-IFNα2b с помощью метода ПЦР, используя в качестве матрицы плазмиду pGEMEX-1/SUMOΔ23-IFNA2B. В последовательности 5`-концевого праймера E-S24 (SEQ ID NO: 9) был предусмотрен сайт EcoRI, в качестве 3`-концевого праймера использовали HSeq (SEQ ID NO: 3). Продукт ПЦР клонировали в вектор pGEMEX-1/TrxA аналогично описанному в Примере 1 по сайтам рестрикции EcoRI и HindIII. Полученную плазмиду pGEMEX-1/TrxA-SUMOΔ23-IFNA2B анализировали методом секвенирования ДНК в пределах вставки.
б) GST
Ген глутатион-S-трансферазы из Schistosomajaponicum (GST) клонировали из коммерческого вектора pET28GST-LIC (GenBank: EF456739.1) методом ПЦР с использованием праймеров: 5`-фланкирующего GST-Dir (SEQ ID NO: 10), содержащего сайт рестриказы NdeI, и 3`-фланкирующего праймера GST-Rev (SEQ ID NO: 11), содержащий сайт рестриктазы EcoRI. Продукт ПЦР клонировали в плазмиду pGEMEX-1 аналогично описанному в Примере 1 по сайтам рестрикции NdeI/EcoRI. Полученную плазмиду pGEMEX-1/GST анализировали методом секвенирования ДНК в пределах вставки и использовали для получения плазмиды pGEMEX-1/GST-SUMOΔ23-IFNA2B аналогично получению плазмиды pGEMEX-1/TrxA-SUMOΔ23-IFNA2B, описанному выше.
В) GSTc (-)пептидом (Linker)
Нуклеотидную последовательность, кодирующую отрицательно заряженный пептид, адаптировали в плазмиду pGEMEX-1/GST-SUMOΔ23-IFNA2B между генами GST и SUMOΔ23 аналогично получению плазмиды pGEMEX-1/GST-SUMOΔ23-IFNA2B, где в качестве 3`-фланкирующего линкера использовали синтетический олигонуклеотид с SEQ ID NO: 12. В результате была получена плазмида, которую обозначили pGEMEX-1/GLSΔ23-IFNA2B.
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 9
SEQ ID NO: 10
SEQ ID NO: 11
SEQ ID NO: 12
Linker:
г) Экспрессионный анализ и анализ гидролиза гибридных белков Ulp1.
Полученными экспрессионными векторами трансформировали клетки E. coli штамма BL21(DE3), высевали на селекционную агаризованную среду YT, содержащую ампициллин. Выросшими бактериальными колониями инокулировали жидкую среду TB5052, содержащую ампициллин, и культивировали 16 часов при 37°C либо 48 часов при 15°C. Затем бактерии собирали центрифугированием, декантировали надосадочную жидкость и осадок замораживали при -20°C.
Для анализа эффективности гидролиза гибридных белков гидролазой Ulp1 клетки размораживали и разрушали ультразвуком с периодическим охлаждением во льду в буфере, содержащем 50 мМ Трис, 150 мМ NaCl, 2 мМ EDTA, 0.1 мМ PMSF, pH 9.0. Клеточный дебрис удаляют центрифугированием при 13000 об/мин 10 мин. К надосадочной жидкости добавляли ULP1 до конечной концентрации 2 мкг/мл и инкубировали 1 час во льду. Эффективность гидролиза анализировали методом электрофореза в ДСН-ПААГ. Данные представлены в таблице 1.
Полученные результаты свидетельствуют о том, что во всех исследованных вариантах предшественника, содержащих в своей структуре различные «таги», наблюдается нормальный процесс гидролиза Ulp1. Вместе с тем, следует отметить, что наличие в составе гибридного белка GST (см. две последние строки в таблице) положительно влияет на рост колоний, соответственно, общий выход гибридного белка.
Пример 3. Получение и испытание ДНК-конструкций предлагаемого типа для различных целевых белков.
Помимо интерферона человека в качестве целевых белков в предлагаемых белках-предшественниках использовали интерферон собаки и прокарбоксипептидазу Б человека.
а) Интерферон собаки (caIFN)
Ген гибридного белка SUMOΔ23-caIFN, состоящий из усеченного гена SUMOΔ23 (Пример 2) и гена интерферона собаки альфа 1 (ABF68838.1), был собран при помощи метода ПЦР из синтетических олигонуклеотидов на основе известной аминокислотной последовательности. При дизайне последовательности руководствовались информацией о частоте встречаемости кодонов в сильно экспрессирующихся генах Eshcherichiacoli. Фланкирующие праймеры 5`-E-S24 (SEQ ID NO: 9) и Са-Rev (SEQ ID NO: 13) содержали сайты рестриктаз EcoRI и HindIII, соответственно. Эти сайты были необходимы для получения экспрессионной конструкции pGEMEX-1/GLSΔ23-caINF. Сборка конструкции велась аналогично сборке вектора pGEMEX-1/GLSΔ23-IFNA2B (конструкции отличаются только тем, что вместо гена интерферона альфа-2b человека в конструкцию включен ген интеферона альфа 1 собаки).
б) Прокарбоксипептидаза (proCPB)
Ген прокарбоксипептидазы Б человека (NP_001862.2) был собран при помощи метода ПЦР и адаптирован в плазмидный вектор pGEMEX-1/GLSΔ23-proCPB аналогично предыдущим примерам с использованием 3`-фланкирующего праймера CPB-Rev (SEQ ID NO: 14).
SEQ ID NO: 13
SEQ ID NO: 14
в) Конструкциями трансформировали клетки E. coli BL21(DE3), культивирование рекомбинантных штаммов проводили при 37°C с получением предшественника в нерастворимой форме, последующим растворением тел включения, рефолдингом гибридного белка и гидролизом его Ulp1 (более подробно все указанные процессы описаны в примере 5).
Полученные данные позволили заключить, что созданный нами гибридный белок-партнер GLSΔ23 позволяет легко растворять «тельца включения», успешно чистить их на аниообменной смоле (Фиг. 2) и отделять его от целевого белка (Фиг. 3). При этом SUMOΔ23 эффективно расщеплялся протеазой Ulp1 во всех трех случаях, т.е. выполнял функцию сайта расщепления в составе гибридного предшественника различных интересующих белков.
Пример 4. Получение рекомбинантного штамма-продуцента ИФН альфa2b человека.
Рекомбинантный штамм, продуцирующий человеческий ИФН альфа2b, был получен на основе описанной в примере 3 первичной культуры клеток E. coli BL21(DE3), трансформированных плазмидой pGLSΔ23-IFNA2B, после 3-х кратного пересева.
Полученный рекомбинантный штамм E. coli BL21(DE3)/pGLSΔ23-IFNA2B характеризовался следующими признаками:
- при микроскопии клетки прямые, палочковидной формы, грамотрицательные, неспороносные;
- при росте на питательном агаре колонии гладкие, круглые, блестящие, серые, края колоний ровные, диаметр 1-2 мм;
- культура хорошо растет на обычно используемых питательных средах, при росте в жидких средах YT, LB культура имеет вид однородной суспензии;
- устойчив к антибиотику ампициллину в концентрации 100 мкг/мл.
Пример 5. Получение немодифицированного ИФН альфa2b человека с использованием рекомбинантного штамма E.coli BL21(DE3)/pGLSΔ23-IFNA2B
а) Культивирование.
Культивирование штамма-продуцента гибридного предшественника интерферона человека альфa2b осуществляли на лабораторном ферментере с рабочим объемом 3 л в сред