Функциональные растворимые гетеродимеры мнс ii класса со стабилизирующей дисульфидной связью
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению рекомбинантных молекул МНС II класса, и может быть использовано в медицине. Рекомбинантная молекула МНС II класса включает: (i) весь или часть внеклеточного участка α-цепи МНС II класса; (ii) весь или часть внеклеточного участка β-цепи МНС II класса; при этом (i) и (ii) обеспечивают функциональный пептид-связующий домен и при этом (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса и полученная рекомбинантная молекула не включает мотив лейциновой молнии. Изобретение позволяет получить рекомбинантные молекулы МНС II класса, стабилизированные дисульфидной связью. 11 н. и 21 з.п. ф-лы, 10 ил., 3 табл., 1 пр.
Реферат
Данное изобретение описывает рекомбинантные молекулы МНС II класса, стабилизированные дисульфидной связью.
Молекула главного комплекса гистосовместимости (МНС) представляет собой центральный компонент иммунной системы позвоночных, находящийся на поверхности всех ядросодержащих клеток. МНС находится в двух основных формах, а именно МНС I и II класса. Важно, что обе версии образуют функциональные комплексы с подвергнутыми протеолизу пептидами, обозначаемыми Т-клеточными антигенными детерминантами, которые располагаются в той же самой клетке, которая экспрессирует указанный МНС. Полученный комплекс пептид/МНС (рМНС) впоследствии располагается в виде трансмембранного комплекса на поверхности клетки - данное явление описано в качестве антиген-презентации. рМНС, находящийся на клеточной поверхности, затем может взаимодействовать со своим когнатным партнером - рецептором T-клетки (TCR), находящемся на поверхности T-лимфоцитов.
Учитывая ключевую роль в адаптивном иммунитете, естественные и прикладные науки по существу заинтересованы в понимании взаимодействия pMHC-TCR на клеточном и молекулярном уровнях и, следовательно, в получении рекомбинантных версий обеих молекул. Кроме того, растет понимание того, что наличие таких рекомбинантных молекул очень важно для изучения и понятия биологии системы, а также для разработки новых терапевтических и диагностических препаратов.
Большое количество медицинских состояний требуют терапевтического вмешательства для модуляции активности иммунной системы пациента. Например, необходимо супрессировать аутоиммунные заболевания и аллергии, гиперактивное состояние иммунной системы и хроническое воспаление. В отличие от этого, иммуностимуляция является способом, подходящим для инфекций и рака, для активации и поражения иммунных клеток относительно раковых клеток. Кроме того, реципиенты трансплантатов обычно нуждаются в иммуносупрессии. Вместе все эти факты ведут к разработке большого количества иммуномодуляторов в промышленности, что оценивается в несколько миллиардов долларов.
Ключ к пониманию иммунного компонента при таких заболеваниях и отбор новых видов лечения состоит во взаимодействии между антиген-презентирующими клетками и T-клетками, или, более специфически, взаимодействии между молекулами МНС I и II класса и TCR. МНС II класса специфически связывается с экзогенными пептидами и представляет их для CD4+ T-хелперов (TH-клеток). Затем TH-клетка активируется и превращается в эффекторную клетку, которая секретирует различные цитокины. Такие цитокины активируют целый ряд других иммунных клеток, задействованных в защите от возникшей угрозы. Нарушение в данной системе может привести, например, к аутоиммунному заболеванию или выживаемости и делению раковых клеток. Таким образом, аутоиммунные заболевания характеризуются сильной взаимосвязью между МНС и инфильтрацией органа-мишени T-клетками.
Платформа для скрининга иммуномодулятора требует наличия стабильных, полностью функциональных и растворимых молекул МНС II класса. Важным является и то, что выработка растворимых молекул МНС II класса в настоящее время затруднена сложной проблемой, а именно, отсутствием молекулярной стабильности.
За последние несколько лет возможность получения растворимых молекул МНС I класса в виде тетрамеров (способ тетрамеров) стала революционной для основной и прикладной иммунологии (Constantin et al., 2002, Biological Research for Nursing, 4: 115-127). Причиной этому стал тот факт, что способ тетрамеров по существу повысил возможность отслеживать путь иммунного ответа специфическим образом относительно антигена и T-клеточного ответа, что оценивается, преимущественно, проточной цитометрией. Такая возможность также позволила более глубже понять иммунную систему и также может привести к возникновению новых диагностических инструментов.
В настоящее время тетрамерные реагенты в большой степени ограничены молекулами МНС I класса, так как должно было быть решено много технических вопросов, связанных с рекомбинантным получением молекул I класса. И в самом деле, относительно молекул МНС II класса, эта задача оказалась на деле значительно сложнее. Таким образом, в настоящее время не существует общего протокола получения тетрамеров МНС II класса, однако в литературе описаны отдельные примеры, представленные также в качестве имеющихся на рынке реагентов (Vollers, S. and Stem, L., 2008, Immunology 123: 305-313). В нескольких случаях, когда использовали тетрамеры МНС II класса, такие тетрамеры использовали в больших количествах, что оказало большое влияние на понимание развития болезни. Таким образом, принимая во внимание доказанное успешное влияние полученных рекомбинантных молекул МНС I класса, можно судить о наличии сильной и четкой мотивации со стороны науки и коммерческих предприятий, направленной на усилия по разработке новых молекул МНС II класса. Однако, учитывая имеющиеся на сегодняшний день проблемы, успех не гарантирован.
По причине частично не известных факторов, молекулу МНС II класса особенно трудно получить в виде устойчивой рекомбинантной молекулы в растворимой форме. Нативная молекула представлена в виде нековалентного трансмембранного гетеродимера, включающего α- и β-цепь, обе из которых имеют трансмембранные участки и принадлежат к суперсемейству иммуноглобулинов (Ig). Внеклеточный участок каждой цепи состоит из двух доменов, каждый включает примерно 90 аминокислотных остатков, при этом два дистальных мембранных домена, α1 и β1 домены, образуют решетчатую α/β структуру, играющую важную роль в связывании пептида с антигенными детерминантами T-клеток. Два проксимальных мембранных домена α2 и β2 образуют дискретные домены Ig. В α и β цепях участок из примерно 20 аминокислотных остатков соединяется с клеточной мембраной, а на цитоплазматической стороне мембраны располагается достаточно короткий пептидный сегмент.
Считается, что димеризация α и β цепей вызвана (i) трансмембранными сегментами, (ii) пептидным связыванием и (iii) обязательными вспомогательными компонентами, находящимися в мембране. Таким образом, после разделения от нативного содержания и получения в виде растворимой молекулы, молекула МНС II класса характеризуется присущей ей низкой устойчивостью и очень низкими уровнями выработки. Кроме того, должна соблюдаться обширная и материалоемкая, зависящая от отдельного случая оптимизация.
Кроме того, принимая во внимание указанные выше требования для димеризации, общие способы получения молекул МНС II класса представлены любым неестественным образом, т.е. любым способом, который отличается от получения с использованием мембраны клетки, которая естественным образом экспрессирует молекулы МНС II класса, например получения в качестве нерастворимых молекул, находящихся на поверхности других биологических молекул, клеток или частиц, например в виде нерастворимых молекул, экспрессируемых на поверхности фага путем слияния с белками капсида вируса, и считаются далеко не простыми.
Таким образом, на данный момент не существует какой-либо общей стратегии, позволяющей получить стабилизированный гетеродимер МНС II класса. Однако был проведен целый ряд исследований, которые представляют специфические для отдельных случаев успешные примеры и демонстрирующие сложность поставленной задачи. Такие примеры представлены (i) эктопической экспрессией связанного с мембраной гетеродимера МНС II класса на поверхности эукариотических клеток с использованием липидного линкера (якоря ГФИ), см. Wettstein et al., 1991, J. of Exp. Medicine, 174: 219-228; (ii) экспрессией экто доменов МНС II класса в клетках насекомых, см. Wallny et al., 1995, Eur. J. Immunology, 25: 1262-1266; (iii) введением гетерологичных мотивов димеризации, таких как лейциновых молний, C-терминально в молекулы МНС II класса в комбинации с получением клеток насекомых, см. Quarsten et al., 2001, J. Immunol., 167: 4861-4868, and Crawford et al., 2006, Immunological Reviews, 210: 156-170; (iv) получением химерных молекул антитело/МНС II класса в комбинации с получением клеток насекомых, см. Casares et al., 1997, Protein Engineering, 10: 1295-1301; (v) использованием систем бактериальной экспрессии, которые позволяют образовывать функциональные тримеры рМНС посредством повторного скручивания с использованием включенных молекул, см. Arimilli et al., 1995, J. Biol. Chem., 270:971-977; или (vi) использованием усеченной одноцепочечной версии МНС II класса бактериального происхождения, которая состоит только из доменов α1 и β1, которые обеспечивают образование функциональных молекул МНС посредством способов повторного скручивания и молекул включения, см. Burrows et al., 1999, Protein Engineering, 12: 771-778. Кроме того, Landais et al., 2009, J. Immunol., 183:7949-7957 описали систему экспрессии клетки насекомых, которая использует внутренние искусственные дисульфидные мостики в сочетании с экзогенными лейциновыми молниями для получения стабилизированных мышиных тетрамеров I-Ad OVA МНС II класса. Важным является тот факт, что, несмотря на повышенные уровни экспрессии, вызванные модификацией, ни одна из таких молекул с очевидно повышенной стабильностью не характеризовалась специфическим окрашиванием, свойственным T-клеткам.
Описанные здесь стратегии предоставляют существенные преимущества над используемыми ранее в науке системами, поскольку они не только обеспечивают общую стратегию, которая может быть применена ко всем молекулам МНС II класса, но также использоваться в системах экспрессии прокариотов, и не требует использования гетерологичных/экзогенных мотивов димеризации, таких как лейциновые молнии. Кроме того, описанные здесь стратегии используют для повышения функциональности, такой как свойственное для T-клеток окрашивание, что непосредственно характерно для введенных модификаций.
Удивительным является тот факт, что исследователи по изобретению идентифицировали общий способ, с использованием которого могут быть преодолены проблемы с нестабильностью, связанные с рекомбинантными молекулами МНС II класса, или уменьшены в большей степени. Такая стратегия включает получение рекомбинантных молекул МНС II класса, в которых присутствуют внеклеточные участки α и β цепей, а гетеродимер α и β цепей стабилизирован введенной рекомбинантным образом/искусственной дисульфидной связью, соединяющей две цепи с использованием доменного взаимодействия α2-β2. Дисульфидная связь блокирует молекулу в устойчивой конформации, в которой она полностью функциональна. Важным и преимущественным является тот факт, что данная стратегия для стабилизации гетеродимера МНС II класса изменчива и не ограничивается одним форматом рекомбинации, что позволяет избежать необходимости экстенсивной и материалоемкой, зависящей от случая оптимизации, описанной выше. Кроме того, в отличие от ряда существующих способов, данная стратегия может использоваться в системах экспрессии прокариотов/хозяевах-прокариотах, что само по себе удивительно, принимая во внимание тот факт, что в прокариотических клетках-хозяевах отсутствует сложный комплекс эукариотической клетки, что обычно требует правильного образования дисульфидной связи и, следовательно, образования функциональных молекул. Данное изобретение не только позволяет решить существующую в настоящее время проблему, мешающую проводить изучение и разработку иммуномодуляторов, но также может оказаться важным инструментом для разработки и модификации T-клеток и использования их в качестве способа терапии.
Таким образом, в одном аспекте данное изобретение описывает рекомбинантную молекулу МНС II класса, которая включает:
(i) весь или часть внеклеточного участка α-цепи МНС II класса;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса;
при этом (i) и (ii) обеспечивают функциональный пептид-связующий домен, и (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса.
Как уже было указано выше, получение таких белков как молекулы МНС II класса, которые состоят из более чем одного полипептида и которые имеют трансмембранный домен, может быть затруднено без использования их нативных мембран, и особенно их растворимых форм, потому что во многих случаях белок стабилизируется, помимо всего прочего, собственным трансмембранным участком и, возможно, вспомогательными компонентами мембраны. Это характерно для молекул МНС II класса и отражено в литературе, где молекулы МНС II класса описаны как нестабильные, без возможности получения их с хорошим выходом, или неспособные распознавать и связывать пептиды. Таким образом, молекулы по данному изобретению представляют собой огромное преимущество в сравнении с известными ранее в науке, так как они являются стабильными и также могут распознавать и связывать пептиды, а также обеспечивать окрашивание T-клеток.
Как это было указано выше, нативные молекулы МНС II класса включают α- и β-цепь, обе из которых имеют трансмембранные участки и принадлежат к суперсемейству иммуноглобулинов (Ig). Внеклеточный участок каждой цепи состоит из двух доменов, каждый включает примерно 90 аминокислотных остатков, при этом два дистальных мембранных домена, α1 и β1 домены, образуют решетчатую α/β структуру, играющую важную роль в связывании пептида с антигенными детерминантами T-клеток. Два проксимальных мембранных домена α2 и β2 образуют дискретные домены Ig. В обеих α- и β-цепях участок из примерно 20 аминокислотных остатков соединяется с клеточной мембраной, а на цитоплазматической стороне мембраны располагается достаточно короткий пептидный сегмент.
Молекулы по данному изобретению включают весь или участок внеклеточного домена α-цепи МНС II класса или весь или участок внеклеточного домена β-цепи МНС II класса. Внеклеточный участок α-цепи МНС II класса включает сигнальную последовательность, мембранный дистальный домен α1 и мембранный проксимальный домен α2 (который образует дискретный домен Ig). Между трансмембранным доменом и доменом α2 существует также спейсерный фрагмент. Подобным образом, внеклеточный участок β-цепи МНС II класса включает сигнальную последовательность, мембранный дистальный домен β1 и мембранный проксимальный домен β2 (который образует дискретный домен Ig), а также спейсерный участок.
Таким образом, в контексте данного изобретения термин «внеклеточный участок α-цепи МНС II класса» не включает трансмембранный домен или цитоплазматический домен α-цепи. В самом деле, в преимущественных вариантах воплощения изобретения рекомбинантные молекулы МНС II класса не включают любые аминокислотные остатки указанного трансмембранного домена (т.е. аминокислоты, кодируемые указанными трансмембранными экзонами) или любые аминокислотные остатки указанных цитоплазматических доменов.
Подобным образом, в контексте данного изобретения термин «внеклеточный участок β-цепи МНС II класса» не включает трансмембранный домен или цитоплазматический домен β-цепи. В самом деле, в преимущественных вариантах воплощения изобретения рекомбинантные молекулы MHC II класса не включают любые аминокислотные остатки указанного трансмембранного домена (т.е. аминокислоты, кодируемые указанными трансмембранными экзонами) или любые аминокислотные остатки указанных цитоплазматических доменов.
Все указанные внеклеточные участки α- и/или β-цепи могут присутствовать в рекомбинантных молекулах по изобретению (т.е. сигнальный пептид, домен α1/β1, домен α2/β2 и спейсерный участок). Кроме того однако, в молекулах по изобретению необходимо присутствие только одной части внеклеточного участка α- и/или β-цепи, при условии, что рекомбинантные молекулы остаются функциональными относительно своей способности связываться с соответствующим пептидом, например, эффекторным пептидом T-клеток, и при условии, что указанные молекулы включают искусственные (не нативные) остатки цистеина в такой форме или конфигурации, что они могут использоваться для образования дисульфидной связи, необходимой для стабилизации рекомбинантной молекулы МНС II класса.
Сигнальный пептид может и не содержать α и/или β цепей рекомбинантных молекул МНС по изобретению, в частности молекула МНС II класса экспрессируется в клетках прокариотов. Такие структуры, в которых отсутствует соответствующее количество N-терминальных аминокислотных остатков, могут легко быть построены и получены специалистом в данной области. Они могут быть протестированы на предмет того, влияют ли такие пропуски на функцию, например, способность связываться с белком или активировать или окрашивать T-клетки, или стабильность молекулы.
Спейсерный участок также может отсутствовать полностью или быть усечен, например, как это показано в экспериментальных Примерах, в которых отсутствует спейсер α-цепи и 9 аминокислот спейсера β-цепи. Опять-таки, такие структуры, в которых отсутствует соответствующее количество аминокислотных остатков спейсера, могут быть легко построены и получены специалистом в данной области. Они также могут быть протестированы на предмет того, если такие пропуски влияют на функцию, например способность связываться с белком или активировать или окрашивать T-клетки, или стабильность молекулы.
Преимущественные молекулы по изобретению включают, по меньшей мере, часть домена α1 и, по меньшей мере, часть домена β1, при условии, что функция таких доменов, а именно связывание с белками или другие описанные здесь функции, например, представление таких белков для T-клеточных рецепторов (TCRs), не затронута. Кроме того, рекомбинантная молекула МНС II класса в целом должна оставаться функциональной в плане способности связываться с белками или других описанных здесь функций, например, представлять такие белки для T-клеточных рецепторов (TCRs). Преимущественно, присутствуют полные или целые домены α1 и/или β1, или по существу полные или целые домены α1 и/или β1, при этом указанные по существу полные или целые домены включают вариации из нативной последовательности, например вставки аминокислот, делеции или замены, которые не влияют на функцию таких доменов связываться с белками или другие функции, описанные в тексте данной заявки, например представлять такие белки для T-клеточных рецепторов (TCRs). Определение того, какие аминокислотные остатки могут быть мутированы, модифицированы или удалены без изменения такой функции, должно быть очевидно для специалиста в данной области. Другие преимущественные функции, которые свойственные для молекул МНС II класса, включают способность активировать T-клетки и, более преимущественно, способность окрашивать T-клетки.
Таким образом, такие преимущественные молекулы по изобретению включают достаточное количество остатков доменов α1 и β1 для способности связывать белки, например для представления таких белков для TCRs, для активации T-клеток или для обеспечения окрашивания T-клеток.
Другие преимущественные молекулы по изобретению включают, по меньшей мере, часть домена α2 и, по меньшей мере, часть домена β2 при условии, что присутствуют ненативные остатки цистеина, используемые для образования дисульфидной связи. Такие остатки цистеина необходимы в соответствующих ориентациях и на соответствующих расстояниях друг от друга, таким образом, между остатками цистеина может образоваться дисульфидный мостик, действуя для стабилизации рекомбинантной молекулы МНС II класса. Кроме того, рекомбинантная молекула МНС II класса в целом должна оставаться функциональной в плане способности связываться с белками или других описанных здесь функций, например представлять такие белки для T-клеточных рецепторов (TCRs). Преимущественно, присутствуют полные или целые домены α2 и/или β2, или по существу полные или целые домены α2 и/или β2, при этом указанные по существу полные или целые домены включат вариации из нативной последовательности, например, вставки аминокислот, делеции или замены, которые не влияют на образование дисульфидного мостика между доменами α2 и β2 и последующую стабилизацию рекомбинантной молекулы МНС II класса, и не влияют губительным образом на скручивание доменов α2 или β2. Определение того, какие аминокислотные остатки могут быть мутированы, модифицированы или удалены без изменения такой функции, должно быть очевидно для специалиста в данной области.
Расположение аминокислот различных структурных и функциональных доменов и участков α и β цепей МНС II класса широко известно и описано в науке, например, в Burrows et al, 1999 (см. выше). Расположение различных доменов также показано на Фигуре 3, и такая информация может быть легко использована для построения рекомбинантных молекул по изобретению, как это описано в тексте данной заявки (см. например Фигуру 7).
Соответствующие функциональные тесты для оценки способности рекомбинантных молекул по изобретению связываться с пептидом, активировать T-клетку или окрашивать T-клетки, также должны быть хорошо известны специалисту в данной области и должны включать, например, способы поверхностного плазменного резонанса (SPR), такие как Biacore, и способы проточной цитометрии, такие как FACS. Использование проточной цитометрии особенно преимущественно, так как она может использоваться в комбинации с живыми клетками.
В контексте данного изобретения термин «дисульфидная связь» описывает любой дисульфидный мостик, например введенный рекомбинантным образом или искусственный дисульфидный мостик, который образован между остатками цистеина, расположенными на домене α2 α-цепи и домене β2 β-цепи гетеродимера МНС II класса (т.е. является междуцепочечным относительно внутрицепочечной дисульфидной связи). Такие дисульфидные связи образуют ковалентную связь между α-цепью и β-цепью и действуют для стабилизации гетеродимера МНС II класса. Таким образом, рекомбинантные молекулы по изобретению устойчивы, но сохраняют полную функциональность, например, у них сохранена их нативная специфичность относительно когнатных лиганд T-клеточных рецепторов, и, преимущественно, они сохраняют свою способность активировать T-клетки или окрашивать T-клетки.
Свойство молекулы МНС II класса по изобретению оставаться устойчивой или стабилизированной может быть оценено с использованием хорошо известных способов, таких как повышенная устойчивость к тепловой денатурации (измерено, например, ИФА, SPR или циркулярным дихроизмом). Более преимущественный тест представляет собой оценку гетеродимеров на геле SDS PAGE. Интактные и стабильные гетеродимеры с дисульфидной связью могут быть легко замечены на геле SDS PAGE в невосстанавливающих условиях, при этом визуализируется полоса при соответствующем молекулярном весе, свойственном интактному гетеродимеру. Соответствующий анализ представлен в Примерах, см. Фигуры 5 и 10.
Такие дисульфидные связи образовываются между остатками цистеина, которые отсутствуют обычно в нативных доменах α2 и β2 MHC II класса. Таким образом, такие остатки цистеинов введены рекомбинантно или искусственным образом, например, путем сайт-специфической мутации соответствующих остатков не являющихся цистеином в нативной молекуле в цистеиновые остатки, что обеспечивает образование дисульфидной связи между нововведенными остатками цистеина в доменах α2 и β2. Такие связи также могут быть описаны в виде внутренних дисульфидных связей.
Соответствующие остатки для мутации в цистеин преимущественно имеют соответствующие β-атомы углерода, расположенные на расстоянии примерно 6Å (0,6 нм), 7Å (0,7 нм) или менее, например, в диапазоне от 4Å (0,4 нм) или от 5Å (0,5 нм) до 6,5Å (0,65 нм) или 7Å (0,7 нм), преимущественно в диапазоне от 5Å (0,5 нм) до 6,5Å (0,65 нм), более преимущественно в диапазоне от 4Å (0,4 нм) или 5Å (0,5 нм) до 5,6Å (0,56 нм) или 6Å (0,6 нм) друг от друга в нативном гетеродимере МНС II класса. Преимущественные сайты для мутации неизменны между видами и между изоформами и изотипами в отдельных видах. В частности, преимущественные сайты для мутации неизменны в последовательностях МНС II класса мыши и человека или между изотипами МНС II класса человека, такими как DP, DQ и DR, или между изотипами мыши, такими как I-Е и I-A.
Кроме того, преимущественные сайты для мутации идентифицируют путем структурной оценки на основе 3D наложения кристаллических структур. В этом случае могут быть исследованы остатки, образующие взаимодействие между доменами α2 и β2, и для дальнейшего анализа или мутации в остатки цистеина могут быть выбраны боковые цепи с β-атомами углерода, расположенными на расстоянии 7Å или менее (или на любом другом расстоянии или диапазоне расстояний, указанном выше) друг от друга. Способы проведения такой структурной оценки должны быть знакомы специалисту в данной области. Например, кристаллические структуры молекул МНС II класса имеются в свободном доступе для такого анализа, например они могут быть получены из банка данных белков RCSB PDB. В науке также представлено соответствующее программное обеспечение или другие способы для проведения подобного 3D наложения кристаллических структур, например, представлено такое программное обеспечение, как PyMOL, MOLMOL, DeepView, и другие, предназначенное для использования на веб-сайтах, такое как iSuperpose.
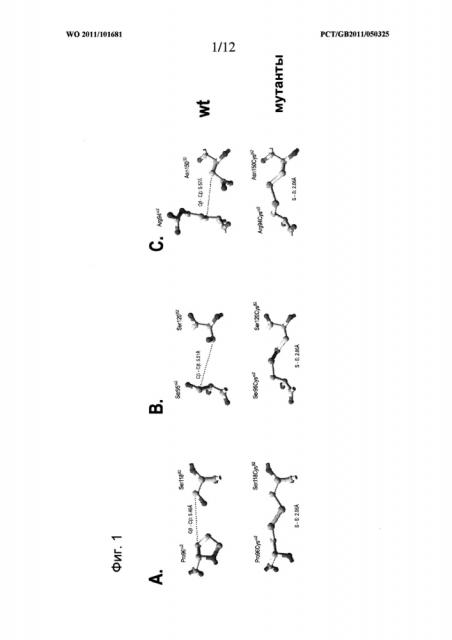
Для образования дисульфидной связи используют отдельные преимущественные пары сайтов, в которые вводят цистеин, представленные одной или несколькими следующими парами, т.е. одной или несколькими парами Pro 96α2-Ser 119β2 (положение 1), Ser 95α2-Ser 121β2 (положение 2), Arg 94α2- Asn 151β2 (положение 3), Phe 148α2-Gly 152β2 (положение 4), Pro 96α2-Thr 101β2 (положение 5), Pro 96α2-Ser 121β2 (положение 6), Ile 106α2-Asn 151β2 (положение 7) и Ser 95α2-Asp 122β2 (положение 8). Пары пронумерованы в соответствии с близостью β-атомов углерода и при использовании любой из таких пар преимущественно используют пары в положениях от 1 до 4 или от 1 до 3. В частности, преимущественно использование пары в положении 1 или положении 2.
Расположение аминокислот и природа аминокислоты в данном положении в парах остатков, расположенных в доменах α2 и β2 и описанных выше, соответствует мышиному изотипу I-Е молекул МНС II класса. Нумерация аминокислот относится к аминокислотам зрелого пептида (т.е. нумерация исключает сигнальный пептид). Типичная эталонная последовательность, которая может использоваться для идентификации расположения модифицированных остатков аминокислот, представлена последовательностью I-Е, указанной в базе данных IMGT и на Фигуре 3 (указана как Н-2ЕА*02 для α-цепи (SEQ ID NO: 1) и Н-2ЕВ*01 для β-цепи (SEQ ID NO: 2)). Действительно, остатки в положении 1, положении 2 и положении 3 промаркированы черной штриховкой на Фигуре 3, а положения других остатков могут быть легко определены на Фигуре 3.
Таким образом, если иное не определено, нумерация и зрелые аминокислотные остатки МНС II класса, описанные в тексте данной заявки, указаны в соответствии с системой IMGT, описанной в Lefranc, М-Р., et al., 2009 (Nuc. Acids Res., 37: D1006-D1012, издание базы данных), вместе с базами данных IMGT, указаны на следующих веб-сайтах: http://imgt.cines.fr; http://www.imgt.org. Соответствующие регистрационные номера GenBank также указаны в Примерах. Например, регистрационные номера для Н-2Е (мышиный I-Е) представлены К00971 (α-цепь) и AF050157 (β-цепь).
В преимущественных вариантах воплощения изобретения дисульфидная связь располагается между остатками цистеина, расположенными на остатках, соответствующих Pro 96α2-Ser 119β2 (положение 1), Ser 95α2-Ser 121β2 (положение 2) или Arg 94α2-Asn 151β2 (положение 3) зрелых полипептидов мышиного изотипа I-Е или эквивалентным положениям в альтернативном изотипе МНС II класса. Эталонные последовательности для определения расположения таких остатков цистеина описаны в тексте данной заявки.
Указанные выше преимущественные пары сайтов также представлены в Таблице 2 с использованием нумерации 1FNG, т.е. одной или несколькими парами Pro 96α2-Ser 118β2 (положение 1), Ser 95α2-Ser 120β2 (положение 2), Arg 94α2-Asn 150β2 (положение 3), Phe 148α2-Gly 151β2 (положение 4), Pro 96α2-Thr 100β2 (положение 5), Pro 96α2-Ser 120β2 (положение 6), Ile 106α2-Asn 150β2 (положение 7) и Ser 95α2-Asp 121β2 (положение 8), и нумерации IMGT. Для нумерации 1FNG порядковый номер аминокислоты в Таблице 2 соответствует нумерации в базе данных Protein Data Bank (PDB) с трехмерной структурной информацией о биологических макромолекулах, номеру записи PDB ID: 1FNG, и можно увидеть, что расположение соответствующих остатков β-цепи в записи в такой базе данных на одну аминокислоту меньше, чем эквивалентные остатки в последовательности базы данных IMGT. Таким образом, данная номенклатура немного отличается.
Эквивалентные остатки, представленные в Таблице 2 и на Фигуре 3, могут быть легко идентифицированы в других мышиных изотипах, например, изотипах I-A, или изотипах человека, например путем выравнивания с использованием программного обеспечения, такого как Clustal. Выравнивание с мышиным изотипом I-A представлено на Фигуре 3. Кроме того, типичные сопоставления с аллотипами человека HLA-DP, -DQ и -DR молекул МНС II класса представлены на Фигуре 7. Расположение эквивалентных остатков в положениях 1, 2 и 3 представлено в Таблице 2 и на Фигуре 3 и промаркировано черной штриховкой на Фигуре 7A для α-цепи и Фигуре 7B для β-цепи, а положения других остатков могут быть легко определены на Фигуре 7. Также видно, что положения α2 и β2 в Таблице 2 и на Фигуре 3 полностью сохранены во всем репертуаре HLA человека.
Таким образом, выравнивание последовательностей, представленное на Фигуре 7, вместе с представленной выше информацией может использоваться для поиска соответствующих остатков для мутации в цистеин в доменах α2 и β2 в любом аллеле МНС человека II класса для образования дисульфидной связи в требуемом месте. Подобные способы выравнивания могут использоваться для идентификации эквивалентных остатков в любом другом виде или изотипе.
Стабилизирующие дисульфидные связи, как это описано в тексте данной заявки, соответствуют другим способам и средствам стабилизации молекул МНС II класса, таким как описанные ранее способы и средства в науке. Например, дисульфидные связи могут использоваться в сочетании с различными мотивами димеризации, такие как мотивы лещиновых молний (например, как это описано в Quarsten et al., 2001 and Crawford et al., 2006, см. выше), или в сочетании со слияниями Ig (т.е. слияниями с участком Fc иммуноглобулина, например, как это описано в Casares et al., 1997, см. выше) и молекулами по изобретению вместе с векторами, кодирующими их, с разработкой соответствующим образом.
Как это указано в любом тексте данной заявки, экспрессия или выработка молекул по изобретению в прокариотических, например бактериальных, хозяевах преимущественны и в таких вариантах воплощения изобретения, в частности, в вариантах воплощения, в которых молекулы изолированы от включенных тел, преимущественно, чтобы, мотивы лейциновых молний или других мотивов димеризации не использовались.
Таким образом, преимущественный аспект изобретения описывает рекомбинантную молекулу МНС II класса, способную экспрессироваться в бактериальном хозяине и включающую:
(i) весь или часть внеклеточного участка α-цепи МНС II класса;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса;
при этом (i) и (ii) обеспечивают функциональный пептид-связующий домен, и (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса.
Другой преимущественный аспект описывает рекомбинантную молекулу МНС II класса, которая включает:
(i) весь или часть внеклеточного участка α-цепи МНС II класса;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса;
при этом (i) и (ii) обеспечивают функциональный пептид-связующий домен, и (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса, и, кроме того, указанная рекомбинантная молекула не включает мотив лейциновой молнии. В других вариантах воплощения изобретения не включен мотив димеризации. В таких вариантах воплощения изобретения преимущественно, чтобы рекомбинантная молекула МНС II класса способна была экспрессироваться в прокариотическом, например, бактериальном, хозяине.
Несмотря на то, что дисульфидные связи по изобретению могут использоваться в сочетании с другими способами и средствами стабилизации молекул МНС II класса, указанные дисульфидные связи могут обеспечивать единственный способ стабилизации молекул МНС II класса. В самом деле, такие варианты воплощения изобретения являются преимущественными. В контексте данного изобретения термин «единственный способ стабилизации молекул МНС II класса» обозначает дисульфидные связи, обеспечивающие единственный или один способ стабилизации молекул в сравнении с любой стабилизацией, которая существует в природе или свойственна отдельной молекуле МНС II класса, например, дисульфидные связи по изобретению обеспечивают единственный или полностью искусственный или введенный рекомбинантно или ненативный способ стабилизации молекулы МНС II класса. Таким образом, такие варианты воплощения изобретения исключают использование других способов стабилизации, описанных в науке, таких как лейциновых молний или других мотивов димеризации.
Удивительным является тот факт, что таких дисульфидных связей достаточно для стабилизации молекул МНС II класса без каких-либо дополнительных ненативных способов стабилизации, таких как мотив димеризации, который представлен в описанных здесь данных, при чем такие молекулы отображаются в стабильной и функциональной форме на поверхности нитевидного бактериофага. Такой результат был очень удивительным, принимая во внимание факт того, что рекомбинантные молекулы, построенные по топологии складчатости Ig, были экспрессированы в прокариотическом хозяине. Складчатость Ig, которая в природе возникает только в домене эукариотов, требует наличия сохраненного моста S-S в интрадомене, который должен быть образован между нативными остатками цистеина (Halaby, D.M., et al., 1999, Protein Eng., 12 (7): 563)) для получения соответствующей функциональной топологии. Следовательно общепринято, что если такая молекула экспрессируется в прокариотическом хозяине, что неизбежно ведет за собой отсутствие сложного механизма шаперонов эукариотической клетки, необходимого для правильного образования моста S-S, очевидным является аберрантное образование моста S-S, что приводит к отсутствию функциональной экспрессии. Нельзя сказать, что рекомбинантные стратегии, включающие повышенное количество цистеинов, приводят к образованию определенных искусственных мостов S-S в таких системах, и, следовательно, обычно считаются непригодными. Таким образом, мы предоставили четкое доказательство того, что это не так, поскольку функциональные молекулы отображены на фаге, как это показано образованием ковалентного димера (Фигуры 5 и 10) со специфическим связыванием с когнатным лигандом (Фигура 6 и Фигура 9).
В одном варианте воплощения изобретения α- и β-цепи молекул МНС II класса по изобретению также включают внутрицепочечные дисульфидные связи, например, встречающиеся в природе внутрицепочечные связи, которые существуют между встречающимися в природе остатками цистеина. Такие встречающиеся в природе внутрицепочечные дисульфидные связи могут существовать, например, в доменах α2 и β2 для образования топологии складчатости Ig таких доменов. Кроме того, большинство молекул МНС II класса несут внутридоменный дисульфидный мостик в домене β1, который соединяет нижнюю часть β-слоя с участком α-спирали. Более того, многие молекулы МНС II класса включают дополнительный несвязанный цистеин в нижней части β-слоя домена β1, который не участвует в образовании любого дисульфидного мостика, но который может образовывать неправильные дисульфидные связи с введенными ненативными остатками цистеина. Таким образом, в преимущественных вариантах воплощения изобретения, в частности, в вариантах воплощения изобретения, в которых используется прокариотическая экспрессия, такой остаток удален, например путем мутации в альтернативный остаток, который сохраняет