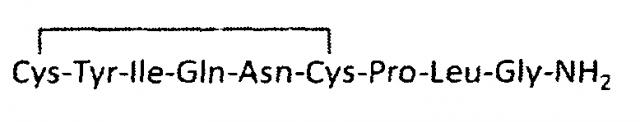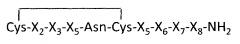Фармацевтическая композиция
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается фармацевтической композиции, содержащей окситоцин и по меньшей мере один неионный эфир целлюлозы, где указанным неионным эфиром целлюлозы является гидроксипропилметилцеллюлоза, и фармацевтическая композиция имеет рН в диапазоне от 3 до 4. Группа изобретений также касается применения по меньшей мере одного неионного эфира целлюлозы для улучшения стабильности фармацевтической композиции, содержащей окситоцин; способа лечения и/или предупреждения климактерического расстройства, включающего введение субъекту, нуждающемуся в этом, терапевтически эффективного количества указанной фармацевтической композиции. Группа изобретений обеспечивает улучшенную стабильность окситоциновых композиций, удобство хранения, в том числе при комнатной температуре, и сохранение биологической активности в течение длительного периода времени. 7 н. и 28 з.п. ф-лы, 1 пр., 4 табл.
Реферат
Область изобретения
Настоящее изобретение относится к фармацевтическим композициям на основе неионных эфиров целлюлозы, а более конкретно - к подобным фармацевтическим композициям, содержащим окситоцин и/или его фрагменты, и/или его варианты, как раскрывается в данном документе, причем указанные фармацевтические композиции обладают улучшенной стабильностью. Окситоцин является природным пептидом, который, как хорошо известно из уровня техники, имеет различные терапевтические применения, такие как лечение климактерических расстройств и связанных с ними различных форм рака, особенно предраковых состояний.
Предпосылки изобретения
Окситоцин был одним из первых выделенных и секвенированных пептидных гормонов. Он представляет собой нонапептид с двумя остатками цистеина, которые образуют дисульфидную связь между положениями 1 и 6, и соответствует формуле,
Окситоцин (SEQ ID NO:1).
В течение длительного времени единственными эффектами, приписываемыми окситоцину, были его стимулирующие воздействия на молокоотдачу и сокращения матки, но в последние десятилетия было показано, что окситоцин оказывает широкий спектр воздействий на центральную нервную систему, CNS. Предположительно окситоцин участвует в регуляции памяти и процесса обучения, а также различных типов поведения, таких как питание, локомоция, а также материнское и половое поведение. Также предполагают, что окситоцин участвует в регуляции сердечно-сосудистых функций, терморегуляции, болевого порога и водного баланса, а также в заживлении ран. Также есть подтверждения того, что окситоцин вовлечен в регуляцию различных иммунных процессов. Также было продемонстрировано, что после повторного применения инъекции окситоцина вызывают понижение артериального давления и увеличение привеса с длительными последствиями. В качестве основного стимулирующего вещества окситоцин играет важную роль во взаимодействии матери и потомства у млекопитающих. Его продукты также могут быть использованы для профилактики у детей, т.е. у уже новорожденных или маленьких детей, развития в более позднем возрасте заболеваний, причем заболевания связаны со стрессовыми условиями во время внутриутробного развития. Таким условиями могут быть заболевания сердца/сосудов, такие как удар, инфаркт миокарда, гипертензия и диабет. В организме человека окситоцин продуцируется в паравентрикулярном ядре, PVN, и надзрительном ядре, SON, гипоталамуса. Он отличается от вазопрессина только двумя аминокислотами, который также продуцируется в этих ядрах. Крупноклеточные окситоцинергические нейроны SON и PVN посылают аксоны на заднюю долю гипофиза, откуда окситоцин попадает в кровяное русло. Мелкоклеточные нейроны, берущие начало в PVN, образуют множество областей в пределах CNS. Клетки, продуцирующие окситоцин, иннервируются холинэргическими, катехоламинергическими, серотонинергическими, а также пептидергическими нейронами. Показано присутствие окситоцина в различных тканях помимо мозга, например в тканях матки, яичников, семенников, вилочковой железы, корковом веществе надпочечников и поджелудочной железе, и предположительно окситоцин оказывает в этих органах местные эффекты. Параллельная секреция окситоцина в областях головного мозга и в кровяном русле происходит в ответ на некоторые раздражители, такие как сосание, но другие раздражители могут вызывать автономную активацию окситоцинергических нейронов, оканчивающихся в мозге или гипофизе.
Эфиры целлюлозы названы так, поскольку они получены на основе целлюлозы, которая является возобновляемым веществом и наиболее распространенным химическим соединением в органической природе. На рынке имеется широкий спектр эфиров целлюлозы, как ионных, так и неионных, например, натрий-карбоксиметилцеллюлоза, гидроксиэтилэтилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксиэтилметилцеллюлоза и гидроксипропилметилцеллюлоза.
Эфиры целлюлозы применяют в качестве добавок в таких различных областях, как продукты питания, краски, регенерация масла, бумага, косметика, лекарственные препараты, адгезивы, печать, сельское хозяйство, керамика, ткани, моющие средства и строительные материалы. Эфиры целлюлозы повышают качество продукта в этих областях и выступают в роли загустителей, водоудерживающих средств, суспендирующих добавок, защитных коллоидов, пленкообразователей или термопластов в таких различных продуктах, как дисперсионные краски, буровые растворы, мороженое, оболочки таблеток, обойный клей и мастика для приклеивания керамической плитки.
Неионные эфиры целлюлозы, такие как метилцеллюлоза, гидроксипропилметилцеллюлоза (также известная как гипромеллоза) и метилгидроксиэтилцеллюлоза, широко используются в фармацевтической промышленности благодаря своей способности загущать, связывать и удерживать воду, а также эмульгировать и суспендировать частицы и образовывать пленки. Дополнительные сведения о неионных эфирах целлюлозы можно найти, например, в WO92/09307.
Пептидная структура окситоцина делает его уязвимым к деградации, и хорошо известным является тот факт, что фармацевтические композиции, содержащие окситоцин, следует хранить в прохладной среде (примерно при 4°С) во избежание значительной деградации и/или агрегации с последующей потерей биологической функции. Например, рекомендуется хранить Syntocinon® (Novartis), концентрированный водный раствор окситоцина для инъекций/инфузий, как правило, при температуре 2-8°С. Срок хранения этого продукта при 25°С уменьшается до 3 месяцев. Другим примером является назальный спрей Syntocinon®, который следует хранить при 2-8°С. Эти водные составы включают буферы, консерванты, кислоты, соль, сорастворители и другие водорастворимые добавки, но не содержат гелеобразующего средства.
Как было показано, предыдущие составы с окситоцином, содержащие ионное гелеобразующее средство натрий-карбоксиметилцеллюлозу (CMC), не обеспечивают подходящей среды для окситоцина. Это описано, например, в экспериментальном разделе данной заявки.
Соответственно, в свете проблем, связанных с известными фармацевтическими композициями, содержащими окситоцин, в данной области техники существует необходимость преодолеть или по меньшей мере смягчить недостатки этих составов, предоставив фармацевтические композиции, в которых улучшена стабильность окситоцина. Такие фармацевтические композиции будут обеспечивать удобное хранение, например, при комнатной температуре, а также будут сохранять свою биологическую активность в течение более длительного периода времени.
Краткое описание изобретения
Проблемы, сформулированные выше, теперь решаются настоящим изобретением, как объясняется далее в данном документе.
Соответственно, настоящее изобретение относится к новым фармацевтическим композициям, содержащим окситоцин и/или один или несколько его фрагментов и/или его вариантов, как описано в данном документе, а также его фармацевтически приемлемые соли и по меньшей мере один неионный эфир целлюлозы, как описано в данном документе, причем указанная фармацевтическая композиция имеет рН в диапазоне от приблизительно 3 до 4.
Неожиданно было показано, что нейтральный неионный эфир целлюлозы, такой как гидроксипропилметилцеллюлоза (НРМС), значительно улучшает стабильность окситоцина в фармацевтической композиции, тем самым обеспечивая фармацевтическую композицию, превосходную в фармацевтическом применении. Соответственно, настоящее изобретение относится к фармацевтическим композициям, содержащим окситоцин (SEQ ID NO:1) и/или один или несколько его фрагментов и/или его вариантов в соответствии с SEQ ID NO:2, или иное, как указано в данном документе, а также его фармацевтически приемлемые соли и по меньшей мере один неионный эфир целлюлозы, такой как гидроксипропилметилцеллюлоза (НРМС).
Данный стабилизирующий эффект неионного эфира целлюлозы также поддерживается низким рН указанной фармацевтической композиции, таким как в диапазоне от приблизительно 3 до 4 и от приблизительно 3 до 3,5. Это даст возможность хранить окситоцин при комнатной температуре в течение более длительного периода времени, чем было возможно ранее, если он находится в такой фармацевтической композиции. Благоприятная среда для пептида окситоцина в такой фармацевтической композиции также должна положительно влиять на его биологическую активность, таким образом, улучшая его терапевтический эффект, поскольку в данном составе присутствует больше биологически активного вещества в течение времени.
Следовательно, настоящее изобретение относится к фармацевтическим композициям, содержащим окситоцин (SEQ ID NO:1) и/или один или несколько его фрагментов и/или его вариантов согласно SEQ ID NO:2, а также его фармацевтически приемлемые соли и по меньшей мере один неионный эфир целлюлозы, такой как гидроксипропилметилцеллюлоза (НРМС), причем указанная фармацевтическая композиция имеет рН в диапазоне от приблизительно 3 до 4, например от приблизительно 3 до 3,5, либо иной, как проиллюстрировано в данном документе, при этом стабильность окситоцина и/или одного или нескольких его фрагментов и/или его вариантов была улучшена. Способность неионного эфира целлюлозы, такого как НРМС, стабилизировать окситоцин, ранее неизвестна и является весьма желательной, поскольку в данной области техники давно ощущается потребность предоставления фармацевтических композиций, содержащих окситоцин, которые не всегда требуют хранения в холодной среде и с которыми, таким образом, проще обращаться.
Настоящее изобретение также относится к медицинским применениям фармацевтических композиций, как описывается в данном документе, например при лечении атрофии влагалища. Следовательно, в других аспектах настоящее изобретение также относится к применению окситоцина и/или одного или нескольких его фрагментов и/или его вариантов и по меньшей мере одного неионного эфира целлюлозы, как описано в данном документе, при изготовлении лекарственного препарата, причем указанный лекарственный препарат имеет рН в диапазоне от приблизительно 3 до 4, для лечения климактерических нарушений, таких как атрофия влагалища. Кроме того, настоящее изобретение относится к способу получения указанной фармацевтической композиции, а также к способам лечения пациента фармацевтической композицией в соответствии с настоящим изобретением.
Подробное описание изобретения
Определения
Во всех случаях, когда в данном документе упоминаются "окситоцин", "пептид окситоцина" и/или "молекула окситоцина", данные выражения включают окситоцин (SEQ ID NO:1) и/или один или несколько его фрагментов и/или его вариантов, как определено в данном документе в соответствии с общей формулой SEQ ID NO:2, или любой другой его вариант и/или фрагмент, как упомянуто в данном документе, а также его аналоги и/или гомологи. В любом случае, когда упоминают фрагмент, вариант или гомолог молекулы/пептида окситоцина, должно подразумеваться, что такой вариант, фрагмент или гомолог проявляет биологическую активность, сравнимую с таковой у молекулы собственно окситоцина (SEQ ID NO:1). Например, можно показать, что вещество проявляет активность окситоцина, путем проведения испытаний, демонстрируя активность исследуемого вещества, например, путем применения двойного слепого рандомизированного протокола, как описано в WO 0178758 (пример 1).
Соответственно, "вариант" окситоцина, как упоминается в данном документе, относится к пептиду, в котором была изменена аминокислотная структура по сравнению с молекулой окситоцина, то есть некоторые положения аминокислот могли заменять путем введения в такие положения других аминокислот, таких как природные или синтетические аминокислоты, как проиллюстрировано в данном документе, либо молекула могла удлиняться путем присоединения одной или нескольких природных или искусственных аминокислот(ы) к обоим концам пептида. Кроме того, могут осуществляться и другие модификации упомянутых пептидов, например, синтетические модификации. Упомянутые "варианты" все же проявляют биологическую активность, аналогичную окситоцину, и указанный вариант также стабилизируется, входя в состав фармацевтической композиции в соответствии с настоящим изобретением.
Далее, "фрагмент" окситоцина, как упоминается в данном документе, представляет собой пептид, который содержит часть аминокислотной последовательности окситоцина, но в котором одна или более аминокислот могли удаляться с одного или обоих концов. Данное выражение также относится к фрагменту варианта окситоцина, как определено в SEQ ID NO:2, следовательно, в настоящее изобретение также включается любой фрагмент пептида, представленный в SEQ ID NO:2.
"Регулирующим рН средством" является любое средство, например, жидкое средство, такое как водная жидкость, способная регулировать и/или поддерживать рН указанной фармацевтической композиции, в которой указанный рН сохраняется приблизительно на выбранном уровне, проиллюстрированном в данном документе.
Таким регулирующим рН средством может быть, например, буфер, такой как цитратный, лактатный или фосфатный. "Буфер" является ионным соединением, обычно солью слабой кислоты или основания, добавляемым в раствор для предотвращения изменения его кислотности или основности и, таким образом, стабилизации его рН. Буферный раствор представляет собой раствор, содержащий такое соединение. Другими примерами регулирующих рН средств являются органические и неорганические кислоты и основания, такие как уксусная кислота, лимонная кислота, фосфорная кислота, соляная кислота и гидроксид натрия.
Известно, что окситоцин подвержен проблемам, связанным с деградацией и/или агрегацией, из-за чего предпочтительно хранить фармацевтические композиции, содержащие окситоцин, в прохладной среде во избежание потери их биологической активности. Неожиданно было показано, что возможно получение фармацевтических композиций, содержащих окситоцин и/или один или несколько его фрагментов и/или его вариантов, как проиллюстрировано в SEQ ID NO:1 и SEQ ID NO:2, с улучшенной стабильностью при использовании по меньшей мере одного неионного эфира целлюлозы в качестве фармацевтического носителя указанной молекулы окситоцина, в комбинации с низким рН. Соответственно, настоящее изобретение относится к фармацевтическим композициям, содержащим окситоцин (SEQ ID NO:1) и/или один или несколько его фрагментов и/или его вариантов в соответствии с SEQ ID NO:2, или иное, как определено в данном документе, а также его фармацевтически приемлемые соли и по меньшей мере один неионный эфир целлюлозы, такой как гидроксипропилметилцеллюлоза (НРМС).
Под улучшенной стабильностью указанной фармацевтической композиции подразумевается улучшенная стабильность биологического вещества, т.е. окситоцина и/или одного или нескольких его фрагментов и/или его вариантов, как определено в данном документе. Следовательно, биологическая активность и терапевтический эффект фармацевтической композиции, как представлено в данном документе, должны улучшаться, избегая чрезмерной деградации и/или агрегации либо другого структурного изменения вещества окситоцина.
Не привязываясь к какой-либо определенной теории, неионный эфир целлюлозы, являясь незаряженной молекулой, по-видимому, стабилизирует молекулу окситоцина, избегая ненужного взаимодействия с ней, то есть с упомянутой молекулой окситоцина. Кроме того, применение подходящего рН в диапазоне от приблизительно 3 до 4, в таком диапазоне как от приблизительно 3 до 3,5, дополнительно вносит свой вклад в стабилизирующее воздействие неионного эфира целлюлозы на окситоцин. Следовательно, снова не привязываясь к какой-либо определенной теории, низкий рН, по-видимому, не только стабилизирует собственно окситоцин, но и также является желательным для части неионного эфира целлюлозы композиции.
В комбинации это обеспечивает превосходную композицию для фармацевтического применения, в которой биологическая и/или терапевтическая активность окситоцина и/или одного или нескольких его фрагментов и/или его вариантов, как проиллюстрировано в данном документе, должна быть увеличена и пролонгирована. Также данную фармацевтическую композицию легче использовать потребителю, так как благодаря своей улучшенной стабильности ее не всегда нужно хранить в холодной среде, а можно более удобно хранить при комнатной температуре, например при применении или складском хранении, без потери биологической активности.
Стабилизирующее действие неионного эфира целлюлозы на молекулу окситоцина в фармацевтической композиции в соответствии с настоящим изобретением отличается от других применяемых фармацевтических носителей, таких как, например, натрий-карбоксиметилцеллюлоза (CMC), в составах с которой, как показано, окситоцин быстрее деградирует и/или агрегирует (см., например, сравнительные примеры в экспериментальном разделе). Не привязываясь к какой-либо определенной теории, это может объясняться тем фактом, что СМС-полимер отрицательно заряжен и может рассматриваться как полианион, способный неблагоприятно взаимодействовать с пептидом окситоцина.
Соответственно, настоящее изобретение относится к фармацевтической композиции, содержащей
a) окситоцин (SEQ ID NO:1) и/или один или несколько его фрагментов и/или его вариантов в соответствии с SEQ ID NO:2, а также его фармацевтически приемлемые соли и
b) по меньшей мере один неионный эфир целлюлозы,
где SEQ ID NO:2 является
X1-X2-X3-X4-Asn-Cys-X5-X6-X7-X8-NH2,
где
X1 выбран из группы, состоящей из Cys и отсутствия;
X2 выбран из группы, состоящей из Tyr, Phe и отсутствия;
Х3 выбран из группы, состоящей из Ile, Val, Hoph, Phe, Cha и отсутствия;
Х4 выбран из группы, состоящей из Gln, Ser, Thr, Cit, Arg и Daba;
X5 выбран из группы, состоящей из Pro и отсутствия;
Х6 выбран из группы, состоящей из Ile, Leu, пробел, Val, Hos, Daba, Thr, Arg и Cit;
Х7 выбран из группы, состоящей из Gly, пробел и Ala;
Х8 выбран из группы, состоящей из Gly и отсутствия,
где указанная фармацевтическая композиция имеет рН в диапазоне от приблизительно 3 до приблизительно 4.
В одном аспекте настоящего изобретения, когда X1 является Cys, то дисульфидная связь образуется между X1 и Cys.
Соответственно, следует понимать, что когда X1 в формуле (I) является цистеином (Cys), то тиольная группа X1 может образовывать дисульфидную связь с тиольной группой цистеина, расположенного между аспарагином (Asn) и X5, таким образом образуя циклическую структуру формулы (Ia):
В дополнительном аспекте обеспечивается фармацевтическая композиция, содержащая окситоцин (SEQ ID NO:1) и гидроксипропилметилцеллюлозу, в которой рН указанной фармацевтической композиции находится в диапазоне от приблизительно 3 до 4, например от приблизительно 3 до 3,5, или иное, как указано в данном документе.
Кроме того, настоящее изобретение также относится к фармацевтической композиции, состоящей из неионного эфира целлюлозы и окситоцина (SEQ ID NO:1) и/или его варианта(ов), и/или его фрагмента(ов), как представлено в данном документе (SEQ ID NO:2), а также его фармацевтически приемлемых солей и регулирующего рН средства, где указанная фармацевтическая композиция имеет рН в диапазоне от приблизительно 3 до 4, например, от приблизительно 3 до приблизительно 3,5. В одном аспекте указанная фармацевтическая композиция состоит из окситоцина (SEQ ID NO:1), гидроксипропилметилцеллюлозы (НРМС), и регулирующего рН средства, где указанная фармацевтическая композиция имеет рН в диапазоне от приблизительно 3 и 4, как, например, от приблизительно 3 до приблизительно 3,5, или иное, как иллюстрируется в данном документе. В одном аспекте указанное регулирующее рН средство представляет собой буфер, например лактатный или цитратный буфер.
В одном аспекте настоящего изобретения указанная фармацевтическая композиция содержит окситоцин, т.е. когда X1 является Cys, X2 является Tyr, Х3 является Ile, X4 является Gln, X5 является Pro, Х6 является Leu, Х7 является Gly, а Х8 отсутствует в SEQ ID NO:2, (Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly-NH2) (SEQ ID NO:1).
Один или несколько вариант(ов) и/или фрагмент(ов) окситоцина в упомянутой фармацевтической композиции (SEQ ID NO:2) также могут быть выбраны из группы, состоящей из следующих соединений и их фармацевтически приемлемых солей:
Мезотоцин: Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Ile-Gly-NH2 (SEQ ID NO:3)
X1 является Cys, X2 является Tyr, Х3 является Ile, X4 является Gln, X5 является Pro, Х6 является Ile, Х7 является Gly, a X8 отсутствует;
Изотоцин: Cys-Tyr-Ile-Ser-Asn-Cys-Pro-Ile-Gly-NH2 (SEQ ID NO:4)
X1 является Cys, X2 является Tyr, Х3 является Ile, X4 является Ser, X5 является Pro, Х6 является Ile, Х7 является Gly, а Х8 отсутствует;
Аннетоцин: Cys-Phe-Val-Arg-Asn-Cys-Pro-Thr-Gly-NH2 (SEQ ID NO:5)
X1 является Cys, X2 является Phe, Х3 является Val, X4 является Arg, X5 является Pro, X6 является Thr, X7 является Gly, a X8 отсутствует;
Вазотоцин: Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 (SEQ ID NO:6)
X1 является Cys, X2 является Tyr, Х3 является Ile, X4 является Gln, X5 является Pro, Х6 является Arg, Х7 является Gly, а Х8 отсутствует;
Вазопрессин: Cys-Tyr-Phe-Gln-Asn-Cys-Pro-Arg-Gly-NH2 (SEQ ID NO:7)
X1 является Cys, X2 является Tyr, Х3 является Phe, X4 является Gln, X5 является Pro, Х6 является Arg, X7 является Gly, a X8 отсутствует;
Cys-Tyr-Ile-Gln-Asn-Cys-NH2 (SEQ ID NO:8)
X1 является Cys, X2 является Tyr, Х3 является Ile, X4 является Gln, a X5-X8 отсутствует;
Cys-Tyr-Ile-Gln-Asn-Cys-Pro-NH2 (SEQ ID NO:9)
X1 является Cys, Х2 является Tyr, Х3 является Ile, X4 является Gln, X5 является Pro, a Х6-Х8 отсутствует;
Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-NH2 (SEQ ID NO:10)
X1 является Cys, X2 является Tyr, Х3 является Ile, Х4 является Gln, X5 является Pro, Х6 является Leu, а Х7-8 отсутствует;
Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly-NH2 (SEQ ID NO:11)
X1 отсутствует, Х2 является Tyr, Х3 является Ile, Х4 является Gln, X5 является Pro, X6 является Leu, X7 является Gly, a X8 отсутствует;
Ile-Gln-Asn-Cys-Pro-Leu-Gly-NH2 (SEQ ID NO:12)
X1-X2 отсутствуют, Х3 является Ile, X4 является Gln, X5 является Pro, X6 является Leu, Х7 является Gly, а Х8 отсутствует;
Gln-Asn-Cys-Pro-Leu-Gly-NH2 (SEQ ID NO:13)
X1-Х3 отсутствуют, X4 является Gln, X5 является Pro, X6 является Leu, X7 является Gly, а Х8 отсутствует;
Ile-Gln-Asn-Cys-Pro-NH2 (SEQ ID NO:14)
X1-X2 отсутствуют, Х3 является Ile, X4 является Gln, X5 является Pro, a X6-X8 отсутствуют;
Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly-Gly-NH2 (SEQ ID NO:15)
X1 является Cys, X2 является Tyr, Х3 является Ile, Х4 является Gln, X5 является Pro, Х6 является Leu, Х7 является Gly, a X8 является Gly;
Gln-Asn-Cys-Pro-Leu-Leu-NH2 (SEQ ID NO:16)
X1-Х3 отсутствуют, X4 является Gln, X5 является Pro, X6 является Leu, X7 является Leu, а Х8 отсутствует;
Cys-Tyr-Val-Thr-Asn-Cys-Pro-Leu-Gly-NH2 (SEQ ID NO:17)
X1 является Cys, Х2 является Tyr, Х3 является Val, Х4 является Thr, X5 является Pro, Х6 является Leu, X7 является Gly, а Х8 отсутствует;
Cys-Tyr-Hoph-Thr-Asn-Cys-Pro-Val-Gly-NH2 (SEQ ID NO:18)
X1 является Cys, X2 является Tyr, Х3 является Hoph, Х4 является Thr, X5 является Pro, X6 является Val, Х7 является Gly, Х8 отсутствует;
Cys-Tyr-Phe-Cit-Asn-Cys-Pro-Leu-Gly-NH2 (SEQ ID NO:19)
X1 является Cys, Х2 является Tyr, Х3 является Phe, X4 является Cit, X5 является Pro, Х6 является Leu, Х7 является Gly, a Х8 отсутствует;
Cys-Tyr-Cha-Arg-Asn-Cys-Pro-Hos-Ala-NH2 (SEQ ID NO:20)
X1 является Cys, X2 является Tyr, Х3 является Cha, X4 является Arg, X5 является Pro, Х6 является Hos, X7 является Ala, а Х8 отсутствует;
Cys-Tyr-Val-Daba-Asn-Cys-Pro-Daba-Ala-NH2 (SEQ ID NO:21)
X1 является Cys, Х2 является Tyr, Х3 является Val, X4 является Daba, X5 является Pro, Х6 является Cit, Х7 является Ala, а Х8 отсутствует;
Cys-Tyr-Hoph-Daba-Asn-Cys-Pro-Cit-Ala-NH2 (SEQ ID NO:22)
X1 является Cys, Х2 является Tyr, Х3 является Hoph, X4 является Daba, X5 является Pro, Х6 является Cit, Х7 является Ala, а Х8 отсутствует;
Cys-Tyr-Phe-Arg-Asn-Cys-Pro-Val-Ala-NH2 (SEQ ID NO:23)
X1 является Cys, Х2 является Tyr, Х3 является Phe, Х4 является Arg, X5 является Pro, Х6 является Val, Х7 является Ala, а Х8 отсутствует; и
Cys-Tyr-Cha-Cit-Asn-Cys-Pro-Arg-Gly-NH2 (SEQ ID NO:24)
X1 является Cys, X2 является Tyr, Х3 является Cha, X4 является Cit, Х5 является Pro, Х6 является Arg, Х7 является Gly, X8 отсутствует.
Соответственно, в одном аспекте настоящее изобретение относится к фармацевтической композиции, в которой указанный один или несколько фрагментов и/или вариантов окситоцина выбран(ы) из группы, состоящей из пептидов, соответствующих SEQ ID NO:3 - SEQ ID NO:24.
Синтетические аминокислоты в указанных веществах имеют следующие структуры:
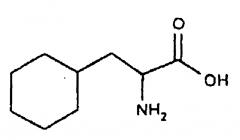
Циклогексилаланин в данном документе обозначен Cha,
,
Гомофенилаланин в данном документе обозначен Hoph,
,
Цитруллин в данном документе обозначен Cit,
,
Диаминобутировая кислота в данном документе обозначена Daba, и
,
Гомосерин в данном документе обозначен Hos,
.
Когда положение в SEQ ID NO:2 обозначено как "отсутствие", это означает, что оно представляет одинарную связь между составляющими (символом, атомом или группой).
Другие варианты окситоцина также могут применяться в фармацевтических композициях согласно настоящему изобретению, таких как встречающиеся в природе или искусственно модифицированные варианты, аналоги и/или производные окситоцина, мезотоцина, изотоцина и/или аннетоцина. Такие варианты могут быть получены добавлением, вставкой, удалением или замещением по меньшей мере одной аминокислоты в этих гормонах. Другие вещества представляют собой предшественники, метаболиты, такие как метаболические производные, т.е. метаболические продукты распада, антагонисты или аналоги веществ, упомянутых в данном документе, проявляющие одинаковые с ними свойства.
Метаболические производные или метаболические продукты распада могут являться окситоцин-подобными пептидами, например состоять из 9 аминокислот, так же как окситоцин, мезотоцин, изотоцин и аннетоцин, но в которых удалены одна или несколько аминокислот с карбоксильного конца или аминного конца, или как с карбоксильного конца, так и с аминного конца, например 1-3 аминокислоты с каждого конца. В определенном аспекте могут быть удалены одна, две или три аминокислоты с карбоксильного конца, т.е. только Gly, Gly и Leu или Gly, Leu и Pro. Предпочтительно с аминного могут быть удалены одна, две или три аминокислоты, т.е. только Cys, Cys и Tyr или Cys, Tyr и Ile.
В некоторых аспектах две или три аминокислоты могли быть удалены как с карбоксильного конца, т.е. только Gly, Gly и Leu или Gly, Leu и Pro, так и одна, две или три аминокислоты - с аминного конца, т.е. только Cys, Cys и Tyr или Cys, Tyr и Ile. Установить, что эти варианты являются аналогами окситоцина, мезотоцина, изотоцина или аннетоцина, можно с помощью иммунологических методов, т.е. RIA (радиоиммунного анализа), IRMA (радиометрических способов), RIST (радиоиммуносорбентного теста) и RAST (радиоаллергосорбентного теста). Настоящее изобретение также включает варианты окситоцина, характеризующиеся идентичностью аминокислотной последовательности с таковой окситоцина по меньшей мере 50, 60, 70, 80, 90, 95, 96, 97, 98 или 99%, причем указанные варианты проявляют активность окситоцина, как определено в данном документе.
Аннетоцин выделяли из дождевого червя, как описано у Oumi Т, Ukena K, Matsushima О, Ikeda Т, Fujita Т, Minakata H, Nomoto K, Annetocin: an oxytocin-related peptide isolated from the earthworm, Eisenia foetida, Biochem Biophys Res Commun 1994, January 14; 198(1); 393-399.
Также существует возможность создавать новые соединения с активностью окситоцина методами компьютерного моделирования. Методы компьютерного моделирования известны специалистам в данной области, например, как описаны в ЕР 0660210 А2.
Настоящее изобретение также относится к фармацевтической композиции, содержащей окситоцин или его вариант как в D-, так и в L-форме, а также его рацематы. В определенном аспекте настоящее изобретение относится к L-форме. С помощью инверсии его последовательности пептида D-форма может быть превращена в L-форму. Эти и названные выше пептиды могут быть синтезированы способами, известными специалистам в данной области техники, например в соответствии с Merrifield, P.В., "Solid Phase Synthesis", Angew. Chemie, 1985, No. 97, p.801.
Фармацевтические композиции в соответствии с настоящим изобретением могут при определенных обстоятельствах содержать вещества, продлевающие или усиливающие действие окситоцина. Такие вещества могут повышать высвобождение окситоцина и/или количество единиц, или сродство рецепторов окситоцина, таких как эстроген и/или лекарственные средства, проявляющие [альфа]2-агонистический эффект, такие как клонидин.
Следует отметить, что фармацевтически приемлемые соли составов в соответствии с настоящим изобретением включены в объем изобретения. Примерами солей соединения являются фармацевтически приемлемые соли присоединения кислот и оснований.
Под выражением "фармацевтически приемлемые соли присоединения кислот" подразумевают любые нетоксичные соли присоединения органических или неорганических кислот соединений SEQ ID NO:1 или SEQ ID NO:2, и/или любых других вариантов и/или фрагментов окситоцина, как описано в данном документе. Иллюстративными примерами неорганических кислот, образующих подходящие соли, являются соляная кислота, бромная кислота, серная кислота, фосфорная кислота и кислые соли металлов, такие как моногидроортофосфат натрия и гидросульфат калия. Иллюстративными примерами органических кислот, которые образуют подходящие соли, являются моно-, ди- и трикарбоновые кислоты. Примерами таких кислот являются уксусная кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота, глутаровая кислота, яблочная кислота, тартаровая кислота, лимонная кислота, аскорбиновая кислота, малеиновая кислота, гидроксималеиновая кислота, бензойная кислота, гидроксибензойная кислота, фенилуксусная кислота, коричная кислота, салициловая кислота, 2-феноксибензойная кислота и сульфоновые кислоты, такие как п-толуолсульфоновая кислота, метансульфоновая кислота и 2-гидроксиэтансульфоновая кислота. Такие соли могут находиться как в гидратной, так и безводной форме. Соли присоединения кислот таких соединений, как правило, растворимы в воде и различных гидрофильных органических растворителях и, по сравнению с их свободными основаниями, как правило, проявляют более высокие температуры плавления.
Под выражением "фармацевтически приемлемые соли присоединения оснований" подразумеваются любые нетоксичные органические или неорганические соли присоединения оснований соединений SEQ ID NO:1 или SEQ ID NO:2, и/или любых вариантов и/или фрагментов окситоцина, как описано в данном документе. Примерами иллюстративных неорганических оснований, образующих подходящие соли, являются гидроксиды и карбонаты щелочных и щелочно-земельных металлов, таких как гидроксид натрия, карбонат натрия, гидроксид калия, карбонат калия, гидроксид кальция, карбонат кальция, гидроксид магния, карбонат магния и аммиак. Примерами иллюстративных органических оснований, образующих приемлемые соли, являются метиламин, диметиламин, триметиламин и пиколин. Такими соединениями могут образовываться как моно-, так и двухосновные соли. Соли присоединения оснований таких соединений, как правило, растворимы в воде и различных гидрофильных органических растворителях и, по сравнению с их свободными основаниями, как правило, проявляют более высокие температуры плавления.
Неионные эфиры целлюлозы фармацевтической композиции в соответствии с настоящим изобретением получены на основе целлюлозы, которая была химически модифицирована путем замещения различных групп на целлюлозном скелете с целью получения растворимости в воде. Для заместителей характерно отсутствие электрического заряда при растворении в воде при нейтральном рН.
Свойства неионных эфиров целлюлозы определяются молекулярной массой (т.е. степенью полимеризации), типом заместителей, а также числом и распределением заместителей в молекуле. Следовательно, в зависимости от окситоцина и/или его фрагментов и/или его вариантов, присутствующих в фармацевтической композиции, неионный эфир целлюлозы может обладать различными свойствами и будет определяться в соответствии с преобладающими обстоятельствами.
Эфиры целлюлозы в соответствии с настоящим изобретением являются неионными, причем в них алкильные и/или гидроксиалкильные группы присоединены к мономерам ангидроглюкозы эфирными связями, образующими гидроксиалкилалкилцеллюлозы, где в алкильных группах содержится от 1 до 4 атомов углерода.
Типичными эфирами целлюлозы для применения в фармацевтических композициях в соответствии с настоящим изобретением являются метилцеллюлоза (МС), гидроксиэтилметилцеллюлоза (НЕМС), гидроксипропилметилцеллюлоза (НРМС), гидроксиэтилэтилцеллюлоза (НЕЕС) и гидроксипропилцеллюлоза (НРС). В этих полимерах заместители являются либо неполярными (например метил), либо имеют незначительную полярность (например гидроксиэтил), которые в комбинации с гидрофильным целлюлозным скелетом образуют амфифильный полимер.
Соответственно, настоящее изобретение относится к фармацевтическим композициям, в которых по меньшей мере один из неионных эфиров целлюлозы выбран из одного или нескольких следующих эфиров целлюлозы: МС, НРМС, НЕЕС, НЕМС и/или НРС, или как дополнительно приводится в данном документе. В одном аспекте в фармацевтической композиции в соответствии с настоящим изобретением упомянутый неионный эфир целлюлозы является гидроксипропилметилцеллюлозой (НРМС).
Показатель рН фармацевтической композиции в соответствии с настоящим изобретением и применительно ко всем его вариантам осуществления и аспектам, как определено в данном документе, может находиться в диапазоне от приблизительно 3 до 4,5, таком как от приблизительно 3,5 до приблизительно 4,5, от приблизительно 3,5 до 4, от приблизительно 3 до 4, от приблизительно 3 до 3,5, от приблизительно 3 до 3,1, от приблизительно 3 до 3,2, от приблизительно 3 до 3,3, от приблизительно 3 до 3,4, от приблизительно 3 до 3,6, от приблизительно 3 до 3,7, от приблизительно 3 до 3,8, от приблизительно 3 до 3,9, от приблизительно 3,1 до 3,2, от приблизительно 3,1 до 3,3, от приблизительно 3,1 до 3,4, от приблизительно 3,1 до 3,5, от приблизительно 3,1 до 3,6, от приблизительно 3,1 до 3,7, от приблизительно 3,1 до 3,8, от приблизительно 3,1 до 3,9, от приблизительно 3,2 до 3,3, от приблизительно 3,2 до 3,4, от приблизительно 3,2 до 3,5, от приблизительно 3,2 до 3,6, от приблизительно 3,2 до 3,7, от приблизительно 3,2 до 3,8, от приблизительно 3,2 до 3,9, от приблизительно 3,3 до 3,5, от приблизительно 3,3 до 3,6, от приблизительно 3,3 до 3,7, от приблизительно 3,3 до 3,8 или от приблизительно 3,3 до 4. Следует отметить, что эти значения являются не совсем точными, что означает, что они могут незначительно варьировать в пределах представленных значений.
Показатель рН фармацевтической композиции, как определено в данном документе, можно регулировать путем добавления к указанной фармацевтической композиции регулирующего рН средства, такого как буфер. В контексте настоящего изобретения указанный буфер может представлять собой лактатный буфер, цитратный буфер, фосфатный буфер или их смесь, но без ограничения таковыми.
Концентрация буфера, добавляемого в фармацевтическую композицию в соответствии с настоящим изобретением, может находиться от приблизительно 20 до 100 мМ, например, от приблизи