Биспецифические антитела, специфичные к антигенам, активирующим т-клетки, и опухолевому антигену, и способы их применения
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается биспецифического антитела, которое специфически связывает активирующий Т-клетки антиген и опухолевый антиген (ТА), содержащего первый Fab-фрагмент и второй Fab-фрагмент, где произведен обмен либо вариабельными областями, либо константными областями между тяжелой и легкой цепями второго Fab-фрагмента; и где биспецифическое антитело не содержит Fc-домен, так что константный участок тяжелой цепи состоит исключительно из одного или более СН1 доменов. Группа изобретений также касается клетки-хозяина, содержащей векторы, включающие молекулы нуклеиновой кислоты, кодирующие легкие цепи и тяжелые цепи указанного биспецифического антитела; применения биспецифического антитела в производстве лекарственного средства для лечения рака. Группа изобретений обеспечивает индуцирование опосредованного Т-клетками апоптоза клеток-мишений. 5 н. и 14 з.п. ф-лы, 9 пр., 23 ил., 1 табл.
Реферат
Область изобретения
Данное изобретение относится к биспецифическим антителам, которые специфически связываются с антигеном, активирующим Т-клетки, и опухолевым антигеном (ТА, от англ. tumor antigen), включающим первый Fab-фрагмент и второй Fab-фрагмент, где произведен обмен либо вариабельными областями, либо константными областями между тяжелой и легкой цепями второго Fab-фрагмента; и где биспецифическое антитело не содержит Fc-домен; к способам их получения, фармацевтическим композициям, содержащим указанные антитела, и к их применению.
Уровень техники
Селективное разрушение отдельной клетки или конкретного типа клеток часто является желательным в различных клинических условиях. Например, основной целью терапии рака является специфическое уничтожение опухолевых клеток с сохранением здоровых клеток и тканей неповрежденными. Один подход заключается в селективной индукции иммунного ответа против опухоли, который вызывает атаку и последующее разрушение опухолевых клеток иммунными эффекторными клетками, такими как натуральные киллеры (NK-клетки) или цитотоксические Т-лимфоциты (CTL, от англ. cytotoxic Т lymphocytes). CTL являются наиболее мощными эффекторными клетками иммунной системы, однако они не могут быть активированы с помощью эффекторного механизма, опосредованного Fc-доменом обычных терапевтических антител. В связи с этим биспецифические антитела, которые способны связываться с поверхностным антигеном на раковых клетках и активирующим инвариантным компонентом Т-клеточного рецепторного (TCR, от англ. Т cell receptor) комплекса, привлекают интерес в последние годы. Одновременное связывание биспецифического антитела с его обеим мишенями приводит ко временному взаимодействию раковой клетки и Т-клетки, что приводит к активации цитотоксических Т-клеток и последующему лизису опухолевой клетки.
Разработано несколько форматов биспецифических антител и исследована их пригодность для опосредованной Т-клетками иммунотерапии рака. Из них так называемые молекулы BiTE (биспецифические проводники Т-клеток) были очень хорошо охарактеризованы и уже показали многообещающие результаты в клинике (обзор в Nagorsen and Bäuerle, Exp Cell Res 317, 1255-1260 (2011)). Молекулы BiTE являются тандемными scFv-молекулами, в которых две scFv-молекулы слиты с помощью гибкого линкера. Другие биспецифические форматы, которые оценивались на взаимодействие с Т-клетками, включают димерные антитела (Holliger et al., Prot Eng 9, 299-305 (1996)) и их производные, такие как тандемные димерные антитела (Kipriyanov et al., J Mol Biol 293, 41-66 (1999)). В последнее время разработаны так называемые молекулы DART (двойной аффинности), которые основаны на формате димерных антител, но обладают С-концевым дисульфидным мостиком для дополнительной стабилизации (Moore et al., Blood 117, 4542-51 (2011)). Так называемые антитела Triomab, которые представляют собой целые гибридные молекулы мышиного/крысиного IgG и в настоящее время оцениваются в клинических испытаниях, представляют большеразмерный формат (обзор в Seimetz et al., Cancer Treat Rev 36, 458-467 (2010)).
Тем не менее, биспецифические антитела, разработанные для опосредованной Т-клетками иммунотерапии рака, как известно, до сих пор имеют серьезные недостатки, связанные с их эффективностью, токсичностью и применимостью. Небольшие конструкции, такие как, например, молекулы BiTE - в то время как они способны эффективно соединять эффекторные клетки и клетки-мишени - имеют очень короткий период полужизни в сыворотке крови, требующий их введения пациентам путем непрерывной инфузии. С другой стороны, IgG-подобные форматы - в то время как они имеют большую пользу из-за длинного периода полужизни - страдают от токсичности, связанной с нативными эффекторными функциями, присущими молекулам IgG. Этот иммуногенный потенциал представляет собой еще один признак IgG-подобных биспецифических антител, неблагоприятный для успешной терапевтической разработки. Наконец, одной из основных задач в общей разработке биспецифических антител остается продукция конструкций биспецифических антител в достаточном для клиники количестве и чистоте. Ошибочное спаривание тяжелых и легких цепей антител с различными специфичностями при совместной экспрессии уменьшает выход правильно собранной конструкции и приводит к образованию ряда нефункциональных побочных продуктов.
Учитывая трудности и недостатки, связанные с имеющимися в настоящее время биспецифическими антителами для опосредованной Т-клетками иммунотерапии рака, остается потребность в новых, усовершенствованных форматах таких молекул. Теперь эти недостатки преодолены посредством новых биспецифических антител изобретения. Новые биспецифические антитела можно легко получить с повышенным выходом благодаря сниженному количеству ошибочно спаренных побочных продуктов, которые демонстрируют меньшую агрегацию, чем фрагменты биспецифических антител, известные в данной области. Применение подхода перехлеста может обеспечить правильную ассоциацию LC без необходимости создавать общую легкую цепь. Кроме того, новые биспецифические антитела имеют более высокую молекулярную массу по сравнению со многими обычными фрагментами биспецифических антител, тем самым предотвращают чрезмерный клиренс почками и приводят к улучшенному времени полужизни in vivo. Новые биспецифические антитела полностью функциональны и имеют сравнимое или улучшенное связывание и активность, как у соответствующих обычных биспецифических антител.
Данное изобретение предусматривает биспецифические антигенсвязывающие молекулы, разработанные для активации и перенаправления Т-клеток, которые сочетают хорошую эффективность и продуктивность с низкой токсичностью и благоприятными фармакокинетическими свойствами.
Краткое описание
Данное изобретение относится к биспецифическим антителам, которые специфически связываются с активирующим Т-клетки антигеном и опухолевым антигеном (ТА), включающим первый Fab-фрагмент и второй Fab-фрагмент, где произведен обмен либо вариабельными областями, либо константными областями между тяжелой и легкой цепями второго Fab-фрагмента; и где биспецифическое антитело не содержит Fc-домен.
Антитела изобретения специфически связываются с опухолевым антигеном на поверхности опухолевой клетки и в то же время связываются с антигеном, активирующим Т-клетки. Поэтому биспецифическое антитело способно вызывать иммунный ответ специфически в месте опухоли, впоследствии приводя к апоптозу клетки-мишени.
В одном аспекте предусмотрено биспецифическое антитело, которое специфически связывает антиген, активирующий Т-клетки, и опухолевый антиген (ТА), содержащее по меньшей мере два Fab-фрагмента, где первый Fab-фрагмент содержит по меньшей мере один антигенсвязывающий сайт, специфичный к опухолевому антигену (ТА); а второй Fab-фрагмент содержит по меньшей мере один антигенсвязывающий сайт, специфичный к антигену, активирующему Т-клетки, где либо вариабельные области, либо константные области тяжелой и легкой цепи второго Fab-фрагмента поменяны; и где биспецифическое антитело лишено Fc-домена.
В частности, данное изобретение относится к биспецифическим антителам, где антиген, активирующий Т-клетки, является антигеном, направленным на CD3 Т-клеточный корецептор (CD3).
В одном аспекте предусмотрено биспецифическое антитело, которое специфически связывается с антигеном CD3 Т-клеточным корецептором (CD3) и опухолевым антигеном (ТА), включающее по меньшей мере два Fab-фрагмента, где первый Fab-фрагмент содержит по меньшей мере один антигенсвязывающий сайт, специфичный к опухолевому антигену (ТА); а второй фрагмент Fab содержит по меньшей мере один антигенсвязывающий сайт, специфичный к CD3 Т-клеточному корецептору (CD3), где либо вариабельные области, либо константные области тяжелой и легкой цепи второго Fab-фрагмента поменяны; и где биспецифическое антитело лишено Fc-домена. В одном воплощении первый и второй Fab-фрагменты соединены через пептидный линкер. Предпочтительно пептидный линкер является (G4S)2-линкером.
В одном воплощении указанное антитело дополнительно содержит третий Fab-фрагмент. В другом воплощении указанный третий Fab-фрагмент содержит по меньшей мере один антигенсвязывающий сайт, специфичный к опухолевому антигену. В одном воплощении третий Fab-фрагмент связан с N- или С-концом легкой цепи или тяжелой цепи первого Fab-фрагмента. В другом воплощении третий Fab-фрагмент связан с N- или С-концом легкой цепи или тяжелой цепи второго Fab-фрагмента. В одном воплощении третий Fab-фрагмент соединен с первым или вторым Fab-фрагментом с помощью пептидного линкера. Предпочтительно указанный пептидный линкер является (G4S)2-линкером.
Биспецифические антитела в соответствии с изобретением являются по меньшей мере двухвалентными и могут быть трехвалентными или поливалентными, например, четырехвалентными или шестивалентными. В одном воплощении указанные биспецифические антитела являются двухвалентными (формат 1+1) с одним сайтом связывания, нацеленным на опухолевый антиген (ТА) и антиген, активирующий Т-клетки, соответственно. В другом воплощении указанные биспецифические антитела являются трехвалентными (формат 2+1) с двумя сайтами связывания, каждый из которых направлен на опухолевый антиген (ТА), и один сайт связывания направлен на антиген, активирующий Т-клетки, как описано в следующем разделе. В предпочтительном воплощении указанный антиген, активирующий Т-клетки, представляет собой CD3.
В соответствии со вторым объектом данное изобретение относится к фармацевтической композиции, содержащей биспецифическое антитело согласно данному изобретению.
В соответствии с третьим объектом данное изобретение относится к биспецифическому антителу согласно данному изобретению для лечения рака. В другом воплощении предусмотрено применение биспецифического антитела в качестве лекарственного средства. Предпочтительно указанное применение является лечением рака.
В соответствии с другими объектами данное изобретение относится к последовательности нуклеиновой кислоты, содержащей последовательность, кодирующую тяжелую цепь биспецифического антитела данного изобретению, к последовательности нуклеиновой кислоты, содержащей последовательность, кодирующую легкую цепь биспецифического антитела данного изобретения, к экспрессионному вектору, содержащему последовательность нуклеиновой кислоты согласно данному изобретению, и к прокариотической или эукариотической клетке-хозяину, содержащей вектор данного изобретения. Кроме того, предусмотрен способ получения антитела, включающий культивирование клетки-хозяина таким образом, что продуцируется антитело.
Краткое описание графических материалов
Фиг. 1: Схематическое изображение типичных форматов биспецифических антител изобретения. а) С-конец молекулы Fab-Crossfab, b) N-конец молекулы Fab-Crossfab с) С-конец молекулы (Fab)2-Crossfab d) N-конец молекулы (Fab)2-Crossfab e) молекула Fab-Crossfab-Fab.
Фиг. 2: Анализ продукции и очистки hu Fab(MCSP)-Crossfab(CD3): SDS-Page: 4-12% Bis/Tris (NuPage [invitrogen]; окрашенный Кумасси): а) 1 - Mark 12 (invitrogen), 2 - hu Fab(MCSP)-Crossfab(CD3) невосстановленные условия; b) 1 - Mark 12 (invitrogen), 2 - hu Fab(MCSP)-Crossfab(CD3) восстановленные условия.
Фиг. 3: Анализ продукции и очистки Fab(MCSP)-Crossfab(CD3). Аналитическая эксклюзионная хроматография, хроматограмма А280 (Superdex 200 10/300 GL [GE Healthcare]; 2 мМ MOPS pH 7,3, 150 мМ NaCl, 0,02% (w/v) NaCl; было введено 50 мкг образца).
Фиг. 4: Анализ продукции и очистки hu Fab(MCSP)-Fab(MCSP)-Crossfab(CD3): SDS-Page: 4-12% Bis/Tris (NuPage [invitrogen]; окрашенный Кумасси): а) 1 - Mark 12 (invitrogen), 2 - hu Fab(MCSP)-Fab(MCSP)-Crossfab(CD3) невосстановленные условия; b) 1 - Mark 12 (invitrogen), 2 - hu Fab(MCSP)-Fab(MCSP)-Crossfab(CD3) восстановленные условия.
Фиг. 5: Анализ продукции и очистки hu Fab(MCSP)-Fab(MCSP)-Crossfab(CD3). Аналитическая эксклюзионная хроматография, хроматограмма А280 (Superdex 200 10/300 GL [GE Healthcare]; 2 мМ MOPS pH 7,3, 150 мМ NaCl, 0,02% (w/v) NaCl; 50 мкг образца было введено).
Фиг. 6: Анализ продукции и очистки hu Fab(MCSP)-Crossfab(CD3)-Fab(MCSP). SDS-Page: 4-12% Bis/Tris (NuPage [invitrogen]; окрашенный Кумасси): a) 1 - Mark 12 (invitrogen), 2 - hu Fab(MCSP)-Crossfab(CD3)-Fab(MCSP) невосстановленные условия; b) 1 - Mark 12 (invitrogen), 2 - hu Fab(MCSP)-Crossfab(CD3)-Fab(MCSP) восстановленные условия.
Фиг. 7: Анализ продукции и очистки hu Fab(MCSP)-Crossfab(CD3)-Fab(MCSP). Аналитическая эксклюзионная хроматография, хроматограмма А280 (Superdex 200 10/300 GL [GE Healthcare]; 2 мМ MOPS pH 7,3, 150 мМ NaCl, 0,02% (w/v) NaCl; было введено 50 мкг образца).
Фиг. 8: Анализ продукции и очистки мышиный Crossfab(CD3)-Fab(MCSP)-Fab(MCSP). SDS-Page: 4-12% Bis/Tris (NuPage [invitrogen]; окрашенный Кумасси): a) 1 - Mark 12 (invitrogen), 2 - мышиный Crossfab(CD3)-Fab(MCSP)-Fab(MCSP) невосстановленные условия; b) 1 - Mark 12 (invitrogen), 2 - мышиный Crossfab(CD3)-Fab(MCSP)-Fab(MCSP) восстановленные условия.
Фиг. 9: Анализ продукции и очистки мышиный Crossfab(CD3)-Fab(MCSP)-Fab(MCSP). Аналитическая эксклюзионная хроматография, хроматограмма А280 (Superdex 200 10/300 GL [GE Healthcare]; 2 мМ MOPS pH 7,3, 150 мМ NaCl, 0,02% (w/v) NaCl; было введено 50 мкг образца).
Фиг. 10: Гибель (измеренная по высвобождению LDH) опухолевых клеток MDA-MB-435 при совместном культивировании с человеческими пан-Т-клетками (соотношение Е:Т = 5:1) и активации в течение 20 часов различными концентрациями hu Fab(MCSP)-Crossfab(CD3) (="Fab-Crossfab"), hu Fab(MCSP)-Crossfab(CD3)-Fab(MCSP) (="Fab-Crossfab-Fab"), hu Fab(MCSP)-Fab(MCSP)-Crossfab(CD3) (="(Fab)2-Crossfab"), а также биспецифическими молекулами (scFv)2 (антиMCSP/антиhuCD3e) (="(scFv)2"). Конструкции с двухвалентным MCSP-нацеливанием демонстрируют цитотоксическую активность, сравнимую с конструкцией "(scFv)2", в то время как конструкция "Fab-Crossfab" с моновалентным MCSP-связыванием имеет явно меньшую активность.
Фиг. 11: Сравнение конструкций hu Fab(MCSP)-Fab(MCSP)-Crossfab(CD3) (="(Fab)2-Crossfab") и (scFv)2 (антиMCSP/антиhuCD3e) (="(scFv)2"). Изображено высвобождение LDH из опухолевых клеток MDA-MB-435 при совместном культивировании с человеческими пан-Т-клетками (соотношение Е:Т = 5:1) и активации в течение 21 часа различными концентрациями биспецифических конструкций и соответствующих IgG. "(Fab)2-Crossfab" индуцирует аопотоз в клетках-мишенях по меньшей мере так же хорошо, как молекула (scFv)2.
Фиг. 12: Сравнение конструкций hu Fab(MCSP)-Fab(MCSP)-Crossfab(CD3) (="(Fab)2-Crossfab") и (scFv)2 (антиMCSP/антиhuCD3e) (="(scFv)2"). Изображено высвобождение LDH из опухолевых клеток человеческой меланомы MV-3 при совместном культивировании с человеческими РВМС (соотношение Е:Т = 10:1) и активации в течение 26 часов различными концентрациями биспецифических конструкций и соответствующих IgG. "(Fab)2-Crossfab" индуцирует аопотоз в клетках-мишенях по меньшей мере так же хорошо, как молекула (scFv)2.
Фиг. 13: Высвобождение LDH из опухолевых клеток B16/F10-huMCSP Fluc2 клона 48, индуцированное путем активации первичных мышиных Т-клеток конструкцией мышиный Crossfab(CD3)-Fab(MCSP)-Fab(MCSP) (=(Fab)2-CrossFab), нацеленной на человеческий MCSP, а также на мышиный CD3. Соотношение эффекторных клеток и клеток-мишеней составляло 5:1. Анализ проводили после инкубации в течение 23,5 ч при 37°С, 5% CO2. Конструкция индуцирует зависимый от концентрации опосредованный Т-клетками апоптоз человеческих клеток-мишеней, экспрессирующих MCSP.
Фиг. 14: Высвобождение LDH из опухолевых клеток B16/F10-huMCSP Fluc2, клона 48, индуцированное путем активации первичных мышиных Т-клеток 50 нМ конструкции мышиного Crossfab(CD3)-Fab(MCSP)-Fab(MCSP) (=(Fab)2-CrossFab), нацеленной на человеческий MCSP, а также на мышиный CD3. Соотношение эффекторных клеток и клеток-мишеней составляло 5:1. Анализ проводили после инкубации в течение 23,5 ч при 37°С, 5% CO2. Конструкция индуцирует опосредованный Т-клетками апоптоз человеческих клеток-мишеней, экспрессирующих MCSP. Наблюдается только слабая гиперактивация Т-клеток при такой концентрации конструкции.
Фиг. 15: Различные уровни цитокинов, измеренные в супернатанте цельной крови после обработки 1 нМ различных CD3-MCSP-биспецифических конструкций ((hu Fab(MCSP)-Fab(MCSP)-Crossfab(CD3) (="(Fab)2-Crossfab") и (scFv)2 (антиMCSP/антиhuCD3e) (="(scFv)2")) в присутствии (А, В) или в отсутствие (С, D) опухолевых клеток Colo-38 в течение 24 часов. 280 мкл цельной крови на лунку высевали в 96-луночный планшет и добавляли 30000 клеток Colo-38, как указано. Основным цитокином, который секретировался при активации Т-клеток в присутствии опухолевых клеток Colo-38, является IL-6, и затем IFN-гамма. Кроме того, также уровни гранзима В сильно повышались после активации Т-клеток в присутствии клеток-мишеней. В целом, конструкция "(scFv)2" повышала уровни TNF и IFN-гамма, а также гранзима В в присутствии клеток-мишеней (А и В) немного больше по сравнению с другими биспецифическими конструкциями.
Не наблюдалось никакой существенной секреции цитокинов Th2 (IL-10 и IL-4) после активации Т-клеток биспецифическими конструкциями в присутствии (или в отсутствие) клеток-мишеней. В этом анализе также наблюдалась слабая секреция IFN-гамма, индуцированная конструкцией "(Fab)2-Crossfab" в отсутствие клеток-мишеней.
Фиг. 16: Уровень поверхностной экспрессии позднего маркера активации CD25 на мышиных пан-Т-клетках, выделенных из селезенки. Мышиные пан-Т-клетки инкубировали с 50 нМ биспецифической конструкции мышиный Crossfab(CD3)-Fab(MCSP)-Fab(MCSP) (=(Fab)2-CrossFab) (нацеленной на мышиный CD3, а также на человеческий MCSP), в присутствии или в отсутствие опухолевых клеток-мишеней B16/F10-huMCSP Fluc2 клона 48, как указано (соотношение Е:Т = 10:1). Изображен уровень экспрессии позднего маркера активации CD25 на CD8+ Т-клетках через 70 часов. Повышающая регуляция CD25 на CD8+ Т-клетках с конструкцией (Fab)2-CrossFab наблюдалась только в присутствии клеток-мишеней. Используемые контрольные IgG, доведенные до той же молярности, не смогли вызвать повышающую регуляцию CD25.
Фиг. 17: Анализ продукции и очистки Fab(CD33)-CrossFab(CD3). SDS-Page: a) 3-8% Tris/Acetate (NuPage [invitrogen]; окрашенный Кумасси): а) 1 - HiMark (invitrogen), 2 - Fab(CD33)-CrossFab(CD3). невосстановленные условия; b) 4-12% Bis/Tris (NuPage [invitrogen]: 1 - Mark 12 (invitrogen), 2 - Fab(CD33)-CrossFab(CD3), восстановленные условия.
Фиг. 18: Анализ продукции и очистки Fab(CD33)-CrossFab(CD3). Аналитическая эксклюзионная хроматография, хроматограмма А280 (Superdex 200 10/300 GL [GE Healthcare]; 2 мМ MOPS pH 7,3, 150 мМ NaCl, 0,02% (w/v) NaCl; вводили 50 мкг образца).
Фиг. 19: Гибель (измеренная по высвобождению LDH) опухолевых клеток MV-3 при совместном культивировании с человеческими РВМС (соотношение Е:Т = 10:1) и активации в течение 24 часов различными концентрациями CD3-MCSP-биспецифических конструкций (hu Fab(MCSP)-Crossfab(CD3); обозначена "1+1 без Fc", и (scFv)2 (антиMCSP/антиhuCD3e) (=референсная молекула "(scFv)2")). Конструкция "1+1 без Fc" индуцирует апоптоз в клетках-мишенях MV-3 с расчетной ЕС50 25,4 пМ, в то время как рассчитанная ЕС50 для референсной молекулы "(scFv)2" составляет 57 пМ, показывая немного более высокую силу молекулы "1+1 без Fc" в отношении ЕС50.
Фиг. 20: Активация CD4+ или CD8+ Т-клеток, измеренная по повышающей регуляции CD69 (А), соответствующему повышению числа CD69-положительных клеток (В) в присутствии huMCSP-положительных опухолевых клеток MV-3 при совместном культивировании с РВМС человека (соотношение Е:Т = 10:1), обработанными CD3-MCSP-биспецифическими конструкциями (hu Fab(MCSP)-Crossfab(CD3); обозначена как "1+1 без Fc", и референсной молекулой (scFv)2 (антиМСSР/антиhuCD3e) (="(scFv)2"), соответственно) в течение примерно 24 часов. В целом, медианные значения CD69 выше на CD8+ Т-клетках по сравнению с CD4+ Т-клетками. Существует четкое зависимое от концентрации увеличение как медианных значений CD69, так и процента CD69-положительных клеток для обеих конструкций.
Фиг. 21: Иллюстрация референсной молекулы (scFv)2.
Фиг. 22: Анализ продукции и очистки (scFv)2 (антиМСSР/антиhuCD3e). SDS-Page: 4-12% Bis/Tris (NuPage [invitrogen]; окрашенный Кумасси): 1 - Mark 12 (invitrogen), 2 - (scFv)2 (антиМСSР/антиhuCD3e) восстановленные условия; 3 - (scFv)2 (антиМСSР/антиhuCD3e), невосстановленные условия.
Figure 23: Анализ продукции и очистки (scFv)2 (антиМСSР/антиhuCD3e) Аналитическая эксклюзионная хроматография, хроматограмма А280 (Superdex 75 10/300 GL [GE Healthcare]; 2 мМ MOPS pH 7,3, 150 мМ NaCl, 0,02% (w/v) NaCl; вводили 50 мкг образца ((scFv)2 (антиМСSР/антиhuCD3e))).
Подробное описание воплощений изобретения
I. Определения
Понятие "каркасного участка", или "FR", относится к остаткам вариабельных доменов, которые отличаются от остатков гипервариабельных областей (HVR). FR вариабельного домена обычно состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно следуют в VH (или VL) в следующей последовательности: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
"Акцепторная человеческая каркасная область" в контексте данного изобретения является каркасной областью, включающей аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасной области вариабельного домена тяжелой цепи (VH), полученной из каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области, определенной ниже. Акцепторная человеческая каркасная область, "полученная из" каркасной области человеческого иммуноглобулина или консенсусной человеческой каркасной области, может содержать одну и ту же аминокислотную последовательность, или она может содержать аминокислотные замены. В некоторых воплощениях число аминокислотных замен составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее, или 2 или менее. В некоторых воплощениях акцепторная человеческая каркасная область VL по своей последовательности идентична VL каркасной последовательности человеческого иммуноглобулина или консенсусной человеческой каркасной последовательности.
"Человеческая консенсусная каркасная область" является каркасной областью, которая представляет наиболее часто встречающиеся аминокислотные остатки в выборе каркасных областей последовательностей VL или VH человеческого иммуноглобулина. Как правило, выбор VL- или VH-последовательностей человеческого иммуноглобулина осуществляется из подгруппы последовательностей вариабельного домена. Как правило, подгруппа последовательностей является такой подгруппой, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одном воплощении для VL подгруппа является подгруппой каппа I, описанной в Kabat et al., см. выше. В одном воплощении для VH подгруппа является подгруппой III, описанной в Kabat et al., см. выше.
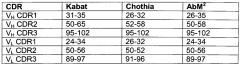
Термины "гипервариабельная область" или "HVR", используемые в данном документе, относятся к областям вариабельного домена антитела, которые являются гипервариабельными в последовательности и/или формируют структурно определенные петли ("гипервариабельные петли"). Как правило, нативные четырехцепочечные антитела состоят из шести HVR, три в VH (Н1, Н2, Н3) и три в VL (L1, L2, L3). HVR, как правило, содержат аминокислотные остатки из гипервариабельных петель и/или из "областей, определяющих комплементарность" (CDR), причем последние имеют наивысшую изменчивость последовательности и/или участвуют в распознавании антигена. Типичные гипервариабельные петли возникают на аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3). (Chothia, C. and Lesk, A.M., J. Mol. Biol. 196 (1987) 901-917). Типичные CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-Н3) возникают на аминокислотных остатках 24-34 в L1, 50-56 в L2, 89-97 в L3, 31-35 В в Н1, 50-65 в Н2 и 95-102 в Н3 (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Термины "гипервариабельные области" (HVR) и "области, определяющие комплементарность" (CDR) используются в данном документе взаимозаменяемо по отношению к участкам вариабельной области, которые образуют антигенсвязывающие области. Данная конкретная область была описана Kabat et al., U.S. Dept. of Health and Human Services, "Sequences of Proteins of Immunological Interest" (1983) и Chothia et al., J. Mol. Biol. 196: 901-917 (1987), где определения включают перекрывание или подгруппы аминокислотных остатков при их сравнении друг с другом. Тем не менее, применение определения к CDR антитела или его вариантов находится в рамках термина, определенного и используемого в данном документе. Соответствующие аминокислотные остатки, которые охватывают CDR, определенные каждой из приведенных выше ссылок, приведены ниже в таблице 1 в качестве сравнения. Точное число аминокислотных остатков, которые охватывают конкретный CDR, будет варьировать в зависимости от последовательности и размера CDR. Специалист в данной области сможет легко определить, какие остатки содержит конкретный CDR с данной аминокислотной последовательностью вариабельной области антитела.
| Таблица 1. | |
| Определения CDR1 | |
| 1 Нумерация всех определений CDR в таблице 1 проводится в соответствии с правилами нумерации, установленными Kabat et. al. (см. ниже). | |
| 2 "AbM" со строчной "b", используемый в таблице 1, относится к CDR, определенным с помощью программного обеспечения моделирования антитела "AbM" от Oxford Molecular. |
Kabat et al. также описали систему нумерации последовательностей вариабельных областей, которая применима к любому антителу. Специалист в данной области сможет однозначно приписать эту систему "нумерации Кабата" к любой последовательности вариабельной области без опоры на какие-либо экспериментальные данные за пределами самой последовательности. Используемое в данном документе понятие "нумерации Кабата" относится к системе нумерации, предложенной в Kabat et al., U.S. Dept. of Health and Human Services, "Sequence of Proteins of Immunological Interest" (1983). Если не указано иное, то ссылки на нумерацию определенных позиций аминокислотных остатков в вариабельной области антитела даются в соответствии с системой нумерации Кабата.
За исключением CDR1 в VH, CDR, как правило, содержат аминокислотные остатки, которые образуют гипервариабельные петли. CDR также включают "остатки, определяющие специфичность", или "SDR", которые являются остатками, которые контактируют с антигеном. SDR содержатся в областях CDR, называемых сокращенно -CDR, или a-CDR. Типичные a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-Н3) возникают на аминокислотных остатках 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35 В в Н1, 50-58 в Н2 и 95-102 в Н3. (см. Almagro and Fransson, Front. Biosci. 13: 1619-1633 (2008)). Если не указано иное, то HVR-остатки и другие остатки в вариабельном домене (например, FR-остатки) пронумерованы в данном документе в соответствии с Kabat et al., см. выше.
Термин "антитело" используется в данном документе в самом широком смысле и охватывает различные структуры антител, включая (но не ограничиваясь ими) моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), а также фрагменты антител до тех пор, пока они проявляют желаемую антигенсвязывающую активность. В частности, термин "антитело" включает биспецифические антитела изобретения, содержащие по меньшей мере два Fab-фрагмента, но не содержащие Fc-домен.
Термин "биспецифическая" означает, что антигенсвязывающая молекула способна специфически связываться по меньшей мере с двумя различными антигенными детерминантами. В некоторых воплощениях биспецифическая антигенсвязывающая молекула способна одновременно связывать две антигенные детерминанты, в частности, две антигенные детерминанты, экспрессированные на двух различных клетках.
Термин "моновалентное связывание с антигеном" означает, что не более чем один антиген, содержащийся в антителе, специфически связывается с этим антигеном.
"Человеческое антитело" является таким антителом, которое обладает аминокислотной последовательностью, соответствующей антителу, которое продуцируется человеком и/или человеческой клеткой или получено из нечеловеческого источника, который использует репертуар человеческих антител или других человеческих последовательностей, кодирующих антитело. Это определение человеческого антитела, в частности, исключает гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
Термин "рекомбинантное человеческое антитело", используемый в данном документе, включает все человеческие антитела, которые получены, экспрессированы, созданы или выделены рекомбинантными способами, например, антитела, выделенные из клетки-хозяина, такой как клетка NS0 или СНО, или животного (например, мыши), которая является трансгенной по генам иммуноглобулина человека, или антитела, экспрессированные с использованием рекомбинантного экспрессионного вектора, которым трансфицирована клетка-хозяин. Такие рекомбинантные человеческие антитела имеют вариабельные и константные области в перегруппированной форме. Рекомбинантные человеческие антитела в соответствии с изобретением были подвергнуты соматической гипермутации in vivo. Таким образом, аминокислотные последовательности VH- и VL-областей рекомбинантных антител представляют собой последовательности, которые, будучи полученными или родственными человеческим зародышевым последовательностям VH и VL, могут не существовать в природе в репертуаре человеческой зародышевой линии антитела in vivo.
"Гуманизированное" антитело относится к химерному антителу, содержащему аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых воплощениях гуманизированное антитело будет содержать по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все HVR (например, CDR) соответствуют таковым в нечеловеческом антителе, и все или по существу все FR соответствуют таковым в человеческом антителе. Гуманизированное антитело, возможно, может содержать по меньшей мере часть константной области антитела, полученной из человеческого антитела. "Гуманизированная форма" антитела, например, нечеловеческого антитела, относится к антителу, которое подверглось гуманизации. Другие формы "гуманизированных антител", охватываемые данным изобретением, являются такими, в которых константная область была дополнительно модифицирована или изменена по сравнению с исходным антителом, чтобы получить свойства в соответствии с изобретением, особенно в отношении C1q-связывания и/или Fc-рецепторного (FcR) связывания.
Термин "химерное антитело" относится к антителу, в котором часть тяжелой и/или легкой цепи получена из конкретного источника или вида, в то время как оставшаяся часть тяжелой и/или легкой цепи получена из другого источника или вида, особенно к полученному с помощью методик рекомбинантной ДНК. Предпочтительными являются химерные антитела, содержащие мышиную вариабельную область и человеческую константную область. Другими предпочтительными формами "химерных антител", охватываемыми данным изобретением, являются те, в которых константную область модифицировали или изменяли по сравнению с исходным антителом, создавая свойства в соответствии с изобретением, особенно в отношении C1q-связывания и/или Fc-рецепторного (FcR) связывания. Такие химерные антитела также называют "антителами с переключением класса". Химерные антитела являются продуктом экспрессированных иммуноглобулиновых генов, содержащих сегменты ДНК, кодирующие вариабельные области иммуноглобулинов, и сегменты ДНК, кодирующие константные области иммуноглобулинов. Способы получения химерных антител включают обычные методики рекомбинантной ДНК и генной трансфекции, в настоящее время хорошо известные в данной области. См., например, Morrison, S.L., et al., Proc. Natl. Acad Sci. USA 81 (1984) 6851-6855; патенты США №№5202238 и 5204244.
Термин "моноклональное антитело", используемый в данном документе, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. из популяции, состоящей из отдельных антител, которые являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантных антител, например, содержащих встречающиеся в природе мутации или образованных во время производства препарата моноклонального антитела, которые могут присутствовать в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклонального антитела направлено против одной детерминанты на антигене. Таким образом, указатель "моноклональное" указывает на характер антитела, которое было получено из популяции по существу гомогенных антител, и не должен быть истолкован как требующий получения антитела каким-либо конкретным способом. Например, моноклональные антитела, используемые в соответствии с данным изобретением, могут быть получены с помощью различных методик, включая, но не ограничиваясь ими, гибридомную методику, рекомбинантную ДНК-методику, методики фагового дисплея, а также методики с использованием трансгенных животных, содержащих все или часть человеческих иммуноглобулиновых локусов, и такие методики и другие иллюстративные методики получения моноклональных антител описаны в данном документе.
Понятие "фрагмент антитела" относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, связывающую антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают, но не ограничиваясь ими, Fv, Fab-, Fab′-, Fab′-SH, F(ab′)2; димерные антитела; линейные антитела; одноцепочечные молекулы антител (например scFv); и полиспецифические антитела, образованные из фрагментов антител. scFv-антитела описаны, например, в Houston, J.S., Methods in Enzymol. 203 (1991) 46-96). Кроме того, фрагменты антител включают одноцепочечные полипептиды, имеющие характеристики VH-домена, а именно возможность группироваться с VL-доменом, или VL-домена, а именно возможность группироваться с VH-доменом для образования функционального антигенсвязывающего сайта и тем самым обеспечения антигенсвязывающего свойства полноразмерных антител.
Используемое в данном документе понятие "Fab-фрагмента" относится к фрагменту антитела, содержащему фрагмент легкой цепи с VL-доменом и константным доменом легкой цепи (CL), и VH-домен и первый константный домен (СН1) тяжелой цепи. Биспецифические антитела изобретения содержат по меньшей мере два Fab-фрагмента, где либо вариабельные области, либо константные области тяжелой и легкой цепи второго Fab-фрагмента меняются. В связи с обменом вариабельных областей или константных областей указанный Fab-фрагмент также упоминается как "кросс-Fab-фрагмент" или "xFab-фрагмент" или "перекрестный Fab-фрагмент". Возможны два разных состава цепей перекрестной Fab-молекулы, и они включены в биспецифические антитела изобретения: с одной стороны, вариабельные области тяжелой и легкой Fab-цепи меняются, т.е. перекрестная Fab-молекула содержит пептидную цепь, состоящую из вариабельной области легкой цепи (VL) и константной области тяжелой цепи (СН1), а пептидная цепь состоит из вариабельной области тяжелой цепи (VH) и константной области легкой цепи (CL). Эта перекрестная Fab-молекула также упоминается как CrossFab(VLVH). С другой стороны, когда константные области тяжелой и легкой цепи Fab-фрагмента меняются, перекрестная Fab-молекула содержит пептидную цепь, составленную из вариабельной области тяжелой цепи (VH) и константной области легкой цепи (CL), и пептидную цепь, составленную из вариабельной области легкой цепи (VL) и константной области тяжелой цепи (СН1). Эта перекрестная Fab-молекула также упоминается как CrossFab(CLCH1).
В одном воплощении указанные Fab-фрагменты соединены через пептидный линкер. Под "соединением" понимается, что Fab-фрагменты связаны пептидными связями либо непосредственно, либо через один или более чем один пептидный линкер.
Термин "пептидный линкер", используемый в изобретении, обозначает пептид с аминокислотными последовательностями, который предпочтительно имеет синтетическое происхождение. Эти пептидные линкеры в соответствии с изобретением используются для соединения одного из Fab-фрагментов с С- или N-концом другого Fab-фрагмента, чтобы сформировать полиспецифическое антитело в соответствии с изобретением. Предпочтительно указанные пептидные линкеры представляют собой пептиды с аминокислотной последовательностью с длиной по меньшей мере 5 аминокислот, предпочтительно с длиной от 5 до 100, более предпочтительно от 10 до 50 аминокислот. В одном воплощении указанный пептид линкер представляет собой (GxS)n или (GxS)nGm, где G = глицин, S = серин, и (х=3, n=3, 4, 5 или 6, и m=0, 1, 2 или 3) или (х=4, n=2, 3, 4 или 5 и m=0, 1, 2 или 3), предпочтительно х=4 и n=2 или 3, более предпочтительно с х=4, n=2. Кроме того, линкеры могут содержать шарнирную область иммуноглобулина (или ее часть). В одном воплощении указанный пептидный линкер представляет собой (G4S)2 (SEQ ID №28). Другими линкерными пептидами, подходящими для соединения Fab-фрагментов, являются, например, (G4S)6-GG (SEQ ID №147) или (SG3)2-(SEG3)4-(SG3)-SG (SEQ ID №148), или EPKSC(D)-(G4S)2 (SEQ ID №№145 и 146).
Термин "антигенсвязывающий домен" относится к части антигенсвязывающей молекулы, которая содержит область, которая специфически связывается с частью или целым антигеном и является комплементарной ему. Если антиген является большим, то антигенсвязывающая молекула может связываться тольк