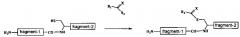Способ высокоэффективного получения полипептидного фрагмента, подходящего для ncl
Иллюстрации
Показать всеИзобретение относится к способу эффективного получения полипептидного фрагмента, подходящего для связывания способом NCL. Способ получения включает стадию взаимодействия полипептида, состоящего из первого полипептидного фрагмента, имеющего на N-конце цистеиновый аминокислотный остаток, и второго полипептидного фрагмента, связанного через вставочную последовательность -Cys-W-(His)n-Z-Met- с CNBr для получения первого полипептидного фрагмента, имеющего на N-конце цистеиновый аминокислотный остаток, и третьего полипептидного фрагмента, стадию последующего взаимодействия с третьим полипептидным фрагментом с соединением, представленным формулой (I), и соединением, представленным формулой (II), для получения второго полипептидного фрагмента, имеющего модифицированный С-конец. Способ эффективен для получения множественных пептидных фрагментов. Также способ позволяет легче, чем при традиционном способе, выполнить сайт-специфическое гликозирование. 2 н. и 17 з.п. ф-лы, 6 ил., 1 пр.
Химическая формула 1
Химическая формула 2
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу эффективного получения полипептидного фрагмента, подходящего для NCL.
Уровень техники
Известны разные способы синтеза белка: биосинтез, химический синтез, бесклеточный синтез. Для биосинтеза используют Е. coli, в клетки которой встраивают ДНК, кодирующую нужный белок, и добиваются экспрессии этого белка. При химическом синтезе целевой белок синтезируют путем последовательного связывания аминокислот методами органической химии. А при бесклеточном синтезе белок синтезируют без клеток с помощью ферментов, присутствующих в различных клетках, например в Е. coli. Перечисленные способы можно использовать изолированно или комбинируя друг с другом в зависимости от цели применения белка, его размера и свойств.
Чтобы синтезировать белок с модифицированной структурой, включающей сахарную цепочку или липид в средней части аминокислотной последовательности, использован способ отдельного синтеза пептидного фрагмента, содержащего сахарную цепочку, и пептидного фрагмента без сахарной цепочки и последующего лигирования этих фрагментов в молекулу целевого белка. Пептидный фрагмент, содержащий сахарную цепочку можно синтезировать химическим путем, используя аминокислоту, предварительно модифицированную сахарной цепочкой, липидом и т.д. Кроме того, пептидный фрагмент, не содержащий сахарной цепочки, можно получить путем химического синтеза или биосинтеза.
Твердофазный синтез в основном применяют в качестве способа химического синтеза пептидной цепи. Однако пептидная цепь, полученная с помощью твердофазного синтеза, обычно короткая и содержит около 50 аминокислотных остатков.
Имеются сообщения о различных способах связывания пептидных цепей, и одним их таких способов, имеющих широкое применение, является способ нативного химического лигирования (NCL - Native Chemical Ligation). Способом NCL можно соединить незащищенные пептидные цепи; этот способ применим для получения естественной амидной (пептидной) связи в месте лигирования (см. ссылку 1 в патентной литературе). Способ NCL представляет собой избирательную химическую реакцию между первым пептидом, имеющим сложную альфа-карбокситиоэфирную часть на C-конце, и вторым пептидом, имеющим цистеиновый остаток на N-конце, в котором тиоловая группа в боковой цепи цистеина (SH-группа называется также сульфгидрильной группой) избирательно реагирует с карбонильным атомом углерода сложной тиоэфирной группы и в реакции обмена тиоловой группы образуется ранний промежуточный продукт со сложной тиоэфирной связью. В этом промежуточном продукте происходит спонтанная внутримолекулярная перестройка, приводящая к смещению амидной связи к месту лигирования и восстановлению тиоловой группы боковой цепи цистеина.
NCL является способом, позволяющим связать две пептидные цепи с помощью пептидной связи путем обычного перемешивания в буферном растворе. С помощью способа NCL избирательно связывают С-конец одного пептида с N-концом другого пептида, даже в случае если реакция происходит между соединениями, имеющими многочисленные функциональные группы, например между пептидами. В связи с этим в синтезе белка важно, как применяется способ NCL.
Однако при применении способа NCL стоит проблема получения сложной тиоэфирной формы пептида, имеющего сложную альфа-карбокситиоэфирную часть на C-конце, которая необходима как исходный материал. Хотя сообщается о существовании различных способов получения пептидных сложных тиоэфиров (источник 1 в непатентной литературе и источник 2 в патентной литературе), в основе всех способов лежит твердофазный синтез, поэтому все они имеют присущие ему ограничения, и размер пептидного сложного тиоэфира, который можно синтезировать с помощью этих способов, ограничен. Кроме того, при применении способа, в котором используется линкер, необходимо отдельно путем химического синтеза получить неприродное или особое производное аминокислоты, в связи с чем способ NCL не всегда прост.
Между тем, в литературе сообщалось также о способе получения полипептидного фрагмента в форме сложного тиоэфира (интеиновый способ) путем биосинтеза (источник 2 в непатентной литературе). Однако при применении данного способа экспрессии полипептида, а также для белкового сплайсинга понадобится целевая пептидная последовательность, и экспрессированный интеин-белковый комплекс всегда должен быть упакован в присущую ему трехмерную структуру. В связи с этим получение пептидного сложного тиоэфира не всегда зависит от полипептидной последовательности, которую предстоит экспрессировать, необходимо всегда оптимизировать условия биосинтеза, а также учитывать его сложность.
Кроме того, в литературе, помимо интеинового способа, сообщается также о способе получения сложного тиоэфира, который можно применить к полипептиду, полученному путем биосинтеза (источник 3 в патентной литературе). Это способ активирования цистеина, содержащегося в синтезированном полипептиде, и расщепления с его помощью сложного тиоэфира в положении активированного остатка цистеина. Иными словами, на N-конце активированного остатка цистеина можно получить пептидный фрагмент в форме сложного тиоэфира. Однако при данном способе полипептид, расщепленный на C-конце активированного остатка цистеина, после расщепления образует на своем N-конце стабильную циклическую структуру и поэтому не может быть использован в дальнейшем при синтезе белка. В связи с этим возникла необходимость в отдельном получении пептидного фрагмента на N-конце пептидного фрагмента, подлежащего лигированию.
Кроме того, несмотря на то что при биосинтезе экспрессируются полноразмерные молекулы белков, экспрессия пептидных фрагментов иногда оказывается неполноценной, например, из-за того, что они воспринимаются клеткой как ошибочные, и экспрессированный пептид разрушается. Соответственно, когда при упомянутом выше способе необходимый пептидный фрагмент после биосинтеза полноразмерного белка отщепляется в виде сложного тиоэфира, полипептид с длинной цепью на C-конце отщепленного пептидного фрагмента не может быть использован.
Список литературы
[Патентная литература 1] International Publication No. 96/34878
[Патентная литература 2] International Publication No. 2007/114454
[Патентная литература 3] International Publication No. 2010/150730
[Непатентная литература]
[Непатентная литература 1] Ingenito et al., J. Am. Chem. Soc. 1999, 121, 11369-11374
[Непатентная литература 2] Schwartz et al., CHEM. COMMUN., 2003 2087-2090
Сущность изобретения
Задачи, которые призвано решить данное изобретение
Цель настоящего изобретения состоит в том, чтобы представить эффективный способ получения первого полипептидного фрагмента, имеющего цистеиновый остаток на N-конце, и второго полипептидного фрагмента, имеющего модифицированный С-конец, которые подходят для лигирования способом NCL.
Средства для решения поставленных задач
Авторы настоящего изобретения в результате многократных экспериментов обнаружили, что первый полипептидный фрагмент, имеющий цистеиновый остаток на N-конце, и второй полипептидный фрагмент, имеющий модифицированный С-конец, которые подходят для соединения способом NCL, можно получить в виде одного полипептида с особой вставленной последовательностью.
Иными словами, настоящее изобретение относится к способу эффективного получения первого полипептидного фрагмента, имеющего на N-конце цистеиновый остаток, и второго полипептидного фрагмента, имеющего модифицированный С-конец, которые можно соединить способом NCL, включающим:
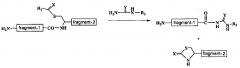
1) Стадию взаимодействия полипептида, имеющего следующую структуру:
(N-концевой) второй полипептидный фрагмент-Cys-W-(His)n-Z-Met-первый полипептидный фрагмент (C-концевой),
где n является целым числом от 0 до 10, Cys означает цистеин, W означает 1, 2 или 3 аминокислоты, Z означает 0, 1 или 2 аминокислоты, His означает гистидин, Met означает метионин, а N-концом первого полипептидного фрагмента является цистеиновый остаток
и для получения приведенных ниже полипептидных фрагментов используется цианид брома CNBr:
(A) первый полипептидный фрагмент, имеющий на N-конце цистеиновый остаток и
(B) третий полипептидный фрагмент, имеющий следующую структуру:
(N-концевой) второй полипептидный фрагмент-Cys-W-(His)n-Z-Met′ (C-концевой) [где Met′ означает производное Met]; и
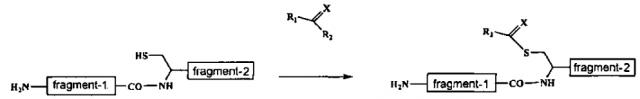
(2) Стадию взаимодействия упомянутого третьего полипептидного фрагмента с соединением, имеющим следующую формулу (I):
[Химическая формула 1]
где
X является атомом серы или кислорода и
R1 и R2 являются удаляемыми группами,
и затем с соединением в органическом растворителе, имеющим следующую формулу (II):
Химическая формула 2
где
Y является атомом кислорода, атомом серы или =NH и
R3 является атомом водорода, ацильной группой или алкоксикарбонильной группой,
для получения второго полипептидного фрагмента, имеющего модифицированный С-конец следующей структуры:
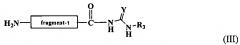
(N-концевой) второй полипептидный фрагмент-C(=O)-NH-С(=Y)NHR3 (C-концевой).
Один вариант осуществления способа по изобретению отличается тем, что включает в себя еще и стадию взаимодействия второго полипептидного фрагмента, имеющего модифицированный С-конец и полученного на упомянутой стадии (2), с тиолом, представленным формулой:
R4-SH,
где R4 является любой из групп, выбираемых из группы, состоящей из замещенной или незамещенной бензильной группы, замещенной или незамещенной арильной группы и замещенной или незамещенной алкильной группы
и обмена -NH-C(=Y)NHR3 группы на C-конце с тиоловой группой для получения второго полипептидного фрагмента, имеющего модифицированный С-конец следующей структуры:
(N-концевой) второй полипептидный фрагмент-C(=O)-SR4 (C-концевой).
Кроме того, в одном варианте осуществления способ по изобретению отличается тем, что X в соединении, представленном упомянутой формулой (I) является атомом серы.
Кроме того, в одном варианте осуществления способ по изобретению отличается тем, что R1 в соединении, представленном упомянутой формулой (I), является -O-C6 арильной группой.
Кроме того, в одном варианте осуществления способ по изобретению отличается тем, что R2 в соединении, представленном упомянутой формулой (I), является атомом галогена или замещенной или незамещенной -S-C6-10 арильной группой.
Кроме того, в одном варианте осуществления способ по изобретению отличается тем, что Y в соединении, представленном упомянутой формулой (II), является =NH.
Кроме того, в одном варианте осуществления способ по изобретению отличается тем, что R3 в соединении, представленном упомянутой формулой (II), является ацетильной группой.
Кроме того, в одном варианте осуществления способ по изобретению отличается тем, что упомянутый полипептид, имеющий следующую структуру:
(N-концевой) второй полипептидный фрагмент-Cys-W-(His)n-Z-Met-первый полипептидный фрагмент (C-концевой),
является рекомбинантным полипептидным фрагментом, экспрессируемым клеткой.
Кроме того, в одном варианте осуществления способ по изобретению отличается тем, что упомянутой клеткой является Е. coli.
Кроме того, в одном варианте осуществления способ по изобретению отличается тем, что W является аминокислотой, выбираемой из группы, состоящей из Val, Ile, Leu и Trp.
Кроме того, в одном варианте осуществления способ по изобретению отличается тем, что n является целым числом от 6 до 10.
Кроме того, другой объект настоящего изобретения относится к способу получения первого полипептидного фрагмента, имеющего на N-конце цистеиновый остаток, подходящего для применения способа NCL, и отличается тем, что полипептид, имеющий следующую структуру:
(N-концевой) второй полипептидный фрагмент-P-Met-первый полипептидный фрагмент (C-концевой),
где P является любым количеством аминокислот от 0 до 10, Met означает метионин, а N-концевым остатком полипептидного фрагмента является цистеиновый остаток,
взаимодействует с CNBr.
Кроме того, другой объект настоящего изобретения относится к способу получения гликозилированного полипептида, включающему:
(1) Стадию классификации и конструирования пептидной последовательности целевого гликозилированного полипептида, получаемого в виде по меньшей мере:
- полипептидного фрагмента, содержащего сахарную цепочку, который состоит из полипептида, содержащего гликозилированную аминокислоту,
- второго полипептидного фрагмента на N-концевой части полипептидного фрагмента, содержащего сахарную цепочку и состоящего из полипептида, содержащего N-концевую часть целевого гликозилированного пептида,
- первого полипептидного фрагмента на C-концевой части полипептидного фрагмента, содержащего сахарную цепочку и состоящего из полипептида, содержащего C-концевую часть целевого гликозилированного пептида.
- полипептидного фрагмента между полипептидным фрагментом, содержащим сахарную цепочку, и вторым полипептидным фрагментом, если присутствие такого фрагмента возможно, и
- полипептидного фрагмента, если присутствие такого фрагмента возможно, между полипептидным фрагментом, содержащим сахарную цепочку, и первым полипептидным фрагментом, в котором первый полипептидный фрагмент сконструирован так, чтобы на N-конце его был цистеиновый остаток.
(2) Стадию получения полипептидного фрагмента, имеющего упомянутую структуру, с помощью вектора экспрессии, включающего нуклеотидную последовательность, кодирующую полипептид следующей структуры:
(N-конец) второй полипептидный фрагмент-Cys-W-(His)n-Z-Met-первый полипептидный фрагмент (С-конец),
где n равно целому числу от 0 до 10, Cys означает цистеин, W означает 1, 2 или 3 аминокислоты, Z означает 0, 1 или 2 аминокислоты, His означает гистидин, a Met означает метионин и N-концевым аминокислотным остатком первого полипептидного фрагмента является цистеин
и обеспечивающую возможность экспрессии клетками Е. coli;
(3) Стадию взаимодействия полипептида со стадии (2) с CNBr для получения следующих полипептидных фрагментов:
(A) первого полипептидного фрагмента с цистеиновым аминокислотным остатком на N-конце и
(B) третьего полипептидного фрагмента следующей структуры:
(N-конец) второй полипептидный фрагмент-Cys-W-(His)n-Z-Met′ (С-конец),
где Met′ означает производное Met;
(4) Стадию взаимодействия упомянутого третьего полипептидного фрагмента с соединением, представленным следующей формулой (I):
Химическая формула 3
где X является атомом серы или атомом кислорода, a R1 и R2 являются удаляемыми группами,
и затем взаимодействия в органическом растворителе с соединением, представленным следующей формулой (II):
Химическая формула 4
где
Y является атомом кислорода, атомом серы или NH группой, и
R3 является атомом водорода, ацильной группой или алкоксикарбонильной группой,
для получения второго полипептидного фрагмента с модифицированным С-концом, имеющего следующую структуру:
(N-концевой) второй полипептидный фрагмент-C(=O)-NH-C(=Y)NHR3 (C-концевой);
(5) Условно стадию взаимодействия второго полипептидного фрагмента, имеющего модифицированный С-конец и полученного на стадии (4), с тиолом, представленным следующей формулой
R4-SH,
в которой R4 является одной какой-либо группой, выбираемой из группы, состоящей из замещенной или незамещенной бензильной группы, замещенной или незамещенной арильной группы и замещенной или незамещенной алкильной группы,
и обмена -NH-C(=Y)NHR3 группы на C-конце с тиоловой группой для получения второго полипептидного фрагмента с модифицированным С-концом, имеющим следующую структуру:
(N-концевой) второй полипептидный фрагмент-C(=O)-SR4 (C-концевой); и
(6) Стадию связывания:
- упомянутого полипептидного фрагмента, содержащего сахарную цепочку,
- упомянутого полипептидного фрагмента, если присутствие его возможно, между полипептидным фрагментом, содержащим сахарную цепочку, и вторым полипептидным фрагментом и
- упомянутого полипептидного фрагмента, если присутствие его возможно, между полипептидным фрагментом, содержащим сахарную цепочку, и первым полипептидным фрагментом, полученным отдельно химическим синтезом с:
первым полипептидным фрагментом, имеющим на N-конце цистеиновый аминокислотный остаток и полученным на стадии (3) и
вторым полипептидным фрагментом, имеющим модифицированный С-конец и полученным на стадиях (4) и (5)
в порядке, который позволит получить целевой гликозилированный полипептид с помощью лигирования.
Кроме того, в одном варианте осуществления изобретения способ получения гликозилированного полипептида отличается тем, что X в соединении, представленном формулой (I), является атомом серы.
Кроме того, в одном варианте осуществления изобретения способ получения гликозилированного полипептида отличается тем, что R1 в соединении, представленном формулой (I), является -O-C6 арильной группой.
Кроме того, в одном варианте осуществления изобретения способ получения гликозилированного полипептида отличается тем, что R2 в соединении, представленном в формуле (I), является атомом галогена или замещенной либо незамещенной -S-C6-10 арильной группой.
Кроме того, в одном варианте осуществления изобретения способ получения гликозилированного полипептида отличается тем, что Y в соединении, представленном формулой (II), является NH группой.
Кроме того, в одном варианте осуществления изобретения способ получения гликозилированного полипептида отличается тем, что R3 в соединении, представленном формулой (II), является ацетильной группой.
Кроме того, в одном варианте осуществления изобретения способ получения гликозилированного полипептида отличается тем, что W является какой-либо аминокислотой, которую выбирают из группы, состоящей из Val, Ile, Leu и Trp.
Кроме того, в одном варианте осуществления изобретения способ получения гликозилированного полипептида отличается тем, что n соответствует любому числу из 6-10.
Эффект от изобретения
В настоящем изобретении предложен способ эффективного получения первого полипептидного фрагмента, имеющего на N-конце цистеиновый остаток, и второго полипептидного фрагмента, имеющего модифицированный С-конец, подходящих для соединения способом NCL.
Кроме того, в соответствии с настоящим изобретением доступный для лигирования пептидный фрагмент, даже если он не может экспрессироваться, можно экспрессировать связанным с другим пептидным фрагментом; способ по изобретению эффективен также в получении множественных пептидных фрагментов.
Кроме того, комбинируя способ по изобретению с традиционными способами синтеза пептидов, можно легко получить длинные цепи пептидов, имеющих модифицированные участки, которые до этого трудно было синтезировать, например, можно использовать способ по изобретению для получения относительно длинной полипептидной цепи из немодифицированных фрагментов, получаемых путем биосинтеза, и твердофазный синтез модифицированного фрагмента, и затем соединить их.
В частности, если модификация состоит в присоединении сахарной цепочки, можно легко получить более длинный пептид с сахарной цепочкой, конструируя путем химического синтеза только фрагмент, содержащий аминокислоту с нативной сахарной цепочкой, и другие пептидные участки путем биосинтеза и затем соединять подходящие пептидные фрагменты с модифицированным фрагментом, лигируя их способом по изобретению.
Кроме того, хорошо известен способ последующего добавления сахарной цепочки и т.д. в пептидную цепь с помощью линкера и возможно также последующее добавление сахарной цепочки к длинной пептидной цепи, полученной путем биосинтеза. Тем не менее, при этом способе связывания с помощью линкера сахарную цепочку и т.д. связывают, использую конкретную аминокислоту или другую структуру. И соответственно, если, например, в пептиде имеется много сайтов, в которых к пептиду можно присоединить сахарную цепочку, то способом по изобретению легче, чем при традиционном способе, выполнить сайт-специфическое гликозилирование. Для этого получают пептид с длинной цепью с помощью биосинтеза, отщепляют от него пептидный фрагмент, содержащий только целевую связывающую область длинной цепи пептида, добавляют в нее сахарную цепочку сахара и затем вновь связывают фрагмент с остальной частью пептида.
Как было показано выше, способ тиоэстерификации пептида, представленный в изобретении, применим для синтеза белка вообще.
Краткое описание фигур
На фиг. 1 показана последовательность генетической информации вектора pET32a для экспрессии полипептида в одном варианте осуществления изобретения.
На фиг. 2 приведена схема биосинтеза полипептидного фрагмента, имеющего вставочную последовательность по изобретению, в клетках Е. coli в одном варианте осуществления изобретения.
На фиг. 3 приведена фотография экспрессированного белка, очищенного на никелевой колонке. Обозначения на фиг. 3: М означает молекулярную массу, Е означает экспрессированную смесь, P означает фракцию, которая течет через колонку, 1-8 - номера фракций, элюированных с помощью 250 мМ имидазола, и В (blank) означает холостой образец.
На фиг. 4 показана схема стадии расщепления полипептидного фрагмента, имеющего вставочную последовательность, экспрессируемого Е. coli, на два полипептидных фрагмента с помощь CNBr в одном варианте осуществления изобретения. Тиоредоксин, добавляемый через метионин к N-концу полипептидного фрагмента, экспрессируемого E. coli, также расщепляется при обработке CNBr.
На фиг. 5a показан результат анализа с помощью ВЭЖХ продукта деградации после обработки CNBr. На фиг. 5b показан результат масс-спектрометрии пептидного фрагмента A, который является производным интерлейкина-13 и имеет его аминокислотную последовательность 1-27. На фиг. 5c показан результат масс-спектрометрии пептидного фрагмента D, который является производным ИЛ-13 и имеет его аминокислотную последовательность 56-112.
На фиг. 6 схематически представлен вариант осуществления изобретения, при котором способ по изобретению применен для получения полипептидного фрагмента, подходящего для лигирования способом NCL; показано разделение производного интерлейкина-13 на четыре полипептидных фрагмента и биосинтез фрагментов A и D в виде слитых белков, имеющих вставочную последовательность.
Описание вариантов осуществления изобретения
Далее будут описаны предпочтительные варианты осуществления изобретения.
Настоящее изобретение включает в себя стадию взаимодействия полипептидом, имеющего следующую структуру (i)
(N-концевой) второй полипептидный фрагмент-Cys-W-(His)n-Z-Met-первый полипептидный фрагмент (C-концевой)…(i),
где n означает любое целое число от 0 до 10, Cys означает цистеин, W означает 1, 2 или 3 аминокислоты, Z означает 0, 1 или 2 аминокислоты, His означает гистидин, Met означает метионин, а N-концевым остатком первого полипептидного фрагмента является цистеиновый остаток,
с CNBr для получения следующих полипептидных фрагментов:
(A) первого полипептидного фрагмента, в котором N-концевым аминокислотным остатком является цистеиновый остаток, и
(B) третьего полипептидного фрагмента, имеющего следующую структуру (ii):
(N-концевой) второй полипептидный фрагмент-Cys-W-(His)n-Z-Met′ (C-концевой)…(ii),
где Met′ означает производное Met.
Понятие «пептид» в описании не имеет каких-либо ограничений и подразумевает две или более аминокислоты, связанные между собой амидной связью; оно включает в себя хорошо известные и новые пептиды, а также измененные пептиды. Молекулы, которые упоминаются в описании как белки, также включены в пептиды. Кроме того, «полипептид» аналогичным образом включен в понятие «пептиды». Пептидная цепь, использованная при применении способа по изобретению, может быть натуральным белком или может быть пептидной цепью, полученной с помощью биосинтеза, химического синтеза или бесклеточного синтеза.
В понятие «измененный пептид» в описании включен натуральный вариант, посттрансляционная модифицированная форма или искусственно измененное соединение пептида. Примеры получения измененных пептидов включают в себя, например, алкилирование, ацилирование (например, ацетилирование), амидирование (амидирование С-конца пептида), карбоксилирование, получение сложного эфира, образование дисульфидной связи, гликозилирование, липидирование, фосфорилирование, гидроксилирование и связывание маркирующего компонента с одним или более аминокислотным остатком или присоединением к одному или более аминокислотному остатку пептида.
Понятие «аминокислота» в описании применяется в самом широком смысле и включает не только натуральные аминокислоты, например серии (Ser), аспарагин (Asn), валин (Val), лейцин (Leu), изолейцин (Ile), аланин (Ala), тирозин (Tyr), глицин (Gly), лизин (Lys), аргинин (Arg), гистидин (His), аспарагиновую кислоту (Asp), глутаминовую кислоту (Glu), глутамин (Gln), треонин (Thr), цистеин (Cys), метионин (Met), фенилаланин (Phe), триптофан (Trp), и пролин (Pro), но и неприродные аминокислоты, в частности варианты и производные аминокислот. Специалистам в данной области понятно, что столь широкое определение аминокислот охватывает также L-аминокислоты, D-аминокислоты, химически модифицированные аминокислоты, в частности их варианты и производные; аминокислоты, не используемые in vivo в синтезе белка, такие, как норлейцин, бета-аланин и орнитин; и синтезированные химическим путем производные, обладающие свойствами аминокислот, которые известны специалистам.
Под выражением «полипептидный фрагмент» в описании подразумевается полипептид, включающий часть аминокислотной последовательности целевого белка, получаемую в процессе синтеза целевого белка.
В описании под «первым полипептидным фрагментом» и «вторым полипептидным фрагментом» подразумеваются фрагменты, каждый из которых включает аминокислотную последовательность целевого белка. «Первый полипептидный фрагмент» и «второй полипептидный фрагмент» синтезированы в связанном через вставочную последовательность виде. Кроме того, в способе по изобретению как «первый полипептидный фрагмент», так и «второй полипептидный фрагмент» можно получить в виде полипептидного фрагмента, подходящего для лигирования.
Первый полипептид является сконструированным полипептидом, в котором аминокислотным остатком на N-конце является цистеиновый остаток. Он при отщеплении первого полипептидного фрагмента обеспечивает возможность его лигирования на N-конце с другим пептидным фрагментом. Кроме того, второй полипептидный фрагмент после отщепления в качестве второго полипептида имеет модифицированный С-конец, подходящий для лигирования, и это обеспечивает возможность лигирования его с другим полипептидным фрагментом на C-конце.
Кроме того, полипептид (i) по изобретению имеет вставочную последовательность «(N-концевой-Cys-W-(His)n-Z-Met-(C-концевой» между первым и вторым полипептидными фрагментами.
В описании n означает целое число от 0 до 10, Cys означает цистеин, W означает 1, 2 или 3 аминокислоты, Z означает 0, 1 или 2 аминокислоты, His означает гистидин, Met означает метионин и аминокислотным остатком на N-конце первого полипептидного фрагмента является цистеиновый остаток.
Кроме того, полипептид (i) можно связать и с другим полипептидным фрагментом на N-конце и/или C-конце через упомянутую выше вставочную последовательность.
Во вставочной последовательности аминокислота, обозначенная буквой «W», предпочтительно включает любую аминокислоту, выбираемую из группы, состоящей из Val, Ile, Leu и Trp, и в частности, предпочтительно, чтобы аминокислота, расположенная рядом с цистеином на N-конце, была выбрана из перечисленных аминокислот. В таком случае, встраивая массивную аминокислоту рядом с Cys, можно подавить побочную реакцию (b), применяя соединение, представленное формулой (II), приведенной ниже, и таким образом увеличить выход второго целевого полипептида с модифицированным С-концом.
Кроме того, во вставочной последовательности (His)n означает гистидиновую метку, которая облегчает очистку полипептида, полученного путем биосинтеза. Способ, с помощью которого можно очистить полипептид, в который добавлена гистидиновая метка, известен специалистам. Например, полипептид можно очистить с помощью поступающего в продажу Ni-NTA агарозного геля.
Если в упомянутую выше вставочную последовательности не включить гистидиновую метку (n=0), полипептид (i) также можно экспрессировать с добавленной на N- или C-конце гистидиновой меткой. Когда вставочная последовательности имеет гистидиновую метку, N предпочтительно является целым числом от 6 до 10.
Кроме того, во вставочной последовательности Met является аминокислотой, используемой для отщепления первого полипептида на C-конце Met.
При отщеплении полипептида, полученного путем биосинтеза (i) в положении Met, его можно обработать, например, CNBr и 70% водным раствором муравьиной кислоты HCOOH при комнатной температуре. Если в пептидной последовательности, которую предстоит обработать содержится количестве Ser или Thr, у которых имеются гидроксильная группа в боковой цепи, возможно нежелательное образование сложного эфира муравьиной кислоты с боковой цепью. В таком случае предпочтительно предпринять меры, позволяющие избежать этерификации, например, уменьшить содержание муравьиной кислоты в реакционном растворе, использовать неорганическую кислоту или ТФУК, чтобы образующийся сложный эфир трифторуксусной кислоты можно было легко удалить.
Примеры предпочтительной кислоты, используемой в упомянутой выше реакции, включают, но не ограничиваются ими, муравьиную кислоту, фосфорную кислоту, трифторуксусную кислоту (ТФУК), трибромуксусную кислоту и метансульфоновую кислоту. Эти кислоты предпочтительно добавляют в концентрации 0,1-50%, более предпочтительно 1-20% и еще более предпочтительно 1-5%.
Кроме того, в описанной выше реакции можно использовать также смешивающийся с водой растворитель. Смешивающийся с водой растворитель не ограничен конкретным количеством растворителей, поскольку может смешиваться с водой, и включает, например, ацетонитрил, трифторэтанол, диметилформамид, диметилсульфоксид (ДМСО) и метиленхлорид, из которых предпочтительны ацетонитрил, трифторэтанол и диметилформамид. Такой растворитель предпочтительно добавляют в концентрации 1%-70%, более предпочтительно 20%-60%, еще предпочтительнее 35%-50%.
В таком случае скорость образования целевого полипептида можно увеличить расщеплением в присутствии кислоты и смешивающегося с водой растворителя.
При отщеплении полипептида (i) в положении Met в вышеупомянутой реакции можно получить полипептидный фрагмент, имеющий аминокислотную последовательность второй полипептидный фрагмент-Cys-W-(His)n-Z-Met′ на N-конце и первый полипептидный фрагмент на C-конце.
Met′ означает производное Met и указывает на образовавшееся производное Met в реакции расщепления, упомянутой выше.
Что касается выражения «первый полипептидный фрагмент» и «второй полипептидный фрагмент», которые содержатся в полипептиде (i) по изобретению, можно сконструировать подходящий предпочтительный фрагмент с учетом длины аминокислотной последовательности или типа аминокислот. Конструируют полипептидный фрагмент по изобретению таким образом, чтобы полученный при биосинтезе полипептидный фрагмент в качестве первого полипептидного фрагмента имел на N-конце цистеиновый остаток.
Полипептидом (i) по изобретению может быть натуральный белок или пептидная цепь, полученная путем биосинтеза, химического синтеза или бесклеточного синтеза, но предпочтительно, чтобы он был рекомбинантным белом, экспрессированным бактериями или клетками. Рекомбинантным белком могут быть белки, имеющие такую же пептидную последовательность, как и натуральный белок, или пептидная последовательность, модифицированная, например, путем мутации или введения метки для очистки, поскольку экспрессируется искусственно в бактериях или других клетках.
Полипептид (i) по изобретению можно получить способом, известным специалистам в данной области. Например, его можно экспрессировать введя целевой ген в рекомбинантньш вектор и создавая условия для экспрессии. В качестве рекомбинантного вектора можно использовать любой вектор, который может трансформировать клетку-хозяина; авторы в зависимости от клетки-хозяина использовали вирусные векторы, такие как плазмиду для E. coli, плазмиду для Bacillus subtilis, плазмиду для дрожжевых грибов, векторы на основе ретровируса и вируса осповакцины, бакуловируса и др. Предпочтительными являются векторы, содержащие регуляторную последовательность, например промотор, который может вызвать экспрессию. Кроме того, клеткой-хозяином может быть любая клетка, которая может экспрессировать чужой ген, встроенный в рекомбинантный вектор; часто в качестве клетки-хозяина используют E. coli, Bacillus subtilis, дрожжевые грибы, клетки насекомых и животных и др.
Для трансфекции клетки-хозяина рекомбинантным вектором можно использовать рутинные способы, например для E. coli - способ теплового шока, способ, основанный на использовании хлорида кальция, способ электропорации, для дрожжевых грибов - способ, основанный на использовании хлорида лития, или элетропорацию. Кроме того, добиться трансформации животной клетки можно с помощью физических методов, таких, как электропорация, или химических методов, таких, как липосомный способ или способ, основанный на применении фосфата кальция, либо с помощью вирусного вектора, например ретровируса. После встраивания в клетку вектора предпочтительно с помощью способа, известного специалистам в данной области, подтвердить, что целевая последовательность ДНК надлежащим образом встроена. Что касается культивирования трансформированной клетки-хозяина условия культивирования можно подобрать исходя из особенностей нутриентов, используемых клеткой-хозяином для питания.
Использованный пептид по изобретению предпочтительно должен быть очищенным. Для этого можно воспользоваться обычно способом общей очистки. Например, в случае рекомбинантного белка после культивирования бактерий или клеток, экспрессирующих используемый здесь рекомбинантный белок, готовят необработанный экстракт пептидов путем удаления бактерий или клеток по способу, известному специалистам, суспендируя их в подходящем буферном растворе, разрушая бактерии или клетки, например ультразвуком, лизоцимом и/или чередованием замораживания и оттаивания, после чего экстракт центрифугируют или фильтруют. Буферный раствор может включать агент, денатурирующий белок, например мочевину или гидрохлорид гуанидина либо поверхностно-активное вещество, например Triton X-100™. Способ очистки полученного экстракта или пептида, содержащегося в культуральной надосадочной жидкости, хорошо известен специалистам. Например, для выделения и очистки выбирают и комбинируют такие методы, как аффинная хроматография, ионообменная хроматография, фильтрация, ультрафильтрация, гель-фильтрация, электрофорез, осаждение в растворе соли, диализ и др.
Кроме того, для облегчения очистки рекомбинантного белка в вектор экспрессии также можно встроить различные метки. Примерами меток, которые можно встроить в вектор экспрессии, могут быть метки, известные специалистам в данной области, например метка, которая повышает эффективность экспрессии, или метка, которая повышает степень очистки, например тиоредоксин, GST-метка, Myc-метка, FLAG-метка и мальтоза-связывающий белок (МВР).
Кроме того, указанные метки также можно связать с полипептидом (i) через Met (метионин). Приготовляя метку, присоединенную, как описано, к полипептиду (i) через метионин, метку можно отщепить при расщеплении на первый и второй полипептидные фрагменты с использованием метионина в качестве мишени.
Кроме того, любой известный в настоящее время способ химического синтеза можно применить для синтеза других полипептидных фрагментов, необходимых