Способ получения 1-геранил-2-метилбензимидазола
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к способу получения 1-геранил-2-метилбензимидазола, включающему аллилирование 2-метилбензимидазола. Согласно предложенному способу сначала осуществляют взаимодействие мирцена с диалкиламином, таким как диметиламин, диэтиламин, пиперидин, морфолин, катализируемое металлическим натрием, затем - кватернизацию полученного геранилдиалкиламина этил- или метилйодидом и проводят аллилирование 2-метилбензимидазола образовавшимся йодидом геранилтриалкиламмония в присутствии гидрида натрия и палладиевого катализатора, получая целевой 1-геранил-2-метилбензимидазол. Технический результат: разработан экологичный и технологичный способ получения 1-геранил-2-метилбензимидазола. 4 з.п. ф-лы, 5 пр.
Реферат
Изобретение относится к химии терпеновых соединений, точнее к способу получения бензимидазолилзамещенного терпена, конкретно 1-геранил-2-метилбензимидазола формулы 1 (CAS No. 82682-54-0), представляющего собой экологически безопасный инсектицид ювеноидного типа.
Соединение 1 относится к терпеновым производным и является известным препаратом, обладающим рострегулирующей активностью в отношении насекомых-вредителей, который широко применяется для защиты растений.
Известно, что соединение 1 ингибирует in vitro хитинсинтетазу [Cohen Е., Kuwano Е., Eto М. The use of Tribolium chitin synthetase assay in studying the effects of benzimidazoles with a terpene moiety and related compounds. Agric. Biol. Chem., 1984, 48 (6), 1715-1716; Cohen E. Chitin synthetase activity and inhibition in different insect microsomal preparations. Experientia, 1985, 41 (4), 470-472; Cohen E., Elster I., Chet I. Properties and inhibition of Sclerotium ralfsii chitin synthetase. Pesticide Science, 1986, 17 (2), 175-182] и проявляет высокую активность в отношении личинок рисового точильщика, ингибируя их дыхание, стимулируя развитие куколок и блокируя взаимодействие NADH и убихинона, т.е. действует по типу ротенона, перицидинов и убицидинов [Nakagawa Y., Kuwano Е., Eto М., Fujita Т. Effects of Insect-Growth-Regulatory Benzimidazole Derivatives on Cultured Integument of the Rice Stem Borer. Agric. Biol. Chem., 1985, 49 (12), 3569-3573]. Соединение 1 испытывали также против хлопковой тли (WO 2005108374), оно почти полностью ингибировало выход сосновой древесной нематоды Bursaphelenchus xylophilus (одного из наиболее опасных вредителей хвойных) из яиц, тогда как метопрен и экдизон были неэффективны [Shuto Y., Kuwano Е. and Watanabe Н. New hatching test for the pine wood nematode and the inhibitory effect of benzimidazole derivatives. Agric. Biol. Chem., 1989, 53 (6), 1711-1712].
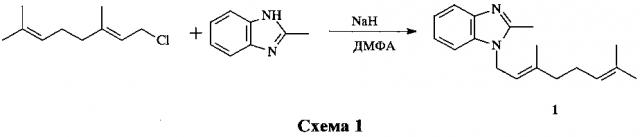
Известен способ получения соединения 1 N-аллилированием 2-метилбензимидазола геранилхлоридом в ДМФА в присутствии гидрида натрия с выходом 79% (схема 1) [JP pat. Appl. №5921671 A; Kuwano Е., Sato N. Insecticidal Benzimidazoles with a Terpenoid Moiety. Agric. Biol. Chem., 1982, 46 (6), 1715-1716].
Указанный способ получения целевого соединения 1 принят в качестве прототипа.
Существенный недостаток прототипа - использование геранилхлорида, который, во-первых, характеризуется сильным слезоточивым и раздражающим кожу и дыхательную систему действием [ЛД50≤200 мг/кг (перорально) согласно www.chemicalbook.com/ChemicalProductProperty_EN_CB0135735.htm, что соответствует высокоопасным соединениям по классификации СанПиН 2.1.4.1074-01], а во-вторых, не является продуктом крупнотоннажного производства.
Задачей настоящего изобретения является разработка экологичного и технологичного способа получения 1-геранил-2-метилбензимидазола (1) из природного сырья, производимого в промышленных масштабах.
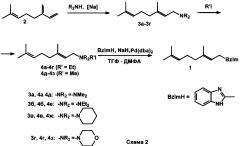
Задача решается заявляемым способом получения соединения 1, включающим N-аллилирование 2-метилбензимидазола геранил-аммониевыми солями (схема 2).
Заявляемый способ включает взаимодействие мирцена с диалкиламином, таким как диметиламин, диэтиламин, пиперидин, морфолин, катализируемое металлическим натрием, при 50-60°C, кватернизацию полученного геранилдиалкиламина этил- или метилйодидом и аллилирование 2-метилбензимидазола образующимся йодидом геранилтриалкиламмония в присутствии гидрида натрия и палладиевого катализатора, в качестве которого используют Pd(dba)2, при 68-72°C, приводящее к получению целевого 1-геранил-2-метилбензимидазола (1).
На первой стадии реакцией мирцена (2) с диметиламином, диэтиламином, пиперидином или морфолином по описанным методикам - при катализе металлическим натрием в отсутствие растворителя при 50-60°C - получают геранилдиалкиламины 3а-3г с выходами 59-75% [Chalk A.J. and Magennis S.A. A comparison of transition metal and non-transition metal oligomerizations of isoprene for the synthesis of terpenes. Annals New York Academy of Sciences, 1980, 333, 286-301; Takabe K., Katagiri Т., Tanaka J., Fujita Т., Watanabe S., Suga K. Addition of dialkylamines to myrcene: N,N-diethylgeranylamine. Organic Syntheses, 1989, 67, 44-46 (или 1993, Coll. Vol. 8, 188-190)].
На второй стадии геранилдиалкиламины 3а-3г подвергают кватернизации этил- или метилйодидом в отсутствие растворителя при 20-25°C в темноте и получают соответствующие аммониййодиды 4а-4з с практически количественными выходами.
На третьей стадии проводят катализируемое Pd(dba)2 аллилирование 2-метилбензимидазола солями 4а-4з в смеси ТГФ и ДМФА при 67-72°C и получают целевой продукт - 1-геранил-2-метилбензимидазол (1) с выходами 80-85%. Использование палладиевого катализатора и мягкие условия реакции обеспечивают высокую изомерную чистоту целевого продукта - более 86%.
Общий выход 1-геранил-2-метилбензимидазола в расчете на исходный мирцен составляет 45-58%.
Заявляемый способ основан на использовании в качестве исходного вещества мирцена, выделяемого из растительного сырья в промышленных масштабах. Мирцен является нетоксичным соединением с ЛД50=5000 мг/кг (перорально) согласно www.xumuk.ru/encyklopedia/2631.html, что соответствует малоопасным соединениям по классификации СанПиН 2.1.4.1074-01.
Мирцен может быть исходным веществом и при получении аллилирующего реагента (геранилхлорида) в способе-прототипе: геранилхлорид синтезируют гидрохлорированием мирцена в дихлорметане газообразным хлористым водородом при катализе CuX (X=Cl, I) и аммониевой или фосфониевой солью. Недостатками такого способа получения геранилхлорида являются использование газообразного HCl, растворителя и трудности с удалением катализаторов - [FR pat. Appl. №2570371 А1 (1986); Bienayme Н., Ancel J.-E., Meilland P., Simonato J.-P. Rhodium(I)-catalyzed addition of phenols to dienes. A new convergent synthesis of vitamin E. Tetahedron Lett., 2000, 41 (18), 3339-3343].
Следует отметить также, что присоединение диалкиламина к мирцену протекает регио- и стереоселективно: получаемый продукт содержит более 90% геранилдиалкиламина [Chalk A.J. and Magennis S.A. A comparison of transition metal and non-transition metal oligomerizations of isoprene for the synthesis of terpenes. Annals New York Academy of Sciences, 1980, 333, 286-301; Takabe K., Katagiri Т., Tanaka J., Fujita Т., Watanabe S., Suga K. Addition of dialkylamines to myrcene: N,N-diethylgeranylamine. Organic Syntheses, 1989, 67, 44-46 (или 1993, Coll. Vol. 8, 188-190)]. Тогда как селективность гидрохлорирования мирцена значительно ниже: получаемый продукт содержит не более 60% геранилхлорида [Fr. 2570371 А1 (1986); Bienayme Н., Ancel J.-E., Meilland P., Simonato J.-P. Rhodium(I)-catalyzed addition of phenols to dienes. A new convergent synthesis of vitamin E. Tetahedron Lett., 2000, 41 (18), 3339-3343], что требует ректификации для выделения его в чистом виде [Panda Н. The Complete Technology Book on Natural Products (Forest Based). Delhi, India: Asia Pacific Business Press, 2002].
Техническим результатом изобретения является новый способ получения 1-геранил-2-метилбензимидазола (1) из доступного растительного сырья, который исключает применение токсичных реагентов.
Заявляемый способ обладает следующими преимуществами:
использует доступное и экологически безопасное исходное соединение - мирцен, который выделяют из растительного сырья, производимого в промышленных масштабах;
не требует применения токсичных реагентов, таких как геранилхлорид, необходимый для осуществления способа-прототипа;
все стадии осуществляют в мягких условиях - при комнатной температуре или 50-72°C и атмосферном давлении;
две стадии из трех проводят в отсутствие растворителей;
выход целевого продукта 1 на стадии аллилирования составляет 80-85%, а изомерная чистота - более 86%.
Таким образом, предлагаемый способ является более технологичным и экологичным, чем прототип.
Авторы настоящего изобретения исследовали активность соединения 1 в биологических испытаниях на большом мучном хрущаке Tenebrio molitor L. - основном вредителе хлебных запасов в Российской Федерации. Соединение 1 было протестировано на активность ювенильных гормонов на куколках большого мучного хрущака лабораторной разводки Всероссийского научно-исследовательского института химических средств защиты растений. Ювеноидный эффект для каждой особи оценивали в баллах по 9-балльной шкале Шмиалека, отражающей различные степени морфогенетических нарушений в процессе превращения куколок во взрослых жуков. Показано, что соединение 1 обладает высокой ювеноидной активностью в 5,0 балла (относительная ошибка 9,1%).
Газожидкостную хроматографию, используемую для определения чистоты полученных соединений, выполняли на хроматографе ЛХМ-8МД (5) со стальной колонкой 2000×3 мм с 15% СКТФТ-50 на хроматоне N-AW, газ-носитель - гелий. Спектры ПМР регистрировали на приборах Bruker Avance-300 и -400 с использованием ТМС в качестве внутреннего стандарта. Хромато-масс-спектральный анализ проводили на приборе Analytical VG 70-70Е при 70 эВ и температуре ионного источника 150°C.
Заявляемое изобретение иллюстрируется приведенными ниже примерами.
Получение 1-геранил-2-метилбензимидазола (1)
Пример 1
1.1. Геранилдиэтиламин (3б). Мелконарезанный металлический Na (0,142 г, 6,0 ммоль, 1,8 мол. %) добавляют в диэтиламин (35,5 мл, 0,344 моль) при комнатной температуре при перемешивании. Через 50 мин к полученной смеси прибавляют мирцен (39,1 г, 0,287 моль) и нагревают при 53°C при перемешивании в атмосфере аргона в течение 18 ч. Реакционную смесь выливают в воду, экстрагируют бензолом, затем гексаном. Объединенные органические слои сушат Na2SO4. Растворители удаляют на роторном испарителе. Фракционная перегонка остатка в вакууме дает 36,7 г (61%) амина 3б с т. кип. 118-124°C/10 мм рт.ст.
1.2. Геранилдиэтилметиламмонийиодид (4е). К амину 3б (3,2 г, 15,3 ммоль) по каплям прибавляют метилйодид (1,14 мл, 18,4 ммоль) в атмосфере аргона. Смесь выдерживают при 25°C в темноте 7 дней. Образовавшееся коричневое масло промывают гексаном методом декантации для удаления непрореагировавшего амина и избытка Mel. Получают 5,1 г (94%) соли 4е в виде вязкого масла.
Спектр ПМР (ДМФА-d7), δ, м.д. (J, Гц): 1,43 (т, 6Н, NCH2CH 3), 1,66 (с, 3Н, 8СН3), 1,72 (с, 3Н, 7аСН3), 1,90 (с, 3Н, 3аСН3), 2,25 (м, 4Н, 4СН2, 5СН2), 3,16 (с, 3Н, NCH3), 3,58 (к, 4Н, NCH2), 4,17 (д, 2Н, 1СН2, J=8,11), 5,16 (т, 1Н, 6СН, J=7,6), 5,55 (т, 1Н, 2СН, J=8,11).
1.3. 1-Геранил-2-метилбензимидазол (1). В атмосфере аргона соль 4е (1,9 г, 5,4 ммоль) суспендируют в ТГФ (12 мл), для растворения соли добавляют ДМФА (1 мл). К полученному раствору последовательно прибавляют 2-метилбензимидазол (0,71 г, 5,4 ммоль), Pd(dba)2 (0,16 г, 0,27 ммоль, 5 мол. %) и NaH (0,17 г, 7,0 ммоль). Гомогенную смесь кипятят в атмосфере аргона при перемешивании 61,5 ч. Полученный винно-красный раствор упаривают на роторном испарителе в вакууме сначала водоструйного, а затем масляного насоса, к остатку приливают воду и экстрагируют 2 раза эфиром. Органический слой сушат Na2SO4, эфир отгоняют. Выпавший осадок (0,3 г) отфильтровывают и промывают эфиром. Маточник упаривают и получают оранжевое масло (1,2 г, 83%), которое очищают колоночной хроматографией на силикагеле, элюент - диэтиловый эфир, при контроле элюированных фракций ТСХ на силуфольных пластинах. Анализ выделенного продукта методами капиллярной ГЖХ и ПМР-спектроскопии показывает, что он содержит 86,3% транс- и 6,4% цис-изомера 1-геранил-2-метилбензимидазола.
Спектр ПМР (CDCl3), δ, м.д. (J, Гц): 1,62 (с, 3Н, 8СН3), 1,69 (с, 3Н, 7аСН3), 1,91 (с, 3Н, 3аСН3), 2,00-2,15 (м, 4Н, 4СН2, 5СН2), 2,64 (с, 3Н, 2′СН3), 4,76 (д, 2Н, 1СН2, J=6,17), 5,07 (т, 1Н, 6СН, J=6,29), 5,24 (т, 2СН, J=6,17), 7,27 (м, 3Н, 3′СН, 4′СН, 5′СН), 7,74 (м, 1Н, 6′СН). Масс-спектр, m/z (I/Imax): 268 (М+, 3,4), 253 (13,8), 225 (4,1), 211 (2,8), 200 (22,1), 185 (100), 172 (9,7), 159 (4,8), 146 (20,7), 132 (93,8), 121 (5,5), 104 (5,5), 91 (11,0), 83 (5,5), 79 (5,5), 69 (4,1), 55 (2,8), 41 (12,4).
Пример 2
2.1. Геранилдиметиламин (3а) получают аналогично соединению 3б (пример 1, п. 1.1), используя 15,5 г (0,344 моль) диметиламина, конденсированного после отгонки из раствора этанола. Выход амина 3а 30,7 г (59%), т. кип. 95-102°C/10 мм рт.ст.
2.2. Геранилтриметиламмониййодид (4д) получают, как описано в примере 1, п. 1.2.
2.3. 1-Гэранил-2-метилбензимидазол (1) получают из аммонийной соли 4д, как описано в примере 1, п. 1.3, с выходом 85%.
Пример 3
3.1. N-геранилпиперидин (3в) получают аналогично соединению 3б (пример 1, п. 1.1), используя 29,3 г (0,344 моль) пиперидина. Выход амина 3в 45,7 г (72%), т. кип. 112-116°С/1 мм рт.ст.
3.2. N-геранил-N-метилпиперидиниййодид (4ж) получают, как описано в примере 1, п. 1.2.
3.3. 1-Геранил-2-метилбензимидазол (1) получают из аммонийной соли 4ж, как описано в примере 1, п. 1.3, с выходом 80%.
Пример 4
4.1. N-геранилморфолин (3г) получают аналогично соединению 3б (пример 1, п. 1.1), используя 30,0 г (0,344 моль) морфолина. Выход амина 3г 48 г (75%), т. кип. 118-123°С/1 мм рт.ст.
4.2. N-геранил-N-метилморфолиниййодид (4з) получают, как описано в примере 1, п. 1.2.
4.3. 1-Геранил-2-метилбензимидазол (1) получают из аммонийной соли 4ж, как описано в примере 1, п. 1.3, с выходом 84%.
Пример 5. Определение инсектицидной активности соединения 1
Инсектицидную активность определяли при нанесении на последний сегмент абдомена куколки через 0-6 ч после отрождения 0,3 мкл 1%-ного ацетонового раствора, содержащего 10000 мг соединения 1 в 1 л. Испытания проводили на двух сериях по 20 особей в каждой. Эффект оценивали при отрождении имаго по 9-балльной шкале Шмиалека [Schmialek P.Z. Naturforsch., 1963, Bd. 18B, Nr. 7, S. 516]. Оценку 0 приписывали куколке, дающей нормальный имаго, оценку 9 - куколке, не дающей имаго и не отличающейся от исходной куколки. Промежуточные оценки соответствовали степени морфогенетических нарушений в превращении куколок в имаго.
После изучения морфологических изменений каждой особи среднюю оценку N в баллах определяли по формуле:
N=(x1·1+x2·2+x3·3+…+xn·n)/А,
где 1, 2, 3, …, n - оценка в баллах от 0 до 9;
x1, x2, x3, …, xn - число куколок, получивших соответствующую оценку;
А - общее число куколок.
По результатам биологических испытаний влияние соединения 1 в ацетоновом растворе в концентрации 10 г/л на активность ювенильного гормона было оценено 5,0 балла (из 9 возможных) с относительной ошибкой 9,1%.
1. Способ получения 1-геранил-2-метилбензимидазола, включающий аллилирование 2-метилбензимидазола, отличающийся тем, что сначала осуществляют взаимодействие мирцена с диалкиламином, таким как диметиламин, диэтиламин, пиперидин, морфолин, катализируемое металлическим натрием, затем - кватернизацию полученного геранилдиалкиламина этил- или метилйодидом и проводят аллилирование 2-метилбензимидазола образовавшимся йодидом геранилтриалкиламмония в присутствии гидрида натрия и палладиевого катализатора, получая целевой 1-геранил-2-метилбензимидазол.
2. Способ по п.1, отличающийся тем, что взаимодействие мирцена с диалкиламином осуществляют при 50-60°C.
3. Способ по п.1, отличающийся тем, что кватернизацию геранилдиалкиламина проводят при температуре 20-25°C.
4. Способ по п.1, отличающийся тем, что в качестве палладиевого катализатора для аллилирования 2-метилбензимидазола используют Pd(dba)2.
5. Способ по п.1, отличающийся тем, что аллилирование 2-метилбензимидазола проводят при 68-72°C.