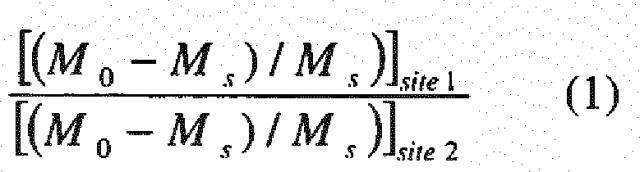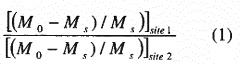Cest-системы, проявляющие не зависящую от концентрации чувствительность
Иллюстрации
Показать всеГруппа изобретений относится к медицине, конкретно к применению неэквивалентных мобильных протонов, принадлежащих к различимым по ЯМР стереоизомерам CEST-агента, в логометрическом способе визуализации с применением CEST и к комплексным соединениям лантаноида (III), демонстрирующим, по меньшей мере, два различимых по ЯМР стереоизомера в растворе, применяемых в качестве не зависящих от концентрации чувствительных CEST-агентов. Различимые по ЯМР стереоизомеры CEST-агента используют в качестве полезных биомаркеров определенного заболевания, точно связанного с данными изменениями. 5 н. и 8 з.п. ф-лы, 21 ил., 10 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области магнитно-резонансной томографии (МРТ), основанной на химическом обменном переносе насыщения (CEST). Более конкретно, оно относится к системам CEST, проявляющим не зависящую от концентрации чувствительность, и к их применению при in vivo картировании физических или химических параметров, представляющих диагностический интерес.
Уровень техники
Метод химического обменного переноса насыщения (CEST) является недавно предложенным способом визуализации, основанным на применении молекул (CEST-агентов), содержащих один или несколько пулов обмениваемого(ых) протона(ов) (см., например, Balaban RS., Methods in Biomedical Magnetic Resonance Imaging and Spectroscopy. Chichester, Великобритания: John Wiley & Sons; 2000. Vol.1, p 661-6667; под редакцией Young IR).
Данный способ визуализации основан на явлении, известном в ЯМР высокого разрешения как эксперимент по двойному резонансу, при котором прикладывают импульс второй радиочастоты (РЧ), точно отцентрированной по резонансной частоте мобильных протонов, получаемой из спектра ЯМР, для того чтобы добиться насыщения их спинов. Таким образом, создают насыщенную намагниченность, которая передается "объемной" воде посредством химического обмена, приводящего к ясному уменьшению сигнала объемной воды. Данный эффект называется переносом насыщения, или ST-эффектом. Контраст на полученном основанном на CEST МР-изображении определяется степенью переноса: чем больше количество насыщенной намагниченности, перенесенной на протоны воды, тем меньше интенсивность полученного сигнала воды, сильнее контраст (отрицательный контраст) на полученном изображении МРТ.
Основным требованием к CEST-агенту является наличие мобильного(ых) протона(ов) (или обмениваемых протонов, что в настоящем описании используется взаимозаменяемо), имеющего соответствующую скорость обмена (Kex) и подходящий интервал химического сдвига от протонов объемной воды, так чтобы существовала возможность как для активации центра обмена, так и для переноса насыщения. Ориентировочно, данное условие достигается, когда kex приближается к Δν (Kex Δν), где Δν представляет собой интервал химического сдвига в Гц между двумя пулами обмена. Известные контрастные CEST-агенты группируют главным образом по диамагнитной и парамагнитной системам. Подходящие примеры низкомолекулярных диамагнитных CEST-агентов (DIACEST) впервые предложил Balaban в WO 00/66180, который провел наибольшую работу в данной области. Макромолекулярные диамагнитные агенты, кроме того, раскрыты, например, в J. Am. Chem. Soc 2001; 123:8628-8629.
О парамагнитных CEST-агентах (PARACEST), преимущественно включая макроциклические тетраамидные производные DOTA, обеспечивающие четыре магнитно эквивалентных или псевдоэквивалентных пула мобильных N-H протонов, впервые сообщил Sherry (см., например, J. Am. Chem. Soc 2001; 123:1517-1518). Важные открытия, касающиеся парамагнитных CEST-агентов также рассматриваются в Magn. Reson. Med 2002; 47:639-648.
Woods et. al продемонстрировали, что OH группы также можно использовать в эксперименте CEST с зондом PARACEST, по меньшей мере, в некоторых условиях эксперимента, включая применение обезвоженных растворителей (см., например, J. Am. Chem. Soc 2006; 128:10155-10162). Тем не менее, при растворении исследуемого комплекса в чистой воде невозможно обнаружить CEST-эффект от гидроксильных и связанных с металлами протонов воды, что препятствует его возможному использованию для применений CEST "in vivo".
Позднее Morrow с сотрудниками продемонстрировали, что в чистой воде можно обнаружить CEST-эффект от спиртовых донорных групп с использованием несущих три положительных заряда макроциклических комплексов Ln(III) с нейтральными лигандами, содержащими боковые спиртовые группы (см., например, Inorg. Chem. 2009; 48:7237-7243). В данной статье рассмотрено существование нескольких стереоизомеров используемых производных циклена и делается вывод, что комплексы Ln(III), имеющие только одну диастереомерную форму в растворе, являются потенциально подходящими для экспериментов PARACEST.
Дополнительный класс особенно высокочувствительных парамагнитных CEST-агентов представлен LIPOCEST, липосомами, содержащими реагент парамагнитного сдвига для протонов воды в водной внутренней полости (см., например, Angew. Chem. Int Ed Engl 2003; 42:4527-4529).
Среди CEST-агентов класс, представляющий особый интерес, представлен "чувствительными" агентами, а именно контрастными агентами, снабженными, по меньшей мере, одним обмениваемым протоном, способность которого к переносу насыщения коррелирует с физико-химическим представляющим диагностический интерес параметром микроокружения, в котором распределен данный агент. Данные агенты, помимо действия в качестве обычных CEST-агентов и обеспечения CEST-контраста, также способны сообщать об изменениях указанного параметра, обычно выбираемого из pH, температуры, концентрации метаболитов или определенных ионов, парциального давления О2 или СО2, активности белков или ферментов, в органе тела или области, в которой они распределены, таким образом, действуя в качестве полезных биомаркеров определенного заболевания, точно связанного с данными изменениями (см., например, Top Curr. Chem. 2002, 221, 123-164).
В этом случае величина переноса насыщения (ST), наблюдаемая в способе CEST, зависит от содержания воды и CEST-зонда, т.е., другими словами, их локальной концентрации в рассматриваемой ткани. Следовательно, особенное чувствительное свойство, проявляемое данными агентами, можно соответствующим образом использовать на практике, только когда известна их фактическая концентрация.
Между тем, для эффективного применения в in vivo определениях чувствительный CEST-агент должен проявлять свою чувствительность не зависящим от концентрации образом.
Эта задача может быть решена с применением CEST-агентов, содержащих, по меньшей мере, два набора магнитно неэквивалентных протонов, ST-эффект которых демонстрирует различную зависимость от представляющего интерес физико-химического параметра. В данном случае, фактически, можно использовать логометрический подход, основанный на следующем уравнении (1):
,
впервые раскрытый Balaban и Ward (для подробностей о приведенном выше уравнении см., например, Magn. Reson. Med. 2000; 44:799-802), использующий сравнительное отношение между ST-эффектами, вызванными селективным облучением двух различных резонансов, соответственно обозначенных как site 1 и site 2 в приведенном выше уравнении, который делает измеренную величину ST и, в свою очередь, определяемый диагностический параметр, не зависящими от абсолютной концентрации введенного CEST-зонда.
Примеры чувствительных агентов, делающих возможным применение данного логометрического подхода, включают мономолекулярные комплексы лантаноида (Ln), содержащие два магнитно неэквивалентных протонных центра, причем один, обычно принадлежит первичной(ым) амидной(ым) группе(ам) на боковом(ых) ответвлении(ях), координированном с металлическим ионом, тогда как второй, обычно представлен молекулой(ами) воды, координированной с Ln-центром хелатного комплекса (см., например, Angew. Chem. Int Ed 2002; 41:1919-1921 и 4334-4336).
Диамагнитные молекулы, такие как 5,6-дигидроурацил и йопамидол, содержащие два пула CEST-активных протонов, также были успешно испытаны в качестве не зависящих от концентрации репортеров pH (см., например, Magn. Reson. Med. 2000; 44:799-802, Invest. Radiol. 2004; 39:235-243; Magn. Reson. Med. 2005; 53:830-834 и J. Am. Chem. Soc 2005; 131:1380-1381). Альтернативно, можно использовать CEST-системы, содержащие два (или более) CEST-зонда, имеющих одинаковую картину биораспределения, но сильно различающимися свойствами ЯМР, например в зависимости от координированного иона Ln(III), каждый из которых обеспечивает различный(е) протонный(е) пул(ы) (см., например, Magn. Reson. Med. 2002; 47:639-648).
Разработка чувствительных CEST-агентов, однако, все еще остается неудовлетворительной, главным образом из-за ограниченного количества CEST-систем, проявляющих не зависящую от концентрации чувствительность.
Сущность изобретения
В соответствии с вышеуказанной задачей настоящее изобретение направлено на определение альтернативного источника магнитно неэквивалентных мобильных протонов, позволяющего разрабатывать основанные на CEST не зависящие от концентрации чувствительные способы, и на альтернативные CEST-системы, проявляющие не зависящую от концентрации чувствительность.
Решения согласно настоящему изобретению относятся к применению различимых по ЯМР стереоизомеров парамагнитного CEST-агента в качестве альтернативного источника магнитно неэквивалентных обмениваемых протонов.
Более конкретно, настоящее изобретение относится к применению различимых по ЯМР изомеров парамагнитного CEST-агента в качестве источника магнитно неэквивалентных мобильных протонов, для того чтобы разрабатывать логометрический способ визуализации с применением CEST.
В другом варианте осуществления настоящее изобретение относится к логометрическому способу CEST МРТ, который включает использование магнитно неэквивалентных мобильных протонов, принадлежащих, по меньшей мере, двум различимым по ЯМР изомерам парамагнитного CEST-агента.
В другом варианте осуществления настоящее изобретение относится к классу комплексных соединений лантаноида (III), снабженных группой обмена протонами на боковом ответвлении хелатирующего лиганда, которые демонстрируют, по меньшей мере, два различимых по ЯМР стереоизомера в растворе, и к применению данных комплексных соединений в логометрических способах визуализации с применением CEST в качестве не зависящих от концентрации контрастных CEST-агентов для получения не зависящего от концентрации CEST-контраста.
В еще одном варианте осуществления настоящее изобретение относится к применению указанных определенных комплексных соединений лантаноида (III) в качестве не зависящих от концентрации чувствительных CEST-агентов и к логометрическому способу визуализации с применением CEST, который включает их применение для получения не зависящей от концентрации карты физического или химического параметра, представляющего диагностический интерес, в органе тела, жидкости или ткани человека или животного.
Краткое описание фигур
Фиг.1: Спектр 1H ЯМР YbHPDO3A в D2O (278K, 600 МГц).
Фиг.2: Панель a) Увеличение спектра YbHPDO3A в D2O (ниже) и H2O (выше), на котором отмечены различные химические сдвиги (соответственно 72 и 99 м.д. при 20°C), демонстрируемые обмениваемыми OH протонами двух различимых изомеров данного комплекса; панель b) Z-спектр YbHPDO3A (24 мМ раствор, 293K, pH 7,31, мощность облучения 24 мкΤ, время облучения 2 с).
Фиг.3: Панель a) МР-изображение in vitro (протонная плотность) фантома, содержащего растворы YbHPDO3A, все с концентрацией 24 мМ, но различными pH (капилляры 1-11) или одинаковым pH (7,31) но различными концентрациями (от 3 до 24 мМ) (капилляры 7, 12-14); панель b) легенда фантома; панель c) карта ST, полученная после облучения гидроксильных протонов при 72 м.д. (20°C; мощность импульса облучения 24 мкТл); панель d) карта ST, полученная после облучения гидроксильных протонов при 99 м.д. (20°C, мощность импульса облучения 24 мкТл); панель e) изменение ST-эффекта при изменении pH, полученное после облучения гидроксильных протонов двух изомеров, соответственно при 72 м.д. (квадраты) и 99 м.д. (кружки) (калибровочные кривые) (24 мМ раствор, 20°C; импульс облучения 24 мкТл; время облучения 2 с); панель f) логометрическая кривая, демонстрирующая зависимость логометрических значений от pH, которую получают, применяя логометрический подход к кривым ST панели e). На данной фигуре логометрическое значение (показанное на вертикальной оси (y) графика) представляет собой значение, вычисленное с применением приведенного выше уравнения (1) после облучения мобильного протона при 72 м.д. (site 1) и 99 м.д. (site 2) соответственно.
Фиг.4: Панель a) логометрическая кривая, демонстрирующая зависимость ST-эффекта от температуры (логометрическое значение, полученное посредством применения логометрического подхода к калибровочным кривым ST, полученным, соответственно, при 20°C (квадраты) и 37°C (кружки); панель b) Z-спектры YbHPDO3A (24 мМ раствор, pH 7,31), полученные при 37°C (темная линия) и 20°C, тот же pH (серая линия), с применением импульса облучения 24 мкТл.
Фиг.5: Панель a) МР-изображение in vitro фантома, содержащего 3 различных конгломерата клеток MSH, которые были инкубированы (капилляр 2) или электропорированы (капилляр 3) с раствором YbHPDO3A, или клеток, инкубированных с PBS и применяемых в качестве контроля (капилляр 1). В фантом также включен пустой капилляр (4); панели b) и c) карты ST, полученные после облучения фантома соответственно при 72 и 99 м.д., соответственно.
Фиг.6: Z-спектр, полученный из мочевого пузыря мыши, которой впрыскивали 200 мкл 150 мМ раствора YbHPDO3A, записанный на спектрометре Bruker Avance 300. В полученном спектре темная линия соответствует аппроксимирующей кривой, и светлая аппроксимирующей кривой, перенесенной, для того чтобы минимум Z-спектра соответствовал 0 м.д.
Фиг.7: Логометрическая кривая YbHPDO3A, измеренная in vitro при 33°, полученная из калибровочных кривых, полученных для данной температуры, как в примере 6.
Фиг.8: Морфологическое изображение (левые изображения) и карты ST, полученные в области опухоли мыши до (PRE) и непосредственно после (Post) в/в инъекции YbHPDO3A. ST-эффект, вычисленный после облучения, соответственно, при 66,2 и 91,6 м.д. наложили на соответствующее анатомическое изображение, на котором область опухоли выглядит как более светлый участок (красный на фактически наблюдаемом изображении). На данной фигуре символ @ указывает на частоту облучения, используемую для того, чтобы вызвать перенос насыщения, то есть, как уже сказано, 66,2 и 91,6 м.д.
Фиг.9: Формула тетрамерного производного YbHPDO3A, иначе обозначаемого как (Yb3+)4HPDO3A-тетрамер или просто тетрамер.
Фиг.10: Панель a) логометрические кривые, измеренные при различных температурах в диапазоне от 298 до 312K после облучения гидроксильных протонов двух изомеров YbHPDO3A-тетрамера и применения логометрического подхода; панель b) зависимость от температуры химического сдвига ЯМР гидроксильных протонов, принадлежащих двум различимым по ЯМР изомерам YbHPDO3A-тетрамера.
Фиг.11: МРТ изображения фантома, содержащего YbHPDO3A-тетрамер в различных концентрациях в диапазоне от 0,26 до 8,4 мМ (pH 7,4 и 298K). Слева T2-взвешенное изображение; справа полученная карта ST.
Фиг.12: Панель a) спектр 1Н ЯМР EuHPDO3A в D2O; панель b) Увеличение спектра ЯМР EuHPDO3A в D2O, 278K, pH 2 (выше) и H2O, 310K, pH 2 (ниже), подтверждающее существование двух различимых по ЯМР изомеров, имеющих химический сдвиг 20,5 и 16,7, соответственно (pH 2 и 20°C), все еще различимых при физиологической температуре (спектрометр Advance 600).
Фиг.13: Панель a) Z-спектры EU(III)HPDO3A (20 мМ) при pH 5,92 и 37°C при различных импульсах мощности; панель b) Z-спектры EU(III)HPDO3A (20 мМ) при pH 7,46 и 37°C при различных импульсах мощности; панель c) профиль ST EU(III)HPDO3A 20 мМ при pH 7,46, 37°C и мощности облучения, равной 24 мкТл.
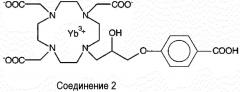
Фиг.14: Z-спектр, полученный при 7 Тл, раствора соединения 2 при pH 5,8 и 298K.
Фиг.15: Зависимость от pH ST-эффекта, полученного после облучения гидроксильных протонов двух магнитно неэквивалентных изомеров, демонстрируемых соединением 2 (при 20°C) (калибровочные кривые).
Фиг.16: Логометрическая кривая, описывающая зависимость ST (логометрические значения) от pH, полученная посредством применения логометрического подхода к кривым ST фиг.15.
Фиг.17: Сравнение спектров 1H ЯМР соединения 3, полученных в D2O при 278K и 298K и магнитном поле 600 МГц. Спектр высокого разрешения, полученный при более низкой температуре, ясно показывает наличие двух наборов сигналов из-за двух основных изомеров (SAP и TSAP) в растворе. Те же самые сигналы гораздо шире при комнатной температуре.
Фиг.18: Z-спектры соединения 3, полученные в растворах (20 мМ), забуференных при различных значениях pH в диапазоне от 6,41 до 8, 20°C; магнитное поле 7 Тл, мощность облучения 24 мкТл.
Фиг.19: Профили переноса насыщения ST (слева) и соответствующие Z-спектры (справа), полученные в водных растворах (20 мМ) соединения 4, забуференных при различных значениях pH в диапазоне от 5,08 до 6,30, при 293K, магнитное поле 7 Тл, мощность облучения 24 мкТл.
Фиг.20: Логометрическая кривая ST, демонстрирующая зависимость от pH логометрических значений, вычисленных для соединения 4 из кривых ST, полученных после облучения гидроксильных протонов при 75 и 100 м.д., соответственно.
Фиг.21: Z-спектры соединения 5, полученные в водных растворах (20 мМ), забуференных при различных значениях pH в диапазоне от 5,5 до 8,1, 20°C; магнитное поле 7 Тл, мощность облучения 24 мкТл.
Подробное описание изобретения
Источник магнитно неэквивалентных мобильных протонов, позволяющий разработать не зависящий от концентрации способ CEST МРТ, раскрытый в настоящем описании, представлен мобильными протонами, принадлежащими, по меньшей мере, двум различимым по ЯМР изомерам парамагнитного CEST-агента.
При этом если не указано иное, выражение "различимые по ЯМР изомеры CEST-агента" означает стереоизомеры данного CEST-агента, обеспечивающие сигналы мобильных протонов, которые разделены и, следовательно, различимы в спектре ЯМР, или, другими словами, которые демонстрируют различные резонансы (в спектре ЯМР) для обмениваемых протонов, причем каждый резонанс соответствует одному из различимых по ЯМР стереоизомеров.
В этом отношении подходящие CEST-агенты, обеспечивающие данный тип магнитно неэквивалентных протонов, являются, предпочтительно, комплексными соединениями лантаноида (III), содержащими группу обмена протонами на боковом ответвлении хелатирующего лиганда, который демонстрирует, по меньшей мере, два различимых по ЯМР стереоизомера в растворе.
Интересно, что спектр ЯМР данных комплексных соединений, фактически, демонстрирует, по меньшей мере, два раздельных резонанса для обмениваемого протона, причем каждый соответствует одному из различимых по ЯМР изомеров, которые можно селективно облучать в логометрических способах визуализации с применением CEST.
Применение различимых по ЯМР изомеров подходящих комплексных соединений лантаноида (III) в качестве источника магнитно неэквивалентных мобильных протонов, пригодного для применения в логометрическом способе визуализации с применением CEST, составляет вариант осуществления настоящего изобретения.
В настоящее время ясно, что для правильного применения данного альтернативного источника неэквивалентных мобильных протонов в in vivo способах, основанных на CEST, необходимо, чтобы комплекс лантаноида, используемый в качестве CEST-зонда, демонстрировал несколько различимых по ЯМР стереоизомеров в физиологических условиях, или, другими словами, чтобы резонансы обмениваемых протонов различных стереоизомеров, демонстрируемых комплексом Ln(III), были еще соответствующим образом сдвинуты и хорошо детектировались в водном растворе при комнатной температуре и физиологическом pH.
В настоящем описании определен особый класс комплексных соединений Ln(III), содержащих макроциклический хелатирующий лиганд, снабженный гидроксильной (-OH) группой обмена протонами на боковом ответвлении, который существует в растворе в виде смеси нескольких различимых по ЯМР изомеров. Преимущественно, спектр ЯМР данных комплексных соединений демонстрирует, по меньшей мере, два резонанса для обмениваемых OH протонов, соответствующих различным стереоизомерам, которые при этом присутствуют и хорошо различимы в водном растворе, и в физиологических условиях по pH и температуре.
Применение данного конкретного класса комплексных соединений лантаноида (III) в логометрическом способе визуализации с применением CEST представляет предпочтительный вариант осуществления настоящего изобретения.
Таким образом, в одном варианте осуществления настоящее изобретение относится к применению комплексных соединений лантаноида (III), содержащих хелатирующий лиганд, снабженный гидроксильной группой обмена протонами на боковом ответвлении, в логометрических способах визуализации с применением CEST, которые используют магнитно неэквивалентные мобильные протоны (по меньшей мере, два), каждый из которых предоставлен различимым по ЯМР стереоизомером рассматриваемого лантаноидного комплекса.
Подходящие металлические ионы лантаноида (III) (или Ln(III)) выбирают из группы, состоящей из: празеодима (III), неодима (III), диспрозия (III), эрбия (III), тербия (III), гольмия (III), тулия (III), иттербия (III) и европия (III), где европий (III) и иттербий (III) являются предпочтительными, и иттербий (III) является особенно предпочтительным.
С другой стороны, подходящие хелатирующие лиганды согласно настоящему изобретению включают макроциклические хелатирующие лиганды, снабженные гидроксильной (OH) группой обмена протонами на одном боковом ответвлении.
Предпочтительными являются хелатирующие лиганды формулы (I):
где:
R представляет собой -CH(R2)-COOH,
R1 представляет собой H или прямую, или разветвленную C1-C5алкильную цепь, которая необязательно прерывается группой, выбранной из -O-, -N-, -CO-, -NHCO-, -CONH-, и необязательно замещена одним или более атомами галогена, гидроксильными (-OH) группами, фенильной или замещенной фенильной группой или группой, выбранной из -COOH, -NHR3 или -NR4R5, где R3, R4 и R5 являются одинаковыми или различными, прямыми или разветвленными C1-C3алкильными группами, которые необязательно замещены одной или более гидроксильными группами или C1-C3алкоксигруппами,
R2 представляет собой H или C1-C5алкильную цепь, которая необязательно замещена одной или C1-C3алкоксигруппой, или гидроксиалкоксигруппой.
В этом отношении специалисту должно быть понятно, что, когда хелатирующий лиганд формулы (I) образует комплекс с несущим три положительных заряда металлическим ионом лантаноида (III), карбоксильная группа фрагмента R находится в соответствующей депротонированной (-CH(R2)-COO-) форме.
В настоящем описании, если не указано иное, под термином прямая, или разветвленная C1-C5алкильная группа подразумевают линейную или разветвленную алкильную цепь, содержащую от 1 до 5 атомов углерода. Подходящие примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и тому подобные.
Вышеуказанные алкильные группы могут быть дополнительно замещены и/или прерываться одной или более галогенными, гидроксильными, алкокси, амино, гидроксиалкокси, фенильными или замещенными фенильными группами, как изложено выше.
Под галогеном или атомами галогена подразумевают атомы йода, хлора, брома или фтора, причем последний является особенно предпочтительным.
Под термином замещенный фенил подразумевают фенильную группу, замещенную одним или более атомами галогена, гидроксильными группами (OH) или C1-C3алкоксигруппами или группой, выбранной из групп -(CH2)nCOOH, -NO2, -NHR3 или -NR4R5, где n равен 0 или 1, и R3, R4 и R5 определены выше.
Под термином C1-C3алкокси подразумевают любую алкилоксигруппу, в которой алкильный фрагмент включают вплоть до 3 атомов углерода.
Под гидроксиалкоксигруппой подразумевают любую из вышеуказанных C1-C3алкоксигрупп, в которой алкильный фрагмент дополнительно замещен гидроксильной группой.
Подходящие примеры алкокси- или гидроксиалкоксигрупп настоящего изобретения включают, например, метокси, этокси, н-пропокси, гидроксиметилокси, -2-гидроксиэтокси, 2,3-дигидроксипропокси и тому подобные.
Предпочтительно, в соединениях формулы (I) R2 представляет собой H, и R1 представляет собой H или прямую, или разветвленную C1-C4алкильную цепь, необязательно прерываемую атомом кислорода или замещенную -ОН, -NH2 или фенильной группой, которая может в свою очередь быть замещена или не замещена гидроксильной группой, C1-C3алкоксигруппой, нитрогруппой или карбоксильной группой.
Еще более предпочтительно, в соединениях формулы (I) R2 представляет собой H, и R1 представляет собой группу, выбранную из:
-H,
-CH3,
-CH2CH3,
-CH2OH,
-CH2-O-CH3,
-CH(CH2OH)2,
-CH2-CH(OH)-CH2OH,
-CH2-O-CH2-C6H5,
-CH2-O-CH2-(C6H5-COOH),
-CH2-O-CH2-(C6H5-NO2).
Особенно предпочтительным согласно настоящему изобретению является комплекс Ln(III) с лигандом формулы (I), где R2 представляет собой H, и R1 представляет собой -CH3, тогда как хелатный ион Ln(III) выбирают из Yb(III) или Eu(III).
Димерные или мультимерные производные, содержащие, по меньшей мере, два хелатирующих лиганда формулы (I), необязательно связанных своими группами R1, которые могут быть соответствующим образом функционализированы, если нужно, включены в настоящее изобретение, и обычно имеют повышенную чувствительность.
Соответственно, в другом варианте осуществления настоящее изобретение относится к комплексным соединениям Ln(III), в которых хелатирующий лиганд является димерным или мультимерным производным соединения формулы (I).
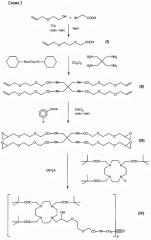
Одним примером данного типа соединения является, например, раскрытое в примере 1 ниже вместе со схемой его получения.
Тетрамерный хелатирующий лиганд примера 1, или HPDO3A-тетрамер, как используется в настоящем описании взаимозаменяемо, а также его соли и его хелатные комплексы с (вплоть до) четырьмя парамагнитными металлическими ионами, являются новыми и составляют дополнительный объект настоящего изобретения.
В этом отношении подходящие парамагнитные металлические ионы выбирают из следующих: Fe(2+), Fe(3+), Cu(2+), Ni(2+), Rh(2+), Co(2+), Cr(3+), Gd(3+), Eu(3+), Dy(3+), Tb(3+), Pm(3+), Nd(3+), Tm(3+), Ce(3+), Y(3+), Ho(3+), Er(3+), La(3+), Yb(3+), Mn(3+), Mn(2+). Более предпочтительно, парамагнитный металлический ион представляет собой Gd(3+) или лантаноидный металл, выбранный из Yb(3+), Eu(3+) или Dy(3+).
Дополнительным объектом настоящего изобретения является диагностическая композиция, содержащая парамагнитный или, особенно, бис- или полихелатный с Ln(III) комплекс димерного или мультимерного производного хелатирующего лиганда формулы (I) или его физиологически приемлемую соль вместе с подходящими добавками и/или носителями, для применения при МР томографии. В предпочтительном варианте осуществления указанная диагностическая композиция содержит (Yb3+)4HPDO3A-тетрамер, имеющий структуру как на фиг.9.
Может быть удобным, чтобы хелатирующий лиганд формулы (I), содержащий, по меньшей мере, три карбоксильные группы на макроциклическом остове, имел форму физиологически приемлемой соли.
Подходящие примеры катионов неорганических оснований, которые можно применять, для того чтобы образовывать соли с лигандами настоящего изобретения, содержат ионы щелочных или щелочноземельных металлов, таких как калий, натрий, кальций или магний.
Предпочтительные катионы органических оснований включают, в том числе, катионы первичных, вторичных и третичных аминов, таких как этаноламин, диэтаноламин, морфолин, глюкамин, N-метилглюкамин, N,N-диметилглюкамин.
Предпочтительные анионы неорганических кислот, которые можно соответствующим образом применять для данной цели, включают ионы галогеновых кислот, такие как хлориды, бромиды, йодиды, или другие ионы, такие как сульфаты.
Предпочтительные анионы органических кислот включают анионы кислот, обычно используемых в фармацевтических способах образования солей основных веществ, такие как, например, ацетат, сукцинат, цитрат, фумарат, малеат или оксалат.
Предпочтительные катионы и анионы аминокислот включают, например, катионы и анионы таурина, глицина, лизина, аргинина, орнитина или аспарагиновой и глутаминовой кислот.
С другой стороны, все три карбоксильные группы макроциклического лиганда участвуют в хелатировании несущего три положительных заряда иона лантаноида. В результате комплексные соединения Ln(III) формулы (I) являются нейтральными и, следовательно, подходящими для применений in vivo без какой-либо дополнительной нейтрализации или солеобразования.
В случае, вместо этого, когда хелатирующий лиганд содержит в своей структуре дополнительную кислотную группу, необходима его нейтрализация с помощью катиона, обычно используемого в фармацевтических способах, например, выбранного из перечисленных выше, для того чтобы получить его физиологически приемлемую соль.
Хелатные комплексы Ln(III) формулы (I), где R1 отличается от H, и их димерное или мультимерное производное включают хиральный центр, представленный гидроксилированным углеродом на боковом ответвлении. Поэтому в растворе они демонстрируют несколько стереоизомерных форм, различающихся, по существу, расположением ацетатных ответвлений (ориентированных по часовой стрелке или против часовой стрелки), двумя конформациями макроциклического кольца и конформацией хирального центра (R,S). В этом отношении специалисту в данной области известно, что когда R1 представляет собой H, указанный углерод утрачивает свою хиральность, но изомеры, отличающиеся расположением ацетатных ответвлений или конформацией кольца, все равно существуют.
Настоящее изобретение основано на том наблюдении, что диастереоизомеры, демонстрируемые в водном растворе при комнатной температуре данным предпочтительным классом комплексных соединений, различимы по спектру ЯМР. Более конкретно, авторы обнаружили, что комплексные соединения Ln(III) формулы (I), предлагаемые данным изобретением, демонстрируют в растворе при физиологических температуре и pH, по меньшей мере, два соответственно сдвинутых резонанса для обмениваемых OH протонов, причем они соответствуют различным различимым по ЯМР диастереоизомерам данного комплекса. Преимущественно подтверждается, что различные стереоизомеры одного и того же комплекса имеют одинаковое биораспределение in vivo и одинаковое отношение относительных концентраций с течением времени. Следовательно, несколько соответственно сдвинутых резонансов OH протонов различимых по ЯМР стереоизомеров комплексного соединения Ln(III) формулы (I), демонстрируемых в растворе, можно эффективно использовать для разработки логометрического способа CEST МРТ, пригодного для применения в условиях in vivo, для того чтобы получить CEST-изображения in vivo, которые не подвержены влиянию локальной концентрации рассматриваемого комплекса.
Кроме того, интересно, что величина переноса насыщения ST, полученного селективным насыщением обмениваемых OH протонов комплексных соединений Ln (III) согласно настоящему изобретению, является заметно чувствительной или, другими словами, восприимчивой к физическим или химическим параметрам микроокружения, в котором они распределены. В результате, особый класс комплексных соединений Ln (III), предлагаемых настоящим изобретением, помимо того, что он пригоден для применения в способе визуализации с применением CEST для получения не зависящего от концентрации CEST-контраста, может также эффективно использоваться в качестве чувствительных CEST-агентов, особенно в логометрических способах визуализации с применением CEST, позволяющих получить измерения in vivo и карты физических или химических параметров, представляющих диагностический интерес, которые не подвержены влиянию локальной концентрации самого агента.
Соответственно, в дополнительном варианте осуществления настоящее изобретение относится к применению комплексного соединения Ln (III) формулы (I) в качестве не зависящего от концентрации чувствительного CEST-агента, особенно в логометрическом способе визуализации с применением CEST для определения физических или химических параметров, представляющих диагностический интерес, in vivo.
В настоящем изобретении, если не указано иное, под физическим или химическим параметром, представляющим диагностический интерес, подразумевают параметр, выбранный из температуры, pH, парциального давления кислорода (pO2) или углекислого газа (pCO2), концентрации определенного иона или метаболита или определенной ферментативной активности.
В этом отношении в настоящее время понятно, что зная значение или карту физического(их) или химического(их) параметра(ов) в исследуемом органе тела или области, доктор может производить диагностические оценки тех физиологических или метаболических процессов, представляющих диагностический интерес, которые непосредственно зависят от указанного(ых) определяемого(ых) параметра(ов).
В другом дополнительном варианте осуществления настоящее изобретение относится к логометрическому способу CEST МРТ, который включает использование, т.е. облучение подходящим радиочастотным импульсом и, таким образом, индуцирование переноса насыщения у сигнала объемной воды, по меньшей мере, двух магнитно неэквивалентных мобильных протонов, которые предоставляются двумя или более различимыми по ЯМР стереоизомерами подходящего CEST-зонда.
В этом отношении специалисту должно быть понятно, что логометрический способ CEST МРТ, использующий магнитно неэквивалентные мобильные протоны, принадлежащие различимым по ЯМР изомерам любого подходящего CEST-зонда, включен в настоящее изобретение. В предпочтительном варианте осуществления рассматриваемый CEST-зонд представляет собой парамагнитный CEST-агент и, более предпочтительно, представляет собой комплексное соединение Ln (III), предлагаемое настоящим изобретением.
В особенно предпочтительном варианте осуществления CEST-зонд представляет собой комплекс Ln(III) с хелатирующим лигандом HPDO3A, или бис- или полихелатный комплекс его димерного или мультимерного производного, или его физиологически приемлемую соль.
Соответственно, в своем предпочтительном варианте осуществления настоящее изобретение относится к логометрическому способу CEST МРТ, который включает применение комплексного соединения Ln (III) формулы (I) или его димерного или мультимерного производного, для получения не зависящей от концентрации визуализации с применением CEST in vivo. Даже более предпочтительно, указанный логометрический способ CEST МРТ применяют для определения физического или химического параметра, представляющего диагностический интерес, in vivo в органе тела, жидкости или ткани человека или животного, которое не подвержено влиянию локальной концентрации CEST-агента.
Более конкретно, в предпочтительном варианте осуществления настоящее изобретение относится к не зависящему от концентрации способу визуализации с применением CEST для получения изображений органа тела, области, жидкости или ткани человека или животного, который включает:
a) введение хелатных комплексов Ln(III) формулы (I) или их димерного или мультимерного производного человеку или животному и необязательно получение морфологических изображений МРТ области органа тела, жидкости или ткани человека или животного, представляющих интерес, предпочтительно с применением T2-взвешенной последовательности,
b) получение Z-спектра в диапазоне частот, точно настроенном на резонансные частоты двух магнитно неэквивалентных мобильных протонов, принадлежащих различимым по ЯМР стереоизомерам введенного комплекса лантаноида, и вычисление логометрических значений из эффекта переноса насыщения (ST), измеренного для двух данных пулов мобильных протонов,
c) получение не зависящих от концентрации изображений указанных области органа тела, жидкости или ткани человека или животного,
причем стадия C данного способа, предпочтительно, включает наложение карты логометрических значений, полученных из измеренных ST-эффектов на стадии b) данного способа, на предварительно полученные морфологические изображения рассматриваемых органа тела, области, жидкости или ткани человека или животного. Для этого на стадии b) получают резонансные частоты двух магнитно неэквивалентных мобильных протонов из спектра ЯМР данного комплекса, который, если он не известен к данному моменту, может быть соответствующим образом получен до визуализации с применением CEST.
Вышеописанный способ визуализации с применением CEST может быть реализован in vitro (ex vivo) или, предпочтитель