Раствор для внутривенного и внутримышечного введения на основе бромдигидрохлорфенилбензодиазепина и способ его получения
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается анксиолитических средств группы бензодиазепинов. Лекарственный состав в форме раствора для внутривенного и внутримышечного введения, содержащий в качестве активного вещества бромдигидрохлорфенилбензодиазепин и вспомогательные агенты, отличающийся тем, что в качестве вспомогательных агентов содержит поливинилпирролидон низкомолекулярный медицинский (молекулярная масса 12600±2700), глицерол, натрия дисульфит, полисорбат-80, натрия гидрофосфата додекагидрат, калия дигидрофосфат, натрия гидроксида раствор 0,1 M и воду для инъекций. Описан также способ получения раствора. Изобретение обеспечивает повышение стабильности препарата. 2 н. и 4 з.п. ф-лы, 4 пр., 2 табл.
Реферат
Изобретение относится к химико-фармацевтической промышленности и касается анксиолитических средств группы бензодиазепинов.
Расстройство адаптации (РА) или состояние субъективного дистресса и эмоционального беспокойства, обычно влияющее на выполнение социальных функций и работоспособность, возникающее в период адаптации к серьезной перемене в жизни или стрессогенному событию в жизни пациента, является частой причиной первичного обращения больных за помощью к врачам разных специальностей [Александровский Ю.А. Пограничные психические расстройства. - М.: Медицина, 2000]. По мнению ряда исследователей в общемедицинской практике у 10% больных обнаруживаются РА, оцениваемые обычно в группе больных с тревожными расстройствами. При лечении РА помимо психотерапии широко применяют анксиолитики, среди которых особенно часто используются бензодиазепины, в частности феназепам.
Создание Феназепама® - один из ярких эпизодов в истории отечественной фармакологии. В начале 1970-х гг. группа ученых под руководством академика В.В. Закусова получила государственный заказ на создание отечественного транквилизатора. Молекулу синтезировали в Одесском физико-химическом институте АН УССР (автор - С.А. Андронати). С разработкой Феназепама® тесно связаны и имена других блестящих ученых - С.Б. Середениной и Т.А. Ворониной (фармакологический скрининг, отбор и изучение); Г.Я. Авруцкого и Ю.А. Александровского (клиническая эффективность и безопасность). Все они в 1980 г. получили Государственную премию СССР, а уникальный препарат (не имеющий аналогов в мире) стал надежным помощником психиатров.
Главные клинические мишени Феназепама® - тревожный синдром и нарушения сна. Исследования показали, что препарат наиболее эффективен при лечении нарушений невротического характера, основной причиной которых является тревога. С первых же часов его применения наблюдается значительное уменьшение тревожного напряжения, раздражительности, нарушений сна, соматовегетативных расстройств (широко применяется в кардиологии). Результаты одной из экспериментальных работ, проведенных в институте фармакологии РАМН, показывают, что в экспериментальных тестах по анксиолитической активности немногие препараты могут быть сравнимы с Феназепамом® по критерию эффективности дозы.
Еще одна замечательная особенность Феназепама® - он самый безопасный бензодиазепиновый транквилизатор (в 2,6 раза менее токсичен, чем диазепам и в 3,8 раза, нежели хлордиазепоксид), что обусловлено широким «коридором» между терапевтической и токсической дозами. Его длинный период полувыведения (150 часов!) не позволяет развиться так называемому «синдрому отдачи», присущему другим бензодиазепинам [Дифференциальный подход к фармакотерапии тревожных расстройств. Сателлитный симпозиум компании «Валента Фарм». XV Съезд психиатров России].
Из патента RU 2224522 С2, опубл. 27.02.2004, известен раствор для инъекций, который содержит, мас. %:
| феназепам | 0,05-0,15 |
| поливинилпирролидон | 0,5-1,2 |
| твин-80 | 2,0-10,0 |
| глицерин | 5,0-15,0 |
| натрий пиросернистокислый | 0,1-0,3 |
| раствор натра едкого до рН | 6,0-7,5 |
| вода | остальное |
Для получения раствора проводят смешивание феназепама с твином-80, перемешивание полученной смеси с глицерином при температуре 70-90°С, добавление натрия пиросернистокислого, поливинилпирролидона, раствора едкого натра в количестве, обеспечивающем рН 6,5-7, и воды, повторное перемешивание и фильтрацию раствора.
В патенте UA 1262 A1, опубл. 30.12.1993, описан способ приготовления инъекционного раствора феназепама. Раствор получается растворением феназепама в этаноле, содержащем низкомолекулярный поливинилпирролидон, растворением полученной твердой дисперсной системы в щелочном растворе твина-80 и последовательным добавлением бензилового спирта, маннита, натрия метабисульфита, водного раствора натрия гидроксида и воды для инъекций.
В качестве ближайшего аналога для состава может быть указан препарат Элзепам® в виде раствора для внутривенного и внутримышечного введения, содержащий бромдигидрохлор-фенилбензодиазепин 1,0 г, поливинилпирролидон низкомолекулярный медицинский (молек. масса 12600±2700) - 9,0 г, глицерол - 100,0 г, натрия дисульфит - 2,0 г, полисорбат-80 -50,0 г, натрия гидроксида раствор 0,1 M до рН 6,0-7,5, воду для инъекций до 1 л.
(http://grls.rosminzdrav.ru/InstrImg.aspx?idReg=8187&t=&isQld=1).
В качестве ближайшего аналога для способа может быть способ по патенту RU 2224522 С2.
Известные состав и способ не обеспечивают значительного очищения от примесей и предупреждения их возникновения при хранении.
Задачей настоящего изобретение является разработка новой инъекционной формы бромдигидрохлорфенилбензодиазепина и способа ее получения.
Задача решается новым лекарственным составом в форме раствора для внутривенного и внутримышечного введения следующего состава, мас.%:
| Бромдигидрохлорфенилбензодиазепин | 0,09-0,11 |
| Поливинилпирролидон | |
| низкомолекулярный медицинский | |
| (молек. масса 12600±2700) | 0,81-0,99 |
| Глицерол | 9,0-11,0 |
| Натрия дисульфит | 0,09-0,11 |
| Полисорбат-80 | 4,5-5,5 |
| Натрия гидрофосфата додекагидрат | 0,48-0,59 |
| Калия дигидрофосфат | 0,02-0,025 |
| Натрия гидроксида раствор 0,1 М | |
| до рН 7.3-7,5 | |
| Вода для инъекций | остальное |
Предложенный состав обладает выраженным анксиолитическим, противосудорожным, центральным миорелаксирующим и снотворным действием, усиливает действие снотворных, наркотических, антипсихотических (нейролептических) и противосудорожных средств, этилового спирта.
Показания к применению: препарат применяют при различных невротических, неврозоподобных психопатических, психопатоподобных и других состояниях, сопровождающихся тревогой, страхом, повышенной раздражительностью, напряженностью, эмоциональной лабильностью, при реактивных психозах, ипохондрически-сенестопатическом синдроме, вегетативных дисфункциях и расстройствах сна. Как противосудорожное средство препарат применяют для купирования эпилептического статуса и серийных судорожных припадков различной этиологии. В неврологической практике препарат применяют для лечения гиперкинезов и тиков, ригидности мышц. В анестезиологии - для премедикации в качестве компонента вводной анестезии.
Способ получения заключается в том, что в воду для инъекций при температуре 30-35°С вносят при перемешивании натрия гидрофосфата додекагидрата, после его полного растворения добавляют калия дигидрофосфат и перемешивают до полного растворения, полученный буферный раствор нагревают до температуры 55-60°С, вносят поливинилпирролидон низкомолекулярный медицинский с молекулярной массой 12600±2700, перемешивают до его полного растворения, вносят глицерол и перемешивают при температуре 35-40°С, затем добавляют натрия дисульфит и перемешивают до растворения, корректируют рН раствора с помощью 0,1 M раствора натрия гидроксида до 7,3-7,5, добавляют раствор бромдигидрохлорфенилбензодиазепина в полисорбате-80, перемешивают до гомогенного состояния, осуществляют стерилизующую фильтрацию раствора, фасуют раствор в ампулы и стерилизуют раствор в ампулах при температуре 118-122°С в течение 8 мин.
Предпочтительно стерилизующую фильтрацию осуществляют через систему фильтров предварительной и стерилизующей фильтрации, где в качестве предварительного используют фильтрующий элемент патронного типа с размером пор от 0,65/0,45 мкм, а в качестве стерилизующего - фильтрующий элемент с размером пор 0,20 мкм, под давлением азота не выше 0,08-0,13 МПа.
Предпочтительно скорость вращения мешалки - от 280 до 450 об/мин.
Предпочтительно используют воду для инъекций высокоочищенную методом электронной ионизации с последующей ульрафильтрацией, стерилизацией и дополнительной очисткой с помощью парового колонного дистиллятора.
Изобретение может быть проиллюстрировано следующими ниже представленными примерами.
Пример 1
Состав (на 1 мл):
Действующее вещество:
| Бромдигидрохлорфенилбензодиазепин | 1,0 мг |
Вспомогательные вещества:
| Поливинилпирролидон | 9,0 мг |
| низкомолекулярный медицинский | |
| (молек. масса 12600±2700) | |
| Глицерол | 100,0 мг |
| Натрия дисульфит | 1,0 мг |
| Полисорбат-80 | 50,0 мг |
| Натрия гидрофосфата додекагидрат | 5,37 мг |
| Калия дигидрофосфат | 0,23 мг |
| Натрия гидроксида раствор 0,1 М | до рН 7,5 |
| Вода для инъекций | до 1,0 мл |
Пример 2. Способ получения раствора
1. Подготовка сырья
Каждую серию субстанции «Бромдигидрохлорфенилбензодиазепин» проверяют в соответствии с утвержденной нормативной документацией. Поливинилпирролидон низкомолекулярный медицинский (молекулярная масса 12600±2700) проверяют в соответствии с ФСП 42-0345-4368-03, USP или Eur. Ph. Глицерол проверяют в соответствии с ГОСТ 6824-96, Eur. Ph или USP.
Натрия дисульфит проверяют в соответствии с Eur. Ph. или USP. Полисорбат-80 проверяют в соответствии с ФС 42-2540-88, Eur. Ph или USP. Натрия гидрофосфата додекагидрат проверяют в соответствии с ГОСТ 4172-76. Калия дигидрофосфат проверяют в соответствии с ГОСТ 4198-75. Натрия гидроксид контролируют по показателям, предусмотренным ГОСТ 4328-77.
2. Подготовка воды для инъекций
Воду высокоочищенную получают на установке водоподготовки модель «SEPTRON®», фирма «CHRIST AQUA PHARMA & ВIOТЕСН», с помощью электродной ионизации. Производительность - 2000 л/ч.
Питьевая вода, подаваемая на установку «SEPTRON®», проходит следующие стадии подготовки:
- фильтрация через фильтры «MSF 25/24», предназначенные для удаления из воды ионов железа и марганца и ее осветление;
- фильтрация через двухколоночный умягчитель, который снаряжен натрий-катионитными фильтрами «RONDOMAT 95Е DWZ 330» с сильнокислотным катеонитом в Na-форме и работает в маятниковом режиме, что обеспечивает непрерывную подачу умягченной воды на установку;
- ультрафиолетовую стерилизацию с помощью установки «Bewades 80 W80/11 LC».
Общая жесткость воды в градусах не должна превышать 0,05°dH.
Подготовленная таким образом умягченная вода подается в патентованный модуль «SEPTRON®», где осуществляются следующие ступени ее очистки: фильтрация, обратный осмос и электрическая деионизация, последняя происходит под воздействием электрического тока, без применения химикатов и при незначительной мощности потребления.
Умягченная вода поступает в камеру, заполненную ионообменным веществом. Приложенный к электродам электрический потенциал создает заряженные ионы в виде ионов натрия и хлорида, которые через мембрану ионного обмена поступают в сборную камеру для утилизации. Ионообменное вещество в модуле «SEPTRON®» уменьшает электрическое сопротивление воды. Метод электродиализации позволяет удалять ионные компоненты из воды без увеличения в ней общего содержания солей.
Вода имеет электропроводимость не более 0,2 µC/см при температуре 25°С.
Вода высокоочищенная, полученная на установке водоподготовки «SEPTRON®» подвергается ультрафильтрации и подвергается ультрафиолетовой стерилизации. Вода высокоочищенная подается на установку системы «COMBITRON». Установка «COMBITRON» представляет собой паровой 4-колонный дистиллятор, в основе работы которого заложен принцип многократного выпаривания и конденсации. Установка «COMBITRON» обеспечивает получение стерильной, свободной от пирогенов воды для инъекций и чистого пара на базе одной технологической установки.
Содержание бактериальных эндотоксинов воды для инъекций с установки «COMBITRON» - не более 0,25 ЕЭ/мл, а электропроводимость при температуре 20°С - не более 1,1 µСм/см.
3. Приготовление раствора
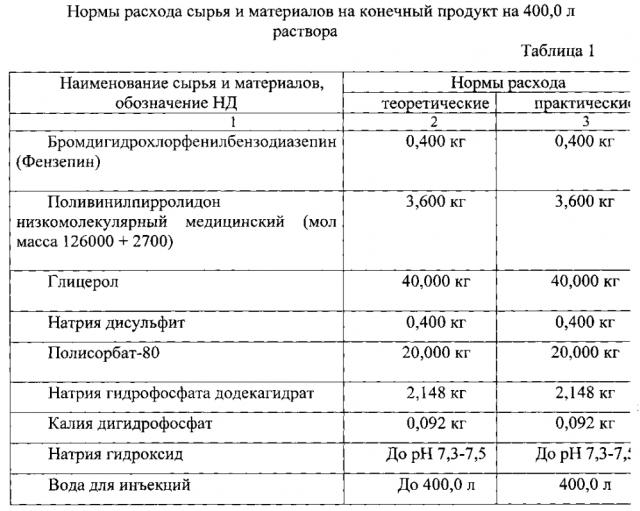
В реактор для приготовления инъекционных растворов вместимостью 1000,0 л, снабженный магнитной мешалкой, паровой рубашкой, системой охлаждения и герметичной крышкой и термометром, подают из сборника 350,00 л свежеприготовленной воды для инъекций. Воду для инъекций охлаждают до 35°С, пропуская через рубашку реактора питьевую воду. Затем в реактор вносят натрия гидрофосфата додекагидрат (2,148 кг) и перемешивают в течение 10 мин до его полного растворения. Скорость вращения мешалки реактора - от 280 до 450 об/мин.
Затем в реактор вносят навеску калия дигидрофосфата (0,092 кг) и перемешивают в течение 10 мин до его полного растворения.
Буферный раствор (40,0 л) в реакторе вместимостью 100,0 л нагревают до температуры 60°С, вносят 3,60 кг повидона. Содержимое реактора перемешивают в течение 60-90 мин до его полного растворения (полноту растворения контролируют визуально через смотровое окно люка реактора).
В реактор с буферным раствором через открытый люк вносят 40,00 кг глицерола. Повышают температуру в реакторе до 40°С и перемешивают 15-20 мин. Скорость вращения мешалки от 280 до 450 об/мин.
Навеску натрия дисульфита (0,40 кг) через открытый люк загружают в реактор для приготовления инъекционных растворов вместимостью 1000,0 л и перемешивают в течение 10-15 мин.
Измеряют рН раствора в реакторе, вносят через открытый люк 0,1 M раствор натрия гидроксида до получения величины рН 7,3-7,5.
Затем в осушенный реактор загружают 20,00 кг полисорбата-80 и нагревают его до температуры 75-80°С.
В стакане из термостойкого стекла взвешивают 0,4000 кг субстанции бромдигидрохлорфенилбензодиазепин.
В стакан с навеской субстанции вносят разогретый полисорбат-80 и перемешивают. Растворенную субстанцию переносят в реактор с полисорбатом. Содержимое реактора перемешивают в течение 90-110 мин до полного растворения бромдигидрохлорфенилбензодиазепина в полисорбате-80 (контролируется визуально через смотровое окно на крышке люка реактора).
Растворенный в полисорбате-80 бромдигидрохлорфенилбензодиазепин из реактора перекачивают с помощью сжатого азота в реактор для приготовления инъекционных растворов вместимостью 1000,0 л и перемешивают в течение 10-15 мин.
Доводят по уровню раствор препарата в реакторе для приготовления инъекционных растворов вместимостью 1000,0 л до метки (400,00 л) с помощью буферного раствора и перемешивают при скорости вращения мешалки 280-450 об/мин в течение 40 мин. Температура содержимого реактора - 30°С.
4. Стадия фильтрации
Стерилизующую фильтрацию раствора осуществляют через систему фильтров предварительной и стерилизующей фильтрации, герметично смонтированных в материальной линии помещения розлива и запайки ампул класса чистоты В (зона В).
Раствор препарата из реактора на фильтрацию передавливают с помощью сжатого азота.
В качестве предварительного используют фильтрующий элемент патронного типа с размером пор от 0,65/0,45 мкм, а в качестве стерилизующего - фильтрующий элемент с размером пор 0,20 мкм. Контроль давления, использующегося при фильтрации, осуществляют по манометру. Фильтрация, по возможности, должна производиться без остановок. Во время фильтрации следят за давлением азота в реакторе, которое не должно превышать 0,08-0,13 МПа.
Профильтрованный раствор препарата поступает в сборник с профильтрованным раствором вместимостью 20,0 л, из которой непосредственно поступает на дозирующие устройства машины наполнения и запайки.
После окончания фильтрации всю систему продувают азотом для удаления остатков раствора препарата из фильтров. Выход на стадии фильтрации составляет порядка 99,50%.
5. Наполнение, запайка и стерилизация ампул
Ампулы с раствором препарата после окончания розлива и запайки стерилизуют в стерилизаторе паровом при температуре 120±2°С в течение 8 мин.
Свойства полученных растворов:
Прозрачность. Раствор должен быть прозрачным или по степени мутности не превышать эталонный раствор I (ГФ XI, вып. 1, с. 198).
Цветность. Раствор должен быть бесцветным или по степени окрашивания не превышать эталонный раствор №46 (ГФ XI, вып.1, с. 194).
рН. От 7.3 до 7,5 (потенциометрически, ГФ XI, вып. 1, с. 113).
Механические включения. Препарат должен выдерживать требования «Инструкции по контролю на механические включения инъекционных лекарственных средств» РД 42-501-98.
Посторонние примеси. Метод ТСХ. Суммарное содержание посторонних примесей (допускается наличие двух пятен) на хроматограмме препарата (100 мкг бромдигидрохлорфенилбензодиазепина), оцененное по величине и интенсивности окраски пятен в сравнении с пятнами на хроматограммах растворов СОВС, не должно превышать 0,25%.
Бактериальные эндотоксины. Предельное содержание бактериальных эндотоксинов должно быть не более 0,25-0,5 ЕЭ на 1 мг бромдигидрохлор-фенилбензодиазепина (ОФС 42-0002-00).
Пирогенность (альтернативно). Препарат должен быть апирогенным (ГФ XI, вып. 2, с. 183). Тест-доза 0,025 мг/кг в 0,5 мл испытуемого раствора.
Стерильность. Препарат должен быть стерильным (ГФ XI, вып. 2, с. 187).
Пример 3. Изучение стабильности
Данные по стабильности препарата с предлагаемой буферной смесью свидетельствуют о сохранении значения рН 7,3-7,5 в растворе лекарственного средства на протяжении всего срока годности (технический результат), по сравнению с известным составом, в котором значение рН в растворе к концу срока годности близится к нижнему пределу - около рН 5,5 (При исследовании других буферных смесей, в частности ацетатного буфера, такого эффекта достичь не удалось).
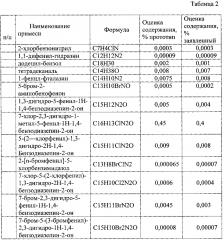
После хранения в течение 3-х лет стабильность растворов изучалась дополнительно, а именно определялось содержание образующихся примесей (см. таблицу 2)
Пример 4. Изучение фармакологических эффектов заявленного состава
1. Анксиолитическое действие предложенного раствора по примеру 1 в условиях внешнего торможения лабиринтного рефлекса. Действие раствора на поведение крыс при эмоциональном стрессе, создаваемом внешним торможением питьевых условных рефлексов, изучали с использованием методики Τ образного лабиринта. Включение светового раздражителя перед выполнением 3-го рефлекса контрольными животными с выработанным навыком приводило к резкому торможению стабильной условной реакции и характеризовалось значительным увеличением (почти в пять раз) латентного времени пробежки по лабиринту.
2. Изучение седативного действия феназепама, в тесте открытого поля. Эксперимент выполнен на 30 белых беспородных крысах - самцах. Все процедуры над животными проводились в соответствии с международными правилами работы с лабораторными животными.
Эмоциональный статус крыс определяли по суммарному числу дефекаций и уринаций за три минуты нахождения животного в открытом поле. Тест «Открытое поле» проводили за 7 суток до введения животных в эксперимент. Первая группа состояла из интактных животных, которых выводили из эксперимента одновременно с животными двух других групп, и являлась контрольной. У животных второй группы моделировали ситуацию хронического стресса. Для этого животных ежедневно в течение 9 суток на пять с половиной часов помещали в пластмассовые цилиндрические камеры с отверстиями для доступа воздуха. Размер камер, как в длину, так и в диаметре превышал размеры животного на 0,5-1 см, что позволяло животному переворачиваться внутри камеры и свободно изменять свою позу. То есть данный способ воздействия не являлся иммобилизацией. В третью группу входили животные, подвергавшиеся хроническому стрессу вышеописанным способом, которым вводили исследуемый состав в/м. Введение раствора начинали за 24 часа до первого сеанса помещения животного в камеру, затем препарат вводили в течение 30 минут после окончания каждого сеанса стрессирующего воздействия. Крысам первой и второй групп по аналогичной схеме спаивали эквивалентные объемы воды. По истечении сроков воздействия животных выводили из эксперимента путем декапитации.
В результате ежедневного помещения животных в камеры на пять часов у крыс повышалась активность коры надпочечников, выражающаяся в увеличении массы надпочечников и уровня 11-оксикортикостероидов в крови относительно этих показателей у контрольных животных. У крыс, которым вводили раствор, реакции со стороны гипоталамо-гипофизарно-надпочечниковой системы не наблюдалось.
В крови крыс, подвергавшихся ежедневному помещению в пластиковые камеры, повышался относительно контроля уровень свободного оксипролина - маркера деградации коллагена. Введение предложенного раствора полностью предотвращало этот эффект хронического стресса на метаболизм соединительной ткани.
1. Лекарственный состав в форме раствора для внутривенного и внутримышечного введения, содержащий в качестве активного вещества бромдигидрохлорфенилбензодиазепин и вспомогательные агенты, отличающийся тем, что в качестве вспомогательных агентов содержит поливинилпирролидон низкомолекулярный медицинский (молекулярная масса 12600±2700), глицерол, натрия дисульфит, полисорбат-80, натрия гидрофосфата додекагидрат, калия дигидрофосфат, натрия гидроксида раствор 0,1 M и воду для инъекций при следующем содержании компонентов, мас.%:
| Бромдигидрохлорфенилбензодиазепин | 0,09-0,11 |
| Поливинилпирролидон | |
| низкомолекулярный медицинский | |
| (молек. масса 12600±2700) | 0,81-0,99 |
| Глицерол | 9,0-11,0 |
| Натрия дисульфит | 0,09-0,11 |
| Полисорбат-80 | 4,5-5,5 |
| Натрия гидрофосфата додекагидрат | 0,48-0,59 |
| Калия дигидрофосфат | 0,02-0,025 |
| Натрия гидроксида раствор 0,1 M | |
| до рН 7,3-7,5 | |
| Вода для инъекций | остальное |
2. Лекарственный состав по п. 1, отличающийся тем, что используют воду для инъекций высокоочищенную методом электронной ионизации с последующей ультрафильтрацией, стерилизацией и дополнительной очисткой с помощью парового колонного дистиллятора.
3. Способ получения лекарственного состава в форме раствора для внутривенного и внутримышечного введения по п. 1 или 2, отличающийся тем, что в воду для инъекций при температуре 30-35°С вносят при перемешивании натрия гидрофосфата додекагидрат, после его полного растворения добавляют калия дигидрофосфат и перемешивают до полного растворения, полученный буферный раствор нагревают до температуры 55-60°С, вносят поливинилпирролидон низкомолекулярный медицинский с молекулярной массой 12600±2700, перемешивают до его полного растворения, вносят глицерол и перемешивают при температуре 35-40°С, затем добавляют натрия дисульфит и перемешивают до растворения, корректируют рН раствора с помощью 0,1 M раствора натрия гидроксида до 7,3-7,5, добавляют раствор бромдигидрохлорфенилбензодиазепина в полисорбате-80, перемешивают до гомогенного состояния, осуществляют стерилизующую фильтрацию раствора, фасуют раствор в ампулы и стерилизуют раствор в ампулах при температуре 118-122°С в течение 8 мин.
4. Способ по п. 3, отличающийся тем, что стерилизующую фильтрацию осуществляют через систему фильтров предварительной и стерилизующей фильтрации, где в качестве предварительного используют фильтрующий элемент патронного типа с размером пор от 0,65/0,45 мкм, а в качестве стерилизующего - фильтрующий элемент с размером пор 0,20 мкм, под давлением азота не выше 0,08-0,13 МПа.
5. Способ по п. 3, отличающийся тем, что скорость вращения мешалки - от 280 до 450 об/мин.
6. Способ по п. 5, отличающийся тем, что используют воду для инъекций, полученную методом электронной ионизации с последующей ультрафильтрацией, стерилизацией и дополнительной очисткой с помощью парового колонного дистиллятора.