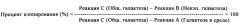Быстрый и точный анализ сиалирования белков
Иллюстрации
Показать всеИзобретение относится к области биохимии. Описана группа изобретений, включающая способ определения процента сиалирования гликопротеина и набор для определения содержания сиаловой кислоты в гликопротеине. Способ включает в себя стадии подготовки белка к анализу, ферментативную обработку подготовленного белка, анализ образцов белка с применением HPAEC-PAD-хроматографии, определение содержания сиаловой кислоты в образцах белка, расчет процента сиалирования белка. Изобретение расширяет арсенал средств для определения процента сиалирования гликопротеинов. 2 н. и 2 з.п. ф-лы, 6 ил, 23 табл, 15 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В этой заявке описываются способы анализа сиалирования белков.
УРОВЕНЬ ТЕХНИКИ
Многие белки требуют гликозилирования для их биологической функции. Часто конечные, "кэппирующие" углеводы гликозильных цепей являются остатками сиаловой кислоты. К сиаловым кислотам относится группа N- и O-связанных нейраминовых кислот. N-связанные сиаловые кислоты образуются путем связывания ацетильных или гликозильных компонентов с амино-остатком нейраминовой кислоты, образуя N-ацетилнейраминовую кислоту (Neu5Ac) и N-гликозилнейраминовую кислоту (Neu5Gc), соответственно. Если амино-группа нейраминовой кислоты замещена гидроксильным компонентом, образуется 3-дезокси-D-глицеро-D-галакто-2-нонулосоновая кислота (KDN). O-связанные сиаловые кислоты образуются путем замещения одной или нескольких гидроксильных групп Neu5Ac, Neu5Gc или KDN метальными, ацетильными, лактоильными, сульфатными или фосфатными группами. Соответственно, существует большая и разнообразная популяция сиаловых кислот.
Кроме того, существует значительный интерес к анализу сиалирования белков в целом, благодаря многочисленным биологическим функциям, приписываемым этим модификациям. Сиалирование может быть важным для фармакокинетики и эффективности белковых биотерапевтических средств. Таким образом, были разработаны способы анализа с целью определения содержания сиаловой кислоты гликопротеинов. Например, могут применяться анализы на основе антител для распознавания конкретных углеводных компонентов. Конечные сиаловокислотные остатки могут ферментативным путем отсоединяться от соответствующего гликопротеина и подвергаться анализу при помощи HPLC. Однако каждый из этих способов имеет недостатки и, как правило, требует чистых образцов или высокой концентрации. Традиционные способы, применяемые в биофармацевтической отрасли, страдают недостатком точности, высокой изменчивостью данных и не могут применяться со сложными культуральными средами из-за помехи матрикса. Описанный авторами способ позволяет преодолеть такие недостатки и обеспечивает точный и воспроизводимый количественный анализ сиалирования белков.
В целом описанный авторами способ включает два этапа: (1) ферментативную реакцию применяют для гидролиза галактозы и остатков сиаловой кислоты из гликопротеинов; и (2) способ ионообменной хроматографии применяют для отделения и подсчета галактозных остатков. Ферментная часть способа включает отцепление открытых (некэппированных) конечных галактозных остатков специфической экзогликозидазой, β-(1-4)-галактозидазой (β-галактозидазой), тогда, как конечные остатки сиаловой кислоты отцепляются α-(2-3,6,8,9)-сиалидазой (α-сиалидазой). Перед расщеплением образец распределяют как минимум по трем пробиркам. Содержимое первой пробирки. Реакция А представляет образец согласно существующему уровню техники и включает только буферы для ферментативной реакции. Содержимое второй пробирки. Реакцию В приводят в реакцию с β-галактозидазой, которая расщепляет все галактозные остатки, не кэппированные сиаловыми кислотами. Содержимое третьей пробирки. Реакция С совместно расщепляется нейраминидазой и β-галактозидазой. Фермент нейраминидаза удаляет кэппирующие сиаловые кислоты и позволяет β-галактозидазе расщеплять все открытые галактозные остатки. Затем применяют высокоэффективную анионообменную хроматографию с импульсным амперометрическим обнаружением (НРАЕС PAD) для определения количества галактозы, присутствующей в трех образцах. Соотношение некэппированной галактозы (т.е. Реакции В) с общим количеством галактозы (т.е. Реакцией С) применяют для расчета процента кэппинга галактозных остатков, при этом также учитывая любую свободную галактозу, присутствующую в среде (Реакция А).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторами описываются способы анализа сиалирования белка. Также описывается способ определения содержания сиалированного белка, включающий: (а) подготовку белка к анализу; (b) ферментативную обработку подготовленного белка, включающую: разделение подготовленного белка на множество образцов белка, включающих (i) как минимум один образец белка в качестве образца среды (Реакция A); (ii) добавление как минимум β-галактозидазы к как минимум одному образцу белка (Реакция В); (iii) добавление как минимум β-галактозидазы и α-сиалидазы к как минимум еще одному образцу белка (Реакция С); и инкубацию множества образцов белка; и (с) анализ множества образцов белка с применением HPAEC-PAD-хроматографии; (d) определение содержания углеводов для множества образцов белка; и (е) расчет процента сиалирования для белка.
Также описывается способ, также включающий (f) анализ множества положительных и отрицательных контрольных образцов с применением НРАЕС-PAD- хроматографии; (g) анализ множества стандартных образцов с применением HPAEC-PAD-хроматографии; и (h) сравнение множества образцов белка с множеством стандартных и контрольных образцов.
Также описывается применение HPAEC-PAD-хроматографии для определения содержания сиалированного белка, включающее: (а) подготовку белка к анализу; (b) ферментативную обработку подготовленного белка, включающую: разделение подготовленного белка на множество образцов белка, включающих (i) как минимум один образец белка в качестве образца среды (Реакция А); (ii) добавление, как минимум, β-галактозидазы к как минимум одному образцу белка (Реакция В); (iii) добавление, как минимум, β-галактозидазы и α-сиалидазы к как минимум еще одному образцу белка (Реакция С); и инкубацию множества образцов белка; и (с) анализ множества образцов белка с применением HPAEC-PAD-хроматографии; (d) определение содержания углеводов для множества образцов белка; и (е) расчет процента сиалирования для белка.
Также описывается применение, также включающее: (f) анализ множества положительных и отрицательных контрольных образцов с применением НРАЕС-PAD-хроматографии; (g) анализ множества стандартных образцов с применением HPAEC-PAD-хроматографии; и (h) сравнение множества образцов белка с множеством стандартных и контрольных образцов.
Также описывается комплект, определяющий содержание любого сиалированного белка, включающий: как минимум одно вместилище, включающее множество вместилищ, включающих предварительно отмеренное количество галактозидазы и сиалидазы; вместилища необязательно содержат как минимум одну буферную композицию, положительный контрольный образец, отрицательный контрольный образец и стандартные углеводные образцы, а также инструкции, в которых описывается способ определения содержания сиалированного белка, включая описания: (а) подготовки белка к анализу; (b) ферментативной обработки подготовленного белка, включающую: разделение подготовленного белка на множество образцов белка, включающих (i) как минимум один образец белка в качестве образца среды (Реакция А); (ii) добавление, как минимум, β-галактозидазы к как минимум одному образцу белка (Реакция В); (iii) добавление, как минимум, β-галактозидазы и α-сиалидазы к как минимум еще одному образцу белка (Реакция С); и инкубацию множества образцов белка; и (с) анализа множества образцов белка с применением НРАЕС-PAD-хроматографии; (d) определения содержания углеводов для множества образцов белка; и (е) расчета процента сиалирования для белка.
Также описывается комплект, также включающий: (f) анализ положительного и отрицательного контрольных образцов с применением HPAEC-PAD-хроматографии; (g) анализ множества стандартных образцов с применением HPAEC-PAD-хроматографии; и (h) сравнение результатов множества образцов белка с результатами множества стандартных образцов.
КРАТКОЕ ОПИСАНИЕ ФИГУР
ФИГУРА 1 схематически показывает Реакции А, В и С и данные, полученные в результате каждой соответствующей реакции. Процент сиалирующего кэппинга определяют по частному разностей в Реакциях С и В и Реакциях С и А, соответственно. См. Уравнение 1.
ФИГУРА 2 показывает типичную хроматограмму для расщепленного образца recAlpha-1 в Реакции С. Время элюирования для галактозы составляет приблизительно от 14 до 16 минут.
ФИГУРА 3 показывает сравнение предшествующего образца recAlpha-1, который был подвергнут либо диализу на деионизированной воде, либо центрифугированию 10 кДа в центробежном фильтре. В диализированном образце оставались примеси, но они почти полностью удалялись при помощи 10 кДа центробежного фильтра.
ФИГУРА 4 демонстрирует, что предыдущие вспомогательные вещества из культуральных сред recAlpha-1 могут обнаруживаться и подвергаться совместному элюированию поблизости от пика галактозы. На графике А показан пик вспомогательного вещества, который в некоторых образцах элюируется после пика галактозы после очистки центробежного фильтра. Для образцов Реакции В пик примесей представляет базовый показатель, полученный на основе пика галактозы, и не интегрируется. Как показано на графике В, пик примесей процесса совместно элюируется с образцом Реакции С. В этом случае пик примесей должен быть расщеплен, как показано выше, для исключения его интеграции с площадью под пиком галактозы.
ФИГУРА 5. Специфичность способа подтверждалась анализом смеси нейтральных и аминомоносахаридов, производных от гликопротеинов.
ФИГУРА 6. Пример типичной стандартной кривой галактозы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Примером белка, поддающегося анализу с применением описанного авторами способа, является ингибитор альфа-1-протеиназы (также известный как альфа-1-антитрипсин). Ингибитор альфа-1-протеиназы является природным серпиновым гликопротеином, задействованным в защите клеток от протеазных ферментов, задействованных в свертывании и воспалении. Отсутствие ингибитора альфа-1-протеазы, дефицит альфа-1-антитрипсина, ведет к респираторным нарушениям, таким как эмфизема и хроническое обструктивное заболевание легких (COPD). Соответственно, существует интерес к использованию ингибитора альфа-1-протеазы в качестве биотерапевтического средства для лечения связанных с дефицитом ингибитора альфа-1-протеазы болезней. Ингибитор рекомбинантной альфа-1 протеиназы (recAlpha-1) подвергали инженерии для секреции клеточной линией PerC6 с N-связанными структурами углевода гликана, частично или полностью кэппированными конечными сиаловыми кислотами (N-ацетилнейраминовыми кислотами). Было продемонстрировано, что уменьшение количества конечных сиаловых кислот сокращает период полувыведения recAlpha-1 из сыворотки. Таким образом, важно знать процент галактозных остатков, кэппированных сиаловыми кислотами в recAlpha-1, при исследовании ее функции или эффективности в качестве терапевтического средства.
ПРИМЕРЫ
Пример 1: Приготовление образца для анализа и ферментативного расщепления
Авторами описывается способ определения содержания сиалирования гликопротеина. Способ начинается с приготовления образца белка для ферментативного гидролиза углеводных компонентов. Соответственно, белок должен быть приведен в состояние, совместимое с ферментативными реакциями, включая регулирование концентрации белка, удаление компонентов раствора, таких как растворенные соли, буферы, другие белки, углеводы, вспомогательные вещества и т.п., которые могут препятствовать действию фермента(ов). В контексте данного описания термин "подготовленный" или фраза "подготовка белка к анализу" означают процесс удаления компонентов раствора, которые могут препятствовать ферментативному гидролизу и разбавлению белкового раствора до оптимальной для анализа концентрации деионизированной водой.
Могут применяться как минимум два неограничивающих типичных способа для подготовки белковых компонентов раствора из белков для анализа: (1) диализ на деионизированной воде или (2) центробежное фильтрование (также известно как спиновая фильтрация). В обоих случаях использовали полупроницаемую мембрану с указанной границей отсечки по молекулярной массе (MWCO) для удаления более низкомолекулярных разновидностей при удерживании анализируемого белка. Диапазон значений MWCO включает 1 кДа, 2.5 кДа, 5 кДа, 10 кДа, 20 кДа, 50 кДа, 100 кДа, 250 кДа и 500 кДа. При процедуре диализа белок вставляли в диализную мембрану и диализировали на избыточном количестве деионизированной воды или подходящего буфера и/или солевого раствора в течение как минимум 4 часов при 4°С.
В альтернативном варианте вместо диализа образец белка может быть подготовлен к ферментативному расщеплению путем центробежного фильтрования. Во время центробежного фильтрования белковый раствор центрифугировали на полупроницаемую мембрану с указанным MWCO. Компоненты раствора с молекулярной массой, меньшей, чем MWCO, во время центрифугирования проходят сквозь фильтр, в то время как белок и более высокомолекулярные разновидности удерживаются. Как правило, белковый раствор концентрировали во время спиновой фильтрации за счет прохождения воды сквозь полупроницаемую мембрану. В качестве типичного неограничивающего примера для приготовления образца белка использовали 10 кДа центробежный фильтр в соответствии с инструкциями производителя.
Перед ферментативным расщеплением образцы белков также разбавляли до концентрации от 1,0 до 1,5 мг/мл деионизированной водой, таким образом, чтобы они пребывали в пределах линейного диапазона анализа. Сразу после разбавления образцов составляли как минимум одну реакцию для каждого состояния (т.е. А, В и С). Приготовленный белковый раствор разделяли как минимум на три образца для ферментативного дегликозилирования. См. Фигуру 1. Реакция А представляла собой контрольный образец существующего уровня техники (для контроля экзогенной галактозы). Эта реакция состоит только из буферов для ферментативных реакций и служит в качестве контроля для углеводов, которые могут существовать в среде, включающей анализируемый белок. Реакция В содержала β-галактозидазу, которая гидролизировала несиалированные углеводные группы, в отличие от "кэппированных" сиалильными группами. Реакция С содержала α-сиалидазу и β-галактозидазу. В этой реакции α-сиалидаза гидролизировала кэппирующие сиалильные компоненты, которые затем позволяли β-галактозидазе гидролизировать все углеводные группы. В этой комбинированной реакции α-сиалидазы и β-галактозидазы, все гликозилирования (т.е., сиалированные и несиалированные) удаляли из белка, в то время как в реакции β-галактозидазы удаляли только некэппированные (несиалированные) углеводные группы. Компоненты трех условий реакции показаны в Таблице 1.
| Таблица 1: | |||||
| Условия гликозилазной реакции | |||||
| Реакция | Деионизированная вода (мкл) | Реакция галактозидазы Буфер(мкл) | Реакция сиалидазы Буфер (мкл) | β-(1-4)-галактозидаза (мкл) | α-(2-3,6,8,9)-сиалидаза (мкл) |
| А - Уровень техники | 12 | 4 | 4 | 0 | 0 |
| B - β-галактозидаза | 10 | 4 | 4 | 2 | 0 |
| C - β-галактозидаза + α-сиалидаза | 8 | 4 | 4 | 2 | 2 |
Отдельные реакции подготавливали в нескольких экземплярах в зависимости от количества образцов, подлежащих расщеплению. Для каждого расщепления 45 мкл образца добавляли в три отдельные пробирки. Затем 20 мкл соответствующей ферментативной реакции А, В или С добавляли в пробирку, предназначенную для этого типа реакции, и нагревали на термомиксере при 37°С с умеренным встряхиванием в течение 2,5-4 часов. Реакцию гасили путем инкубации при 90°С в течение 5 минут.
Сразу после завершения расщепления образцы подготавливали для хроматографического анализа путем комбинирования 30 мкл образца и 20 мкл 0,02 мг/мл дезоксирибозного стандарта в флаконе и тщательного перемешивания. Затем образцы помещали на автодозатор для HPLC при 10°С и прогоняли, применяя способ хроматографии, описанный в Примере 2.
Пример 2: Способы хроматографии
Анализ при помощи высокоэффективной анионообменной хроматографии с импульсным амперометрическим обнаружением (HPAE-PAD) выполняли при помощи систем для ионной хроматографии Dionex ICS-3000 с одним насосом, термостатированными автодозаторами, установленными на 10°С, и электрохимическими детекторами (Dionex, Sunnyvale, CA). Используют золотые (Au) электроды для импульсного амперометрического обнаружения (PAD) (Dionex Prod. No.060139). Форма волны, используемая для анализа образца, была указана в технической записке 21 от Dionex, в которой описываются оптимальные настройки для PAD углеводов, как показано в Таблице 2. См. Dionex Technical Note 21, Optimal Settings for Pulsed Amperometric Detection of Carbohydrates Using the Dionex ED40 Electrochemical Detector, Dionex (1998).
| Таблица 2: | ||
| Рекомендуемые Dionex оптимальные настройки формы волны для PAD образцов углеводов | ||
| Время | Потенциал (В) | Интеграция |
| 0,00 | +0,1 | |
| 0,20 | +0,1 | Начало |
| 0,40 | +0,1 | Конец |
| 0,41 | -0,2 | |
| 0,42 | -0,2 | |
| 0,43 | +0,6 | |
| 0,44 | -0,1 | |
| 0,50 | -0,1 |
Хроматографию выполняли с применением анионообменной колонки Dionex CarboPac РА10 4×250 мм (Dionex Prod. No.046110) с встроенной предколонкой CarboPac РА10 4×50 мм (Dionex Prod. No.046115) и 4×50 мм аминоулавливающей колонкой (Dionex Prod. No.046112) для связывания десиалированного белка и предотвращения его адсорбции в колонку.
Первую мобильную фазу (А), содержащую 20 мМ NaOH, использовали для изократического разделения при скорости потока 1 мл/мин в течение 30 минут (время первичного прогона составляло 28 минут, но продлевалось до 30 минут во время проявления, что давало больше времени на повторное уравновешивание в 100% мобильной фазе А). Вторую мобильную фазу (В), содержащую 500 мМ NaOH, использовали для элюирования колонки, очистки колонки и очистки электродов. Способ хроматографического элюирования, включающий функцию ramp wash с применением мобильных фаз А и В, показан в Таблице 3. Вводимый объем образца составлял 20 мкл. Анализы данных выполняли с использованием программы для анализа данных хроматографии Chromeleon® 6.8 (Dionex).
| Таблица 3: | |||
| Способ хроматографического элюирования HPAE-PAD | |||
| Время (мин) | % А (20 мМ NaOH) | % В (500 мМ NaOH) | Время линейного изменения(мин) |
| 0,0 | 100 | 0,0 | - |
| 19,0 | 100 | 0,0 | 0,5 |
| 19,5 | 0,0 | 100 | - |
| 24,5 | 0,0 | 100 | 0,5 |
| 25,0 | 100 | 0,0 | - |
| 30,0 | 100 | 0,0 | - |
Пример 3: Стандарты, контрольные образцы, градуирование и приемлемость системы
Концентрацию галактозы определяют относительно известного количества 10 мМ стандарта галактозы (BioAssay Systems, EGAL-100), который последовательно разбавляли в линейном диапазоне от 8 пмоль до 1,5 нмоль. Во время разработки способа для каждой точки осуществляли одно введение перед введением образцов для обеспечения функционирования колонки и системы. См. Фигуру 6.
Моносахарид 2-дезокси-D-рибозу (дезоксирибозу) использовали в качестве внутреннего стандарта. Равноценное количество дезоксирибозы добавляли ко всем образцам белков, стандартным и контрольным образцам для наблюдения за функционированием электрода. Характер PAD требует применения внутреннего стандарта для исправления различий в показаниях детектора, которые для разных вводимых образцов могут быть разными. Площадь под пиком галактозы для всех образцов корректировали путем деления площади галактозы на площадь дезоксирибозы.
Положительный контроль использовали для обеспечения точности анализа при каждом его выполнении. Она требуется для наблюдения за функцией фермента и обеспечения надлежащего обращения с образцом. Контрольная реакция представляла собой смесь 1:1 серийно выпускаемого сиалированного фетуина крупного рогатого скота и асиалофетуинового стандарта (Sigma F3004 и А4781, соответственно). Отдельно сиалированный фетуин имеет процент кэппинга свыше 99%, а асиалофетуин имеет процент кэппинга 0%. При смешивании в одинаковых пропорциях соотношение кэппинга (сиалирования) для фетуина должно составлять 50%±3%. Фетуиновый контроль изготавливали большой партией, которую делили на аликвоты, замораживали при -70°С и отдельный образец размораживали и использовали в качестве контроля каждый раз при расщеплении и прогонке набора образцов с применением описанных авторами способов.
Эксперимент на приемлемость системы для обеспечения эффективности аналитического способа наблюдали с использованием смеси галактозы и дезоксирибозы, которую вводили в начале прогона, с "заключением в скобки" после каждых введенных 12 образцов (т.е., 2 образца в двух экземплярах), и в конце прогона для наблюдения за функционированием электрода и колонки в течение всего прогона. Серия экспериментов для типичного хроматографического прогона представлена в Таблице 4.
| Таблица 4: | |||
| Типичная последовательность хроматографического прогона | |||
| Образец | Содержание | Повторы | Вводимый объем (мкл) |
| 1 | Чистый буфер а | 3 | 20 |
| 2 | Высок, конц. ст. - Приемлемость системы | 3 | 20 |
| 3 | Низк. конц. ст. b | 1 | 20 |
| 4 | Высок. конц. ст. b | 1 | 20 |
| 5 | Чистый фермент с | 1 | 20 |
| 6 | Фетуин - Реакция В d | 1 | 20 |
| 7 | Фетуин - Реакция С d | 1 | 20 |
| 8 | Фетуин - Реакция В d | 1 | 20 |
| 9 | Фетуин - Реакция С d | 1 | 20 |
| 10 | Высок. конц. ст. - Приемлемость системы b | 1 | 20 |
| 11 | Чистый буфер а | 1 | 20 |
| 12 | Образец 1 - Реакция А | 1 | 20 |
| 13 | Образец 1 - Реакция В | 1 | 20 |
| 14 | Образец 1 - Реакция С | 1 | 20 |
| 15 | Образец 1 - Реакция А | 1 | 20 |
| 16 | Образец 1 - Реакция В | 1 | 20 |
| 17 | Образец 1 - Реакция С | 1 | 20 |
| 18 | Чистый буфер а | 1 | 20 |
| 19 | Образец 2 - Реакция А | 1 | 20 |
| 20 | Образец 2 - Реакция В | 1 | 20 |
| 21 | Образец 2 - Реакция С | 1 | 20 |
| 22 | Образец 2 - Реакция А | 1 | 20 |
| 23 | Образец 2 - Реакция В | 1 | 20 |
| 24 | Образец 2 - Реакция С | 1 | 20 |
| 25 | Высок. конц. ст. - Приемлемость системы b | 1 | 20 |
| 26 | Чистый буфер а | 1 | 20 |
| N … | N… | 1 | 20 |
| N+1 | Высок. конц. ст. - Приемлемость системы b | 3 | 20 |
| N+2 | Промывание | - | - |
| а Чистый буфер вводили без материала (т.е., с содержанием только мобильной фазы А). Дополнительное введение холостого раствора может быть необходимым для обеспечения чистоты и уравновешенности колонки. Рекомендуется второе введение холостого раствора для определения чистоты колонки. Введение холостого раствора также должно выполняться как минимум один раз для каждых 6 вводимых образцов или раньше в случае необходимости (чистый буфер). | |||
| b Низкоконцентрированный стандарт представлял собой 8 пмоль галактозы, а |
| Высококонцентрированный стандарт - 1500 пмоль галактозы. Эти аналитические стандарты были предусмотрены, чтобы гарантировать результаты образца в пределах линейного диапазона наинизшей и наивысшей концентраций для аналитической пробы. Аналитический контроль 1500 пмоль также использовали в качестве контроля приемлемости системы (например, высококонцентрированный стандарт - приемлемость системы) в течение всего прогона для наблюдения за функционированием электрода и колонки и должен "заключаться в скобки" после каждых введенных 12 образцов (т.е., четырех прогонов наборов образцов А, В и С). | |
| с Вводимый чистый фермент содержал ферменты (т.е., β-галактозидазу и α-сиалидазу) и буферы без образца белка (т.е., Реакцию С без анализируемого белка). | |
| d Фетуин крупного рогатого скота (смесь 1:1 сиалированного фетуина и асиалофетуина) использовали в качестве положительного контроля для сиалирования. |
Пример 4: Корректировка и расчет результатов
Репрезентативная хроматограмма показана на Фигуре 2. Площади всех введенных образцов корректировались площадью дезоксирибозы. Корректировку выполняли путем деления пика галактозы на площадь пика дезоксирибозы. Это скорректированное число использовали для расчета процента сиалирования. Для расчета этого процента определяли соотношение некэппированной галактозы с общей галактозой при помощи Уравнения 1:
Для расчета процента кэппирования площадь галактозы делили на площадь дезоксирибозы для получения скорректированных показателей площади галактозы. Процент кэппирования рассчитывали для каждого из введенных в двух экземплярах образцов с использованием скорректированных площадей. Скорректированную площадь галактозы, измеренную для Реакции В, вычитали из скорректированной площади галактозы, определенной на основе Реакции С; это значение соответствует количеству кэппированной сиалилом галактозы. Скорректированную площадь галактозы, определенную для Реакции А, затем вычитали из скорректированной площади галактозы, измеренной для Реакции С; это значение соответствует общему показателю галактозы (т.е., кэппированной и некэппированной). Показатель кэппированной галактозы (С-В) делили на общий показатель галактозы (С-А) и умножали на 100 для получения процента сиалилового кэппинга. Репрезентативные данные показаны в Таблице 5.
| Таблица 5: | |||||
| Репрезентативные данные кэппирования галактозы | |||||
| Образец | Площадь дезоксирибоз ы (nC × мин) | Площадь галактозы (nC × мин) | Скорректи рованная площадь (nC [ мин) | Процент кэппирования | Средний процент кэппирования |
| Образец 1 - Реакция А | 4,597 | 0,162 | 0,035 | 97,9 | 97,8 |
| Образец 1 - Реакция В | 4,523 | 0,537 | 0,119 | ||
| Образец 1 - Реакция С | 4,461 | 17,545 | 3,933 | ||
| Образец 1 - Реакция А | 4,723 | 0,150 | 0,032 | 97,7 | |
| Образец 1 - Реакция В | 4,633 | 0,548 | 0,118 | ||
| Образец 1 - Реакция С | 4,557 | 17,48 | 3,763 |
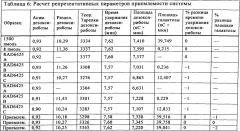
Приемлемость системы наблюдали с использованием смеси галактозы и дезоксирибоза, которую вводили в начале прогона и в конце прогона для наблюдения за функционированием электрода и колонки в течение всего прогона. Указанный средний процент кэппирования определяли на основе скорректированных площадей двукратных введений. Если площадь под пиком галактозы в Реакции В была меньшей, чем площадь под пиком галактозы в стандарте 8 пмоль, процент кэппирования указывали как ">[кэппинг]%" (т.е., "более"), рассчитанный на основе площади под пиком галактозы стандарта 8 пмоль в числителе расчета. Коэффициент асимметрии пика (называемый "асимметрией" в программе Chromeleon®), теоретических тарелок и разделение рассчитывали и определяли при помощи программы сбора данных Dionex. Расчеты остальных критериев приемлемости системы производили вручную. Репрезентативные параметры приемлемости системы показаны в Таблице 6.
Критерии допустимости анализа приемлемости системы показаны в Таблице 7.
| Таблица 7: | |
| Критерии допустимости анализа приемлемости системы | |
| Параметры приемлемости системы | Критерии |
| Процентная разница времени удержания дезоксирибозы в образце относительно времени удержания дезоксирибозы в среднем показателе высоко- и низкоконцентрированного стандарта | ±5% |
| Процентная разница площади галактозы первичного контроля анализа (высококонцентрированный стандарт) и контрольных введений для "заключения в скобки" (т.е. введений высококонцентрированного стандарта для проверки приемлемости системы) | ±15% |
| Процентная разница % кэппинга двойных образцов recAlpha-1 | ±2% |
| Процентная разница результата % кэппирования контроля на основе предварительно установленного и ожидаемого результата % кэппирования. | ±3% установленного значения |
| Коэффициент асимметрии пика (т.е., асимметрия)* | 1±0,2 |
| Таблица 7: | |
| Критерии допустимости анализа приемлемости системы | |
| Параметры приемлемости системы | Критерии |
| Теоретические тарелки* | >2000 |
| Разделение* | >8,5 |
| * Коэффициент асимметрии пика определяли, используя пик дезоксирибозы для каждого вводимого образца. |
Пример 5: Стехиометрия образца/ферментативных реакций и время расщепления
С целью оптимизации скорости ферментативной реакции анализировали соотношение фермента с белком. Фермент β-галактозидаза обеспечивался производителем с активностью >3 ед./мл (удельная активность >6 ед./мг), в то время как α-Фермент сиалидаза обладает активностью 5 ед./мл (удельная активность при 135 ед./мг). Количество каждого фермента поддерживали на постоянном уровне по 4 мкл, что соответствует 0,012 единицы β-галактозидазы и 0,02 единицы α-сиалидазы в реакции, в то время как количество белка колебалось от 540 до 2160 пмоль. Анализируемые образцы представляли собой подвергнутый буферному обмену и фильтрованный recAlpha-1 в супернатанте клеточной культуры в концентрации 1,4 мг/мл. Образцы подготавливали, как показано в Таблице 8.
| Таблица 8: | ||
| Стехиометрия реакции | ||
| Объем образца RAD0906(мкл) | Объем реакции (мкл) | Концентрация образца после добавления реакции (мг/мл) |
| 20 | 20 | 0,7 |
| 40 | 20 | 0,9 |
| 80 | 20 | 1,1 |
Для каждого показателя стехиометрии реакции и момента времени расщепления recAlpha-1 анализировали площадь под хроматографическим пиком галактозы и определяли процент кэппирования. В Таблице 9 показаны сводные результаты, демонстрирующие, что показатель кэппинга не меняется ни при каких стехиометрических условиях. Начальный показатель стехиометрии реакции (например, 2,2×10-5 ед./пмоль белка) определяли в соответствии с рекомендациями производителя. Однако эти результаты указывают, что ферменты могут быть избыточными в рекомендуемых поставщиком условиях, даже при повышении концентрации белка в 4 раза. При таком широком динамическом диапазоне стехиометрии выбирали "средние" стехиометрические условия (т.е., приблизительно 1,1×10-5 ед./пмоль белка) с целью упрощения процедуры, минимизации стоимости фермента и обеспечения возможности достаточной устойчивости в приготовлении образца.
Стехиометрию реакции также исследовали путем сравнения результатов кэппинга для предыдущего образца recAlpha-1 (RAD-0637), изготовленного в 1-й день с использованием 4 мкл фермента в реакции и 2-й день (через 14 дней) с использованием 2 мкл фермента. Результаты эксперимента показывают одинаковый показатель кэппинга для количества фермента 2 мкл и 4 мкл, что свидетельствует о том, что количество 2 мкл фермента было достаточным для доведения реакции до завершения, в соответствии с вышеуказанным наблюдением (Таблица 10).
| Таблица 10: | ||
| Результаты количества фермента | ||
| Дата анализа | Объем фермента (мкл) | Процент кэппирования |
| 1-й день | 4 | 97,4 |
| 2-й день | 2 | 97,2 |
Пример 6: Внутренний стандарт
При этом способе HPAEC-PAD применяли внутренний стандарт для нормализации площади под пиком галактозы вследствие естественной изменчивости амперометрического обнаружения каждого вводимого образца. Сначала испытывали два внутренних стандарта: галактозамин и дезоксирибозу.
Оба внутренних стандарта функционировали надлежащим образом, и время элюирования обоих достаточно отличалось от времени галактозы и не препятствовало количественному определению. Хотя галактозамин функционировал надлежащим образом, наблюдались некоторые несоответствия показателей площади под пиком, которые требовали более широких критериев допустимости для наблюдения за функционированием системы. Таким образом, в качестве внутреннего стандарта выбирали дезоксирибозу. Кроме того, дезоксирибозу обычно используют в качестве промышленного стандарта для осуществления способов амперометрического обнаружения. Площади под пиками дезоксирибозы демонстрируют меньшую изменчивость по всей последовательности введений и могут использоваться при более жестких критериях допустимости.
Во время проявки наблюдались некоторые вещества с необъяснимым увеличением или уменьшением площади дезоксирибозы. Однако в этих же образцах за увеличением или уменьшением площади дезоксирибозы следовало противоположное изменение пика галактозы (Таблица 11).
| Таблица 11: | ||
| Изменения в наблюдаемой площади под пиком дезоксирибозы | ||
| Название образца | Площадь дезоксирибозы (nC × мин) | Площадь галактозы (nC × мин) |
| Фетуин, Реакция В | 3,724 | 11,858 |
| Фетуин, Реакция С | 3,940 | 25,019 |
| Фетуин, Реакция В | 5,482 | 8,363 |
| Фетуин, Реакция С | 5,179 | 17,452 |
| RAD6236, Реакция А | 3,855 | 0,082 |
| RAD6236, Реакция В | 3,885 | 0,548 |
| RAD6236, Реакция С | 3,991 | 11,560 |
| RAD6236, Реакция А | 4,589 | 0,089 |
| RAD6236, Реакция В | 4,483 | 0,406 |
| RAD6236, Реакция С | 4,540 | 10,227 |
Как правило, колебания площади под пиком могли объясняться как различия в реакции со стороны электрода. В таком случае можно было бы ожидать, что оба пика должны повышаться или понижаться. Был проведен эксперимент, в котором дезоксирибозу добавляли к трем образцам, но не смешивали. Образцы анализировали путем HPAEC-PAD, затем удаляли и вихревали для обеспечения смешивания образца и внутреннего стандарта. Затем образцы вводили повторно. Результаты этих экспериментов показывают, что колебания площади являются результатом недостаточного смешивания образца и внутреннего стандарта. Это указывает на возможность расслоения между раствором внутреннего стандарта и образцом, и пользователи должны в достаточной мере смешивать реакцию перед помещением на поддон автодозатора. Результаты этих экспериментов сведены в Таблице 12.
| Таблица 12: | |||
| Подтверждение недостаточного смешивания как причины колебаний площади под пиком дезоксирибозы | |||
| Образец | Приготовление | Площадь дезоксирибозы (nC × мин) | Площадь галактозы (nC × мин) |
| RAD6249, Реакция С | Без смешивания | 3,172 | 22,260 |
| Фетуин, Реакция С | Без смешивания | 2,460 | 17,247 |
| 2С9, Реакция С | Без смешивания | 2,762 | 18,110 |
| RAD6249, Реакция С | После смешивания | 4,704 | 17,607 |
| Фетуин, Реакция С | После смешивания | 4,933 | 12,440 |
| 2С9, Реакция С | После смешивания | 4,877 | 14,671 |
Пример 7: Сравнение ферментов от разных поставщиков
С учетом критичности качества ферментов β-галактозидазы и сиалидазы для скорости реакции и количественного определения галактозы сравнивали ферменты β-галактозидазу и α-сиалидазу от четырех разных поставщиков. Цель состояла в измерении достаточности скорости реакции, которая бы обеспечивала точную реакцию, и определении запасного поставщика на случай недоступности ферментов от основного поставщика. Выбранными поставщиками были Sigma, Glyko-Prozyme, New England BioLabs и QA Bio. Ферменты от QA Bio использовали в большинстве описанных авторами экспериментов. Ферменты от Sigma были исключены, когда ферментативная реакция не дала ответа. Ферменты от Glyko-Prozyme также были исключены как вариант, когда показатели площади под пиком галактозы для образцов, обработанных β-галактозидазой, оказались такими же, как для образцов, обработанных β-галактозидазой и α-сиалидазой в двух отдельных экспериментах (т.е., активность α-сиалидаза не обнаруживалась). Эксперименты с прямым сравнением ферментов от New England BioLabs и QA Bio подготавливали и проводили в один день. Результаты также сравнивали с данными предыдущих дней с теми же образцами, расщепленными ферментами от QA Bio. Процентные различия между двумя ферментами были пренебрежимыми, и относительное стандартное отклонение (% RSD) для нескольких экспериментальных прогонов указывало, что ферменты от New England BioLabs β-Галактозидаза и α-сиалидаза были сравнимы с QA