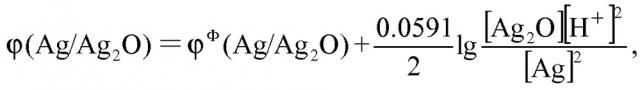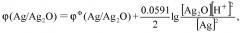Способ и устройство для определения величины рн раствора
Иллюстрации
Показать всеСогласно изобретению предложены устройство измерения величины pH и способ измерения величины pH раствора. Устройство измерения величины pH может содержать: первый электрод и второй электрод, при том что первый электрод и второй электрод должны быть помещены в раствор; источник питания для подачи биполярного прямоугольного потенциального импульсного сигнала к первому электроду и второму электроду; причем первый электрод содержит электрод из переходного металла/оксида переходного металла, а второй электрод содержит инертный электрод; средства измерения тока, соединенные между первым электродом и вторым электродом для измерения тока I, протекающего через первый электрод и второй электрод; и вычислительный блок для вычисления величины pH раствора, исходя из измеряемого тока. Изобретение обеспечивает возможность избежать использования стеклянного электрода и насыщенного каломельного электрода, что оказывает благоприятное воздействие на ежедневное техническое обслуживание устройства измерения величины pH и защиту окружающей среды, и это также оказывает благоприятное воздействие на миниатюризацию и уменьшение ограничений для устройства измерения величины pH, кроме того, только измерение тока, протекающего через электродную пару, для вычисления величины pH раствора облегчает мониторинг изменения величины pH раствора в режиме реального времени. 2 н. и 9 з.п. ф-лы, 7 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области определения величины pH, более конкретно к устройству измерения величины pH и к способу измерения величины pH.
УРОВЕНЬ ТЕХНИКИ
pH является одним из самых важных параметров для характеристики химических свойств раствора. В настоящее время наиболее широко используемым датчиком для измерения величины pH раствора является стеклянный электрод. В некоторых особых случаях (ситуациях), например, при использовании в живых организмах, необходимо, чтобы датчик pH, например, стеклянный электрод, мог быть миниатюризован, однако из-за хрупкости стекла, миниатюризация датчика pH, например, стеклянного электрода, ограничена. Кроме того, в некоторой коррозионной окружающей среде, например, в растворах фтористоводородной кислоты, стеклянный электрод не реагирует соответствующим образом на измерение pH.
Стеклянный электрод ограничен для промышленного использования и интегрирование его в домашнее устройство также затруднено из-за возможной проблемы с безопасностью (хрупкость стекла), профессиональных требований к техническому обслуживанию и короткому сроку службы, и т.д.
С другой стороны стеклянный электрод обычно используют в качестве рабочего электрода в известном уровне техники, и используют совместно с электродом сравнения, например, Ag/AgCl насыщенным каломельным электродом. Поскольку каломель и подобное являются токсичными и загрязняют окружающую среду, лучше избегать использования насыщенного каломельного электрода. Кроме того, использование электрода сравнения также приводит к высокой стоимости и затруднению при техническом обслуживании электродной пары, составленной стеклянным электродом и электродом сравнения.
Таким образом, существует настоятельная потребность в этой области техники решить упомянутые выше технические проблемы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, настоящее изобретение предлагает усовершенствованную схему измерения величины pH, которая дает возможность решить или, по меньшей мере, устранить часть дефектов, существующих в известном уровне техники.
Согласно первому аспекту настоящего изобретения предлагается устройство измерения величины pH, которое включает в себя:
первый электрод и второй электрод, при том что первый электрод и второй электрод должны быть помещены в раствор;
источник питания для подачи биполярного прямоугольного потенциального импульсного сигнала к первому электроду и ко второму электроду;
средства измерения тока, соединенные между первым электродом и вторым электродом для измерения тока I, протекающего через первый электрод и второй электрод; и
вычислительный блок для вычисления величины pH раствора, на основании измеренного тока I.
В варианте осуществления настоящего изобретения первый электрод может включать в себя электрод из переходного металла/оксида переходного металла, а второй электрод может включать в себя инертный электрод. Электрод из переходного металла/оксида переходного металла можно выбрать, например, из Ag/Ag2O-электрода, W/WO3-электрода, Mn/MnO-электрода или Ir/IrO2-электрода, а инертный электрод можно выбрать, например, из Cu-электрода, Pt-электрода, Au-электрода или электрода из нержавеющей стали. Предпочтительно электродом из переходного металла/оксида переходного металла является Ag/Ag2O-электрод, а инертным электродом является электрод из нержавеющей стали.
В другом варианте воплощения настоящего изобретения устройство измерения величины pH настоящего изобретения может включать в себя блок сохранения для предварительного сохранения функции, которая коррелирует (устанавливает взаимосвязь) ток I и величину pH. Альтернативно блок сохранения предварительно запоминает множество функций, коррелирующих ток I и величину pH, причем каждая функция связана с типом измеряемого раствора.
Альтернативно устройство измерения величины pH может включать в себя интерфейс пользователя для получения данных, отражающих тип измеряемого раствора для выбора функции из упомянутого множества функций.
Альтернативно вычислительный блок может вычислить величину pH измеряемого раствора на основании измеренного тока I и предварительно введенной в память функции.
Согласно второму аспекту настоящего изобретения, предлагается способ измерения величины pH, который включает в себя:
подачу биполярного прямоугольного потенциального импульсного сигнала к первому электроду и ко второму электроду, помещенным в раствор;
измерение тока I, который протекает через первый электрод и второй электрод; и
вычисление величины pH раствора на основании измеренного тока I.
В варианте воплощения настоящего изобретения первый электрод может включать в себя электрод из переходного металла/оксида переходного металла, а второй электрод может включать в себя инертный электрод. Электрод из переходного металла/оксида переходного металла можно выбрать, например, из Ag/Ag2O-электрода, W/WO3-электрод, Mn/MnO-электрод, или Ir/IrO2-электрода, а инертный электрод можно выбрать, например, из Cu-электрода, Pt-электрода, Au-электрода или электрода из нержавеющей стали.
В другом варианте воплощения настоящего изобретения способ измерения величины pH согласно настоящему изобретению дополнительно включает в себя предварительный ввод в память функции, которая коррелирует ток I и величину pH. Альтернативно предварительно введенным может быть множество функций, коррелирующих ток I и величину pH, причем каждую из функций приводят в соответствие с типом измеряемого раствора.
Альтернативно способ измерения величины pH согласно изобретению может дополнительно включать в себя получение данных, отражающих тип измеряемого раствора, от интерфейса пользователя для выбора функции из упомянутого множества функций.
Альтернативно способ измерения величины pH согласно настоящему изобретению может дополнительно включать в себя вычисление величины pH измеряемого раствора на основании измеренного тока I и предварительно введенной в память функции.
С помощью упомянутого выше выполнения настоящего изобретения можно исключить использование хрупкого стеклянного электрода и электрода сравнения, например, Ag/AgCl насыщенного каломельного электрода, что оказывает благоприятное действие на ежедневное техническое обслуживание устройства измерения величины pH и на защиту окружающей среды, и это также оказывает благоприятное воздействие на миниатюризацию и уменьшение ограничений для устройства измерения величины pH. Кроме того, только измерение тока, протекающего через электродную пару (составленную первым электродом и вторым электродом), для вычисления величины pH измеряемого раствора приносит много преимуществ, которые облегчают мониторинг изменения величины pH раствора в режиме реального времени, принося тем самым много неожиданных преимуществ, среди прочих, в область промышленного производства.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 схематично показывает устройство измерения величины pH согласно одному аспекту настоящего изобретения.
Фиг. 2А схематично показывает схему расположения блока памяти и вычислительного блока согласно варианту осуществления настоящего изобретения.
Фиг. 2В схематично показывает схему расположения блока памяти, интерфейса пользователя и вычислительного блока согласно варианту осуществления настоящего изобретения.
Фиг. 3 схематично показывает биполярный прямоугольный потенциальный импульсный сигнал, используемый для настоящего изобретения.
Фиг. 4 схематично показывает выходной сигнал тока, измеренного в настоящем изобретении.
Фиг. 5 схематично показывает характеристические точки выходного сигнала тока для регрессии методом частичных наименьших квадратов (PLSR).
Фиг. 6А схематично показывает соответствующую связь между предполагаемой величиной pH, полученной вычислением регрессии методом частичных наименьших квадратов (PLSR), и экспериментальной величиной pH, при том что Ag/Ag2O электрод используют в качестве рабочего электрода, а электрод из нержавеющей стали используют в качестве противоэлектрода.
Фиг. 6В схематично показывает соответствующую связь между предполагаемой величиной pH, полученной вычислением регрессии методом частичных наименьших квадратов (PLSR), и экспериментальной величиной pH, при том что W/WO3 электрод используют в качестве рабочего электрода, а электрод из нержавеющей стали используют в качестве противоэлектрода.
Фиг.7 схематично показывает блок-схему последовательности операций способа измерения величины pH согласно другому аспекту настоящего изобретения.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Далее в данном документе настоящее изобретение будет описано более подробно со ссылкой на прилагаемые чертежи и пример варианта (вариантов) осуществления.
Прежде всего, принцип настоящего изобретения вводится следующим образом:
в электрохимии для измерения pH раствора обычно используют рабочий электрод и противоэлектрод. Например, в случае, когда Ag/Ag2O электрод используют в качестве рабочего электрода, а Pt электрод используют в качестве противоэлектрода и когда биполярный прямоугольный потенциальный импульсный сигнал подают к рабочему электроду и противоэлектроду, будет происходить следующая реакция:
если Ag/Ag2O электрод работает как анод:
(1)
Если Ag/Ag2O электрод работает как катод:
(2)
На основании приведенной выше реакции изменение потенциала Ag/Ag2O электрода можно вычислить согласно следующей формуле:
например, когда Ag/Ag2O-электрод работает как анод, происходит реакция, показанная формулой (1)
(3)
Предположим, что , тогда упомянутое уравнение (3) может приближенно выглядеть:
(4)
Из формулы (4) можно видеть, что величина pH раствора может быть получена в результате изменения потенциала Ag/Ag2O-электрода. В процессе реакции между поверхностью Ag/Ag2O-электрода и раствором, изменение потенциала Ag/Ag2O-электрода будет совмещаться с внешним напряжением, поданным к рабочему электроду и противоэлектроду. Полагая, что внешнее напряжение не изменяется, поскольку реакция окисления происходит на поверхности Ag/Ag2O-электрода, (если Ag/Ag2O-электрод работает как катод, то реакция восстановления будет происходить на поверхности Ag/Ag2O-электрода, как показано в формуле (2)), изменяется напряжение между поверхностью Ag/Ag2O-электрода и раствором. Полагая, что импеданс раствора не изменяется, при изменении напряжения между поверхностью Ag/Ag2O электрода и раствором будет изменяться ток I, который протекает через рабочий электрод и противоэлектрод. Значит, изменение напряжения можно отразить фиксированным (зарегистрированным) током I, который протекает через рабочий электрод и противоэлектрод. Данное изобретение разработано полностью на основе приведенного выше принципа.
После введения принципа настоящего изобретения далее будет описана регрессия методом частичных наименьших квадратов (PLSR), используемая в данном изобретении.
Из приведенного выше принципа настоящего изобретения можно видеть, что изменение потенциала между поверхностью рабочего электрода, например, Ag/Ag2O-электрода и раствором можно отразить фиксированным током I, который протекает через рабочий электрод и противоэлектрод, и, что между изменением потенциала между поверхностью Ag/Ag2O электрода и раствором ϕ=(Ag/Ag2O)-ϕφ(Ag/Ag2O) и величиной pH раствора существует линейная зависимость (как показано в формуле (4)), и, следовательно, существует также линейная зависимость между током I, который протекает через рабочий электрод и противоэлектрод, и величиной pH раствора. Исходя из линейной зависимости двух последних, также можно использовать метод частичных наименьших квадратов (PLSR) для обработки соответствующих данных, причем процедура обработки вводится следующим образом:
Полагая, что X является входным вектором характеристического значения тока I, т.е. {x0 … xn}, что Y является выходным значением, представляющим величину pH, например, водного калибровочного раствора и что существует линейная зависимость между Y и X:
(5)
в которой B является вектором {b0 … bn}, а g является коэффициентом. Определяемый вектор B и коэффициент g в функциональной формуле (5) можно определить заранее, используя, например, водный калибровочный раствор, с тем, чтобы определить линейную зависимость между Y, представляющим величину pH, и входным вектором X, представляющим характеристическое значение тока I. Например, в случае, когда авторы исследовали несколько (насколько возможно много, как правило, больше, чем 6) величин pH водного калибровочного раствора, данные выборки x0 … xn тока I, протекающего через рабочий электрод и противоэлектрод, получены в результате измерения точек выборки при различном времени. Эти данные вводятся в функциональную формулу (5) для получения:
(6).
Минимальное отклонение (минимальную дисперсию) данных можно получить оптимизацией B и g. В настоящем изобретении для оптимизации B и g автор изобретения использует функцию Matlab: pls регрессию (X,Y). Альтернативно специалист в данной области техники может также использовать для оптимизации B и g другие математические программные средства, такие как Maple, Mathematica. Специалисту в данной области знаний не трудно использовать функцию оптимизации, исходя из полученных знаний или соответствующих учебников; значит, здесь это подробно объясняться не будет.
Можно подставить данные выборки x0a … xma тока I, полученные для измеряемого раствора, в формулу (5) для вычисления величины pH раствора, которую надо определить, используя функциональную формулу (5) с оптимизированными B и g. Эта вычисленная величина pH может служить предполагаемой величиной pH измеряемого раствора. После этого аппроксимируется (согласуется) вычисленная величина pH измеряемого раствора с действительной измеренной величиной pH раствора, обнаружив, что существует относительно небольшое отклонение между вычисленной величиной pH и действительной измеренной величиной pH. Следовательно, это дополнительно является доказательством того, что предположение предварительно установленной линейной зависимости (т.е. установление B и g) между Y, представляющим величину pH, и вектором входа X, представляющим характеристическое значение тока I, и вычисленной затем величины pH измеряемого раствора спомощью измеренного тока I, который протекает через электродную пару, является обоснованным, как предполагалось авторами.
Соответствующие эксперименты, проведенные авторами настоящего изобретения, представлены далее в данном документе.
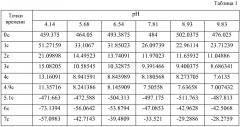
Авторы используют Ag/Ag2O-электрод в качестве рабочего электрода и электрод из нержавеющей стали в качестве противоэлектрода, калибровочным раствором является вода. Биполярный прямоугольный потенциальный импульсный сигнал, как показано на Фиг.3, подается на Ag/Ag2O-электрод и электрод из нержавеющей стали, после чего измеряется ток I, который протекает через Ag/Ag2O-электрод и электрод из нержавеющей стали, в двенадцати временных точках отбора 0с, 1с, 2с, 3с, 4с, 4.9с, 5.1с, 6с, 7с, 8с, 9с, 10с. Шесть групп экспериментальных данных, измеренных авторами, включены В Таблицу 1:
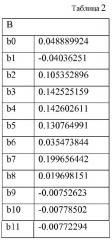
Например, для первой группы экспериментов, в случае, когда величина pH водного калибровочного раствора составляет 4,14, и точки времени отбора составляют 0 с, 1 с, 2 с, 3 с, 4 с, 4,9 с, 5,1 с, 6 с, 7 с, 8 с, 9 с, 10 с, измеренные токи, которые протекают через Ag/Ag2O-электрод и электрод из нержавеющей стали, составляют 459,375, 51,27159, … - 37,4951. Например, для второй группы экспериментов, в случае, когда величина pH водного калибровочного раствора составляет 5,68, и временные точки отбора составляют 0 с, 1 с, 2 с, 3 с, 4 с, 4,9 с, 5,1 с, 6 с, 7 с, 8 с, 9 с, 10 с, измеренные токи, которые протекают через Ag/Ag2O-электрод и электрод из нержавеющей стали составляют 464,05, 33,1067 … -28,6738. Относительно данных с третьей по шестую группу экспериментов, даны ссылки на Таблицу 1. Затем шесть групп данных Таблицы 1 подставляют в функциональную формулу (5), минимальную дисперсию данных можно получить оптимизированием B и g. Следовательно, определяют B и g. Полученные величины для B приведены в Таблице 2.
Полученный коэффициент g=21,123.
После того, как определены величины B и g, определяют также линейную зависимость между X, представляющим характеристические точки измеренного тока I, и Y, представляющим величину pH измеряемого раствора. Что касается раствора, который нужно определить, например, буферного раствора Na2HPO4, то значения X{x0,x1…x11} характеристических точек тока I, который протекает через Ag/Ag2O-электрод и электрод из нержавеющей стали, получают выборкой при временных точках отбора 0 с, 1 с, 2 с, 3 с, 4 с, 4,9 с, 5,1 с, 6 с, 7 с, 8 с, 9 с, 10 с, после чего можно вычислить соответствующие величины pH. Фиг. 4 схематично показывает выходной сигнал тока, измеренный в экспериментах, т.е. кривую изменения тока, который течет через Ag/Ag2O-электрод и электрод из нержавеющей стали, относительно времени. Здесь автор измеряет выходной сигнал тока пяти периодов, каждый период составляет 10с. Фиг.5 схематично показывает характеристические точки выходного сигнала тока для регрессии методом частичных наименьших квадратов (PLSR), где автор изобретения выделяет двенадцать характеристических точек в одном периоде, представленных на фигуре небольшими кружочками. Временные точки отбора, которым соответствуют двенадцать характеристических точек, составляют 0 с, 1 с, 2 с, 3 с, 4 с, 4,9 с, 5,1 с, 6 с, 7 с, 8 с, 9 с, 10 с, соответственно. Для удобства вычисления авторы выделяют кривую выходного тока от 5 с до 15 с, как один период и начинают отсчитывать время от 0 с выделенного периода, как показано во временном сегменте от 0 с до 10 с на Фиг.5.
Фиг. 6А показывает соответствующее соотношение между предполагаемой величиной pH, полученной в результате вычисления регрессии методом частичных наименьших квадратов (PLSR) и величиной pH, измеренной в экспериментах, взяв в качестве измеряемого раствора буферный раствор Na2HPO4. Например, когда вычисленная величина pH (предполагаемая величина pH) составляет 3,9, измеренная в действительности величина pH (измеренная величина pH) составляет 4,1; когда предполагаемая величина pH составляет 6,6, измеренная величина pH составляет 5,7; когда предполагаемая величина pH составляет 6,2, измеренная величина pH составляет 6,5; когда предполагаемая величина pH составляет 8,1, измеренная величина pH составляет 7,8; когда предполагаемая величина pH составляет 8,9, измеренная величина pH составляет 8,8; когда предполагаемая величина pH составляет 9,1, измеренная величина pH составляет 9,7. Существует разница между предполагаемой величиной pH и измеренной величиной pH, поскольку величина pH используемого водного калибровочного раствора и величина pH измеряемого раствора, в точности не совпадают, поскольку существует отклонение между определяемыми B и g в функциональной формуле (5) и действительной ситуацией. Отклонение между предполагаемой величиной pH и измеренной величиной pH может быть вызвано экспериментальными условиями; что может быть установлено специалистом в данной области техники, это то, что в некоторых ситуациях, где не требуется очень точное определение величины pH, устройство измерения величины pH настоящего изобретения является достаточным для замены стеклянного электрода и электрода сравнения, используемых в предшествующем уровне техники.
Фиг. 6В схематично показывает соответствующую зависимость между предполагаемой величиной pH, полученной в результате вычисления регрессии методом частичных наименьших квадратов (PLSR) и величиной pH, измеренной в экспериментах, и величиной pH, измеренной в экспериментах, в случае, когда авторы используют W/WO3 электрод в качестве рабочего электрода, а электрод из нержавеющей стали в качестве противоэлектрода, а другие условия эксперимента являются такими же, как и условия на Фиг. 6A.
Следует отметить, что указанными выше калибровочными растворами, используемыми авторами, являются шесть видов водных калибровочных растворов (насколько возможно много для повышения точности), причем каждый водный калибровочный раствор имеет соответствующую величину pH, например, величина pH первого вида водного калибровочного раствора составляет 4,14, а величина pH второго вида водного калибровочного раствора составляет 5,68…, как показано в Таблице 1. Специалист в данной области техники должен понимать, что можно использовать также и другие калибровочные растворы с определенными величинами pH при применении настоящего изобретения, до тех пор, пока диапазон значений pH из множества выбранных калибровочных растворов охватывает диапазон значений pH измеряемого раствора. Например, если диапазон значений pH измеряемого раствора может быть 5-8, то диапазон значений pH различных выбранных калибровочных растворов может быть 4-9, поскольку диапазон значений pH 4-9 охватывает диапазон значений pH 5-8.
Несмотря на то, что измеряемым раствором, используя варианты осуществления настоящего изобретения, является буферный раствор Na2HPO4, специалисту в данной области техники легко понять, что устройство измерения величины pH настоящего изобретения не ограничивается определением величины pH буферного раствора Na2HPO4. Устройство измерения величины pH настоящего изобретения можно использовать для многих промышленных или местных применений, для которых требуется мониторинг величин pH в реальном времени.
На Фиг. 6A диапазон величины pH шести видов водных калибровочных растворов для проведения экспериментов колеблется в пределах 4-9, определяя тем самым линейную функцию, применяемую для измеряемого раствора, в диапазоне 4-9, причем упомянутая функция коррелирует зависимость между X, представляющим характеристические точки измеренного тока I, и Y, представляющим величину pH измеряемого раствора. Специалисту в данной области техники следует понимать, что относительно других диапазонов величины pH, например, 1-3 или 10-14, следует также повторить приведенные выше эксперименты для определения соответствующих B и g, определяя тем самым линейную функцию, используемую для этого диапазона величины pH.
Поскольку определение B и g в функциональной формуле (5) соотносится с используемой электродной парой и выбранным калибровочным раствором (т.е. выбранным диапазоном величины pH) тогда, в случае если пользователь выбирает различные электродные пары и различные калибровочные растворы (с различными диапазонами величины pH), будут получаться различные функциональные формулы, если B и g определяют с помощью калибровочного раствора с известной величиной pH и измерения тока, протекающего через выбранную электродную пару, что не трудно понять специалисту в данной области техники. Например, если пользователь выбирает Ag/Ag2O-электрод в качестве рабочего электрода, электрод из нержавеющей стали в качестве противоэлектрода и для калибрования шесть видов водных калибровочных растворов с величиной pH в диапазоне 4-9 (каждый вид водного калибровочного раствора имеет определенную величину pH), то получается линейная функция Y1=X1B1+g1 между X, представляющим характеристические точки измеренного тока I, и Y, представляющим величину pH измеряемого раствора, например, вектор B{b0, b1 … b11} и соответствующий, определенный коэффициент g=21,123, показанный в Таблице 2, обозначают в данном документе, как B1, g1. Если пользователь меняет рабочий электрод и выбирает Mn/MnO-электрод в качестве рабочего электрода, электрод из нержавеющей стали в качестве противоэлектрода и шесть видов водных калибровочных растворов с величиной pH в диапазоне 4-9 для калибрования (как показано на Фиг. 6B) то получается линейная функция Y2=X2B2+g2, в которой B2, g2 должны отличаться от B1, g1, следовательно, функциональная формула Y2=X2B2+g2 должна отличаться от функциональной формулы Y1=X1B1+g1. Если пользователь по-прежнему выбирает Ag/Ag2O-электрод в качестве рабочего электрода и электрод из нержавеющей стали в качестве противоэлектрода, в то же время изменяя калибровочный раствор, например, выбирая шесть видов щелочных растворов с величиной pH в диапазоне 8-11 в качестве калибровочных растворов для калибрования (каждый вид из щелочных растворов с определенной величиной pH), то получается линейная функция Y3=X3B3+g3, в которой B3, g3 должны отличаться от B1, g1 и B2 и g2, следовательно, функциональная формула Y3=X3B3+g3 должна отличаться как от функциональной формулы Y1=X1B1+g1, так и от функциональной формулы Y2=X2B2+g2, что не трудно понять специалисту в данной области техники.
Фигуры настоящего изобретения будут описаны в дальнейшем в этом документе.
Фиг. 1 схематично показывает устройство 100 измерения величины pH согласно одному аспекту настоящего изобретения, которое может содержать: первый электрод 101 и второй электрод 102, при том, что первый электрод 101 и второй электрод 102 должны быть помещены в измеряемый раствор 103. Когда первый электрод 101 используют как рабочий электрод, второй электрод 102 используют как противоэлектрод. Специалист в данной области техники должен понимать, что когда первый электрод 101 используют как противоэлектрод, второй электрод 102 используют как рабочий электрод. В вариантах осуществления настоящего изобретения приведены различные ситуации, в которых первый электрод 101 используют как рабочий электрод. Чтобы исключить использование стеклянного электрода, первый электрод 101 настоящего изобретения может содержать электрод из переходного металла/оксида переходного металла, например, электрод из Ag/Ag2O, электрод из W/WO3, электрод из Mn/MnO или электрод из Ir/IrO2 и т. д. Второй электрод 102 настоящего изобретения может включать в себя инертный электрод, например, Cu-электрод, Pt-электрод, Au-электрод или электрод из нержавеющей стали и т. д. Включать в себя инертный электрод, например, Cu-электород, Pt-электород, Au-электрод или электород из нержавеющей стали и т.д. В вариантах осуществления настоящего изобретения, измеряемым раствором может быть вода, буферный раствор Na2HPO4, другие различные растворы, в которых измеряют величину pH.
Устройство 100 измерения величины pH настоящего изобретения может дополнительно включать в себя источник питания 104 для подачи биполярного прямоугольного потенциального импульсного сигнала к первому электроду 101 и второму электроду 102. Фиг.3 схематично показывает биполярный прямоугольный потенциальный импульсный сигнал, используемый в настоящем изобретении; амплитуда биполярного прямоугольного потенциального импульсного сигнала составляет ±1 В, период следования импульсов составляет 10 с. Специалист в данной области техники должен понимать, что настоящее изобретение подходит также для других биполярных прямоугольных потенциальных импульсов с амплитудой ±2 В и периодом следования импульсов 10 с или с амплитудой ±1 В и периодом следования импульсов 20 с и т. д. Таким образом, форма импульса на Фиг. 3 является только схематичной, настоящее изобретение не ограничивается этим.
Устройство 100 измерения величины pH настоящего изобретения может дополнительно включать в себя средства 105 измерения тока, соединенные между первым электродом 101 и вторым электродом 102 для измерения тока I, протекающего через первый электрод 101 и второй электрод 102.
Устройство 100 измерения величины pH настоящего изобретения может дополнительно включать в себя вычислительный блок 106 для настоящего изобретения вычислительный блок 106 может быть вычислительным блоком, включающим в себя блок памяти (блок хранения данных) 207, т. е. запоминающий блок 207 объединяют с вычислительным блоком 106; Фиг. 2A как раз показывает случай, в котором блок памяти 207 объединяют с вычислительным блоком 106a. Альтернативно блок памяти 207 может также быть отдельным блоком, т. е. блок памяти 207 и вычислительный блок 106a являются отдельными блоками (не показано). В блок памяти 207 можно предварительно ввести функцию, связанную с током I и величиной pH, например, pH=BI+g, которая является аналогичной линейной функции между X, представляющим характеристические точки измеряемого тока I, и Y, представляющим величину pH измеряемого раствора, как показано в функциональной формуле (5), вектор B и коэффициент g в ней определяют. Вычислительный блок 106 вычисляет величину pH измеряемого раствора на основании измеренного I и предварительно введенной функции pH=BI+g. Альтернативно в блок памяти 207 можно предварительно вводить множество функций, причем каждая функция коррелирует ток I и величину pH, связанную с типом измеряемого раствора. Например, функции pH=IB1+g1; pH=IB2+g2; pH=IB3+g3; pH=IB4+g4; pH=IB5+g5, связанные с типами измеряемых растворов, т.е. сильнокислый, слабокислый, нейтральный, слабощелочной, сильнощелочной, могут быть предварительно введены в блок памяти 207, при том, что B1, g1, B2, g2, B3, g3, B4, g4, B5, g5, определяют заранее в соответствии с регрессией методом наименьших частичных квадратов, введенной (представленной) выше, поэтому линейные функциональные зависимости между током I и величиной pH в функциях pH=IB1+g1; pH=IB2+g2; pH=IB3+g3; pH=IB4+g4; pH=IB5+g5, также определены.
В варианте осуществления настоящего изобретении устройство 100 измерения величины pH настоящего изобретения может дополнительно включать в себя интерфейс пользователя 208 для приема от пользователя данных, отражающих тип измеряемого раствора, для выбора функции из упомянутого множества функций. Например, если раствором, который необходимо измерить является водопроводная вода, пользователь может ввести или выбрать “нейтральный” на интерфейсе пользователя, например, на программируемой клавиатуре или жидкокристаллической сенсорной панели в качестве типа измеряемого раствора, а функцией, которая соответствует водопроводной воде, как типу измеряемого раствора, является pH=IB3+g3. Если измеряемым раствором является пищевой уксус, пользователь может ввести непосредственно или выбрать “слабокислый” на интерфейсе пользователя, например, на программируемой клавиатуре или жидкокристаллической сенсорной панели в качестве типа измеряемого раствора, который необходимо определить, а функцией, которая соответствует пищевому уксусу, как типу измеряемого раствора, является pH=IB2+g2. Затем вычислительный блок 106b вычисляет величину pH измеряемого раствора на основании измеренного тока I и предварительно введенной в память функции (т.е. функции, выбранной из пяти функций). Приведенная выше ситуация показана на Фиг. 2B.
Специалисту в данной области техники следует знать, что приведенные выше типы измеряемых растворов, т.е. сильнокислый, слабокислый, нейтральный слабощелочной, сильнощелочной, и пять соответствующих функций pH=IB1+g1; pH=IB2+g2; pH=IB3+g3; pH=IB4+g4; pH=IB5+g5, являются только схематичными, т.е. настоящее изобретение не ограничено приведенными выше типами растворов, которые необходимо измерить, и функциями, и специалист в данной области техники может осуществить различные модификации, например, составление трех типов измеряемых растворов, и трех соответствующих функций, для того, чтобы упростить этапы обработки; или составление большего количества типов измеряемых растворов и большего количества соответствующих функций, для того, чтобы более конкретно подразделить типы измеряемых растворов.
Фиг. 7 схематично показывает блок-схему последовательности операций способа 700 измерения величины pH согласно еще одному аспекту изобретения. Способ 700 на Фиг. 7 начинается с S701, а после чего в S702 биполярный прямоугольный потенциальный импульсный сигнал подают к первому электроду 101 и второму электроду 102, которые помещают в измеряемый раствор с тем, чтобы стимулировать возможную реакцию на первом электроде 101. Первый электрод 101 может включать в себя электрод из переходного металла/оксида переходного металла, а второй электрод 102 может включать в себя инертный электрод. Электрод из переходного металла/оксида переходного металла можно выбрать из Ag/Ag2O-электрода, W/WO3-электрода, Mn/MnO-электрода или Ir/IrO2-электрода, а инертный электрод можно выбрать из Cu-электрода, Pt-электрода, Au-электрода или электрода из нержавеющей стали. Затем в S703 измеряют ток, который протекает через первый электрод 101 и второй электрод 102. Наконец вычисляют величину pH измеряемого раствора на основании из измеренного тока I. Альтернативно можно на этапе S703 предварительно ввести в блок памяти 207 функцию, которая коррелирует ток I и величину pH перед измерением тока I, который протекает через первый электрод 101 и второй электрод 102, например, предварительно ввести в память в блок памяти 207 изготовителем или пользователем в соответствии с руководством пользователя. Такую стадию предварительного введения в память можно выполнить или перед этапом S702, или после этапа S702 и перед этапом S703.
Альтернативно можно предварительно ввести в память множество функций, например, в блок памяти 207 изготовителем или пользователем в соответствии с руководством пользователя. Эту стадию предварительного введения в память можно выполнить или перед этапом S702 или после этапа S702 и перед этапом S703. Каждая из множества функций коррелирует ток I и величину pH, связанную с типом измеряемого раствора. Например, функции pH=IB1+g1; pH=IB2+g2; pH=IB3+g3; pH=IB4+g4; pH=IB5+g5, связанные с типами измеряемых растворов, т.е. сильнокислый, слабокислый нейтральный, слабощелочной и сильнощелочной можно предварительно ввести в память в блок памяти 207, при том, что B1, g1, B2, g2, B3, g3, B4, g4, B5, g5, определяют согласно регрессии методом наименьших частичных квадратов, введенной (представленной) выше, поэтому линейные функциональные зависимости между током I и величиной pH в функциях pH=IB1+g1; pH=IB2+g2; pH=IB3+g3; pH=IB4+g4; pH=IB5+g5, также определены.
Еще в одном варианте осуществления способ 700 измерения величины pH дополнительно может включать в себя получение данных, отражающих тип измеряемого раствора от интерфейса пользователя для выбора функции из упомянутого множества функций. Эту стадию можно выполнить после предварительного введения в память множества функций и перед подачей биполярного прямоугольного импульсного сигнала к первому электроду 101 и второму электроду 102. Например, если измеряемым раствором является водопроводная вода, пользователь может ввести непосредственно или выбрать “нейтральный” на интерфейсе пользователя, например, на программируемой клавиатуре или жидкокристаллической сенсорной панели в качестве типа измеряемого раствора, а функцией, которая соответствует водопроводной воде, как типу измеряемого раствора является pH=IB3+g3. Если измеряемым раствором является пищевой уксус, пользователь может ввести непосредственно или выбрать “слабокислый” на интерфейсе пользователя 208, например, на программируемой клавиатуре или жидкокристаллической сенсорной панели в качестве типа измеряемого раствора, а функцией, которая соответствует пищевому уксусу, как типу измеряемого раствора, является pH=IB2+g2. Затем вычислительный блок 106b вычисляет величину pH