Олигонуклеотидные праймеры и флюоресцентный зонд с внутренним гасителем, комплементарные участку гена р30 (cp204l) вируса африканской чумы свиней, для использования в полимеразной цепной реакции в режиме реального времени
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к синтетическим олигонуклеотидным зондам и праймерам для выявления ДНК вируса африканской чумы свиней. Предложенные синтетические олигонуклеотидные праймеры и флуоресцентно меченый зонд с внутренним гасителем комплементарны консервативной области гена Р30 (CP204L) вируса африканской чумы свиней и имеют следующий нуклеотидный состав:
Предложенное изобретение может быть использовано в генодиагностике инфекционных болезней свиней и ветеринарной вирусологии. 4 табл., 2 пр.
Реферат
Изобретение относится к области биотехнологии, а именно к синтетическим олигонуклеотидным зондам и праймерам, комплементарным консервативной области гена P30 (CP204L) вируса африканской чумы свиней, для выявления ДНК вируса африканской чумы свиней. Предложенное изобретение может быть использовано в генодиагностике инфекционных болезней свиней и ветеринарной вирусологии. Способ выявления вируса АЧС основан на постановке полимеразной цепной реакции (ПЦР) в режиме реального времени с использованием олигонуклеотидных праймеров и флюоресцентного зонда с внутренним гасителем, комплементарных участку гена P30 (CP204L) вируса АЧС. Разработанный зонд и олигонуклеотидные праймеры позволяют повысить чувствительность и специфичность ПЦР для выявления ДНК вируса АЧС по сравнению с системой, основанной на выявлении гена р72 (B646L) вируса АЧС. Изобретение относится к ветеринарной вирусологии, а именно к средствам диагностики.
Африканская чума свиней - контагиозная вирусная болезнь, характеризующаяся лихорадкой, цианозом кожных покровов, тяжелыми дистрофическими и некротическими поражениями клеток ретикулоэндотелиальной системы. Восприимчивы домашние и дикие свиньи независимо от породы и возраста. Различают сверхострое, острое, хроническое и бессимптомное течение болезни [1, 2].
Заболеванию подвержены свиньи всех возрастных групп. Естественным резервуаром вируса являются дикие свиньи Африканского континента [3].
Предварительный диагноз устанавливают комплексно на основании эпизоотологического обследования, клинических признаков, патоморфологических изменений. Окончательный диагноз на АЧС устанавливают с учетом лабораторных исследований, включающих в себя полимеразную цепную реакцию [4], реакцию прямой иммунофлюоресценции [5], реакцию гемадсорбции [6] и биопробу на восприимчивых животных [7].
Существуют функциональные аналоги предложенного изобретения, основанные на «классическом» TaqMan зонде и паре праймеров на ген р72 (B646L) для выявления генома вируса АЧС. Однако флюоресцентных зондов с внутренним гасителем и праймеров на ген P30 (CP204L) для выявления вируса АЧС в России не зарегистрировано. Ране сотрудниками ГНУ ВНИИВВиМ Россельхозакадемии был получен патент на тест-систему для выявления ДНК вируса АЧС методом ПЦР с электрофоретической детекцией. Как известно, технология ПЦР в режиме реального времени, для проведения которой и предназначены олигонуклеотидный зонд и праймеры, комплементарные консервативной области гена P30 (CP204L) вируса АЧС, позволяет значительно увеличить чувствительность и специфичность теста. На российском рынке представлены несколько диагностикумов АЧС методом ПЦР в режиме реального времени, в состав которых входят синтетические олигонуклеотидные праймеры и зонды, которые могут служить прототипами данного изобретения. Примерами таких диагностикумов могут служить тест-система «АЧС» для выявления вируса африканской чумы свиней методом полимеразной цепной реакции (ФБУН ЦЦНИИ Эпидемиологии Роспотребнадзора, г. Москва), тест-система для выявления вируса африканской чумы свиней методом полимеразной цепной реакции (АНО «НИИ ДПБ», г. Москва, тест-система для выявления ДНК вируса АЧС методом ПЦР в реальном времени (ГНУ Всероссийский НИИ Ветеринарной Вирусологии и Микробиологии Россельхозакадемии, п. Вольгинский). В данных тест-системах используются классические зонды (краситель и гаситель на 5' и 3' концах), что может приводить к образованию ложноположительных результатов за счет высокого уровня фоновой флюоресценции. Предложенные олигонуклеотидный зонд с внутренним гасителем флюоресценции и олигонуклеотидные праймеры, комплементарные участку гена P30 (CP204L) вируса АЧС, позволяют выявлять геном вируса АЧС с более высокой чувствительностью, чем запатентованные и представленные на рынке тест-системы и наборы.
Целью изобретения является дизайн олигонуклеотидного зонда с внутренним гасителем и двух олигонуклеотидных праймеров, комплементарных консервативной области гена p30 (CP204L) вируса АЧС, для выявления генома вируса АЧС методом ПЦР в режиме реального времени.
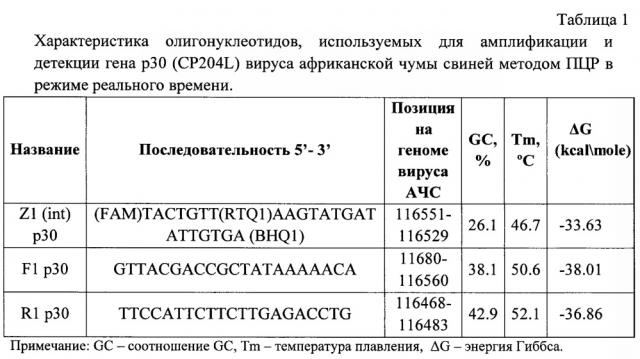
Для достижения поставленной цели были подобраны и синтезированы специфические олигонуклеотидные праймеры и зонд, которые используются в ПЦР для идентификации вируса АЧС (Таблица 1).
Способ обнаружения ДНК вируса АЧС в пробах органов, образцах крови инфицированных свиней методом ПЦР в режиме реального времени с использованием предложенных олигонуклеотидного зонда с внутренним гасителем и двух олигонуклеотидных праймеров, комплементарных к консервативной области гена p30 (CP204L) вируса АЧС, включает предварительный этап денатурации ДНК при 94°C в течение 2 мин. ПЦР включает 35 циклов амплификации: 94°C - 30 с, 56°C - 30 с, 68°C - 30 с. Затем проводят оценку и учет результатов реакции.
Техническим результатом изобретения является общедоступность, безопасность, высокая диагностическая чувствительность (100% по сравнению с применением олигонуклеотидных праймеров и зонда на ген Р72), а также сокращение времени проведения диагностической работы (на 5-10 минут) с целью выявления генома вируса африканской чумы свиней.
Сущность изобретения заключается в том, что выявление генома вируса АЧС проводят методом полимеразной цепной реакции в режиме реального времени, с использованием олигонуклеотидного зонда с внутренним гасителем флюоресценции. Применение зонда с внутренним гасителем позволяет увеличить эффективность накопления флуоресценции в ходе ПЦР в реальном времени.
Существенным отличием заявляемого способа является то, что применение зонда с двумя гасителями позволяет значительно снизить фоновую флуоресценцию и повысить четкость флуоресцентного сигнала при учете результатов ПЦР в режиме реального времени.
Пример 1. Постановка ПЦР в режиме реального времени с использованием олигонуклеотидного зонда с внутренним гасителем и двух олигонуклеотидных праймеров, комплементарных консервативной области гена p30 (CP204L) вируса АЧС.
Состав реакционной смеси для постановки ПЦР в режиме реального времени представлен в таблице 2. В отдельной пробирке готовят общую реакционную смесь на N образцов, в число которых входят положительный контроль (с водным раствором ДНК вируса АЧС) и отрицательный контроль (с бидистиллированной водой). Реактивы вносят в последовательности, приведенной в таблице 2. Фермент добавляют в последнюю очередь. В пробирке объемом 0,2 мл вносят общую реакционную смесь в объеме 20 мкл.
В реакции используют 5 мкл ДНК, полученной при выделении.
ПЦР проводят в амплификаторах ДТ-96 (ДНК-Технология, Россия), Rotor-Gene Q (QIAGEN, Германия) и других приборах с флуоресцентной детекцией по каналу FAM/Green. При следующих режимах (Таблица 3):
Пример 2. Определение специфичности и чувствительности метода выявления генома вируса АЧС с использованием олигонуклеотидного зонда с внутренним гасителем и двух олигонуклеотидных праймеров, комплементарных консервативной области гена p30 (CP204L) вируса АЧС.
Синтетические олигонуклеотидные зонды были проверены на специфичность и чувствительность. Установлено, что в ПЦР с использованием разработанных праймеров и зондов не амплифицируется ДНК других бактерий и вирусов, что показывает диагностическую специфичность и чувствительность 100%.
Диагностическая чувствительность. Была подтверждена на панели 20 (14 положительных и 6 отрицательных) проб патологического материала (легкое, селезенка, лимфоузлы), полученных от павших от АЧС (Таблица 4).
Диагностическая специфичность. В результате исследований было показано, что отсутствуют неспецифические реакции при тестировании образцов геномной ДНК свиньи и следующих микроорганизмов: вирус классической чумы свиней (штаммы Ши-Мынь, ЛК-ВНИИВВиМ, ЛК-К), вирус болезни Ауески (интактный), цирковирус свиней-1 и цирковирус свиней 2.
Выделение нуклеиновых кислот. ДНК выделяют из вируссодержащего материала с использованием коммерческих наборов.
Постановка ПЦР в режиме реального времени. На N количество образцов готовят реакционную смесь согласно таблице 2. Амплификация и детекция флюоресценции производятся согласно температурным режимам, указанным в таблице 3.
Учет результатов амплификации. Результаты интерпретируются на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне (0.05) пороговой линии - значение Ct.
Образец считается положительным на наличие генома вируса АЧС при значении Ct<33. Образцы, не пересекающие пороговую линию, и образцы со значением Ct>33 считаются отрицательными.
Источники информации
1. Бакулов, И.А. Проблемы современной эволюции африканской чумы свиней / И.А. Бакулов, В.В. Макаров // Вестник сельскохозяйственных наук. - 1990. - №12. - С. 122-128.
2. Бакулов, И.А. Эпизоотология: африканская чума свиней / И.А. Бакулов. - Москва: Колос, 1969. - С. 267-290.
3. Козлова, Д.И. Современные проблемы африканской чумы свиней / Д.И. Козлова, В.А. Бесхлебнов. - М.: ВНИИТЭИСХ, 1980. - 60 с.
4. A highly sensitive and specific gel-based multiplex RT-PCR assay for the simultaneous and differential diagnosis of African swine fever and Classical swine fever in clinical samples / M. Aguero, J. Fernandez, L.J. Romero, M.J. Zamora, C. Sanchez, S. Belak, M. Arias, J.M. Sanchez-Vizcaino // Vet Res. - 2004. - Vol. 35. - P. 551-563.
5. Heuschele, W.P. Fluorescent antibody studies on African swine fever virus / W.P. Heuschele, L. Coggins, S.S. Stone // Amer. J. vet. Res. - 1966. - №27. - 477-484.
6. Malmquist, W.A. Hemadsorption and cytopathic effect produced by African swine fever virus in swine bone marrow and buffy coat cultures/ W.A. Malmquist, D. Hay // Am J Vet Res. - 1960. - №21. - P. 104-108.
7. Sanchez - Botija, C. African swine fever / C. Sanchez- Botija, A. Ordas // Seminar in the EEC Programme. Madrid, 1976. - P. 658-668.
Синтетические олигонуклеотидные праймеры и флуоресцентно меченый зонд с внутренним гасителем, комплементарные консервативной области гена Р30 (CP204L) вируса африканской чумы свиней и имеющие следующий нуклеотидный состав:
| F1 р30 | 5'-GTTACGACCGCTATAAAAACA-3' |
| R1 р30 | 5'-TTCCATTCTTCTTGAGACCTG-3' |
| Z1 (int) p30 | 5'-(FAM)TACTGTT(RTQ1)AAGTATGATATTGTGA(BHQ1)-3' |