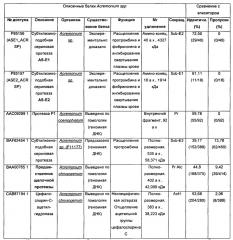
Полипептид, обладающий активностью, индуцирующей защиту против биотического стресса у растений, кодирующая его нуклеотидная последовательность, микроорганизм, композиции и способы
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой полипептид с элиситорной активностью в отношении иммунного ответа на патогены у растений, представляющий собой субтилизин, имеющий происхождение из штамма Acremonium strictum, где такой полипептид имеет аминокислотную последовательность SEQ ID NO: 2. Изобретение относится таже к молекуле нуклеиновыой кислоты, кодирующей такой полипептид, микроорганизму, трансформированному такой нуклеиновой кислотой, а также к композиции, содержащей конидии такого микроорганизма. Изобретение позволяет расширить ассортимент элиситоров в отношении иммунного ответа на патогены, применяемые для растений. 10 н. и 16 з.п. ф-лы, 20 ил., 2 табл., 13 пр.
Реферат
Данное изобретение относится к полипептиду, обладающему активностью, индуцирующей защиту против биотического стресса у растений, кодирующей его нуклеотидной последовательности, микроорганизму, композициям и способам. Более конкретно, данное изобретение относится к полипептиду субтилизину, имеющему происхождение из Acremonium stnctum, где такой полипептид обладает элиситорной активностью. Согласно конкретному воплощению изобретения полипептид кодируется нуклеотидной последовательностью SEQ ID NO: 1 или последовательностями, по меньшей мере на 90% гомологичными ей, и имеет аминокислотную последовательность SEQ ID NO: 2 или последовательности, по меньшей мере на 90% гомологичные ей, где такой полипептид обладает элиситорной активностью.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Земляника представляет собой фрукт, обладающий замечательными характеристиками, который можно употреблять в пищу свежим, высушенным, замороженным или консервированным. С экономической точки зрения земляника представляет собой очень важную культуру, учитывая используемое количество ресурсов и технологий, не говоря уже о дополнительном значении, которое может быть приобретено за счет того, что можно обеспечить ее промышленное производство и экспорт.
Одной из главных проблем производства земляники является большое число заболеваний и вредителей (биотического стресса), которые поражают культурные сорта земляники, что приводит к ограничению продукции и качества плодов. Главной причиной биотического стресса для земляники являются грибковые заболевания.
Существует много заболеваний, наиболее часто встречающимися из которых являются следующие.
Корневая гниль и гниль корневой шейки: несколько заболеваний, вызываемых грибами родов Phytophthora, Rhizoctonia и Colletotrichum (антракноз).
Заболевания листьев: Xanthomonas fragariae (угловатая пятнистость листьев); Gnomonia comari (некорневая пятнистость); Mycosphaerella fragariae или Ramularia (пятнистость листьев); Diplocarpon earliana (ожог или пятнистость листьев); Dendrophoma/Phomopsis obscurans (пятнистость); Sphaerotheca maculans (мучнистая роса); Colletotrichum spp. (антракноз).
Заболевания цветков и плодов: Rhizopus stolonifer (гниль); Botrytis cinerea (серая плесень); Colletotrichum spp. (антракноз).
Антракноз земляники, вызываемый грибковым комплексом Colletotrichum, определенно является заболеванием, которое оказывает наиболее неблагоприятное воздействие на культуру, поражая почти каждый орган растения и приводя к большим потерям как в продукции плодов, так и в теплицах (выгонка рассады), в основном в тропических и субтропических агроклиматических регионах.
В результате широкого разнообразия патогенов (по меньшей мере три различных вида) почти все разновидности земляники чувствительны к антракнозу. С точки зрения генетического улучшения культуры сложно объединить в одном сорте гены, придающие определенные характеристики в отношении продукции, тепличного разведения и устойчивости к заболеваниям, и еще сложнее к заболеванию, вызываемому различными патогенами, такому как антракноз.
Управление культурой вместе с химическими обработками способствуют уменьшению заболеваемости антракнозом. Тем не менее, чрезмерное использование агрохимикатов оказывает сильное воздействие на деградацию экосистемы и на здоровье сельскохозяйственных рабочих, а также на загрязнение воды и на содержание токсичных остатков в пище, не говоря уже о том, что способствует возникновению устойчивых к фунгицидам штаммов грибов и имеет непосредственное влияние на устранение естественных врагов вредителей. Избыток фунгицидных остатков в плоде может вызывать серьезные проблемы при продвижении на рынок или экспорте земляники из-за несоответствия стандартам качества, предъявляемым местными органами управления или рынками импорта.
В настоящее время существует основное всеобщее соглашение относительно содействия, в целом, требующего ответственного отношения или устойчивого сельского хозяйства посредством развития производственных систем, интегрирующих агрономические методы, оказывающие низкое влияние на окружающую среду (интегрированное производство). Среди различных биологических подходов, охватываемых в рамках биотехнологии, включено использование сортов с увеличенной устойчивостью (в результате обычного или основанного на молекулярной биотехнологии генетического улучшения), а также средств биологического контроля (ВСА).
ВСА могут (1) действовать непосредственно на патоген, как в случае "антагонистических микроорганизмов"; (2) оказывать непрямое действие посредством взаимодействия в растении-хозяине, обеспечивая защиту против заболевания, путем: передачи гиповирулентности вирулентным штаммам, таким образом, нейтрализуя такое заболевание или (3) путем активации защитных механизмов растения, известных как "индуцированная устойчивость" или "предварительная иммунизация".
Растения защищают себя от потенциальных инвазирующих патогенов либо через морфологические структуры, действующие как физические барьеры, которые подавляют проникновение и развитие патогена, либо путем биохимических реакций, происходящих в различных тканях растений, продуцируя токсичные для патогена вещества или создавая условия, которые подавляют проникновение и развитие микроорганизма в хозяине. Такая защита может быть либо представлена частью растения, представляющей неспецифическую защиту против широкого диапазона микроорганизмов, либо индуцирована в присутствии поражающего патогена. В последнем случае растения, как и другие живые существа, активируют свои собственные системы защиты, когда они распознают молекулу, имеющую происхождение из патогенного микроорганизма, или когда они обнаруживают любую молекулу, образующуюся во время инвазии патогена, любую из которых называют "индуктором" или "элиситором" защиты.
Во взаимодействиях растение/патоген индуцирующие молекулы оповещают о присутствии инвазирующего патогена, когда патоген распознается растением-хозяином (Nürnberger, 1999. Cell Mol. Life Sci. 55, 167-182). При раннем распознавании элиситоров поражающего патогена растение производит быструю активацию своих механизмов защиты, которые блокируют инфекцию, останавливая продвижение патогена. В этом случае утверждают, что взаимодействие растение/патоген несовместимо, поскольку не приводит в результате к заболеванию, фитопатогенный штамм определяют как невирулентный (Keen, 1990. Annu. Rev. Genet. 24, 447-463). Наоборот, у растения развивается заболевание тогда, когда оно неспособно обнаружить агрессию патогена или когда оно обнаруживает заболевание (его элиситоры) поздно, и, несмотря на запуск некоторых механизмов защиты, они не достаточны для своевременной остановки инвазии, таким образом, утверждают, что взаимодействие растение/патоген является совместимым, и штамм считают вирулентным.
Во время грибковой инфекции растения могут распознавать агрессор при помощи ряда элиситоров. Некоторые из индуцирующих молекул имеют происхождение из патогена (несобственные факторы) и могут присутствовать на грибковой поверхности (например, хитин и глюкановые фрагменты) или секретироваться патогеном (например, белки авирулентности); в то время как другие молекулы (известные как собственные факторы) продуцируются растением во время грибковой инвазии, такие как в случае фрагментов стенки растительной клетки (например, олигогалактуронаты, хитин, гептаглюканы, моносилированные гликопептиды), высвобождающихся из полимерных предшественников под действием гидролитических ферментов инвазирующего патогена (Кподде, 1996. The Plant Cell 8, 1711-1722). Таким образом, элиситоры могут быть классифицированы как предварительно образованные соединения, которые присутствуют на поверхности патогена, или как индуцируемые, так как они синтезируются при взаимодействии между патогеном и растением-хозяином.
Как правило, распознавание патогена и последующая активация резистентных ответов на заболевание у растений могут происходить на уровне видов (например, видовая устойчивость или устойчивость растения-нехозяина, или сортовая неспецифическая устойчивость хозяина, или врожденный иммунитет) или на уровне генотипа (сортовая специфическая устойчивость хозяина). Специфическая устойчивость сорта проявляется у заданного сорта против одного или сниженного числа патогенных штаммов и представляет то, что известно как ответ типа "ген к гену", генетически определяемый комплементарной парой, кодируемой геном авирулентности (Avr) патогена, и продуктом гена устойчивости (R) растения.
Таким образом, когда белок AVR непосредственно или опосредованно распознается устойчивым растением-хозяином, он действует в качестве "специфического элиситора" защиты и может быть обнаружен системой контроля растения. Тем не менее, врожденный иммунитет представляет собой преобладающую форму устойчивости у всех видов растений. В этом ответе значительное разнообразие продуктов, ассоциированных с так называемыми "общими элиситорными" микроорганизмами, вызывает защитный ответ у множества видов растений и не зависит от конкретного сорта. Термин "патоген-ассоциированный молекулярный паттерн" (РАМР) относится к любой молекуле, способной активировать систему защиты растения, и он может быть обнаружен у широкого диапазона патогенов (Bent and Mackey, 2007. Annu. Rev. Phytopathol. 45, 399-436). Kamoun (Kamoun, 2006. Annu. Rev. Phytopathol. 44, 41-60) сообщают об элиситорах, продуцируемых патогенными для растений грибами оомицетами, тогда как Stergiopoulos et al. (Stergiopoulos and de Wit, 2009. Annu. Rev. Phytopathol. 47, 233-263) описывают известные на данный момент времени белки грибковой авирулентности.
После распознавания элиситора идентифицирован ряд цитологических сдвигов и биохимических ответов в растительных клетках. С биохимической точки зрения можно сказать, что индуктор взаимодействует с одним рецептором на клеточной поверхности, который обнаруживает внеклеточный сигнал и преобразует его во внутриклеточные сигналы, трансдукция которых предполагает (а) ионные трансмембранные жидкости (т.е. вход Ca2+, H+ и Cl-); (б) продукцию активных форм кислорода, таких как H2O2, O2- и т.д., токсичных для клеток, производя "окислительный взрыв"; (в) продукцию окиси азота (NO); г) фосфорилирование/дефосфорилирование митоген-активируемых протеинкиназ (MAPK) и других кальций-зависимых протеинкиназ (CDPK).
Эти сигналы дают начало ранним защитным ответам в области инфицирования и поздним защитным ответам в удаленных участках растения.
Локальные защитные ответы на элиситоры подразумевают регуляцию нескольких генов, которые вносят вклад в формирование защитных физиологических условий против инвазирующих патогенов. В области инфицирования такие ответы включают генерирование активных форм кислорода (ROS), быструю аккумуляцию нескольких ферментов и метаболитов, таких как, например,, белки, вовлеченные в продукцию сигналов, таких как салициловая кислота (SA), жасмонаты и/или этилен, и ферменты, связанные с метаболизмом фенилпропаноиднов (PAL: фениламмоний-лиаза, CHS: халконсинтаза и т.д.) и биосинтезом фитоалексинов, низкомолекулярные вторичные метаболиты, обладающие антимикробной активностью, и так называемые PR-белки (белки, связанные с патогенезом). Такая защита ограничена участком, окружающим область проникновения патогена.
В некоторых случаях клетки в области инфицирования могут претерпевать процесс клеточной гибели, который обычно становится видимым как гиперчувствительный ответ. Гиперчувствительный ответ (HR) заключается в быстрой и локализованной гибели клеток хозяев, инвазированных патогеном, посредством явления некроза или запрограммированной клеточной гибели (PCD). Это явление ассоциировано с утолщением в клеточной стенке пораженных клеток путем локальных лигнификаций и аккумуляции каллозы, перекрестного связывания богатых гидроксипролином гликопротеинов (HRGP), активации ферментов, вовлеченных в перекрестное связывание молекул в качестве стратегии растения ограничить колонизацию областями инфицирования.
Салициловая кислота (SA) представляет собой растительный гормон, который наряду с другими функциями ингибирует каталазу, усугубляющую окислительный стресс, а также координирует экспрессию подгруппы PR-белков, которых разделяют на три класса: хитиназы, глюканазы и хитин-связывающие белки. В заключение, для того, чтобы убить или успешно остановить инвазирующий микроорганизм, требуется специальная и точно выверенная по времени координация индуцированных защитных ответов.
Локальная инфекция часто приводит к индукции похожих защитных ответов в неинфицированных растительных тканях, таким образом приводя к устойчивости к последующим инфекциям (Kuć, 1982. BioScience 32, 854-860). Данная линия защиты приводит к аккумуляции белков и гидролитических ферментов по всему организму, таким образом, она названа "системной" (Hunt and Ryals, 1996. Crit. Rev. Plant Sci. 15, 583-606). Она обычно обеспечивает устойчивость к первичному индуцирующему агенту (вирулентный патовар), а также к широкому диапазону других грибковых, бактериальных и вирусных патогенов (иммунизация). Когда данный защитный ответ опосредован действием авирулентного патогена, тогда его называют "системной приобретенной устойчивостью" (SAR). Кроме того, системная устойчивость также может быть запущена ризосферным непатогенным микроорганизмом, и в этом случае ее называют "индуцированной системной устойчивостью" (ISR); или она может быть индуцирована повреждениями (механическим повреждением).
Различные системные защитные ответы, ассоциированные с инфицированиями патогеном, включают индукцию нескольких генов PR, аккумуляцию фитоалексинов, индукцию ROS и микро-HR.
Вышеописанное предполагает, что индукция системного защитного ответа широкого спектра (или SAR, или ISR) может быть использована в качестве стратегии "иммунизации" для того, чтобы предупредить или снизить заболевания урожая (индуцированная устойчивость или IR). Для земляники применение IR предложено для того, чтобы контролировать Phytophthora spp.(Eikemo et al., 2003. Plant Dis. 87, 345-350) и Botrytis (Adikaram et al., 2002. Australasian Plant Pathology 31(3), 223-229). Данное явление защиты растения-хозяина, которое первоначально было названо как "перекрестная защита", было использовано в качестве средства управления вызванными вирусом заболеваниями путем предварительной инокуляции ослабленными штаммами того же самого вируса, приводя, таким образом, к тому, что вирус, инокулированный первым, предупреждал развитие более позднего вируса. Затем стало ясно, что также возможно увеличить устойчивость к труднопреодолимым штаммам грибкового патогена путем предварительной инокуляции авирулентным генотипом тех же самых видов грибов или путем нанесения ризосферного непатогенного микроорганизма; как изложено выше, указанное последним явление было названо ISR в противоположность SAR.
В отличие от ответа, индуцированного ризосферным непатогенным микроорганизмом, реализация SAR-подобной системы в полевых условиях, которая подразумевает непосредственное инфицирование растения живым патогенным микроорганизмом, невозможна, поскольку она вызывает серьезные проблемы, среди которых стоит упомянуть, что возможно, что авирулентный штамм, используемый для защиты сорта, может вызвать заболевание в других восприимчивых генотипах (Fulton, 1986. Annu. Rev. Phytopathol. 24, 67-81). Биотехнологический вариант решения этой проблемы и индукции устойчивости включает инактивацию патогена и нанесение фрагментов различных патогенных культур (непатогенных экстрактов), которые сохраняют активность индукции защиты и в то же самое время утрачивают патогенный потенциал, то есть использование фракций инактивированного патогена, содержащих агент(ы), индуцирующий(ие) защиту. Более глубокие знания об указанной системе дадут возможность непосредственного нанесения элиситорных молекул, происходящих из взаимодействия растение/авирулентный патоген, способных обеспечить устойчивость против заболеваний путем индукции системного защитного ответа широкого спектра (SAR-элиситор), для экспрессии такого гена авирулентности патогена в трансгенных растениях.
В настоящее время известно очень немного элиситоров, которые могут эффективно индуцировать устойчивость. Для земляники зарегистрированные биопестициды с элиситорным действием включают белки гарпин (товарный знак: MESSENGER®), альтернатива использованию метилбромида, который является эффективным против бактериальной пятнистости листьев, бактериальной тристецы, бактериальной пятнистости, некоторых грибковых заболеваний; и хитозан (товарный знак: ELEXA-4®), который является активным против галовых тлей и пылевидной милдью и серой плесени. Тем не менее, до сих пор не был предложен какой-либо тип метода биологического управления для контроля антракноза (Colletotrichum spp.) у земляники.
В свете изложенного выше, испытывая недостаток решений относительно обеспечения новых способов лечения и/или предупреждения заболевания, авторы изобретения идентифицировали в данной заявке новый белок, выделяемый в среду Acremonium strictum, и очистили его до гомогенного состояния. Данный белок действует в качестве фактора авирулентности (элиситор), запуская различные защитные механизмы, иммунизирующие растение, таким образом делая его устойчивым к заболеваниям, таким как антракноз, вызываемый Colletotrichum spp.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Предложен полипептид субтилизин, обладающий элиситорной (индуцирующей) активностью защиты против биотического стресса у растений, имеющий происхождение из Acremonium strictum, например, Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396, и обладающий элиситорной активностью. Полипептид кодируется нуклеотидной последовательностью SEQ ID NO: 1 или последовательностями, по меньшей мере на 90% гомологичными ей, и имеет аминокислотную последовательность SEQ ID NO: 2 или последовательности, по меньшей мере на 90% гомологичные ей, где такой полипептид обладает элиситорной активностью.
Предложена нуклеотидная последовательность, кодирующая элиситорный полипептид, представленный в последовательности SEQ ID NO: 1 или последовательностях, по меньшей мере на 90% гомологичных ей.
Предложен микроорганизм, продуцирующий элиситорный полипептид, представляющий собой штамм Acremonium strictum SS71, депонированный в немецком центре депонирования DSMZ под номером доступа DSM 24396.
Предложена композиция, полезная для индукции устойчивости к биотическим факторам у растений, содержащая конидии Acremonium strictum и эксципиенты, например, содержащая от 1×103 до 1×108 конидий/мл. Предпочтительно, композиция содержит конидии штамма Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396.
Предложена композиция, полезная для индукции устойчивости к биотическим факторам у растений, содержащая Acremonium strictum. Предпочтительно, композиция содержит экстракт штамма Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396. Экстракт может представлять собой бесклеточный супернатант или конидиальный экстракт.
Предложена композиция, содержащая от 2,5 до 15 мкг/мл элиситорного полипептида.
Предложен способ получения и очистки элиситорного полипептида, включающий следующие стадии:
(а) культивирование Acremonium strictum, предпочтительно Acremonium strictum SS71 под номером доступа DSM 24396;
(б) извлечение супернатанта;
(в) концентрирование супернатанта и
(г) ультрафильтрацию продукта, полученного на предшествующей стадии.
Предложен способ индукции устойчивости к патогенам у растений, включающий нанесение на такое растение композиции, имеющей происхождение из Acremonium strictum, например, штамма Acremonium strictum SS71 под номером доступа DSM 24396. Композиция может представлять собой: конидиальную суспензию штамма, бесклеточный экстракт, конидиальный экстракт, культуральный супернатант, раствор элиситорного полипептида или их комбинацию. Конидиальная суспензия может быть нанесена в концентрации от 1×103 до 1×108 конидий/мл, бесклеточный экстракт может быть представлен в концентрации от 0,4 до 9 мкг белка/мл, конидиальный экстракт может быть представлен в концентрации от 0,12 до 1,5 мкг белка/мл, и раствор элиситорного полипептида может быть представлен в концентрации от 2,5 до 15 мкг/мл. Поскольку элиситор генерирует неспецифический системный ответ, то способ по изобретению обеспечивает защиту против широкого диапазона патогенов, эффективную для противогрибковой, противобактериальной и противовирусной защиты. Способ может быть применен, среди прочего, в отношении следующих патогенов: Colletotrichum spp., Botrytis cinera или Xanthomonas fragariae. Кроме того, механизмы защиты, запускаемые элиситором, широко распространены в царстве растений, причем способ эффективен для любого типа растения, в частности eudicotyledons, такого как земляника (Fragaria × ananassa), томат (Solarium lycopersicon) или Arabidopsis thaliana, путем опрыскивания надземных частей, пропитывания или орошения.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1: Фиг.1 иллюстрирует степень тяжести заболевания (DSR) антракноза у растений земляники сорта Pájaro, обработанного экстрактами, содержащими элиситор, за 48 часов до инокуляции вирулентным изолятом С.acutatum M11. Растения оценивали через 40 DAI (суток после инокуляции) М11. СЕ: конидиальный экстракт (10 мкг белка/мл), полученный путем обработки ультразвуком; SN: жидкий культуральный супернатант, выращенный в PG (картофельно-глюкозной) среде до стационарной фазы (10 мкг белка/мл). Ctr-PC: инфицированный М11 растительный контроль, предварительно инокулированный авирулентным штаммом (SS71) A. strictum. Ctr.-Ca: инфицированный М11 растительный контроль без предварительной обработки. DSR означает оценку тяжести заболевания.
Фиг.2: на Фиг.2А показана температурная чувствительность элиситорной активности. Анализы осуществляли с концентрированными и диализированными культуральными супернатантами изолята A. strictum SS71, выращенного в PG среде до стационарной фазы. (A) SN: экстракт без обработки. SN1: экстракт, нагретый до кипения в кипящей водяной бане в течение 15 мин; SN2: экстракт, нагретый до 120°С путем автоклавирования (избыточное давление 1 атм (101325 Па)) в течение 15 мин. На Фиг.2В показана чувствительность элиситорной активности к расщеплению протеиназой K. SN: экстракт без обработки; SNA: экстракт, обработанный протеиназой К (100 мкг/мл) в течение 1 часа при 50°С; и SNB: экстракт, обработанный в течение 12 часов при 50°С. Контроли: Ctr.-PC: инфицированные М11 растения, предварительно инокулированные авирулентным штаммом (SS71) A.strictum. Ctr.-Ca: инфицированные М11 растения без предварительной обработки. Анализы проводили через 40 DAI. DSR означает оценку тяжести заболевания.
Фиг.3: на Фиг.3 показана первая стадия очистки грибкового элиситора по изобретению в профиле, полученном из хроматографического разделения FPLC с использованием анионообменной Q-матрицы, уравновешенной при 7,5 (Pharmacia). Элюирование осуществляли с использованием ступенчатого возрастающего градиента NaCl (0-100%). Активность сконцентрирована в пике
Фиг.4: на Фиг.4 показана вторая стадия очистки грибкового элиситора по изобретению в профиле, полученном из хроматографического разделения FPLC с использованием матрицы гидрофобного взаимодействия Phenyl Superose HP (Pharmacia), уравновешенной Tris-HCl (50 мМ, pH 7,5), EDTA (этилендиаминтетрауксусная кислота) (1 мМ) и (NH4)2SO4 (1,5 М), и с элюцией с использованием ступенчатого уменьшающегося градиента (NH4)2SO4 (100-0%). Активность сконцентрирована в пуле IV.
Фиг.5: на Фиг.5 показаны белки, представленные во фракциях с I по IV (общая загрузка 20 мкг), полученных при помощи FPLC в Phenyl Superose HP (Фиг.4), разделенных при помощи 12% SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия). Активность сконцентрирована в пуле IV. Стрелка указывает на активный элиситорный белок, очищенный впоследствии до гомогенности (Фиг.6).
Фиг.6: на Фиг.6 показан SDS-PAGE при 10% активной субфракции (7 мкг общего белка), полученной посредством повторной хроматографии пула IV при помощи Phenyl Superose HP с элюцией в тем же самых условиях, как упомянутые на Фиг.4, с использованием ступенчатого обратного градиента (NH4)2SO4 (100-0%). Активный белок элюируют с колонки Phenyl Superose HP при концентрации (NH4)2SO4 0,5 М.
Фиг.7: на Фиг.7 показано изображение растений, обработанных и необработанных элиситором по изобретению (2,5 мкг белка/мл) и после инфицирования вирулентным изолятом (М11) С.acutatum через 40 суток после инокуляции. В верхнем ряду изображены растения, предварительно обработанные элиситором, а в нижнем ряду изображены растения, обработанные водой (контроль вирулентности), соответственно, за 48 ч до инокуляции патогеном М11.
Фиг.8: на Фиг.8 показаны картины аккумуляции активных форм кислорода (ROS) через 4 ч после обработки путем опрыскивания элиситором (10 мкг белка/мл) листьев земляники сорта Pájaro. (А) Аккумуляция H2O2, обнаруживаемая при помощи DAB (способ с использованием диаминобензойной кислоты), (В) аккумуляция O2- (супероксидный анион), обнаруживаемая при помощи NBT (способ с использованием нитросинего тетразолия) и (С) в качестве контроля лист, обработанный водой. Масштабная линейка указывает 100 мкм.
Фиг.9: на Фиг.9 показаны изображения аккумуляции аутофлуоресцирующих частиц после обработки путем пропитывания элиситором (50 мкл, 10 мкг белка/мл) листьев земляники сорта Pájaro. (А) Лист, обработанный в нулевой момент времени или обработанный водой, (В) флуоресценция через 12 часов после обработки и (С) флуоресценция через 72 часа после обработки. Изображения получали во флуоресцентном микроскопе (320 нм, Leitz). Масштабная линейка указывает 300 мкм.
Фиг.10: на Фиг.10 показаны изображения аккумуляции каллозы в листьях земляники сорта Pájaro через 7 суток после обработки путем опрыскивания элиситором (10 мкг белка/мл; А) или водой (контроль; В); или 2 суток после инокуляции вирулентным изолятом С.acutatum M11 растений, обработанных за 7 суток до этого элиситором (10 мкг белка/мл; С); и в качестве контроля растения, лишь инфицированные М11 (D). Масштабная линейка указывает 100 мкм.
Фиг.11: на Фиг.11 показана диаграмма, отображающая аккумуляцию салициловой кислоты в листьях земляники сорта Pájaro после обработки путем опрыскивания водой □, ВТН (S-метилбензо[1,2,3]тиадиазол-7-карботиокислота), являющейся аналогом SA (0,5 мМ) , и элиситором (15 мкг белка/мл) ■.
Фиг.12: на Фиг.12 показана схема эксперимента, внешний вид растений земляники сорта Pájaro после различных обработок и значения DSR через 40 DAI. Один из листьев растений обрабатывали элиситором (стрелка) за 7 суток до инфицирования оставшейся наземной части путем опрыскивания вирулентным изолятом С.acutatum M11 (1,5×106 конидий/мл). (А) растения, предварительно обработанные элиситором (5 мкг белка/мл), (В) растения, предварительно обработанные ВТН (0,5 мМ), (С) растения, предварительно обработанные SA (0,5 мМ) и (D) водой. DSR означает оценку тяжести заболевания.
Фиг.13: на Фиг.13 показана диаграмма, отображающая симптоматику заболевания в нескольких сортах земляники, предварительно обработанных элиситором (10 мкг белка/мл), имеющим происхождение из A.strictum SS71. DSR означает оценку тяжести заболевания.
Фиг.14: на Фиг.14 показана диаграмма, отображающая измерения продукции NO (окись азота) и ROS (H2O2) в культуре клеток томата (Solarium lycopersicon) при помощи флуоресцентных зондов. Флуоресцентный зонд DAF-FMDA использовали для обнаружения NO, а зонд H2DCF-DA использовали для обнаружения ROS, в обоих случаях λвозбужд. составляла 480 нм; λизлуч. составляла 525 нм. Время инкубации составляло 30 минут при комнатной температуре. Элиситор использовали в концентрации 10 мкг/мл для NO и 5 мкг/мл для ROS; ксиланазу (индукторный контроль) в концентрации 100 мкг/мл для NO и 10 мкг/мл для ROS.
Фиг.15: на Фиг.15 показаны изображения максимальной продукции внутриклеточной перекиси водорода с флуоресцентным зондом дихлорфлуоресцеиндиацетатом (DCFH-DA) в листьях Arabidopsis thaliana, обнаруживаемой при помощи флуоресцентной микроскопии (УФ (ультрафиолетовый) свет). Панель (А) соответствует ткани листа контрольных растений, обработанных путем опрыскивания водой через 2 hpt (часа после обработки), тогда как панель (В) соответствует обработке элиситором в тот же момент времени (2 hpt). Единицы масштаба указывают на 100 мкм.
Фиг.16: на Фиг.16 показаны изображения, отображающие изменение со временем образования супероксидного радикала, обнаруживаемого путем окрашивания NBT листьев Arabidopsis thaliana, обработанных элиситором через 2 hpt (A), 4 hpt (В) и 6 hpt (С), и их соответствующие контроли (обработанные водой) в каждый момент времени (D-F).
Фиг.17: на Фиг.17 показаны аминокислотные последовательности (метод Эдмана) трех проанализированных фрагментов (триптическое расщепление) защитного элиситорного полипептида массой 34 кДа по настоящему изобретению, выделенного из A.strictum.
Фиг.18: на Фиг.18 показана нуклеотидная последовательность, кодирующая полипептид с элиситорной активностью по настоящему изобретению; А: полноразмерная нуклеотидная последовательность зрелого транскрипта или комплементарной ДНК (кДНК) (SEQ ID NO: 1); В: нуклеотидные последовательности, представляющие максимально близкие значения, и их видовые источники, полученные при помощи Blast X.
Фиг.19: (А): показана последовательность элиситорного белка, имеющего происхождение из нуклеотидной последовательности кДНК (SEQ ID NO: 2); (В): аминокислотные последовательности, представляющие максимально близкие значения, и видовые источники, полученные при помощи Blast Р; (С): структура субтилизина, полученного из Trichoderma koningii, показывающая ингибиторный домен 19 и каталитический домен S8. Показано, что полученные последовательности, представляющие собой фрагменты изобретения (элиситорный белок защиты растений массой 34 кДа), находятся в пределах каталитического домена белка (пептидаза S8). Также показана длина аминокислотной последовательности каждого домена.
Фиг.20: на Фиг.20 показаны сдвиги поглощения при λ, равной 405 нм, с течением времени. Кривые показывают протеолитическую активность элиситорного белка при 15 мкг/мл (▲) и субтилизина из Bacillus subtilis (0,04 мкг/мл), использованного в качестве положительного контроля (■). Кривая (♦) свидетельствует о аутопротеолитической активности хромогенного субстрата. Увеличение поглощения является следствием ферментативной реакции протеолиза хромогенного субстрата N-Suc-Ala-Ala-Pro-Phe-p-NA путем высвобождения p-NA (п-нитроанилид) (λ равна 405 нм).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
Для целей настоящей заявки на изобретение термины "элиситор или элиситоры" относятся к любому соединению, способному индуцировать любой тип защитного ответа у растения. Элиситоры могут представлять собой молекулы самой различной природы: белки, углеводы, липиды, небольшие пептиды, небольшие соединения гетерогенного происхождения, такие как вторичные метаболиты, сахар и/или аминокислотные производные, жирные кислоты и их комбинации.
Элиситорная способность имеет то же самое значение, что и активность, индуцирующая защиту против стресса у растений, например,, биотического стресса.
С другой стороны, используемый в данной заявке термин "индуцированная устойчивость" (IR) относится к явлению, при котором растение, подвергнутое соответствующей стимуляции своей защиты путем предварительного воздействия элиситором, приобретает повышенный уровень устойчивости против патогенов.
Антракноз представляет собой грибковое заболевание, которое вызывает голонекроз в вегетативной части растения. Инфекционная форма видов Colletotrichum spp., вызывающая антракноз, представляет собой конидии, которые при прорастании проникают через устьица, трихомы или непосредственно через эпидермис листьев растений, и поражают проводящую ткань (ксилему), вызывая опоясывание черешка. Симптомы начинают проявляться в верхней части черешка и продолжаются с поражением корневой шейки (видоизмененный стебель), приводя к смерти растения. Оценку тяжести симптомов антракноза осуществляют на черешке в соответствии со шкалой, установленной Delp и Milholand (Delp and Milholand, 1980. Plant Dis. 64, 1071-1073), которая устанавливает оценку тяжести заболевания (DSR). Данная шкала DSR варьирует от 1 до 5, увеличиваясь в соответствии с тяжестью симптомов заболевания, определенных в черешках. Различные степени тяжести классифицируют следующим образом:
- степень инфицирования №1: без поражений;
- степень инфицирования №2: поражения длиной менее чем 3 мм и неглубокие темные пятна вдоль черешка (небольшие черные точки);
- степень инфицирования №3: поражения длиной 3-10 мм, темные пятна, обычно окруженные красным цветом;
- степень инфицирования №4: тяжелые поражения и опоясывание черешка, которые могут затрагивать до 50% его длины;
- степень инфицирования №5: очень тяжелое поражение с опоясыванием черешка, которое может затрагивать более чем 50% его длины и/или приводить к гибели растение.
Протокол, использованный для оценки развития антракноза в настоящей заявке, был следующим:
1) поражения оценивают в черешках трех полностью раскрывшихся самых молодых листьев;
2) в том случае, когда имеется несколько степеней симптомов в одном и том же растении, тогда используют максимальную степень в момент наблюдения;
3) симптомы заболевания оценивают через 9, 21, 30, 40 суток после инокуляции (dpi: суток после инокуляции) вирулентным патогеном в соответствии с улучшенной процедурой Salazar et al., 2001 (REDBIO Brasil) и 2002 (REDBIO Argentina).
Для практических целей и упрощения при представлении результатов в настоящей заявке приведены только степени симптомов через 40 суток после инокуляции (40 dpi) для каждого фитопатологического анализа.
Развитие заболевания и полное восстановление партии растений рассматривали в качестве стандартов оценки. Восстановление растения определяют в соответствии с DSR в конце оценки, т.е. 40 суток (DSR40), где:
- DSR40 равна 1, полное восстановление или отсутствие заболевания;
- DSR40 равна 2, частичное восстановление;
- DSR40 равна 3-5, сохранение заболевания.
Восстановление растения представляет собой меру эффективности индуктора защиты в отношении продукта, используемого при обработке растения.
В данной заявке предложен элиситор, дающий возможность предупреждения и/или лечения заболеваний растения, таких как антракноз. Более конкретно, в настоящем изобретении предложен полипептид, кодируемый нуклеотидной последовательностью SEQ ID NO: 1 или последовательностями, по меньшей мере на 90% гомологичными ей. В предпочтительном воплощении, такой полипептид содержит аминокислотную последовательность SEQ ID NO: 2 или последовательности, по меньшей мере на 90% гомологичные ей, где такой полипептид обладает элиситорной активностью. В еще одном более предпочтительном воплощении полипептид по настоящему изобретению имеет происхождение из штамма Acremonium strictum, предпочтительно такой штамм представляет собой штамм Acremonium strictum SS71, депонированный в соответствии с Будапештским договором 14 декабря 2010 года в немецком центре депонирования DSMZ под номером доступа DSM 24396.
Полипептид по настоящему изобретению был получен после оценки нескольких локальных изолятов различных штаммов грибковых патогенов земляники из северо-западной области Аргентины, многие из которых соответствуют различным видам Colletotrichum, включающим комплекс грибов, ответственных за антракноз в культуре земляники: С.fragariae, С.acutatum, С.gloeosporioides. В результате данной оценки выделенный и очищенный штамм SS71, идентифицированный как Acremonium strictum, представляющий собой объект изобретения, оказался вирулентным для некоторых сортов земляники (т.е. сорта Chandler), в то же время он является полностью авирулентным для других сортов земляники, таких как земляника сорта Pájaro. Штамм Acremonium strictum SS71 экспрессирует полипептид, имеющий аминокислотную последовательность SEQ ID NO: 2 или последовательности, по меньшей мере на 90% гомологичные ей, где такой полипептид обладает элиситорной активностью.
В результате анализа, проведенного на различных изолятах, можно видеть, что взаимодействие растение/патоген является высокоспецифичным, т.е. оно зависит от генотипа растения и патогена (патовара или штамма). Различные патовары могут оказывать влияние на определенный генотип земляники с различными степенями тяжести, и наоборот, различные сорта земляники и их разновидности отвечают различными способами, когда их подвергают контрольному заражению одним и тем же патогенным изолятом.
Была установл