Мультимер непептидильный полимер-инсулин и способ его получения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к комплексу гексамера конъюгата непептидильного полимера и инсулина с ионами трехвалентного кобальта, и может быть использовано в медицине. Изобретение позволяет получить стабильную гексамерную форму инсулина, связанного с непептидильным полимером, обладающую увеличенным временем жизни и сохраняющую функцию регулирования уровня глюкозы в крови. Полученный комплекс может быть использован в составе фармацевтической композиции при лечении диабета. 5 н. и 10 з.п. ф–лы, 4 ил., 2 табл., 7 пр.
Реферат
Область техники
Изобретение относится к мультимеру непептидильный полимер-инсулин, содержащему два или более конъюгата непептидильный полимер-инсулин, полученных путем связывания непептидильного полимера и инсулина посредством ковалентной связи, в котором конъюгаты образуют комплекс с ионом кобальта с образованием мультимера, способу и набору для получения мультимера, фармацевтической композиции для предупреждения или лечения диабета, содержащей мультимер в качестве активного ингредиента, и способу предупреждения или лечения диабета посредством введения этой композиции субъекту.
Предшествующий уровень техники
Инсулин состоит из 51 аминокислоты и имеет молекулярную массу 5808 дальтон (Да). Инсулин образуется в бета-клетках островков Лангерганса в поджелудочной железе и хранится в виде гексамера (структура из шести молекул инсулина) до абсорбции в кровеносный сосуд в биологически активной мономерной форме. Образование гексамера обеспечивается посредством координации ионов цинка и гидрофобным взаимодействием между тремя димерами. Внутри гексамера существуют два участка связывания ионов металла, и в каждом участке содержатся три гистидиновых остатка от трех димеров. Участки связывания существуют на обоих концах гексамера или в нижней части туннельной структуры, идущей через центр от поверхности, в соответствии с конформацией гексамера инсулина (T- или R-конформация).
В настоящее время большинство коммерческих препаратов рекомбинантного инсулина и аналогов инсулина существуют в виде гексамерных препаратов. То есть их готовят в виде препарата посредством включения 3 мг/мл или более инсулина в буферный раствор, содержащий гексамер-стабилизирующие соединения, цинк и фенол (или крезол). По сравнению с мономерными формами гексамерные препараты обеспечивают высокую устойчивость к фибриллированию и дезаминированию, тем самым повышая стабильность инсулина и продлевая срок годности. Более того, после подкожной инъекции гексамерные препараты демонстрируют более низкую абсорбцию из места инъекции в кровь чем мономерная форма, и, таким образом, они выгодно отличаются продолжительным сроком действия. Согласно предыдущим исследованиям низкая скорость абсорбции объясняется обратной зависимостью между размером молекулы и капиллярной проницаемости в депо. Эти свойства гексамеров были применены в недавно разработанных аналогах инсулина длительного действия для создания замедленной или продолжительной абсорбции инсулина после подкожной инъекции. Типичным примером является инсулин детемир, полученный посредством присоединения цепи жирной кислоты к лизину в положении 29 B-цепи природного инсулина (Havelund et al., 2004). Согласно этому исследованию, поскольку введенный инсулин детемир образует в организме дигексамер, он образует большой молекулярный комплекс посредством гидрофобного взаимодействия с альбумином. Таким образом, период полуабсорбции при подкожном введении, который представляет собой время, затрачиваемое половиной дозы препарата, вводимого подкожно, для прохождения через капиллярную стенку, был в 4 раза дольше чем у природного инсулина-гексамера.
Однако гексамерные препараты имеют недостаток в том, что они не могут быть применены для инсулиновых аналогов, которые имеют модификацию по первой аминокислоте фенилаланину B-цепи природного инсулина, поскольку фенилаланиновый остаток оказывает влияние на стабильность структуры гексамера. Согласно предыдущему исследованию при использовании пегилированного инсулина (Hinds, et al., 2000), когда инсулиновые аналоги, полученные посредством присоединения ПЭГ (полиэтиленгликоля) с молекулярной массой 750 Да или 2000 Да к аминоконцу B-цепи природного инсулина, анализировали посредством кругового дихроизма в УФ диапазоне и седиментационного равновесия, большинство из них существовало в виде мономера в пределах концентрации 0,1-1,0 мМ. С другой стороны, природный инсулин главным образом существует в виде гексамера в соответствующих пределах концентрации. Таким образом, трудно обеспечить преимущество продолжительной абсорбции инсулина после подкожной инъекции при использовании пегилированного инсулина-гексамера. Другими примерами инсулиновых аналогов являются альбумин-инсулиновый конъюгат, гликозилированный инсулин или тому подобные.
Поэтому существует насущная необходимость в разработке препарата, который приводит к образованию мультимеров инсулиновых аналогов, для улучшения их фармакологических свойств, таких как стабильность и способность к продолжительному действию.
Раскрытие сущности изобретения
Техническая проблема
Таким образом, авторы изобретения индуцировали образование гексамеров ПЭГ-инсулина при использовании ионов кобальта и затем анализировали их фармакологические свойства. В результате было установлено, что диссоциация гексамеров ПЭГ-инсулина на мономеры происходила в соответствии с постепенным изменением концентрации от микромоль (мкМ) до наномоль (нМ), их гидродинамический объем сильно увеличивался по сравнению с конъюгатами ПЭГ-инсулин и гексамером инсулина, и гексамеры ПЭГ-инсулина сохраняли стабильную гексамерную форму по сравнению с коммерческими препаратами инсулина длительного действия, что явилось завершением изобретения.
Решение проблемы
Задача изобретения состоит в том, чтобы предложить мультимер непептидильный полимер-инсулин, содержащий два или более конъюгата непептидильный полимер-инсулин, полученных путем связывания непептидильного полимера и инсулина посредством ковалентной связи, где конъюгаты образуют комплекс с ионом кобальта с образованием мультимера.
Другая задача изобретения состоит в том, чтобы предложить способ получения мультимера непептидильный полимер-инсулин, включающий стадию взаимодействия конъюгатов непептидильный полимер-инсулин с раствором, содержащим ионы кобальта, с получением мультимеров непептидильный полимер-инсулин.
Другая задача изобретения состоит в том, чтобы предложить фармацевтическую композицию для предупреждения или лечения диабета, содержащую мультимер непептидильный полимер-инсулин в качестве активного ингредиента.
Другая задача изобретения состоит в том, чтобы предложить способ предупреждения или лечения диабета, включающий стадию введения фармацевтической композиции субъекту, страдающему диабетом, или с подозрением на диабет.
Другая задача изобретения состоит в том, чтобы предложить набор для приготовления мультимера непептидильный полимер-инсулин, содержащего конъюгаты непептидильный полимер-инсулин, полученные путем связывания непептидильного полимера и инсулина посредством ковалентной связи; и раствор, содержащий ионы кобальта, где раствор содержит соль, которая диссоциирует на двухвалентные ионы кобальта вследствие сольватации в водном растворе, и окислитель, гидрат соли, который диссоциирует на двухвалентные ионы кобальта вследствие сольватации в водном растворе, и окислитель, или соль, которая диссоциирует на трехвалентные ионы кобальта вследствие сольватации в водном растворе, или ее гидрат.
Полезные эффекты изобретения
Мультимер непептидильный полимер-инсулин по изобретению является перспективным, поскольку он обладает значительно большим гидродинамическим объемом и высокой стабильностью по сравнению с конъюгатом непептидильный полимер-инсулин и мультимером инсулина. Поэтому после подкожной инъекции мультимер по изобретению имеет большой объем перед диссоциацией на мономеры вследствие естественного разбавления, и, таким образом, его быстрой абсорбции в кровоток не происходит. Следовательно, большое количество лекарственного препарата может быть введено за один раз. Кроме того, поскольку он обладает свойством медленной диссоциации на мономеры, он полезен при разработке препаратов инсулина длительного действия.
Краткое описание графических материалов
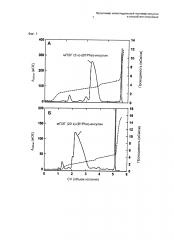
На фиг.1(А) показан результат катионообменной хроматографии (СЕС) выделенного инсулина, где ПЭГ (5 к) связан с аминоконцом его B-цепи, и на фиг.1(Б) показан результат катионообменной хроматографии выделенного инсулина, где ПЭГ (20 к) связан с аминоконцом его B-цепи.
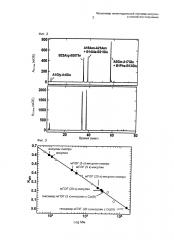
На фиг.2 показан результат изучения участка присоединения ПЭГ при сравнении хроматограмм фрагментов природного инсулина человека (верхняя) и конъюгата ПЭГ-инсулин (нижняя) при помощи Glu-C пептидного картирования.
На фиг.3 показан результат измерения гидродинамических объемов конъюгата ПЭГ-инсулин и гексамера ПЭГ-инсулин с кобальтом посредством эксклюзионной хроматографии (SEC), в которой линию регрессии рассчитывают по времени элюирования стандартных белков (каждый из шести белых кружков, начиная с левого верхнего угла: апротинин, 6,5 кДа; рибонуклеаза, 13,7 кДа; кональбумин, 75 кДа; иммуноглобулин G, 150 кДа; ферритин, 443 кДа; тиреоглобулин, 669 кДа).
На фиг.4 показан результат эксклюзионной хроматографии очищенных гексамера ПЭГ (5 к) - инсулин с кобальтом (▲), гексамера ПЭГ (20 к) - инсулин с кобальтом (■) и гексамера инсулина с кобальтом (●) для изучения их диссоциации на мономеры при разведении в фосфатно-солевом буферном растворе Дульбекко (DPBS).
Лучший способ осуществления изобретения
В одном аспекте согласно изобретению предложен мультимер непептидильный полимер-инсулин, содержащий два или более конъюгата непептидильный полимер-инсулин, полученных путем связывания непептидильного полимера и инсулина посредством ковалентной связи, где конъюгаты образуют комплекс с ионом кобальта с образованием мультимера.
Использованный здесь термин "конъюгат непептидильный полимер-инсулин" относится к конъюгату, в котором непептидильный полимер и инсулин связаны посредством ковалентной связи. В изобретении конъюгат непептидильный полимер-инсулин функционирует как мономер, который является составной частью мультимера непептидильный полимер-инсулин.
Предпочтительно конъюгат непептидильный полимер-инсулин может представлять собой конъюгат, полученный путем связывания непептидильного полимера с аминоконцом A-цепи инсулина, аминоконцом B-цепи инсулина или лизином в положении 29 B-цепи инсулина посредством ковалентной связи, и более предпочтительно представляет собой конъюгат, полученный путем связывания непептидильного полимера с аминоконцом B-цепи инсулина посредством ковалентной связи.
Использованный здесь термин "инсулин" относится к пептиду, который секретируется поджелудочной железой в ответ на повышенные уровни глюкозы в крови для перемещения глюкозы в печень, мышечную или жировую ткань и превращения ее в гликоген и для прекращения использования жира в качестве источника энергии и, следовательно, контроля уровня глюкозы в крови. Этот пептид включает природный инсулин, агонисты природного инсулина, предшественники природного инсулина, производные инсулина, его фрагменты и его варианты.
Термин "природный инсулин" представляет собой гормон, который секретируется поджелудочной железой для активации абсорбции глюкозы и подавления расщепления жиров и, таким образом действует, контролируя уровень глюкозы в крови. Инсулин образуется из предшественника, который не вовлечен в регулирование уровня глюкозы в крови, известного как проинсулин, путем процессинга. Аминокислотные последовательности инсулина являются следующими:
Альфа-цепь:
Gly-lle-Val-Glu-Gln-Cys-Cys-Thr-Ser-lle-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Ty r-Cys-Asn (SEQ ID NO: 1)
Бета-цепь:
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr (SEQ ID NO: 2)
Природный инсулин представляет собой гетеродимер, образованный посредством связывания A-цепи и B-цепи между собой посредством двух дисульфидных связей, в котором цистеин в положении 6 A-цепи и цистеин в положении 7 B-цепи, и цистеин в положении 20 A-цепи и цистеин в положении 19 B-цепи образуют дисульфидные связи соответственно.
Термин "агонист инсулина" означает соединение, которое связывается с рецептором инсулина, демонстрируя биологическую активность, равную активности инсулина, которое не соответствует структуре инсулина.
Термин "вариант инсулина" представляет собой пептид, имеющий одну или более чем одну аминокислотную последовательность, отличающуюся от последовательности природного инсулина, и означает пептид, который сохраняет функцию регулирования уровня глюкозы в крови в организме. Вариант инсулина может быть получен посредством любого их способов, включающих замену, добавление, делецию и модификацию, или посредством их комбинации в части аминокислотных последовательностей природного инсулина.
Термин "производное инсулина" означает пептид, имеющий по меньшей мере 80%-ную гомологию последовательностей аминокислот с природным инсулином, и который может иметь несколько групп на аминокислотном остатке, химически замещенных (например, альфа-метилирование, альфа-гидроксилирование), удаленных (например, дезаминирование) или модифицированных (например, N-метилирование), и обладает функцией регулирования уровня глюкозы в крови в организме.
Термин "фрагмент инсулина" означает фрагмент, который имеет одну или более чем одну аминокислоту, добавленную или удаленную на аминоконце или С-конце природного инсулина, к которому могут быть добавлены не встречающиеся в природе аминокислоты (например, D-аминокислота), и обладает функцией регулирования уровня глюкозы в крови в организме.
Термин "непептидильный полимер", использованный здесь, относится к биосовместимому полимеру, включающему два или более повторяющихся звена, связанных друг с другом посредством любой ковалентной связи, исключая пептидную связь. Непептидильный полимер может иметь молекулярную массу от 1 до 100 кДа и предпочтительно от 1 до 20 кДа.
Кроме того, непептидильный полимер может иметь одинарную концевую реакционноспособную группу или двойную концевую реакционноспособную группу, способную связываться с белком. Предпочтительно реакционноспособная группа может быть выбрана из группы, состоящей из альдегидного, пропиональдегидного, бутилальдегидного, малеимидного и сукцинимидного производного. В частности, когда непептидильный полимер имеет реакционноспособную альдегидную группу на обоих концах молекулы, он эффективно связывается по обоим концам с инсулином и иммуноглобулином с минимальными неспецифическими взаимодействиями. Конечный продукт, образованный посредством восстановительного алкилирования альдегидной связи, значительно более стабилен чем продукт, соединенный амидной связью. Альдегидная реакционно-способная группа селективно связывается с аминоконцом при низких значениях pH и связывается с остатком лизина с образованием ковалентной связи при высоких значениях pH, таких как pH 9,0.
Предпочтительно непептидильный полимер, используемый в изобретении, может быть выбран из группы, состоящей из биоразлагаемого полимера, липидного полимера, хитина, гиалуроновой кислоты и их комбинации, и более предпочтительно биоразлагаемый полимер может представлять собой полиэтиленгликоль, полипропиленгликоль, сополимер этиленгликоля и пропиленгликоля, полиоксиэтилированный полиол, поливиниловый спирт, полисахарид, декстран, поливинилэтиловый эфир, полимолочную кислоту (PLA) или полимолочную-гликолевую кислоту (PLGA) и гораздо более предпочтительно полиэтиленгликоль (ПЭГ). Кроме того, их производные, известные в данной области техники, и производные, которые легко получить посредством способа, известного в данной области техники, могут быть включены в объем изобретения. Например, когда используют непептидильный полимер с присоединенным L-гамма-глутаматом, образование мультимера полимер-инсулин может удачно происходить вследствие взаимодействия между молекулами L-гамма-глутамата.
Использованный здесь термин "мультимер непептидильный полимер-инсулин" или "мультимер непептидильный полимер-инсулин с кобальтом" представляет собой мультимер, в котором конъюгаты непептидильный полимер-инсулин образуют комплекс с ионом кобальта, и включает соединение, которое образовано посредством координации ионов кобальта к одной молекуле мультимера непептидильный полимер-инсулин.
Предпочтительно мультимер непептидильный полимер-инсулин может представлять собой димер, тример, тетрамер, пентамер или гексамер и предпочтительно представляет собой гексамер непептидильный полимер-инсулин.
Предпочтительно мультимер непептидильный полимер-инсулин может представлять собой мультимер, образованный с помощью катионов трехвалентного кобальта. Препарат мультимера непептидильный полимер-инсулин из конъюгатов непептидильный полимер-инсулин образуется при использовании катиона трехвалентного кобальта Co (III) в качестве координирующего иона металла. Более предпочтительно конъюгаты образуют комплекс с катионом трехвалентного кобальта с образованием гексамера непептидильный полимер-инсулин, где катион трехвалентного кобальта образует октаэдральную координацию B10His (молекулы гистидина в положении 10 B-цепи инсулина).
В конкретном воплощении изобретения один из мультимеров непептидильный полимер-инсулин, гексамер непептидильный полимер-инсулин, включает соединение, которое образовано посредством координации двух или более ионов трехвалентного кобальта к одной молекуле мультимера инсулина.
В природе цилиндрический гексамер инсулина, имеющий поперечное сечение тороидальной формы, образуется посредством координационной связи ионов двухвалентного цинка и гидрофобного взаимодействия между тремя димерами инсулина. В одном гексамере инсулина существуют два участка связывания ионов металла, и в каждом участке содержатся три гистидиновых остатка (в положении 10 B-цепи) от трех димеров. Два иона трехвалентного кобальта в участках связывания ионов металла гексамера непептидильного полимера и инсулина стабилизируют структуру гексамера.
Мультимер непептидильный полимер-инсулин по изобретению имеет больший гидродинамический объем, чем конъюгат непептидильный полимер-инсулин и мультимер инсулина с кобальтом и обладает свойством медленной диссоциации на мономеры. Таким образом, он демонстрирует превосходную продолжительность in vivo эффективности и стабильности, тем самым являясь полезным для лечения диабета.
В одном примере по изобретению монопегилированный конъюгат непептидильный полимер-инсулин получали посредством присоединения ПЭГ к аминоконцу В-цепи инсулина (Примеры 1 и 2) и подтверждали активность конъюгата in vitro (Пример 3).
Кроме того, когда гексамер (гексамер ПЭГ-инсулин с кобальтом) получают при использовании конъюгата и ионов кобальта, его гидродинамический объем сильно увеличивается (Примеры 4 и 5). Гексамер ПЭГ-инсулин с кобальтом демонстрировал соотношение гексамер-мономер 70% или выше при низкой концентрации 0,04 мкМ, тогда как гексамер инсулина с кобальтом демонстрировал соотношение гексамер-мономер 20% при низкой концентрации. Таким образом, гексамер ПЭГ-инсулин с кобальтом является стабильным, поскольку он может быть получен в виде гексамерного препарата при низкой концентрации (Пример 6). Кроме того, гексамер ПЭГ-инсулин с кобальтом демонстрирует более короткое время элюирования и более низкий коэффициент диссоциации, чем имеющийся в продаже инсулин длительного действия, такой как левемир, состоящий из инсулина детемир, и лантус, состоящий из гексамера инсулина гларгин, имеющий замену и вставку в B-цепи инсулина, что указывает на то, что гексамер имеет больший объем и стабильность, чем коммерческие препараты инсулина после подкожной инъекции (Пример 7). Эти результаты подтверждают, что мультимер непептидильный полимер-инсулин по изобретению имеет превосходную продолжительность in vivo эффективности и стабильности, и, таким образом, мультимер или композиция, содержащая этот мультимер, может использоваться для лечения диабета.
В другом аспекте согласно изобретению предложен способ получения мультимера непептидильный полимер-инсулин по изобретению, включающий стадию взаимодействия конъюгатов непептидильный полимер-инсулин с раствором, содержащим ионы кобальта, с получением мультимеров непептидильный полимер-инсулин.
В изобретении полученные конъюгаты непептидильный полимер-инсулин подвергают взаимодействию с раствором, содержащим ионы кобальта таким образом, чтобы получить мультимер непептидильный полимер-инсулин по изобретению, в котором конъюгат непептидильный полимер-инсулин может быть получен посредством ковалентного связывания инсулина с непептидильным полимером, имеющим реакционноспособную группу, выбранную из альдегидных, малеимидных и сукцинимидных производных, и выделения конъюгатов непептидильный полимер-инсулин из реакционной смеси.
Сукцинимидное производное из числа реакционноспособных групп непептидильного полимера может представлять собой сукцинимидилпропионат, гидроксисукцинимидил, сукцинимидилкарбоксиметил или сукцинимидилкарбонат.
Молярное отношение иона кобальта к конъюгату непептидильный полимер-инсулин может составлять от 0,1 до 1.
Может быть использован любой раствор без ограничения при условии, что раствор содержит ионы кобальта. Предпочтительно раствор может содержать соль, которая диссоциирует на ионы двухвалентного кобальта вследствие сольватации в водном растворе, ее гидрат, соль, которая диссоциирует на ионы двухвалентного кобальта вследствие сольватации в водном растворе, и окислитель, гидрат соли, которая диссоциирует на ионы двухвалентного кобальта вследствие сольватации в водном растворе, и окислитель, или соль, которая диссоциирует на ионы трехвалентного кобальта вследствие сольватации в водном растворе, или ее гидрат. Более предпочтительно раствор может содержать соль, которая диссоциирует на ионы двухвалентного кобальта вследствие сольватации в водном растворе, и окислитель, гидрат соли, которая диссоциирует на ионы двухвалентного кобальта вследствие сольватации в водном растворе, и окислитель, или соль, которая диссоциирует на ионы трехвалентного кобальта вследствие сольватации в водном растворе, или ее гидрат.
Соль, которая диссоциирует на ионы двухвалентного кобальта, может представлять собой хлорид кобальта (II) (CoCl2), и соль, которая диссоциирует на ионы трехвалентного кобальта, может представлять собой хлорид кобальта (III) (CoCl3).
Кроме того, окислитель, используемый в изобретении, может включать вещество, такое как пероксид водорода, который обладает окислительной способностью для превращения ионов двухвалентного кобальта в водном растворе и в мультимере непептидильный полимер-инсулин в ионы трехвалентного кобальта. Предпочтительно молярное отношение окислителя к иону двухвалентного кобальта может составлять от 0,5 до 5.
Предпочтительно взаимодействие может быть проведено в буферном растворе при значениях pH от 5 до 9 и более предпочтительно в буферном растворе при значениях pH от 7,5 до 8,5.
В другом аспекте согласно изобретению предложена фармацевтическая композиция для предупреждения или лечения диабета, содержащая мультимер непептидильный полимер-инсулин по изобретению в качестве активного ингредиента.
Кроме того, в другом аспекте согласно изобретению предложен способ предупреждения или лечения диабета, включающий стадию введения фармацевтической композиции по изобретению субъекту, страдающему диабетом, или с подозрением на диабет.
Использованный здесь термин "диабет" означает заболевание обмена веществ, вызванное нарушением секреции или функции инсулина. Композицию по настоящему изобретению вводят субъекту, для того чтобы регулировать уровень глюкозы в крови, тем самым лечить диабет.
Использованный здесь термин "предупреждение" означает все действия, при которых симптомы диабета подавляются или развитие диабета задерживается с помощью введения композиции, а термин "лечение" означает все действия, при которых симптомы диабета ослабляются или смягчаются с помощью введения композиции. Лечение диабета может быть применено к любому млекопитающему, которое может страдать диабетом, и примеры млекопитающих включают людей и приматов, а также домашний скот, такой как крупный рогатый скот, свинья, овца, лошадь, собака и кошка без ограничений, и представляют собой предпочтительно человека.
Использованный здесь термин "введение" означает введение предварительно определенного количества вещества пациенту посредством определенного подходящего способа. Мультимер непептидильный полимер-инсулин может быть введен посредством любого из общепринятых способов, при условии, что он обеспечивает его доставку в нужную ткань. Предполагают множество способов введения, включая внутрибрюшинный, внутривенный, внутримышечный, подкожный, внутрикожный, пероральный, местный, интраназальный, внутрилегочный и ректальный, но изобретение не ограничено этими приведенными в качестве примера способами введения. Однако, поскольку при пероральном введении пептиды подвергаются расщеплению, то активные ингредиенты композиции для перорального введения должны быть покрыты оболочкой или приготовлены в виде препарата для защиты от разложения в желудке. Предпочтительно мультимер может быть введен в виде инъекции. Кроме того, фармацевтическая композиция может быть введена при использовании определенного устройства, способного доставлять активные ингредиенты в клетку-мишень.
Мультимер непептидильный полимер-инсулин по изобретению сохраняет свою форму без диссоциации на мономеры в пределах низких концентраций, тем самым демонстрируя высокую стабильность при хранении в виде фармацевтической композиции (фиг.4). Поэтому фармацевтическая композиция по изобретению может включать мультимер непептидильный полимер-инсулин по изобретению в концентрации от 0,01 мкМ до 100 мкМ, предпочтительно от 0,1 мкМ до 100 мкМ, более предпочтительно от 1 мкМ до 100 мкМ и даже более предпочтительно от 10 мкМ до 100 мкМ.
Фармацевтическая композиция по изобретению может включать фармацевтически приемлемый носитель. Для перорального введения фармацевтически приемлемый носитель может включать связующее вещество, смазывающее вещество, разрыхлитель, эксципиент, солюбилизатор, диспергирующий агент, стабилизатор, суспендирующий агент, краситель и ароматизатор. Для инъецируемых препаратов фармацевтически приемлемый носитель может включать буферный агент, консервант, анальгетик, солюбилизатор, изотонический агент и стабилизатор. Для препаратов для местного введения фармацевтически приемлемый носитель может включать основание, эксципиент, смазывающее вещество и консервант. Фармацевтическая композиция по изобретению может быть приготовлена в виде различных лекарственных форм в комбинации с вышеупомянутыми фармацевтически приемлемыми носителями. Например для перорального введения фармацевтическая композиция может быть приготовлена в виде таблеток, пастилок, капсул, эликсиров, суспензий, сиропов или облаток. Для инъекционных препаратов фармацевтическая композиция может быть приготовлена в виде стандартной лекарственной формы, такой как многодозовый контейнер или ампула в качестве однодозовой лекарственной формы. Фармацевтическая композиция также может быть приготовлена в виде растворов, суспензий, таблеток, пилюль, капсул и препаратов длительного действия.
С другой стороны, примеры носителя, эксципиента и разбавителя, подходящих для приготовления фармацевтических препаратов, включают лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральные масла. Кроме того, фармацевтические препараты могут дополнительно включать наполнители, антикоагулянты, смазывающие вещества, увлажняющие агенты, ароматизаторы и антисептики.
Композиция по изобретению может быть введена в фармацевтически эффективном количестве. Использованный здесь термин "фармацевтически эффективное количество" относится к количеству, достаточному для лечения заболеваний, которое соответствует разумному соотношению польза-риск, подходящему для лечения. Эффективная дозировка композиции по изобретению может быть определена в зависимости от субъекта и тяжести заболевания, возраста, пола, активности лекарственного средства, чувствительности к лекарственному средству, времени введения, путей введения, скоростей экскреции, продолжительности лечения, совместно используемых лекарственных средств и других факторов, известных в медицине.
Мультимер непептидильный полимер-инсулин по изобретению имеет превосходную продолжительность in vivo эффективности и стабильности, чем конъюгат непептидильный полимер-инсулин и мультимер инсулина, тем самым являясь полезным для предупреждения и лечения диабета. Таким образом, введение содержащей его фармацевтической композиции способствует предупреждению и лечению заболевания.
В другом аспекте согласно изобретению предложен набор для приготовления мультимера непептидильный полимер-инсулин по изобретению, содержащий конъюгаты непептидильный полимер-инсулин, полученный путем связывания непептидильного полимера и инсулина посредством ковалентной связи; и раствор, содержащий ионы кобальта, в котором раствор содержит соль, которая диссоциирует на ионы двухвалентного кобальта вследствие сольватации в водном растворе, и окислитель; гидрат соли, которая диссоциирует на ионы двухвалентного кобальта вследствие сольватации в водном растворе, и окислитель; или соль, которая диссоциирует на ионы трехвалентного кобальта вследствие сольватации в водном растворе, или ее гидрат.
В наборе для приготовления мультимера непептидильный полимер-инсулин по изобретению соль или ее гидрат и окислитель могут храниться в одном контейнере или раздельно в индивидуальных контейнерах.
Кроме того, набор по изобретению может дополнительно включать инструкции, в которых описаны оптимальные условия взаимодействия, и фармацевтически приемлемый носитель. Инструкции могут включать руководство, такое как буклет или брошюра, этикетку, прикрепленную к набору, и описание на поверхности упаковки, содержащей набор. Помимо этого, руководство может включать информацию, опубликованную или предоставленную электронными средствами, такими как интернет.
Способ осуществления изобретения
Ниже изобретение будет описано более подробно с учетом следующих Примеров. Однако эти Примеры приведены только с целью иллюстрации и не предназначены для ограничения изобретения.
Пример 1. Синтез и выделение конъюгата ПЭГ-инсулин
Для связывания мПЭГ-альдегида (монометоксиполиэтиленгликоль-альдегид), имеющего молекулярную массу 5 к или 20 к, с аминоконцом B-цепи природного инсулина человека инсулин и мПЭГ-альдегид подвергали взаимодействию в молярном соотношении 1:2 при концентрации инсулина 2 мг/мл при 4°C в течение 12 ч. На данном этапе взаимодействие проводили в 100 мМ буферном растворе цитрата натрия при рН 6,0 и в него добавляли 20 мМ цианборгидрид натрия (SCB) в качестве восстановителя. Монопегилированный инсулин по аминоконцу B-цепи выделяли из реакционной смеси при использовании смолы SOURCE 15S (GE Healthcare), упакованной в колонку HR (GE Healthcare). Как показано на фиг.1, конъюгат ПЭГ (5 к или 20 к) - инсулин наблюдали в главном пике (фиг.1).
Колонка: смола Source 15S, упакованная в колонку HR (GE Healthcare)
Скорость потока: 1,8 мл/мин
Градиент: А0→50% 100 мин B (A: 20 мМ цитрат натрия (цитрат натрия) pH 3,0 плюс 60% этанол, B: A плюс 0,5 М KCI).
Пример 2. Пептидное картирование конъюгата ПЭГ-инсулин
Конъюгат ПЭГ-инсулин или природный инсулин человека расщепляли при использовании Glu-C (Roche Applied Science). Взаимодействие проводили в условиях 20 мМ буфера HEPES (2-[4-(2-гидроксиэтил)пиперазин-1-ил]-этансульфоновой кислоты) при pH 8,2 и 25°С в течение 12 ч. Реагент анализировали посредством высокоэффективной жидкостной хроматографии с обращенными фазами. Колонка Jupiter 5 микрон С18 (Phenomenex, Inc.) управлялась модулем Agilent 1200 Series. Как показано на фиг.2, было установлено, что большая часть ПЭГ присоединена к аминоконцу B-цепи инсулина (фиг.2).
Колонка: Jupiter 5 мкм С18 (Phenomenex, Inc.)
Скорость потока: 1 мл/мин
Градиент: A10→30% 65 мин B, A30→40% 5 мин B (A: 20 мМ сульфат натрия pH 2,0, B: A плюс 100% ацетонитрил).
Пример 3. Проверка эффективности in vitro
Для дифференцировки мышиного фибробласта 3T3-L1 в адипоцит клетки засевали в 48-луночный планшет, содержащий среду 10% FBS (фетальная бычья сыворотка) ЮМЕМ (среда Игла в модификации Дульбекко), содержащую дексаметазон, IBMX (изобутилметилксантин) и инсулин, при плотности клеток 1,0⋅105 на лунку. Дифференцированные клетки три раза промывали DPBS (фосфатно-солевой буферных раствор Дульбекко) и культивировали на среде DMEM без сыворотки в течение 4 ч. Природный инсулин человека, ПЭГ (5 к) - инсулин и ПЭГ (20 к) - инсулин готовили в содержащей сахар среде DMEM в соответствующем диапазоне концентраций и затем добавляли в 48-луночный планшет, содержащий дифференцированные адипоциты. После культивирования при 37°С в течение 24 ч измеряли остаточную концентрацию сахара в среде при использовании набора реактивов для определения D-глюкозы (Megazyme), и значения ЕС50 подсчитывали и указывали в таблице 1.
| Таблица 1 | ||
| Белок | ЕС50 (нМ) | Относительная активность (%) |
| Природный инсулин человека | 5,69±1,13 | 100 |
| ПЭГ (5 к) - инсулин | 9,48±2,77 | 60 |
| ПЭГ (20 к) - инсулин | 13,55±0,71 | 42 |
Эти результаты показывают, что ПЭГ-инсулин обладает активностью инсулина.
Пример 4. Приготовление и очистка гексамера ПЭГ-инсулин с кобальтом
Конъюгаты ПЭГ-инсулин в 20 мМ буфере HEPES (pH 8,2) смешивали с раствором хлорида кобальта в соотношении кобальт: гексамер 3:1. Для превращения ионов двухвалентного кобальта в ионы трехвалентного кобальта добавляли пероксид водорода в количестве, в два раза превышающем общее число ионов двухвалентного кобальта, и оставляли при комнатной температуре в течение 2 ч. После этого гексамеры ПЭГ-инсулин с кобальтом выделяли посредством SEC (эксклюзионная хроматография).
Колонка: Superdex 200 16/60 препаративной категории (GE Healthcare)
Скорость потока: 0,4 мл/мин
Буфер: 20 мМ HEPES pH 8,2 плюс 0,2 М NaCl.
Пример 5. Измерение гидродинамического объема гексамера ПЭГ-инсулин с кобальтом
Гидродинамический объем конъюгата ПЭГ-инсулин или гексамера ПЭГ-инсулин с кобальтом измеряли в соответствии с условиями, описанными в примере 4, за исключением того, что в качестве колонки использовали Superdex 200 10/300 GL. Линию регрессии рассчитывают по объему элюирования стандартного белка. Коэффициент распределения (Kav) определяют, как указано ниже.
Kav=(Ve-V0)/(Vt-V0)
Ve представляет собой объем элюирования, V0 представляет собой свободный объем, определенный с помощью голубого декстрана, и Vt представляет собой объем слоя.
Как показано на фиг.3, было установлено, что гексамер ПЭГ (5 к)-инсулин с кобальтом (300 кДа) имел гидродинамический объем приблизительно в 5 раз больше чем мономер (60 кДа), и гексамер ПЭГ (20 к) - инсулин с кобальтом (1600 кДа) имел гидродинамический объем приблизительно в 10 раз больше чем мономер (фиг.3).
Эти результаты показывают, что мультимер ПЭГ - инсулин с кобальтом обладает значительно большим гидродинамическим объемом по сравнению с мономерами, и, таким образом, почечный порог выведения снижается, увеличивая срок сохранения in vivo эффективности.
Пример 6. Измерение степени диссоциации гексамера ПЭГ-инсулин с кобальтом при разведении
Гексамер ПЭГ-инсулин с кобальтом и очищенный гексамер инсулина с кобальтом в концентрации 100 мкМ разводили в DPBS до концентрации 1 мкМ, 0,1 мкМ и 0,04 мкМ. Их оставляли при комнатной температуре в течение 16 ч и затем концентрировали до 0,3 мМ при использовании центрофужного концентратора (Vivaspin 20, Sartorius). Анализ проводили в соответствии с условиями, оп